物化B(相平衡例题).
- 格式:ppt
- 大小:384.00 KB
- 文档页数:44

物理化学练习(相平衡)答案一、选择题1. 2408[答] (A) 恒沸混合物与化合物不同,没有确定的组成。
只在压力恒定时,其组成才一定,即恒沸混合物的沸点随外压而改变。
2. 2399[答] (A) C= C- R - R' = 5 - 2 - 0 = 33. 2562[答] (B) 4. 2635答:(C)(2分)5. 2404[答] (B) C= S - R - R' = 3 - 0 - 0 = 3f= C- Φ+ 1 = 3 - 2 + 1 = 26. 2644答:(B)(2分)7. 2401[答] (C)CH3COOH + C2H5OH = CH3COOC2H5+ H2OC= S - R - R' = 4 - 1 - 1 = 2f = C+ 2 - Φ= 2 + 2 - 2 = 28. 2329答:(C) (2分)9. 2552答:(D)(2分)根据水的相图,欲使水在K15.373时稳定存在,水的蒸气压必须大于它在该温度下的平衡蒸气压kPa325.101。
10. 2396[答] (C)S = 5 , R = 3 , R' = 0,C= 5 - 3 = 2f*= 2 -Φ+ 1 = 0, 最大的Φ= 3 , 除去硫酸水溶液与冰还可有一种硫酸水含物与之共存。
11. 2739答:(C)(2分)12. 2481[答] (A) 是错误的。
13. 2551答:(C)(2分)Φ21122气相区:f C=-+=-+=Φ21221气液共存区:f C=-+=-+=Φ01100(各物质在临界点时T p,有定临界点:f C**=-+=-+=植)14. 2394[答] (C) S = 6 , R = 4 , R' = 0,C= 6 - 4 - 0 = 2f* = 2 -Φ+ 1 = 3 -Φ= 0 , Φ= 315. 2435[答] (B) (2分)因为等温下,f*=2-Φ+1 Φ最多为3所以,除水蒸汽相外,最多可有两种水合盐16. 2398[答] (A)(1) 入塔前,物种数S = 3 ,独立组与数C= 3(2) 已达平衡C= S - R - R' = 3 - 1 - 0 = 2(3) 只充 NH3气入塔并达平衡C= S - R - R' = 3 - 1 - 1 = 1因 2NH3 N2+ 3H2R = 1又 [H2] = 3[N2] R' = 117. 2613[答] (1) (C) (1分)(2) (D)(1分)18. 2640答:(B)(2分)=-+-=-+-=2122211f CΦ二、计算题19. 2493[答] (1) 在三相点时,p s= p l , 即11.986 -1360 K/T = 9.729 -874 K/T解得三相点,T= 215.3K (2分)由lg[p$(三相点)/Pa]= 11.986 –1360 K/T= 5.6692 (2分)三相点的压力:p(三相点) = 4.70×105 Pa (1得 CO2分)(2) 由蒸气压方程lg(p$/Pa) = 常数- ΔH/(2.303 RT) (1分)得Δsub Hm= 2.303×8.314×1360 J·mol-1= 26 040 J·mol-1 (1分)Δvap Hm= 2.303×8.314×874 J·mol-1 = 16 740 J·mol-1 (1分)Δfus Hm= ΔsubHm-ΔvapHm= 9300 J·mol-1 (1分)Δfus Sm= ΔfusHm/T = 9300 J·mol-1/ 215.3 K= 43.2 J·K-1·mol-1 (1分)20. 2598[答] (1) a.不稳定化合物Na Cl·2H2O中NaCl的质量分数为mNaCl /(m NaCl +OH2m) = 0.619b.-21℃有三相平衡线 (冰,不稳定化合物和 22.3% NaCl水溶液平衡共存) c. -9℃时有三相线 (无水 NaCl,不稳定化合物和 27% NaCl水溶液) 绘制相图如下,各区相态为:1. l;2. sOH2+l; 3. l+sOH2Nacl2; 4. l+ sNaCl; 5. sOH2+sOH2Nacl2⋅;6. sOH2Nacl2⋅+sNaCl(5分)(2) 1000 g 28% 的 NaCl 溶液冷却到 -10℃最多可析出NaCl为w NaCl克w l(28-27) = w NaCl(100-28) w l= 1000 g - w NaClwNaCl= 13.7 g (4分)(3) -21℃(1分)21. 2597[答] (1) 各区域相态如下:1 . l (熔液)2 . l + sA 3 . l + sC(C 为不稳定化合物)4 . l + s B5 . s A + s C6 . s C + s B (3分)EF 、GH 线上:f *= C + 1 -Φ = 2 + 1 -Φ= 0 CD 线上:f *= C + 1 -Φ= 1 + 1 - 1 = 1 (2分)(2) 低共熔温度时,μs A (T ,p ) =μl A (T ,p ),d μs A = d μl A -S s s A ,m d T =-S l A d T + RT dln a A (1)(Δfus S m /RT )d T = dln a A(Δfus H m /RT 2)d T = dln a A ΔH (T ) =ΔH (610 K) +T C T T p d 21⎰∆= 15 250 + 5T (2)T 1= 610 K ,T 2= T 将 (2) 式代入 (1) 式并积分得 a A = 0.4979 ,γA = a A /x A = 0.83 (5分) 22. 2673[答] (1) M (H 2O)=0.018 kg ·mol -1;M (Li 2SO 4)=0.110 kg ·mol -1 w (H 2O)=(0.018 kg ·mol -1)/[(0.110 kg ·mol -1)+(0.018 kg ·mol -1)] =0.141=14.1 %所以水合盐为:Li2SO4·H2O (1分)同理:W[(NH4)2SO4]=(0.132 kg·mol-1)/[(0.132 kg·mol-1)+(0.018kg·mol-1)=54.5 %所以复盐为:(NH4)2SO4·Li2SO4(1分)(2) 各区存在的相:①为不饱和溶液的单相区;②为s1与其饱和溶液的两相区;③为s1, s1·s2和组成为F的饱和溶液的三相共存;④为s1·s2与其饱和溶液的两相区;⑤为s1·s2, s2·H2O和其饱和溶液E三相共存;⑥为s2·H2O与其饱和溶液两相共存;⑦为s1·s2, s2, s2·H2O三固相共存区。

第六章相平衡练习题、是非题,下列各题的叙述是否正确,对的画V错的画X1、纯物质两相达平衡时,两相的吉布斯函数值一定相等。
()2、理想液态混合物与其蒸气达成气、液两相平衡时,气相总压力p与液相组成X B呈线性关系。
()3、已知Cu-Ni可以形成完全互溶固熔体,其相图如右图,理论上,通过精炼可以得到两个纯组分。
()4、二组分的理想液态混合物的蒸气总压力介于二纯组分的蒸气压之间。
()5、在一定温度下,稀溶液中挥发性溶质与其蒸气达到平衡时气相中的分压与该组分在液相中的组成成正比。
()6 恒沸混合物的恒沸温度与恒沸组成不随压力而改变。
()7、在一个给定的体系中,特种数可以分析问题的角度不同而不同,但独立组分数是一个确定的数。
()8、自由度就是可以独立变化的变量。
()9、单组分体系的相图中两相平衡线都可以用克拉贝龙方程定量描述。
()10、在相图中总可以利用杠杆规则计算两相平衡时两相的相对量。
()二、选择题1、在p下,用水蒸气蒸馏法提纯某不溶于水的有机物时,系统的沸点:()(1)必低于373.2 K;(2)必高于373.2 K;(3)取决于水与有机物的相对数量;(4)取决于有机物相对分子质量的大小。
2、已知A(l)、B(l)可以组成其t-x(y)图具有最大恒沸点的液态完全互溶的系统,则将某一组成的系统精馏可以得到:()。
(1)两个纯组分;(2)两个恒沸混合物;(3)一个纯组分和一个恒沸混合物。
3、已知A和B可构成固溶体,在组分A中,若加入组分B可使固溶体的熔点提高,则组B在此固溶体中的含量必__________ 分B在组分液相中的含量。
(1)大于;(2)小于;(3)等于;(4)不能确定。
4、硫酸与水可形成H2SO4H2OG), H2SO42H2OG), H2SO44H2OG)三种水合物,问在101325 Pa的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种?()(1)3种;(2) 2种;(3) 1种;(4)不可能有硫酸水合物与之平衡共存5、对恒沸混合物的描写,下列各种叙述中哪一种是不正确的?(1)与化合物一样,具有确定的组成;(2)恒沸混合物的组成随压力的改变而改变;(3)平衡时,气相和液相的组成相同;(4)其沸点随外压的改变而改变。


第五章 相平衡一、填空题1、一定温度下,蔗糖水溶液与纯水达到渗透平衡时的自由度数等于__________。
2、纯物质在一定温度下两相共存时的自由度数等于__________。
3、NaCl(S)和含有稀盐酸的NaCl 饱和水溶液的平衡系统,其独立组分数是_______。
4、设下列化学反应同时共存时并达到平衡(900-1200K ):()()()g CO s CaO s CaCO 23+=()()()()g O H g CO g H g CO 222+=+()()()g H s CaCO s CaO g CO g O H 232)()(+=++则该系统的自由度数为______。
5、含KNO 3和NaCl 的水溶液与纯水达到渗透平衡时,其组分数为____,相数为___, 自由度数为____。
6、在氢和石墨的系统中,加一催化剂,H 2和石墨反应生成n 种碳氢化合物,此系统的独立 组分数为______。
7、完全互溶的双液系中,在x B =0.6处,平衡蒸气压有最高值,那么组成为x B =0.4的溶液在 气液平衡时,x B (g )、x B (l )、x B (总)的大小顺序为______。
将x B =0.4的溶液进行 精馏时,塔顶将得到______。
8、对于渗透平衡系统,相律的形式应写成______。
9、NH 4Cl 固体分解达到平衡时,())()(s Cl NH 34g NH g HCl +=,系统的独立组分数为___,自由度为___。
10、将AlCl 3溶于水中,全部水解,生成Al(OH)3沉淀,此系统自由度数f=____。
11、已知100o C 时水的饱和蒸气压为101.325KPa,用公式_________可求出25o C 时 水的饱和蒸气压。
答案1、22、03、24、35、3;2:46、27、x B (g )>x B (总)>x B (l ) x B =0.6恒沸混合物 8、3+Φ-=k f 9、1;1 10、2 11、⎪⎪⎭⎫⎝⎛-∆=211211lnT T RH p p mr二、单选题1、右图为H 2OA.-(NH 4)2SO 4B.的沸点-组成图。

第六章 相平衡1. 如果只考虑温度和压力的影响, 纯物质最多可共存的相有()(A) P =1 (B) P =2 (C) P =3 (D) P =42.将固体NH 4HCO 3(s)放入真空容器中,恒温到400K ,NH 4HCO 3 按下式分解并达到平衡: NH 4HCO 3(s) = NH 3(g) + H 2O(g) + CO 2(g),系统的组分数 C 和自由度数F 为()(A) C = 2,F = 1 (B) C = 2,F = 2 (C) C = 1,F = 0 (D) C = 1,F = 13. 298 K 时,蔗糖水溶液与纯水达渗透平衡时,整个系统的组分数、相数、自由度数为:()(A) C = 2,P = 2,F = 1 (B) C = 2,P = 2,F = 2(C) C = 2,P = 1,F = 2 (D) C = 2,P = 1,F = 34. 区别单相系统和多相系统的主要根据是()(A)化学性质是否相同 (B)物理性质是否相同(C)物质组成是否相同 (D)物理性质和化学性质是否都相同5. 液体A 与B 形成蒸气压正偏差很大的溶液,在精馏塔中精馏时,塔釜得到的是:()(A)恒沸混合物 (B)纯A (C)纯B (D) 纯A 或纯B1. 克拉佩龙方程m md d H p T T V ∆=∆,其压力随温度的变化率一定大于0。
2. 一定温度下的乙醇水溶液,可用克-克方程计算其饱和蒸气压。
3. 在相图中总可以利用杠杆规则计算两相平衡时两相的相对含量。
4. 单组分系统的相图中两相平衡线都可以用克拉佩龙方程定量描述。
1. Mg (熔点924K )和Zn (熔点692K )的相图具有两个低共熔点,以各为641K (3.2% Mg ,质量百分数,下同),另一个为620K (49% Mg ),在系统的熔点曲线上有一个最高点863 K (15.7% Mg )。
(1)绘出Mg 和Zn 的T -x 图,并标明各区中的相。

物理化学《相平衡》习题及答案选择题1.二元恒沸混合物的组成(A)固定(B) 随温度而变(C) 随压力而变(D) 无法判断答案:C2.一单相体系, 如果有3种物质混合组成, 它们不发生化学反应, 则描述该系统状态的独立变量数应为(A) 3个 (B) 4个 (C) 5个 (D) 6个答案:B。
F=C-P+2=3-1+2=43.通常情况下,对于二组分物系能平衡共存的最多相为(A) 1 (B) 2 (C) 3 (D) 4 答案:D。
F=2-P+2=4-P,F不能为负值,最小为零。
当F=0时P=4。
4.正常沸点时,液体蒸发为气体的过程中(A) ΔS=0 (B) ΔG=0 (C) ΔH=0 (D) ΔU=0 答案:B。
此为可逆过程故ΔG=0。
5.以下各系统中属单相的是(A) 极细的斜方硫和单斜硫混合物 (B) 漂白粉 (C) 大小不一的一堆单斜硫碎粒(D) 墨汁答案:C。
6.NaCl(s), NaCl水溶液及水蒸汽平衡共存时, 系统的自由度(A) F=0 (B) F=1 (C) F=2 (D) F=3 答案:B。
F=C-P+2,C=2,P=3,故F=2-3+2=1。
7.如果只考虑温度和压力的影响, 纯物质最多可共存的相有(A) P=1 (B) P=2 (C) P=3 (D) P=4答案:C。
F=C-P+2=1-P+2=3-P,当F最小为零时P=3。
8.对于相律, 下面的陈述中正确的是(A) 相律不适用于有化学反应的多相系统 (B) 影响相平衡的只有强度因素(C) 自由度为零意味着系统的状态不变 (D) 平衡的各相中, 系统包含的每种物质都不缺少时相律才正确答案:B9.关于三相点, 下面的说法中正确的是(A) 纯物质和多组分系统均有三相点 (B) 三相点就是三条两相平衡线的交点(C) 三相点的温度可随压力改变 (D) 三相点是纯物质的三个相平衡共存时的温度和压力所决定的相点答案:D10.用相律和Clapeyron•方程分析常压下水的相图所得出的下述结论中不正确的是(A) 在每条曲线上, 自由度F=1 (B) 在每个单相区, 自由度F=2(C)在水的凝固点曲线上, ΔHm(相变)和ΔVm的正负号相反(D)在水的沸点曲线上任一点,压力随温度的变化率都小于零。

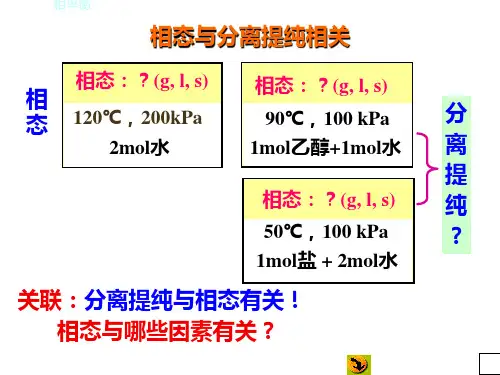
第四章 相平衡一、 基本内容本章运用热力学方法推导相平衡系统共同遵守的规律—相律;介绍单组分或多组分系统内达平衡时的状态图—相图的绘制、相图的分析和相图的应用。
通过本章的学习,可以应用相律判断各类相平衡系统中的相数、组分数和自由度数;了解各类相图的绘制方法,正确分析相图中各点、线、面的意义,解释外界条件变化时系统经历的相变,并能根据所给条件粗略画出相图;能应用杠杆规则计算相平衡系统中各相的相对数量,明确蒸馏、精馏、结晶、萃取等工业过程分离、提纯物质的基本原理和最佳途径。
〔一〕相变在聚集态内部能与其它物质区分的“均匀系〞称为“相〞,描述“相〞的特征是:宏观 物理性质与化学性质均匀一致;其物质的数量可以任意改变〔量变〕;相与相之间不强求明显的物理界面。
例如水池中插板、冰被破碎,并不改变原有相数的平衡状态。
相变则标志质〔物理性质和化学性质〕的飞跃,根据物性的不同有一级相变和二级相变之分,一级相变广为存在,其特征是物质在两相平衡时化学势的一级偏微商不相等,∆V ≠0,∆H ≠0,∆S ≠0,曲线变化呈现明显折点〔有二条切线〕。
这类相变符合克拉贝龙方程:VT HdT dp ∆∆=。
二级相变的特征是物质在二相平衡时化学势的一级偏微商相等,曲线变化呈现圆滑过渡〔只有一条切线〕。
而二级偏微商不等,C p 、α(等压热膨胀系数)、β〔等温压缩系数〕在相变温度时曲线的变化不连续。
二级相变因∆H =0,不适用克拉贝龙方程而适用埃伦菲斯方程α∆∆=TV C dT dpp 。
某些金属的铁磁→顺磁转变,低温下超导性能的转变等属于此类。
〔二〕相律系统达热力学平衡时,若有C 种组分,Φ个相,通常仅将温度与压力2个强度性质考虑进去,组成一个全部是独立变量的以自由度数f 表达的函数关系式: f =C -Φ+2。
此即为吉布斯相律公式。
如有磁场、重力场以与有渗透压等其它因素影响,则应将常数2改为n 。
〔三〕相图相图是一些描述相平衡规律的图形。

第六章相平衡6.1指出下列平衡系统中的组分数C,相数P及自由度F。
(1)I2(s)与其蒸气成平衡;(2)CaCO3(s)与其分解产物CaO(s)和CO2(g)成平衡;(3)NH4HS(s)放入一抽空的容器中,并与其分解产物NH3(g)和H2S(g)成平衡;(4)取任意量的NH3(g)和H2S(g)与NH4HS(s)成平衡。
(5)I2作为溶质在两不互溶液体H2O和CCl4中达到分配平衡(凝聚系统)。
解:(1)C = 1, P = 2, F = C–P + 2 = 1 – 2 + 2 = 1.(2)C = 3 – 1 = 2, P = 3, F = C–P + 2 = 2 – 3 + 2 = 1.(3)C = 3 – 1 – 1 = 1, P = 2, F = C–P + 2 = 1 – 2 + 2 = 1.(4)C = 3 – 1 = 2, P = 2, F = C–P + 2 = 2 – 2 + 2 = 2.(5)C = 3, P = 2, F = C–P + 1 = 3 – 2 + 1 = 2.6.2已知液体甲苯(A)和液体苯(B)在90 C时的饱和蒸气压分别为=和。
两者可形成理想液态混合物。
今有系统组成为的甲苯-苯混合物5 mol,在90 C下成气-液两相平衡,若气相组成为求:(1)平衡时液相组成及系统的压力p。
(2)平衡时气、液两相的物质的量解:(1)对于理想液态混合物,每个组分服从Raoult定律,因此(2)系统代表点,根据杠杆原理6.3单组分系统的相图示意如右图。
试用相律分析途中各点、线、面的相平衡关系及自由度。
解:单相区已标于图上。
二相线(F = 1):三相点(F = 0):图中虚线表示介稳态。
6.4已知甲苯、苯在90 ︒C下纯液体的饱和蒸气压分别为54.22 kPa和136.12 kPa。
两者可形成理想液态混合物。
取200.0 g甲苯和200.0 g苯置于带活塞的导热容器中,始态为一定压力下90 ︒C的液态混合物。

物理化学《相平衡》习题及答案2-3 选择题1、水煤气发生炉中共有)()()()(22g CO g CO g O H s C 、、、及)(2g H 5种物质,它们能发生下述反应:)(2)()(2g CO s C g CO ⇒+,)()()()(222g O H g CO g H g CO +⇒+,)()()()(22g CO g H s C g O H +⇒+,则此体系的组分数、自由度为( C )A.5、3B.4、3C.3、3D.2、22、物质A 与B 可形成低共沸混合物E ,已知纯A 的沸点小于纯B 的沸点,若将任意比例的A+B 混合在一个精馏塔中精馏,则塔顶的馏出物是( C )A.纯AB.纯BC.低共沸混合物D.都有可能3、克拉贝隆-克劳修斯方程适用于( C )A.)()(22g I s I ⇔B.)()(金刚石石墨C C ⇔C.),,(),,(222112p T g I p T g I ⇔D.)()(22l I s I ⇔4、将一透明容器抽成真空,放入固体碘,当温度为50℃时,可见到明显的碘升华现象,有紫色气体出现。
若温度维持不变,向容器中充入氧气使之压力达到100kPa 时,将看到容器中( C )A.紫色变深B.紫色变浅C.颜色不变D.有液态碘出现5、在一定温度下,水在其饱和蒸汽压下汽化,下列各函数增量中那一项为零( D )A.U ∆B.H ∆C.S ∆D.G ∆6、在一定外压下,多组分体系的沸点( D )A.有恒定值B.随组分而变化C.随浓度而变化D.随组分及浓度而变化7、压力升高时,单组份体系的沸点将( A )A.升高B.降低C.不变D.不一定8、进行水蒸气蒸馏的必要条件是( A )A.两种液体互不相容B.两种液体蒸汽压都较大C.外压小于101kPaD.两种液体的沸点相近9、液体A 与液体B 不相混溶。
在一定温度T ,当有B 存在时,液体A 的蒸汽压为( B )A.与体系中A 的摩尔分数成比例B.等于T 温度下纯A 的蒸汽压C.大于T 温度下纯A 的蒸汽压D.与T 温度下纯B 的蒸汽压之和等于体系的总压力10、氢气和石墨粉在没有催化剂时,在一定温度下不发生化学反应,体系的组分数是( A )A.2B.3C.4D.511、上述体系中,有催化剂存在时可生成n 种碳氢化合物,平衡是组分数为( A )A.2B.4C.n+2D.n12、相率适用于( D )A.封闭体系B.敞开体系C.非平衡敞开体系D.以达到平衡的多向敞开体系13、某物质在某溶剂中的溶解度( C )A.仅是温度的函数B.仅是压力的函数C.同是温度和压力的函数D.除了温度压力以外,还是其他因素的函数14、在实验室的敞口容器中装有单组份液体,对其不断加热,则看到( A )A.沸腾现象B.三项共存现象C.临界现象D.生化现象15、相图与相率之间的关系是( B )A.相图由相率推导得出B.相图由实验结果绘制得出,不能违背相率C.相图决定相率D.相图由实验结果绘制得出,与相率无关16、下述说法中错误的是( C )A.通过相图可确定一定条件下体系由几相构成B.相图可表示出平衡时每一相的组成如何C.相图可表示达到相平衡所需时间的长短D.通过杠杆规则可在相图上计算各相的相对含量17、三组分体系的最大自由度及平衡共存的最大相数为( D )A.3;3B.3;4C.4;4D.4;518、定容条件下)(4s HS NH 的分解压力为1θp 时,反应)()()(234g S H g NH s HS NH +⇔的标准平衡常数是( C )A.1B.1/2C.1/4D.1/819、水的三相点附近其蒸发热为44.821-⋅mol kJ ,熔化热为5.991-⋅mol kJ ,则在三相点附近冰的升华热约为( B )A.38.831-⋅mol kJB.50.811-⋅mol kJC.-38.831-⋅mol kJD.-50.811-⋅mol kJ20、在相图上,当物系点处于哪一点时,只存在一个相( C )A.恒沸点B.熔点C.临界点D.最低共沸点21、具有最低恒沸温度的某两组份体系,在其T-x 相图的最低点有( A )A.l g x x f ==;0B.l g x x f ==;1C.l g x x f >=;0D.l g x x f >=;122、80℃时纯苯的蒸汽压为0.991θp ,纯甲苯的蒸汽压为0.382θp ,若有苯-甲苯气、液平衡混合物在80℃时气相中苯的摩尔分数为30.0=苯y 则液相组成苯x 接近于( D )A.0.85B.0.65C.0.35 D0.1423、体系处于标准状态时,能与水蒸气共存的盐可能是: CA. Na 2CO 3B. Na 2CO 3 Na 2CO 3•H 2O Na 2CO 3•7H 2OC. Na 2CO 3 Na 2CO 3•H 2OD. 以上全否24.一个水溶液共有S 种溶质,相互之间无化学反应。

复旦物理化学1000题相平衡72
摘要:
一、引言
二、相平衡的定义和基本原理
三、相平衡的应用领域
四、相平衡在化学反应中的作用
五、相平衡对环境和经济的影响
六、结论
正文:
一、引言
相平衡是物理化学中的一个重要概念,涉及气相、液相和固相之间的相互转化。
在自然界和人类活动中,相平衡现象普遍存在,理解和掌握相平衡对于解决实际问题具有重要意义。
二、相平衡的定义和基本原理
相平衡是指在一定温度和压力下,多相体系中各相的组成和分布保持不变的状态。
相平衡的基本原理是热力学第二定律,即熵增原理。
在相平衡状态下,各相的熵值达到最大,且各相之间的化学势相等。
三、相平衡的应用领域
相平衡在许多领域有广泛应用,如地质学、材料科学、环境科学和化工等。
在地质学中,相平衡研究有助于揭示岩石相变、成矿作用等地质过程。
在材料科学中,相平衡原理可用于研究材料的制备、性能和稳定性等。
四、相平衡在化学反应中的作用
相平衡在化学反应中起关键作用。
在相平衡状态下,化学反应可以进行到最大限度,反应速率最大。
同时,相平衡也决定了化学反应的方向和限度。
五、相平衡对环境和经济的影响
相平衡现象对环境和经济发展具有重要影响。
例如,地球大气中的温室气体增加导致气候变暖,进而影响农业、水资源和生态系统。
此外,相平衡原理在石油、天然气和矿产资源开发中也有重要作用。
六、结论
相平衡是物理化学中的基本概念,具有广泛的应用价值。
第六章相平衡练习题一、是非题,下列各题的叙述是否正确,对的画√错的画×1、纯物质两相达平衡时,两相的吉布斯函数值一定相等。
()2、理想液态混合物与其蒸气达成气、液两相平衡时,气相总压力p与液相组成x呈线性关系。
()B3、已知Cu-Ni 可以形成完全互溶固熔体,其相图如右图,理论上,通过精炼可以得到两个纯组分。
()4、二组分的理想液态混合物的蒸气总压力介于二纯组分的蒸气压之间。
( )5、在一定温度下,稀溶液中挥发性溶质与其蒸气达到平衡时气相中的分压与该组分在液相中的组成成正比。
()6、恒沸混合物的恒沸温度与恒沸组成不随压力而改变。
( )7、在一个给定的体系中,特种数可以分析问题的角度不同而不同,但独立组分数是一个确定的数。
()8、自由度就是可以独立变化的变量。
()9、单组分体系的相图中两相平衡线都可以用克拉贝龙方程定量描述。
()10、在相图中总可以利用杠杆规则计算两相平衡时两相的相对量。
( )二、选择题1、在p下,用水蒸气蒸馏法提纯某不溶于水的有机物时,系统的沸点:()。
(1)必低于 K;(2)必高于 K;(3)取决于水与有机物的相对数量;(4)取决于有机物相对分子质量的大小。
2、已知A(l)、B(l)可以组成其t-x(y)图具有最大恒沸点的液态完全互溶的系统,则将某一组成的系统精馏可以得到:( )。
(1)两个纯组分;(2)两个恒沸混合物;(3)一个纯组分和一个恒沸混合物。
3、已知A和B 可构成固溶体,在组分A 中,若加入组分B 可使固溶体的熔点提高,则组B 在此固溶体中的含量必________组分B 在组分液相中的含量。
(1)大于;(2)小于;(3)等于;(4)不能确定。
4、硫酸与水可形成H2SO4H2O(s),H2SO42H2O(s),H2SO44H2O(s)三种水合物,问在101325 Pa的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种( )(1) 3种; (2) 2种; (3) 1种; (4) 不可能有硫酸水合物与之平衡共存5、对恒沸混合物的描写,下列各种叙述中哪一种是不正确的(1) 与化合物一样,具有确定的组成;(2) 恒沸混合物的组成随压力的改变而改变;(3) 平衡时,气相和液相的组成相同;(4) 其沸点随外压的改变而改变。
物理化学答案——第五章-相平衡[1]第五章相平衡⼀、基本公式和内容提要基本公式1. 克劳修斯—克拉贝龙⽅程mmH dp dT T V ?=?相相(克拉贝龙⽅程,适⽤于任何纯物质的两相平衡)2ln mH d p dT RT=相(克劳修斯—克拉贝龙⽅程,适⽤与其中⼀相为⽓相,且服从理想⽓体状态⽅程的两相间平衡)2.特鲁顿(Trouton)规则1188vap mvap m bH S J mol k T --?=?≈??(T b 为该液体的正常沸点)3.相律f+Φ=C+n C=S-R-R ′ f+Φ=C+2 (最普遍形式)f* +Φ=C+1 (若温度和压⼒有⼀个固定,f * 称为“条件⾃由度”)*4. Ehrenfest ⽅程2112()p p C C dpdT TV αα-=-(C p ,α为各相的恒压热容,膨胀系数)基本概念1.相:体系中物理性质和化学性质完全均匀的部分,⽤Φ表⽰。
相的数⽬叫相数。
2.独⽴组分数C =S -R -R ′,S 为物种数,R 为独⽴化学反应计量式数⽬,R ′为同⼀相中独⽴的浓度限制条件数。
3.⾃由度:指相平衡体系中相数保持不变时,所具有独⽴可变的强度变量数,⽤字母 f 表⽰。
单组分体系相图相图是⽤⼏何图形来描述多相平衡系统宏观状态与 T 、p 、X B (组成)的关系。
单组分体系,因 C =1 ,故相律表达式为 f =3-Φ。
显然 f 最⼩为零,Φ最多应为 3 ,因相数最少为 1 ,故⾃由度数最多为 2 。
在单组分相图中,(如图5-1,⽔的相图)有单相的⾯、两相平衡线和三相平衡的点,⾃由度分别为 f =2、f =1、f =0。
两相平衡线的斜率可由克拉贝龙⽅程求得。
图5-1⼆组分体系相图根据相律表达式f=C-Φ+2=4-Φ,可知f最⼩为零,则Φ最多为 4 ,⽽相数最少为 1 ,故⾃由度最多为 3 。
为能在平⾯上显⽰⼆组分系统的状态,往往固定温度或压⼒,绘制压⼒-组成(p-x、y)图或温度-组成(T-x、y)图,故此时相律表达式为f*=3-Φ,⾃然f*最⼩为 0 ,Φ最多为 3,所以在⼆组分平⾯图上最多出现三相共存。
物理化学《相平衡》习题及答案选择题1.二元恒沸混合物的组成(A)固定(B) 随温度而变(C) 随压力而变(D) 无法判断答案:C2.一单相体系, 如果有3种物质混合组成, 它们不发生化学反应, 则描述该系统状态的独立变量数应为(A) 3个 (B) 4个 (C) 5个 (D) 6个答案:B。
F=C-P+2=3-1+2=43.通常情况下,对于二组分物系能平衡共存的最多相为(A) 1 (B) 2 (C) 3 (D) 4 答案:D。
F=2-P+2=4-P,F不能为负值,最小为零。
当F=0时P=4。
4.正常沸点时,液体蒸发为气体的过程中(A) ΔS=0 (B) ΔG=0 (C) ΔH=0 (D) ΔU=0 答案:B。
此为可逆过程故ΔG=0。
5.以下各系统中属单相的是(A) 极细的斜方硫和单斜硫混合物 (B) 漂白粉 (C) 大小不一的一堆单斜硫碎粒(D) 墨汁答案:C。
6.NaCl(s), NaCl水溶液及水蒸汽平衡共存时, 系统的自由度(A) F=0 (B) F=1 (C) F=2 (D) F=3 答案:B。
F=C-P+2,C=2,P=3,故F=2-3+2=1。
7.如果只考虑温度和压力的影响, 纯物质最多可共存的相有(A) P=1 (B) P=2 (C) P=3 (D) P=4答案:C。
F=C-P+2=1-P+2=3-P,当F最小为零时P=3。
8.对于相律, 下面的陈述中正确的是(A) 相律不适用于有化学反应的多相系统 (B) 影响相平衡的只有强度因素(C) 自由度为零意味着系统的状态不变 (D) 平衡的各相中, 系统包含的每种物质都不缺少时相律才正确答案:B9.关于三相点, 下面的说法中正确的是(A) 纯物质和多组分系统均有三相点 (B) 三相点就是三条两相平衡线的交点(C) 三相点的温度可随压力改变 (D) 三相点是纯物质的三个相平衡共存时的温度和压力所决定的相点答案:D10.用相律和Clapeyron•方程分析常压下水的相图所得出的下述结论中不正确的是(A) 在每条曲线上, 自由度F=1 (B) 在每个单相区, 自由度F=2(C)在水的凝固点曲线上, ΔHm(相变)和ΔVm的正负号相反(D)在水的沸点曲线上任一点,压力随温度的变化率都小于零。
物理化学相平衡习题第五章相平衡物化试卷(⼀)1. NH4HS(s)和任意量的NH3(g)及H2S(g)达平衡时,有:(A) C= 2,Φ = 2,f= 2(B) C= 1,Φ = 2,f= 1(C) C= 2,Φ = 3,f= 2(D) C= 3,Φ = 2,f= 32.将固体 NH4HCO3(s) 放⼊真空容器中,恒温到 400 K,NH4HCO3 按下式分解并达到平衡: NH4HCO3(s) = NH3(g) + H2O(g) + CO2(g) 体系的组分数 C 和⾃由度数 f 为: (A) C= 2, f= 1 (B) C= 2, f= 2(C) C= 1, f= 0 (D) C= 3, f= 23. 某体系存在 C(s),H2O(g),CO(g),CO2(g),H2(g) 五种物质,相互建⽴了下述三个平衡:H2O(g) + C(s) === H2(g) + CO(g)CO2(g) + H2(g) === H2O(g) + CO(g)CO2(g) + C(s) === 2CO(g) 则该体系的独⽴组分数 C 为:(A) C=3 (B) C=2 (C) C=1 (D) C=44. 某⼀⽔溶液中有 n种溶质,其摩尔分数分别是x1,x2,...,xn,若使⽤只允许⽔出⼊的半透膜将此溶液与纯⽔分开,当达到渗透平衡时⽔⾯上的外压为 pw,溶液⾯上外压为 ps,则该体系的⾃由度数为:(A) f=n (B) f=n+1 (C) f=n+2 (D) f=n+35. NaCl ⽔溶液和纯⽔经半透膜达成渗透平衡时,该体系的⾃由度是:(A) 1 (B) 2 (C) 3 (D) 46. 在 101 325 Pa 的压⼒下,I2在液态⽔和 CCl4中达到分配平衡 (⽆固态碘存在),则该体系的⾃由度数为:(A) f*= 1 (B) f*= 2 (C) f*= 0 (D) f*= 37. ⼆元合⾦处于低共熔温度时物系的⾃由度 f 为:(A) 0 (B) 1 (C) 2 (D) 38. CuSO4与⽔可⽣成CuSO4.H2O,CuSO4.3H2O,CuSO4.5H2O三种⽔合物,则在⼀定温度下与⽔蒸⽓平衡的含⽔盐最多为:(A) 3种 (B) 2种(C) 1种 (D) 不可能有共存的含⽔盐9. 由CaCO3(s),CaO(s),BaCO3(s),BaO(s)及CO2(s)构成的平衡体系,其⾃由度为:(A) f=2 (B) f=1 (C) f=0 (D) f=310. 三相点是:(A) 某⼀温度,超过此温度,液相就不能存在(B) 通常发现在很靠近正常沸点的某⼀温度(C) 液体的蒸⽓压等于25℃时的蒸⽓压三倍数值时的温度(D) 固体、液体和⽓体可以平衡共存时的温度和压⼒11. 某⼀物质 X在三相点时的温度是20℃,压⼒是2个标准⼤⽓压。
第5章 相平衡复习、讨论基本内容:➢ 相:体系内部物理性质和化学性质完全均匀的一部分。
气相、液相、固相 ➢ 相数:体系内相的数目Φ≥1➢ 相图:描述多相体系状态随浓度、温度、压力等变量的改变而发生变化的图形➢ 均相体系:只有一相的体系Φ=1 ➢ 多相体系:含多相的体系Φ>1➢ 凝聚体系:没有(或不考虑)气相的体系 ➢ 物系点:相图中表示体系总组成的点 ➢ 相点:表示某一个相的组成的点➢ 液相线:相图中表示液相组成与蒸气压关系的曲线 ➢ 气相线:相图中表示气相组成与蒸气压关系的曲线 ➢ 步冷曲线:冷却过程温度随时间的变化曲线T-t➢ 独立组分数:C = S - R - R',S 为物种数,R 为体系中各物种之间独立的化学平衡关系式个数,R’为浓度和电中性限制条件的数目。
对于浓度限制条件,必须是某个相中的几种物质的浓度之间存在某种关系时才能作为限制条件。
C=1单组分体系,C=2二组分体系。
若没有化学变化:C=S ;含单质的体系且R ’=0:C=N ;含单质的体系且S>N :R = S – N 。
➢ 自由度:确定平衡体系状态所需要的独立强度变量的数目f ≥0➢ 最低(高)恒沸点:对拉乌尔定律正(负)偏差很大的双液系的T —x 图上的最低(高)点。
恒沸点时气相组成与液相相同,具有纯物质的性质,一定压力下恒沸混合物的组成为定值(f*=C-Φ+1=1-2+1=0)。
➢ 最低(高)恒沸混合物:最低(高)恒沸点对应的混合物。
恒沸物是混合物而不是化合物➢ 会溶温度(临界溶解温度):部分互溶双液系相图上的最低点或最高点 ➢ 转熔温度:不稳定化合物分解对应的温度➢ 共轭层:部分互溶双液系相图上的帽形区内溶液为两层➢ 相律:平衡体系中相数、独立组分数与变量数之间的关系f = C - Φ + n ➢ 杠杆规则:液相的物质的量乘以物系点到液相点的距离,等于气相的物质的量乘以物系点到气相点的距离。
Bn BBn n l ×(X B -x B )=n g ×(y B -X B )单组分体系相图(p-T):水、CO 2、C二组分体系相图(T-x):液-液体系:简单的低共熔混合物形成化合物稳定的化合物不稳定的化合物形成固溶体完全互溶固溶体部分互溶固溶体有一低共熔点有一转熔温度完全互溶理想的非理想偏差不很大正偏差很大 负偏差很大部分互溶具有最高会溶温度具有最低会溶温度同时有最高和最低会溶温度没有会溶温度不互溶液-固体系:基本要求:1. 明确基本概念(相、相数、组分数、自由度;S 、R 、R ’、f 、C 、Φ)2. 能熟练运用相律f=C-Φ+n (n 通常为2,在限制T 或p 时<2,也可能>2,见后面例题“NaCl 水溶液与纯水达成渗透平衡”)3.会用杠杆规则(适用于任何两相区)求两相平衡体系中两相的组成和量4.熟悉二组分体系的相图(会确定图中点、线、面的相态、相数、自由度等)5.熟悉相图规律、基本相图➢两相区的两侧是两个不同的单相区,两相区包含的两种相态就是两个单相区的相态➢三相线的两端分别顶着两个单相区、中间与另一个单相区相连➢在临界点以下,任何两个相数相同的相区都不可能上下相邻(相区交错规则)6.能够由步冷曲线画相图,或由相图画步冷曲线(相图中的两相平衡线与步冷曲线的转折点对应;三相线与步冷曲线的平台对应)。