实验报告:蟾蜍坐骨神经干动作电位引导及传导速度测定
- 格式:docx
- 大小:18.41 KB
- 文档页数:2

一、实验目的1. 了解和掌握蛙坐骨神经干动作电位的引导方法。
2. 观察坐骨神经干动作电位的波形特征。
3. 学习并掌握动作电位传导速度的测定方法。
4. 了解神经兴奋传导的基本原理。
二、实验原理动作电位是神经细胞膜在受到刺激时产生的一种短暂而迅速的电位变化。
通过在神经干表面放置电极,可以记录到神经干动作电位的变化。
动作电位的传导速度可以通过测量神经干长度和兴奋传导时间来计算。
三、实验材料1. 实验对象:蛙或蟾蜍2. 实验器材:微机生物信号采集处理系统、蛙类坐骨神经腓肠肌标本制备手术器械和药品1套、神经标本屏蔽盒、滤纸片、棉球、10% KCl溶液。
3. 实验药品:任氏液,2%普鲁卡因。
四、实验步骤1. 制备神经标本:将蛙或蟾蜍处死,用剪刀剪开背部皮肤,暴露坐骨神经,用手术剪分离出坐骨神经。
2. 连接电极:将两个电极分别放置在坐骨神经的远端和近端,确保电极与神经良好接触。
3. 设置信号采集系统:将电极连接到微机生物信号采集处理系统,设置好采样参数。
4. 给予刺激:用10% KCl溶液滴在近端电极上,给予神经刺激。
5. 观察并记录:观察微机屏幕上的波形,记录动作电位的波形特征。
6. 测定传导速度:测量神经干长度和兴奋传导时间,计算动作电位传导速度。
五、实验结果1. 动作电位波形:观察到的动作电位波形呈双相,先出现一个正向波峰,然后出现一个负向波峰。
2. 传导速度:根据实验数据计算得出动作电位传导速度约为15.2 m/s。
六、实验讨论1. 动作电位的产生和传导是神经细胞功能的基础。
通过本实验,我们了解了动作电位的引导方法,并观察到了其波形特征。
2. 动作电位传导速度的测定有助于了解神经系统的功能状态。
在本实验中,我们成功测定了动作电位传导速度,为后续研究提供了基础数据。
3. 实验过程中,我们发现动作电位波形呈现双相,这可能与神经干中不同类型的神经纤维有关。
在神经干中,存在不同传导速度和兴奋阈值的神经纤维,它们产生的动作电位叠加在一起,形成了复合动作电位。


生理实验报告!蟾蜍坐骨神经干动作电位的引导、传导速度和兴奋不应期的测定【实验目的】1. 观察蟾蜍坐骨神经动作电位的基本波形,加深理解兴奋传导的概念,理解可兴奋性在兴奋过程中的变化过程;2. 进一步掌握坐骨神经—腓神经标本的制备方法与引导动作电位的方法;3. 进一步熟悉实验室里仪器设备的操作。
【实验原理】1. 神经干动作电位是神经兴奋的客观标志。
当神经受到有效刺激时,处于兴奋部位的膜外电位负于静息部位,当动作电位通过后,兴奋处的膜外电位又恢复到静息时的水平。
神经干兴奋过程所发生的这种膜电位变化称神经复合动作单位。
如果将两个引导电极置于神经干表面时(双极引导),动作电位将先后通过两个引导电极,可记录到两个相反的电位偏转波形,称为双向动作电位;2. 神经纤维兴奋的标志是产生一个可传播的动作电位。
测定神经干上的神经冲动的传导速度,可以了解神经的兴奋状态。
在示波器上测量动作电位传导一定距离所耗费的时间,便可计算出兴奋的传导速度;3. 神经与肌肉等可兴奋组织的兴奋性在一次兴奋过程中可发生一系列变化,及绝对不应期、相对不应期、超常期和低常期,组织的兴奋性才可恢复。
为了测定神经干在兴奋过程中的兴奋性变化,可用双刺激法检查刺激引起的兴奋阙值和电位变化,即可观察到神经组织兴奋性的变化过程。
【实验对象】蟾蜍【实验器材】蛙类手术器械,BL-410生物信号记录分析系统,神经屏蔽盒,任氏液(林格液)等。
【实验步骤】制备蟾蜍坐骨神经-腓神经标本,并放入神经屏蔽盒内;(一)双相动作电位1.打开BL-410?实验项目?神经肌肉实验?神经干动作电位引导?记录出双相动作电位;2.由小到大改变刺激强度,记录阈强度和最大刺激强度;3.观察双相动作电位波形,测量最适刺激强度时的潜伏期、时程和波幅; (二)引导出最大刺激强度时的动作电位波形1.BL-410仪器操作:实验项目?神经肌肉实验?神经干动作电位传导速度测定?输入两电极之间的距离分别用潜伏期法和潜峰法测量其传导速度;2.潜伏期法:测量第一个通道动作电位潜伏期的时间(t),输入刺激电极到第一个引导电极间的距离(S),屏幕右上角显示传导速度和根据速度的公式计算传导速度:v=S/t;3.潜峰法:测量两个通道电位的动作电位的波峰间的时间差,为(t2-t1),测量并输入两对引导电极间的距离为(S2-S1),屏幕右上角显示传导速度和用公式计算传导速度:v=(S2-S1)/(t2-t1)。

实验名称:蟾蜍坐骨神经干复合动作电位(CAP)的测定实验目的:1. 确定蟾蜍坐骨神经干复合动作电位(CAP)的临界值和最大值。
2. 测定蟾蜍坐骨神经干CAP的传导速度。
3. 确定蟾蜍坐骨神经干CAP的不应期(相对不应期和绝对不应期)。
实验材料:1. 实验动物:蟾蜍(Bufo bufo gargarizans)2. 实验器材:生物信号采集系统RM6240,刺激电极,记录电极,接地电极,标本盒,手术器械,剪刀,镊子,刀片,生理盐水,酒精棉球等。
实验方法:1. 蟾蜍坐骨神经标本的制作:- 双毁髓处死蟾蜍后,剥去皮肤,暴露腰骶丛神经。
- 游离大腿肌肉之间的坐骨神经干及其下行到小腿的两个分支:胫神经和腓神经。
- 三段结扎,剪去无关分支后离体。
- 注意保持神经湿润。
2. 神经标本的连接:- 将神经搭于标本盒内,保证神经与电极充分接触。
- 中枢端接触刺激电极S1和S2,外周端接触记录电极R1-R2,之间接触接地电极。
3. 刺激输出线的连接:- 刺激输出线两夹子分别连接标本盒的刺激电极S1和S2。
- 插头接生物信号采集系统RM6240的刺激输出插口。
4. 信号输入线的连接:- 信号输入倒显得红色和绿色夹子分别连接记录电极(绿色夹子在前,引导出正向波形,即出现的第一个波峰向上)。
- 黑色夹子连接接地电极,插头接通道1。
5. 实验步骤:- 设置刺激参数:刺激频率、刺激强度、时间间隔等。
- 记录蟾蜍坐骨神经干复合动作电位(CAP)的波形。
- 逐渐增加刺激强度,观察CAP波形的变化。
- 确定CAP的临界值和最大值。
- 逐渐增加刺激强度,观察CAP传导速度的变化。
- 确定CAP的传导速度。
- 逐渐增加刺激强度,观察CAP不应期的变化。
- 确定CAP的相对不应期和绝对不应期。
实验结果:1. CAP临界值和最大值:- 当刺激强度为1.0 mA时,CAP的临界值为0.6 mV。
- 当刺激强度为1.5 mA时,CAP的最大值为1.2 mV。

蟾蜍的解剖与观察生命科学院张茜 111070094一、实验目的意义两栖动物绝大多数都是对人类有益的,例如消灭害虫、作药用资源等等。
蟾蜍作为医学、生理学重要的实验动物则使用更为广泛。
通过观察两栖类外形、皮肤、消化、呼吸、泄殖和循环等系统,了解两栖动物z 在生理学、药理学、毒理学等实验中常用组的准确取材。
重点:了解在摄食方式、营养、呼吸、排泄、生殖及血液循环器官系统的形态特征。
难点:理解两栖动物了解两栖动物由水生发展到陆地生活的各个器官结构与功能的适应性。
二、实验对象的获得与麻醉获得途径主要是由野外捕获或从特种养殖场购买(如牛蛙养殖场)。
抓取方法: 抓住其后腿,有经验者也可抓住其身体或借助一块布来抓,因蛙体表粘滑且蟾蜍体表有毒液分泌。
麻醉:两栖类皮肤有渗透性,放入含麻醉剂的溶液中就很容易麻醉。
0.1%的甲磺酸—三卡因(ms—222)水溶液在几分钟内即可麻醉动物,所需时间因身体大小而异。
也可用呼吸性麻醉剂,将蛙或蟾蜍放进玻璃罩或标本瓶内,同时放人浸有乙醚的棉花,几分钟后,即可发生作用。
三、实验操作与观察(一)外形观察将活蛙(或蟾蜍)静伏于解剖盘内,观察蛙(蟾蜍)的身体,可区分为头部、躯干和四肢三部分。
1.头部头:呈扁等腰三角形。
眼睛:在头两侧,稍向背部突出,有上下眼睑。
瞬膜:在下眼睑的内侧,为一半透明的薄膜,该膜向上延展可覆盖眼球。
外鼻孔:两眼的前方,近于头的前端的一对小孔内鼻孔:拉开下颌,在口腔顶壁的前端有一小孔鼻膜:在外鼻孔外缘的一对瓣状膜口:头端腹面有一很大的横裂鼓膜:眼后有一明显的褐色而稍下凹的圆形膜,是中耳腔与外界接触的地方。
蟾蜍的鼓膜较小,不明显耳后腺:蟾蜍鼓膜后上方有一对椭圆形的隆起,是由若干毒腺集合而成的,故又叫毒腺。
在受到压挤时,可分泌出一种乳白色的粘稠液,经加工之后即为中药“蟾酥”舌:在下颌前端内侧着生一柔软粘滑的舌,折向口腔内部,用镊子轻轻将舌拉出展平,可以看到蟾蜍的舌尖钝圆状。

一、实验目的1. 了解神经干动作电位的基本原理和传导过程;2. 掌握神经干动作电位传导速度和不应期的测定方法;3. 分析神经干动作电位在不同条件下的变化规律。
二、实验原理神经干动作电位是指神经纤维在受到刺激时,产生的一系列电生理现象。
当神经纤维膜电位达到一定阈值时,钠离子内流,产生动作电位,进而引起邻近神经纤维的兴奋和传导。
本实验通过观察和测量神经干动作电位,了解其传导速度和不应期等参数。
三、实验材料1. 实验动物:蟾蜍;2. 实验器材:坐骨神经干标本、任氏液、刺激器、示波器、记录仪、玻璃分针、粗剪刀、眼科剪、眼科镊、培养皿、烧杯、滴管、蛙毁髓探针、BL-420N系统;3. 实验药品:2%普鲁卡因。
四、实验方法1. 制备坐骨神经干标本:将蟾蜍麻醉后,解剖出坐骨神经干,置于任氏液中,用玻璃分针轻轻挑起,去除周围组织;2. 安装电极:将刺激电极和记录电极分别固定在坐骨神经干的两端,连接BL-420N系统;3. 刺激和记录:启动刺激器,给予坐骨神经干一定强度的刺激,观察示波器上的波形,记录动作电位传导速度和不应期;4. 重复实验:改变刺激强度,重复实验,观察动作电位传导速度和不应期的变化规律。
五、实验结果1. 动作电位传导速度:在实验条件下,坐骨神经干动作电位传导速度约为15.2 m/s;2. 不应期:在实验条件下,坐骨神经干动作电位不应期约为0.5 ms;3. 刺激强度与传导速度的关系:随着刺激强度的增加,动作电位传导速度逐渐增加,但增加幅度逐渐减小;4. 刺激强度与不应期的关系:随着刺激强度的增加,动作电位不应期逐渐延长。
六、实验讨论1. 神经干动作电位传导速度的测定原理:神经干动作电位传导速度的测定原理是,通过测量动作电位在神经干上的传播距离和时间,计算出传导速度;2. 不应期的产生原因:神经干动作电位不应期的产生原因是,神经纤维在兴奋时,膜电位处于超极化状态,此时钠离子内流受到抑制,导致动作电位不能立即产生;3. 刺激强度与传导速度、不应期的关系:刺激强度与传导速度呈正相关,但并非线性关系;刺激强度与不应期呈正相关。
蟾蜍坐骨神经干动作电位的引导、传导速度和兴奋性不应期的测定一、实验目的1、熟悉仪器设备的操作。
2、掌握神经干动作电位的引导及传导速度的测定方法。
3、测定神经干不应期,理解可兴奋组织的兴奋性在兴奋过程中的变化过程。
二、实验原理1、将两个引导电极置于神经干表面时,动作电位将先后通过两个电极引导处,可记录到电位偏转波形。
2、在示波器上测量动作电位传导一定距离所耗费的时间,可计算出兴奋的传导速度。
3、神经与肌肉等可兴奋组织的兴奋性在一次兴奋过程中可发生一系列变化,即绝对不应期、相对不应期、超常期和低常期,组织的兴奋性才逐渐恢复。
可先给一个条件刺激以引起兴奋,然后再用另一检验性刺激在前一兴奋的不同时相给予刺激,检查神经对检验性刺激反应的兴奋阈值以及所引起的动作程度,即可观察到神经组织兴奋性的变化过程。
三、实验对象:蟾蜍。
四、实验器材:蛙类手术器械,BL-410生物信号记录分析系统,神经屏蔽盒,任氏夜等。
五、实验步骤1、制备蟾蜍坐骨神经干标本(1)脊髓捣毁法处死蟾蜍,剪除躯干上部和内脏,注意勿损伤到坐骨神经,仅留下下后肢、骶骨、脊柱和坐骨神经。
(2)剥皮:握住脊柱断面(不要触碰神经),剥掉蟾蜍的皮肤。
(3)游离坐骨神经:沿脊柱一侧用玻璃探针分离坐骨神经,将其结扎并剪断。
再将坐骨神经大腿部分从坐骨神经沟中游离出来,将坐骨神经一直游离到腘窝处。
(4)游离腓神经,在此过程中动作要轻,切勿损伤神经。
2、仪器连接。
3、实验观察。
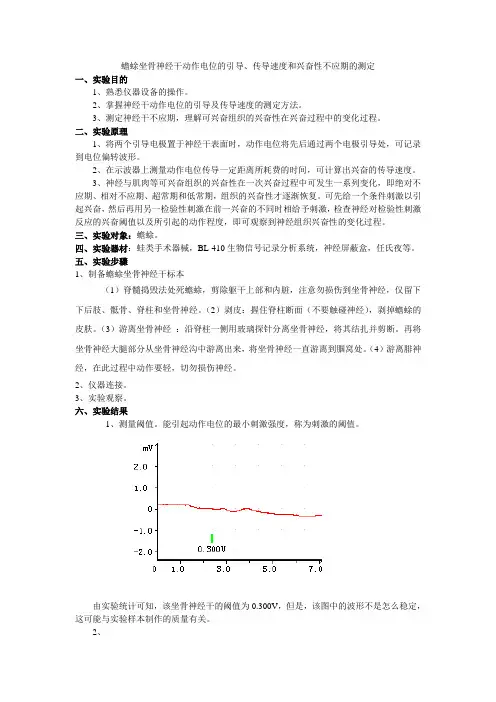
六、实验结果1、测量阈值。
能引起动作电位的最小刺激强度,称为刺激的阈值。
由实验统计可知,该坐骨神经干的阈值为0.300V,但是,该图中的波形不是怎么稳定,这可能与实验样本制作的质量有关。
2、(1)(2)(3)(4)图(1)为潜峰法测得的神经干动作电位的传导速度,两个通道的动作电位波峰的时间差为t2-t1=0.6ms,两对引导电极间的距离为S2-S1=1.8cm.屏幕上显示的传导速度为28.3m/s,利用公式计算的传导速度v=(S2-S1)/(t2-t1)=30m/s.图(2)为双相动作电位图。

一目的要求:1.学习蛙类动物单毁髓与双毁髓的方法。
2.学习并掌握蛙类坐骨神经干标本的制备方法。
3.学习电生理学实验方法。
4.观察蟾蜍坐骨神经干复合动作电位的波形,了解其产生的基本原理。
二基本原理:神经干在受到有效刺激后,可以产生动作电位,标志着神经发生兴奋。
如果在神经干另一端引导传来的兴奋冲动,可以引导出双相的动作电位,如在两个引导电极之间将神经麻醉或损坏,则引导出的动作电位即为单相向动作电位。
神经细胞的动作位是以”全或无”方式发生的。
坐骨神经干是由很多不同类型的神经纤维组成的,所以,神经干的动作电位是复合动作电位。
复合动作电位的幅值在一定刺激强度下是随刺激强度的变化而变化的。
三动物与器材:蟾蜍、常用手术器械(手术剪、手术镊、金冠剪、眼科剪、毁髓针和玻璃分针)、蛙板、固定针、不锈钢盘、污物缸、粗棉线、任氏液、计算机生理信号处理系统、神经屏蔽盒。
四方法步骤:1.蟾蜍的单毁髓与双毁髓一手握住蛙或蟾蜍(可用纱布包裹蟾蜍躯干部),背部向上。
用拇指压住蛙或蟾蜍的背部,食指按压其头部前端,使头端向下低垂; 另一手持毁髄针,由两眼之间沿中线向后触划,当触及到两耳中间的凹陷处(此处与两眼的联机成等边三角形)时,持针手即感觉针尖下陷,此处即是枕骨大孔的位置。
将毁髄针由凹陷处垂直刺入,即可进入枕骨大孔(图t-1)。
然后将针尖向前刺入颅腔,在颅腔内搅动,以捣毁脑组织。
如毁髄针确在颅腔内,实验者可感到针尖触及颅骨。
此时的动物为单毁髓动物。
再将毁髓针退至枕骨大孔,针尖转冋后方,与脊柱平行刺入椎管,以捣毁脊髓。
彻底捣毁脊髓时,可看到动物的后肢突然蹬直,而后瘫痪如棉(图t-2),此时的动物为双毁髓动物。
如动物仍表现肢肌肉紧张或活动自如,必须重新毁髓。
操作过程中应注意使蟾蜍头部向外侧(不要挤压耳后腺),防止耳后腺分泌物射入实验者眼内(如被射入,则需立即手生理盐水冲洗眼睛)。
2.坐骨神经干标本制备(1) 剥制后肢标本(图t-3)(2) 分离两后肢(图t-4)(3) 分离坐骨神经(图t-5)3.测定:阈刺激、最大刺激,打印不同刺激引起的动作电位重叠显示波形。

神经干双向动作电位的引导传导速度及不应期的测定组员:陈良鹏肖瑶伍思静袁果曼罗冰清实验目的:观察蟾蜍坐骨神经动作电位的基本波形,掌握坐骨神经制备方法与引导动作电位的方法,理解与刺激和最大刺激强度的概念测定潜伏期时程和波幅,学会通过潜伏期法和潜峰法测定神经冲动的传导速度,通过测定神经干不应期理解兴奋性在兴奋过程中的变化过程。
实验对象:蟾蜍实验药品和器材:蛙类手术器械,BL-410生物信号记录分析系统,神经屏蔽盒,任氏液等。
实验原理:1、神经动作电位是神经兴奋的客观标志。
当神经受到有效刺激时,处于兴奋部位的膜外电位负于静息电位;当动作电位通过后,兴奋处的膜外电位又恢复到静息时水平。
神经干兴奋过程所发生的膜电位变化称神经复合动作电位。
如果将两个引导电极置于神经干表面时(双极引导),动作电位将先后通过两个引导电极处,可记录到两个相反的电位偏转波形,称为双向动作电位。
2、神经纤维兴奋的标志是产生一个可传播的动作电位。
测定神经干上的神经冲动的传导速度,可以了解神经的兴奋状态。
在示波器上测量动作电位传导一定距离所耗费的时间,便可计算出兴奋的传导速度。
3、神经与肌肉等可兴奋组织兴奋性在一次兴奋过程中可发生系列变化,即绝对不应期相对不应期超常期和低常期,组织的兴奋性才逐渐恢复。
为了测定神经干在兴奋过程中的兴奋性变化,可先给一个条件刺激以引起神经兴奋,然后再用另一检验性刺激,检查神经对检验性刺激反应的兴奋阈值以及所引起的动作电位(AP)幅度,即可观察到神经组织兴奋性的变化过程。
在本次实验中,主要观察的是不应期的变化,而非整个兴奋性的周期性变化。
实验对象:蟾蜍实验步骤及方法:1.坐骨神经—腓神经标本的制备。
2.将标本放入神经屏蔽盒,(注意刺激电极端为神经干的中枢端)。
3.仪器连接。
4.BL-410的操作。
实验内容:1、刺激坐骨神经时诱发产生的动作电位由在最适刺激强度时动作电位原图上进行区间测量可知,潜伏期为0.32ms,时程t1为 1.92ms ,波幅为11.08mV。

蟾蜍的解剖与观察生命科学院张茜 111070094一、实验目的意义两栖动物绝大多数都是对人类有益的,例如消灭害虫、作药用资源等等。
蟾蜍作为医学、生理学重要的实验动物则使用更为广泛。
通过观察两栖类外形、皮肤、消化、呼吸、泄殖和循环等系统,了解两栖动物z 在生理学、药理学、毒理学等实验中常用组的准确取材。
重点:了解在摄食方式、营养、呼吸、排泄、生殖及血液循环器官系统的形态特征。
难点:理解两栖动物了解两栖动物由水生发展到陆地生活的各个器官结构与功能的适应性。
二、实验对象的获得与麻醉获得途径主要是由野外捕获或从特种养殖场购买(如牛蛙养殖场)。
抓取方法: 抓住其后腿,有经验者也可抓住其身体或借助一块布来抓,因蛙体表粘滑且蟾蜍体表有毒液分泌。
麻醉:两栖类皮肤有渗透性,放入含麻醉剂的溶液中就很容易麻醉。
0.1%的甲磺酸—三卡因(ms—222)水溶液在几分钟内即可麻醉动物,所需时间因身体大小而异。
也可用呼吸性麻醉剂,将蛙或蟾蜍放进玻璃罩或标本瓶内,同时放人浸有乙醚的棉花,几分钟后,即可发生作用。
三、实验操作与观察(一)外形观察将活蛙(或蟾蜍)静伏于解剖盘内,观察蛙(蟾蜍)的身体,可区分为头部、躯干和四肢三部分。
1.头部头:呈扁等腰三角形。
眼睛:在头两侧,稍向背部突出,有上下眼睑。
瞬膜:在下眼睑的内侧,为一半透明的薄膜,该膜向上延展可覆盖眼球。
外鼻孔:两眼的前方,近于头的前端的一对小孔内鼻孔:拉开下颌,在口腔顶壁的前端有一小孔鼻膜:在外鼻孔外缘的一对瓣状膜口:头端腹面有一很大的横裂鼓膜:眼后有一明显的褐色而稍下凹的圆形膜,是中耳腔与外界接触的地方。
蟾蜍的鼓膜较小,不明显耳后腺:蟾蜍鼓膜后上方有一对椭圆形的隆起,是由若干毒腺集合而成的,故又叫毒腺。
在受到压挤时,可分泌出一种乳白色的粘稠液,经加工之后即为中药“蟾酥”舌:在下颌前端内侧着生一柔软粘滑的舌,折向口腔内部,用镊子轻轻将舌拉出展平,可以看到蟾蜍的舌尖钝圆状。

山东大学人体机能学实验报告【实验名称】蟾蜍坐骨神经干动作电位传导速度和兴奋性不应期的测定【实验目的】加深理解兴奋传导的概念,掌握测定神经干动作电位传导速度的方法。
熟悉仪器设备的操作。
【实验对象】蟾蜍【实验药品和器材】蛙类手术器械,BL-410生物信号记录分析系统,神经屏蔽盒,任氏液等。
【实验步骤及方法】(详见书P57.P58)1.坐骨神经—腓神经标本的制备。
2.将标本放入神经屏蔽盒,(注意刺激电极端为神经干的中枢端)。
3.仪器连接。
4.BL-410的操作。
【实验结果】1.神经干动作电位的引导2.坐骨神经干动作电位传导速度V=(S2-S1)/(t2-t1)实验测得两对引导电极之间的距离为1.6cm,两个通道的动作电位波峰间的时间差为0.60ms。
计算得到传导速度V=26.7m/s3.二次刺激在兴奋周期之后相对不应期受到二次刺激绝对不应期受到二次刺激二次刺激没有出现相应的动作电位。
【实验结论】实验测得两对引导电极之间的距离为1.6cm,两个通道的动作电位波峰间的时间差为0.60ms。
计算得到传导速度V=26.7m/s【讨论与分析】1.神经干不能太干也不能太湿,剥离完整后在任氏液体中稳定15分钟左右,取出用滤纸吸干周围的任氏液。
2.神经干放置在引导电极上时,尽量拉直,不能使它下垂或斜向放置,以免影响神经干长度测量准确性。
3.神经干要尽可能长,两个引导电极之间的距离越远,测量的传导速度就越准确。
一、实验目的要求1.学习蟾蜍坐骨神经干标本的制备方法。
2.观察蛙坐骨神经干复合动作电位的波形,并了解其产生的基本原理。
二、实验原理1、神经干受到有效刺激后,可以产生动作电位,在另一端可以引导出双相的动作电位,如果在两个引导电极之间将神经麻醉或损坏,则引导出的动作电位即为单相动作电位。
2、坐骨神经干是以由很多不同类型的神经纤维组成的,所以,神经干的动作电位是复合动作电位。
复合动作电位的幅值在一定刺激强度下是随刺激强度的变化而变化的。
一、前言动物生理实验是生理学研究中不可或缺的环节,通过对动物生理过程的观察和测量,可以揭示动物生命活动的内在规律。
本报告册旨在记录动物生理实验的过程、结果及分析,为生理学研究和教学提供参考。
二、实验内容1. 实验一:蟾蜍坐骨神经干复合动作电位(CAP)(1)实验目的确定蟾蜍坐骨神经干复合动作电位(CAP)的临界值、最大值、传导速度及不应期。
(2)实验方法采用蟾蜍坐骨神经标本,通过生物信号采集系统记录CAP,分析其临界值、最大值、传导速度及不应期。
(3)实验结果与分析根据实验数据,得出蟾蜍坐骨神经干CAP的临界值、最大值、传导速度及不应期,并与理论值进行比较,分析误差原因。
2. 实验二:小鼠生理指标测定(1)实验目的掌握健康小鼠的外观检查方法、性别鉴定、捉拿和固定方法、小鼠灌胃给药与小鼠腹腔注射给药等技术。
(2)实验方法观察小鼠的外观、性别、捉拿、固定、给药等操作,记录相关数据。
(3)实验结果与分析根据实验数据,分析小鼠的生理指标,如体重、心率、呼吸频率等,并与正常值进行比较,判断小鼠生理状态。
3. 实验三:蟾蜍骨骼肌生理(1)实验目的确定蟾蜍骨骼肌收缩的阈水平和最大收缩,分析刺激强度与肌肉收缩之间的关系曲线,确定收缩的三个时期:潜伏期、缩短期、舒张期,分析刺激频度与肌肉收缩的关系。
(2)实验方法采用蟾蜍腓肠肌标本,通过生物信号采集系统记录肌肉收缩,分析其阈水平和最大收缩、刺激强度与肌肉收缩之间的关系曲线、收缩的三个时期及刺激频度与肌肉收缩的关系。
(3)实验结果与分析根据实验数据,得出蟾蜍骨骼肌收缩的阈水平和最大收缩、刺激强度与肌肉收缩之间的关系曲线、收缩的三个时期及刺激频度与肌肉收缩的关系,并与理论值进行比较,分析误差原因。
4. 实验四:实验动物学实验(1)实验目的熟悉实验动物的操作流程,包括抓取、固定、编号、给药、取血、麻醉、绝育、解剖等。
(2)实验方法按照操作流程,对实验动物进行各项操作,记录相关数据。
神经干动作电位及其传导速度的测定1.实验目的:应用微机生物信号采集处理系统和电生理实验的方法,测定蛙类坐骨神经干双相、单相动作电位,测定神经冲动的传导速度。
2.实验材料和方法:⑴材料:蟾蜍;任氏液;BB-3G标本屏蔽盒,微机生物信号采集处理系统。
⑵方法:2.1系统连接和参数设置启动RM6240系统:点击“实验”菜单,选择“神经干动作电位”项目。
仪器参数:1、2通道时间常数0.02s、滤波频率3kHz、灵敏度5mV,采样频率40~100kHz,扫描速度1.0ms/div。
单刺激模式,刺激宽度0.1ms,延迟1ms,同步触发。
2.2制备蟾蜍坐骨神经干标本2.2.1毁蟾蜍脑脊髓和下肢标本制备2.2.2剥皮的下肢标本俯卧位于蛙板上,并剪除其骶骨。
用玻璃分针分离脊柱两侧的坐骨神经,穿线,紧靠脊柱根部结扎,近中枢端剪断神经干,用尖头镊子夹结扎线将神经干从骶部剪口处穿出。
2.2.3用分针循股二头肌和半膜肌之间的坐骨神经沟,纵向分离暴露坐骨神经大腿部分,直至分离至腘窝胫腓神经分叉处,并用分针将腓浅神经、胫神经与腓肠肌和胫骨前肌分离。
2.2.4提起一侧结扎神经的线头,置剪刀于神经与组织之间,紧贴股骨,腘窝,顺神经走向,剪切至跟腱并剪断跟腱和神经。
剥离附着在神经干上的组织,完成后将其浸入盛有任氏液培养皿中待用。
2.3实验观察2.3.1神经干标本兴奋性将神经干移入标本屏蔽盒内,中枢端置于刺激电极处。
在刺激器功能框,选中触发选项,选择单刺激,波宽0.1ms,刺激电压1.0V,按“开始刺激”,观察屏幕上是否有动作电位,若神经干标本兴奋性良好,继续下一项目。
2.3.2中枢端引导动作电位神经干末梢置于刺激电极处,刺激电压1.0V,波宽0.1ms,按“开始刺激”,测定第1对引导电极引导的双相动作电位正相波和负相波的振幅和时程。
2.3.3末梢端引导动作电位和测定动作电位传导速度神经干中枢端置于刺激电极处,刺激电压1.0V,波宽0.1ms,按“开始刺激”,测定第1对引导电极引导的双相动作电位正相波和负相波的振幅和时程。
一、蟾蜍坐骨神经干动作电位引导及传导速度测定实验目的:加强理解兴奋传导的概念,掌握测定神经干动作电位传导速度的方法。
熟悉仪器设备的操作。
实验原理:通过测出示波器上动作电位传导的距离和传导所需的时间,计算传导速度。
1.潜伏期法:测量第一个通道动作电位潜伏期的时间t,输入刺激电极到第一个引导电极间的距离s,v=s/t。
2.潜峰法:测量两个通道的动作电位波峰间的时间差和两对引导电极间的距离,v=(s2-s1)/(t2-t1)。
实验步骤:1.制备坐骨神经-腓神经标本,放入神经屏蔽盒。
2.连接仪器,引导动作电位波形。
3.剪裁编辑图形,计算传导速度。
实验结果:1.图形2.计算S=10mm, t=0.33ms, v=10mm/0.33ms=33m/s分析讨论:1. 当刺激端和记录端离得较远时,引导的复合动作电位波形会发生什么改变,为什么?2.用什么方法可使复合动作电位传导速度的测量更准确?实验结论:神经干动作电位的传导速度为33m/s.二、兴奋性不应期的测定实验目的:了解测定不应期的方法和原理,并加深对兴奋性在兴奋过程中的变化过程的理解。
实验原理:神经纤维受到适宜刺激后,产生兴奋,即动作电位。
一次兴奋产生后,必须经绝对不应期、相对不应期、超常期等变化后,兴奋性才能恢复。
本实验通过生物电放大器引导并记录神经干复合动作电位,验证和测量动作电位的不应期。
先给一个条件刺激,再用另一个检验刺激在兴奋的不同时期给予刺激,检查兴奋未阈值及所引起动作电位的幅度。
实验步骤:1.制备坐骨神经-腓神经标本,并浸在任氏液中约5分钟,待其兴奋性稳定后实验。
2.连接仪器,设置实验参数,观察并测量神经干的不应期。
实验结果:(见图)分析讨论:1.为什么要先引导神经纤维的单向复合动作电位,然后再测量其兴奋性的不应期?2.神经干不应期与单根神经纤维的不应期有何不同?实验结论:兴奋性的不应期包括绝对不应期、相对不应期、超常期、低常期。
神经干双向动作电位的引导传导速度及不应期的测定作者:2011222681宋利婷组员:2011222702曾惜 2011222709张芮 2011222698杨袁虹一、实验对象:蟾蜍二、实验目的:观察蟾蜍坐骨神经动作电位的基本波形,掌握坐骨神经制备方法与引导动作电位的方法,理解与刺激和最大刺激强度的概念测定潜伏期时程和波幅,学会通过潜伏期法和潜峰法测定神经冲动的传导速度,通过测定神经干不应期理解兴奋性在兴奋过程中的变化过程。
三、实验内容图一:阈刺激和最大刺激强度的测定由上图可知,以0.100v为起始刺激强度,在0.100到0.300v的刺激时,不产生动作电位,逐渐增大强度,一直到当刺激强度为0.4V时,刚好引产生动作电位,即阈刺激为0.4V,当刺激强度达到1.4V后,即使再增加刺激强度,动作电位的幅也不再改变,即最大(适)刺激强度为1.4V.图二:潜伏期波幅时程及速度的测定由在最适刺激强度时动作电位原图上进行区间测量可知,潜伏期为0.60ms,时程t1为 2.84ms ,波幅为 2.72mV,输入刺激电极到第一个引导电极间距离s=1.3cm,以传导速度和根据速度的公式计算传导速度v1=s/t1,求得的速度v1=45m/s图三:潜峰法测量速度如图是通过测量两个通道的动作电位波峰间的时间差,为(t1-t2),测量并输入两对引导电极间的距离为(s2-s1),s2=4.7cm,s1=3.8cm,t1-t2=0.28ms,由传导速度和用公式计算传导速度:v2=(s2-s1)/(t1-t2),v2=321m/s图四:绝对不应期和相对不应期的测定由上图可知当刺激间隔为4.3mS时,第二个刺激引起的动作电位幅度刚好开始降低,的第二个刺激已经落入第一次兴奋的相对不应期,当刺激间隔为1.6mS时,第二个动作电位完全消失,几次是第二个刺激落入第一个刺激的绝对不应期期。
相对不应期=总不应期-绝对不应期=4.3ms-1.6ms=2.7ms四、实验讨论1、为什么在一定范围内,用电刺激神经,动作电位随刺激强度增大而增大,并没有出现“全或无”的现象?答:一根神经纤维在受到阈值以上刺激产生动作电位不随着刺激强度增大而增大,但是坐骨神经干是有许多神经纤维组成的,在受到阈值以上刺激时,由于引起不同数目神经纤维产生动作电位,但是每个神经对刺激的兴奋性,随着刺激强度增大,神经纤维产生动作电位的数目也越多,动作电位的幅度也就越大,当全部神经纤维都产生动作电位时,动作电位的幅度就不会增大了.故在一定范围内,坐骨神经干动作电位的幅度为何随着刺激强度增大而增大.2、为什么兴奋上神经上出现单向传导?答:因为在一个神经纤维细胞上,当某点受到刺激时,形成产生动作电位,形成局部电流,双向传导,当电流传导到两个神经纤维细胞相接触的部位,即神经突触时,但是兴奋只能从突触前膜穿到突触后膜,所以兴奋上神经上是单向传导的。
一、蟾蜍坐骨神经干动作电位引导及传导速度测定实验目的:加强理解兴奋传导的概念,掌握测定神经干动作电位传导速度的方法。
熟悉仪器设备的操作。
实验原理:通过测出示波器上动作电位传导的距离和传导所需的时间,计算传导速度。
1.潜伏期法:测量第一个通道动作电位潜伏期的时间t,输入刺激电极到第一个引导电极间的距离s,v=s/t。
2.潜峰法:测量两个通道的动作电位波峰间的时间差和两对引导电极间的距离,v=(s2-s1)/(t2-t1)。
实验步骤:1.制备坐骨神经-腓神经标本,放入神经屏蔽盒。
2.连接仪器,引导动作电位波形。
3.剪裁编辑图形,计算传导速度。
实验结果:1.图形2.计算S=10mm, t=0.33ms, v=10mm/0.33ms=33m/s分析讨论:1. 当刺激端和记录端离得较远时,引导的复合动作电位波形会发生什么改变,为什么?2.用什么方法可使复合动作电位传导速度的测量更准确?实验结论:神经干动作电位的传导速度为33m/s.二、兴奋性不应期的测定实验目的:了解测定不应期的方法和原理,并加深对兴奋性在兴奋过程中的变化过程的理解。
实验原理:神经纤维受到适宜刺激后,产生兴奋,即动作电位。
一次兴奋产生后,必须经绝对不应期、相对不应期、超常期等变化后,兴奋性才能恢复。
本实验通过生物电放大器引导并记录神经干复合动作电位,验证和测量动作电位的不应期。
先给一个条件刺激,再用另一个检验刺激在兴奋的不同时期给予刺激,检查兴奋未阈值及所引起动作电位的幅度。
实验步骤:1.制备坐骨神经-腓神经标本,并浸在任氏液中约5分钟,待其兴奋性稳定后实验。
2.连接仪器,设置实验参数,观察并测量神经干的不应期。
实验结果:(见图)分析讨论:1.为什么要先引导神经纤维的单向复合动作电位,然后再测量其兴奋性的不应期?2.神经干不应期与单根神经纤维的不应期有何不同?实验结论:兴奋性的不应期包括绝对不应期、相对不应期、超常期、低常期。
蟾蜍坐骨神经-腓肠肌标本的制作以及神经动作电位观察及传导速度测定一:实验目的1、掌握蛙类动物单毁髓与双毁髓的方法2、掌握坐骨神经-腓肠肌标本的制备3、掌握测定神经动作电位传导速度的原理与方法二:实验材料1、材料:蟾蜍2、器材:常用手术器械(毁髓针、手术镊、手术剪、骨钳、玻璃分针、图钉、蛙板、不锈钢盘)、污物缸、信号采集处理系统、神经屏蔽盒3、试剂:任氏液三:实验方法与步骤1、蟾蜍的双毁髓一只手握住蟾蜍,拇指按住其背部,食指压住其头部;另一只手捏住其嘴部将其头部上下轻轻扳动,找到第一道折痕,其中部即为枕骨大孔,用毁髓针垂直插入枕骨大孔;然后将针尖向前刺入颅腔并搅动以捣毁脑组织,此时的蛙为单毁髓动物;再将毁髓针退至枕骨大孔,针尖转向后方与脊柱平行刺入椎管,捣毁脊髓,彻底捣毁脊髓时可看到蟾蜍的后肢突然蹬直而后瘫软,此时的动物为双毁髓动物。
注意:a、若毁髓后蟾蜍的四肢肌肉紧张或活动自如,需重新毁髓;b、操作要快、准,且操作过程中不要挤压到蟾蜍的耳后腺,避免其分泌蟾酥。
2、坐骨神经-腓肠肌标本的制作(1)剥离后肢标本。
将蟾蜍背面向上置于蛙板上,用手术镊轻轻提起两前肢间的背部皮肤,用手术剪横向环形剪开皮肤,将蟾蜍身体下半部的皮肤剥离。
将蟾蜍剖腹,内脏向头部方向掀起,用骨钳在其第三节脊椎骨处剪断脊柱,然后用手术剪剪断相连的肌肉组织。
(2)分离两后肢。
用左手托起标本,拇指和食指固定住两后肢的肌肉,右手持骨钳剪断耻骨,手术剪剪开肌肉连接;纵向剪开脊柱使两后肢完全分离。
一只放入任氏液中备用,另一只用于继续下一步操作。
注意:在分离两后肢时需谨慎,不要使剪刀偏离中线太远以免损伤神经。
(3)分离坐骨神经。
将后置的脊柱端腹面向上,趾端想外侧翻转,使其足底向上,用图钉将其固定在蛙板上。
用玻璃分针沿脊神经向后分离坐骨神经。
股部沿肱二头肌和半膜肌之间的裂缝找到坐骨神经,用镊子和手术剪仔细去除半膜肌和肱二头肌,使神经暴露出来。
用玻璃分针轻轻挑起神经,自前向后剪断支配腓肠肌之外的分支,并去除神经上的其它组织。
一、蟾蜍坐骨神经干动作电位引导及传导速度测定
实验目的:加强理解兴奋传导的概念,掌握测定神经干动作电位传导速度的方法。
熟悉仪器设备的操作。
实验原理:通过测出示波器上动作电位传导的距离和传导所需的时间,计算传导速度。
1.潜伏期法:测量第一个通道动作电位潜伏期的时间t,输入刺激电极到第一个引导
电极间的距离s,v=s/t。
2.潜峰法:测量两个通道的动作电位波峰间的时间差和两对引导电极间的距离,v=
(s2-s1)/(t2-t1)。
实验步骤:1.制备坐骨神经-腓神经标本,放入神经屏蔽盒。
2.连接仪器,引导动作电位波形。
3.剪裁编辑图形,计算传导速度。
实验结果:1.图形
2.计算
S=10mm, t=0.33ms, v=10mm/0.33ms=33m/s
分析讨论:
1. 当刺激端和记录端离得较远时,引导的复合动作电位波形会发生什么改变,为什么?
2.用什么方法可使复合动作电位传导速度的测量更准确?
实验结论:神经干动作电位的传导速度为33m/s.
二、兴奋性不应期的测定
实验目的:了解测定不应期的方法和原理,并加深对兴奋性在兴奋过程中的变化过程的理解。
实验原理:神经纤维受到适宜刺激后,产生兴奋,即动作电位。
一次兴奋产生后,必须经绝对不应期、相对不应期、超常期等变化后,兴奋性才能恢复。
本实验通过生物电放大器引导并记录神经干复合动作电位,验证和测量动作电位的不应期。
先给一个条件刺激,再用另一个检验刺激在兴奋的不同时期给予刺激,检查兴奋未阈值及所引起动作电位的幅度。
实验步骤:
1.制备坐骨神经-腓神经标本,并浸在任氏液中约5分钟,待其兴奋性稳定后实验。
2.连接仪器,设置实验参数,观察并测量神经干的不应期。
实验结果:(见图)
分析讨论:
1.为什么要先引导神经纤维的单向复合动作电位,然后再测量其兴奋性的不应期?
2.神经干不应期与单根神经纤维的不应期有何不同?
实验结论:兴奋性的不应期包括绝对不应期、相对不应期、超常期、低常期。