赤霉素检测方法
- 格式:doc
- 大小:33.00 KB
- 文档页数:2

反向电渗流非水毛细管电泳法快速测定微量赤霉素郭振朋;王晓瑜;陈义【摘要】A non⁃aqueous capillary electrophoresis ( NACE) method for the rapid determination of micro gibberellins (GAs) was established. Dynamically poly(ethylene oxide) coated capillary was used, and electroosmotic flow ( EOF ) was reversed by using positive ions and adjusted by regulation the types and concentrations of the positive ions, running buffer, and pH of the buffer. With a buffer of 95% ( v/v ) methanol containing 10 mmol/L ammonium acetate at an acidity of 0�08% ( v/v) acetic acid, the EOF was successfully reversed to separate the eight GAs in less than 10 min. Its applicability was validated by the determination of GAs in germinating wheat seeds, with relative standard deviations ( RSDs) ≤2�1% ( intra⁃day) or ≤4�3% ( inter⁃day) for migration times, and RSDs≤4�5% ( intra⁃day) or≤6�9% ( inter⁃day) for peak areas. The limits of detection ( S/N=3) were in the range of 1�10-2�20 mg/L, with correlation coeffi⁃cients ( r2 ) of 0�998 2-0�999 3. The recoveries of the spiked samples were between 87�2% and 93�5%. The established method is simple, rapid, stable, and compatible with mass spectrome⁃try, so it is valuable to be further studied.%赤霉素是一类重要的植物激素,是结构相似的弱酸性二萜类化合物。


高效液相色谱法分离和测定小麦中的5种内源激素张玉琼;仲延龙;高翠云;董召荣;陈娜;王梅方【摘要】A high performance liquid chromatographic (HPLC) method was developed to determine the five endogenous hormones including indole-3-acetic acid (IAA),abscisic acid (ABA),gibberellic acid (GA3),zeatin (ZT) and salicylic acid (SA) in wheat.The separation conditions were optimized,and methanol was chosen as the extraction solvent.Then the extract was extracted by petroleum ether and ethyl acetate,and purified with the Sep-Pak C18 column.The chromatographic conditions were as follows:Eclipse XDB-C18 reversed phase column (250 mm ×4.6 mm,5 μm),the flow rate of 1 mL/min,the injection volume of 10 μL,and the detection wavelength of 240 nm were used for the separation of SA from 14.5 min to 18 min,while the detection at 254 nm used for the separation of the others.Methanol (A) and acetic acid aqueous solution (pH 3.6) (B) were used as the mobile phases with the linear gradient set as follows:0-7 min 20% A,7-10 min 20%A-28% A,10-17 min 28% A,17-19min 28% A-40% A,19-35 min 40% A.The results showed that:the hormones were separated well with the recoveries of 96.9%-98%,and the RSDs were in the range of 1.54% to 2.29%.It is a reliable method for rapid,accurate separation and determination of the endogenous hormones in wheat.%建立了高效液相色谱法(HPLC)用于分离和测定小麦中的吲哚乙酸(IAA)、脱落酸(ABA)、赤霉素(GA3)、玉米素(ZT)和水杨酸(SA)5种植物内源激素.经过条件优化,选用甲醇作为样品提取溶剂.然后,经石油醚和乙酸乙酯萃取,经Sep-Pak C18小柱纯化.液相色谱的分离采用Eclipse XDB-C18(250 mm ×4.6 mm,5μm)反相色谱柱;流速为1 mL/min;进样量10μL.检测器波长设置为254 nm; 14.5 min时切换到240 nm; SA洗脱后即18min时切换回254 nm.流动相A为甲醇,B为乙酸溶液(pH 3.6).梯度条件为0~7 min,20%A;7~10 min,20%A~ 28%A;10~17 min,28%A;17 ~ 19 min,28% A~40% A; 19 ~35 min,40%A.结果表明,小麦中各激素的分离效果理想,加标回收率达96.9%~ 98%,相对标准偏差在1.54%~ 2.29%之间.因此,该方法的建立为快速、准确地分离和测定小麦内源激素提供了可靠的方法.【期刊名称】《色谱》【年(卷),期】2013(031)008【总页数】4页(P800-803)【关键词】高效液相色谱法;内源激素;小麦【作者】张玉琼;仲延龙;高翠云;董召荣;陈娜;王梅方【作者单位】安徽农业大学生命科学学院,安徽合肥230036;安徽农业大学生命科学学院,安徽合肥230036;安徽农业大学生命科学学院,安徽合肥230036;安徽农业大学农学院,安徽合肥230036;安徽农业大学生命科学学院,安徽合肥230036;安徽农业大学生命科学学院,安徽合肥230036【正文语种】中文【中图分类】O658植物激素对植物的种子萌发、生长、开花、成熟、衰老、休眠等生命活动起直接或间接的调节、控制作用[1,2]。
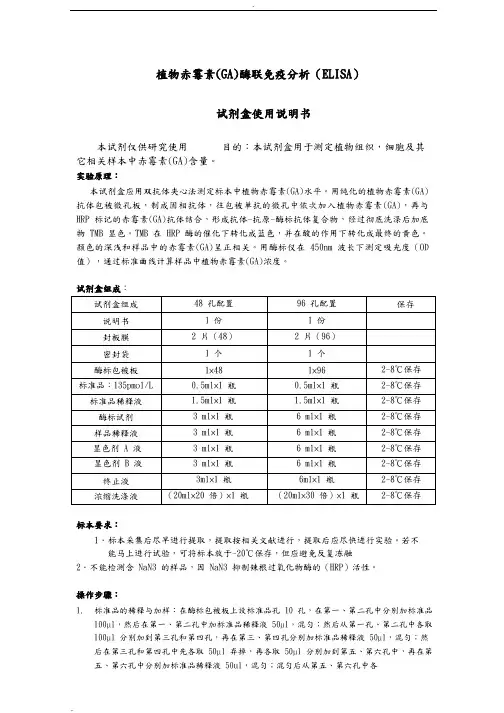
植物赤霉素(GA)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定植物组织,细胞及其它相关样本中赤霉素(GA)含量。
实验原理:本试剂盒应用双抗体夹心法测定标本中植物赤霉素(GA)水平。
用纯化的植物赤霉素(GA)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入植物赤霉素(GA),再与HRP 标记的赤霉素(GA)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物 TMB 显色。
TMB 在 HRP 酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的赤霉素(GA)呈正相关。
用酶标仪在 450nm 波长下测定吸光度(OD 值),通过标准曲线计算样品中植物赤霉素(GA)浓度。
试剂盒组成:标本要求:1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上进行试验,可将标本放于-20℃保存,但应避免反复冻融2.不能检测含 NaN3 的样品,因 NaN3 抑制辣根过氧化物酶的(HRP)活性。
操作步骤:1.标准品的稀释与加样:在酶标包被板上设标准品孔 10 孔,在第一、第二孔中分别加标准品100µl,然后在第一、第二孔中加标准品稀释液50µl,混匀;然后从第一孔、第二孔中各取100µl 分别加到第三孔和第四孔,再在第三、第四孔分别加标准品稀释液50µl,混匀;然后在第三孔和第四孔中先各取50µl 弃掉,再各取50µl 分别加到第五、第六孔中,再在第五、第六孔中分别加标准品稀释液 50ul,混匀;混匀后从第五、第六孔中各1取50µl 分别加到第七、第八孔中,再在第七、第八孔中分别加标准品稀释液50µl,混匀后从第七、第八孔中分别取50µl 加到第九、第十孔中,再在第九第十孔分别加标准品稀释液50µl,混匀后从第九第十孔中各取50µl 弃掉。



植物激素检测⽅法植物激素是植物体内合成的⽤于调控植物⽣成发育的⼩分⼦化合物。
⽬前,被公认的植物激素有6⼤类:细胞分裂素类(CK)、⾚霉素类(GAs)、⽣长素类(Auxins)、脱落酸类(ABA)、⼄烯和油菜素甾醇类(BRs)。
以下介绍⼏种常⽤的植物激素检测⽅法。
1. ⽣物检测法利⽤植物激素作⽤于植物组织或离体器官后产⽣的特异性反应,从⽽间接对植物激素的含量进⾏检测。
然⽽,不同结构的⾚霉素、⽣长素或激动素对不同⽣物检测法的响应有差异,因此有时可能⽆法测出。
由于⽣物检测法可以检测植物激素的活性,常⽤于植物激素的定性分析,也常与其他检测⽅法结合使⽤。
2. ⽓相⾊谱法通过与标准样品共⾊层分离来鉴定样品中植物激素的含量,但由于⽆法排除杂质与标准品的共⾊层分离,所以不能准确检测植物激素含量。
待测样品必须形成易挥发的甲基化和三甲基硅烷化衍⽣物才可以运⽤⽓相⾊谱法检测,所以在⼄烯的测定种,⽓相⾊谱法⽐较常⽤。
3. 酶联免疫法(ELISA法)将抗原或抗体与酶结合形成酶标抗原或抗体,加⼊酶反应的底物后,底物被酶催化⽣成有⾊产物,通过颜⾊反应的深浅来进⾏定性或定量分析。
酶联免疫吸附法的主要缺点在于抗体的制备复杂,且检测中难以排除交叉反应,⽆法保证植物激素检测的准确性。
4. ⾼效液相⾊谱法⾼效液相⾊谱法与不同检测器结合,能直接分析多种植物激素,是⽬前应⽤较⼴泛的植物激素检测⽅法之⼀。
除⼄烯外的其它植物激素均可以采⽤⾼效液相⾊谱法进⾏检测。
5. 质谱法液质联⽤(LC-MS)和⽓质联⽤(GC-MS)克服了⾼效液相⾊谱和⽓相⾊谱的在植物激素定性和定量⽅⾯的局限性,成为普遍接受和认可的植物激素检测⽅法。
GC-MS具有选择性好、专⼀性强、灵敏度⾼等特点,不⾜之处在于对样品的纯化要求很⾼,且样品需要衍⽣化处理。
不同于GC-MS,LC-MS不需要衍⽣化处理,简化了操作步骤,缩短了检测时间。
因此LC-MS更适⽤于植物激素的检测(除⼄烯外)。

植物激素的测定方法植物激素是一类在植物生长和发育过程中起调节作用的化合物。
它们能够通过调节细胞分裂、扩展和分化以及调控植物对环境的适应能力,从而影响植物的形态和功能。
为了研究和了解植物激素的作用机制,科学家们发展了多种测定植物激素的方法。
这些方法可以帮助我们准确地测定植物激素的浓度,并进一步揭示植物激素在植物生长和发育中的作用。
一种常用的测定植物激素的方法是高效液相色谱法(HPLC)。
HPLC 是一种基于植物激素在液相中的分离和检测原理的分析方法。
首先,样品中的植物激素会被提取出来,然后通过在柱子中的固定相上进行分离,最后利用紫外光谱仪或质谱仪等设备进行检测和定量。
这种方法具有高分离效果、高灵敏度和高准确性的优点,常用于测定植物激素如生长素、赤霉素、脱落酸等的浓度。
除了HPLC,放射免疫测定法(RIA)也是一种常用的测定植物激素的方法。
RIA利用植物激素与标记同位素结合的原理,通过测量放射性同位素的放射线强度来定量植物激素的浓度。
这种方法具有高灵敏度和高特异性的优点,可以测定植物激素如赤霉素、激动素、玉米素等的浓度。
酶联免疫吸附测定法(ELISA)也是一种常用的测定植物激素的方法。
ELISA利用植物激素与特异性抗体的结合反应,通过测量抗体与酶标记物质之间的酶活性来定量植物激素的浓度。
这种方法具有简单、快速和高灵敏度的优点,常用于测定植物激素如赤霉素、生长素、激动素等的浓度。
除了上述几种常用的测定方法,还有一些新兴的测定植物激素的方法也在不断发展中。
例如,质谱法(MS)是一种基于植物激素分子的质量和质荷比的分析方法,可以精确测定植物激素的结构和浓度。
另外,生物传感器和光谱法等新技术也被应用于植物激素的测定领域,为研究人员提供了更多的选择。
测定植物激素的方法多种多样,各有优劣。
科学家们根据研究目的和需求选择合适的方法来测定植物激素的浓度。
这些测定方法的发展和应用,不仅有助于我们深入了解植物激素的作用机制,还为植物生长和发育的调控提供了重要的理论和实践基础。

附件3豆芽中植物生长调节剂的测定BJS 2017031范围本方法规定了豆芽中11种植物生长调节剂的高效液相色谱-串联质谱测定方法。
本方法适用于豆芽中6-苄基腺嘌呤、4-氯苯氧乙酸、赤霉素、吲哚乙酸、吲哚丁酸、2,4-二氯苯氧乙酸、4-氟苯氧乙酸、异戊烯腺嘌呤、氯吡脲、多效唑和噻苯隆的检测。
2原理试样经含1%甲酸的乙腈溶液匀浆提取,脱水,离心后,上清液经分散固相萃取净化,用高效液相色谱-串联质谱测定,外标法定量。
3试剂和材料除另有规定外,本方法所用试剂均为分析纯,水为GB/T 6682 规定的一级水。
3.1试剂3.1.1甲醇:色谱纯。
3.1.2乙腈:色谱纯。
3.1.3甲酸:色谱纯。
3.1.4乙酸铵:色谱纯。
3.1.5无水硫酸镁。
3.1.6无水乙酸钠。
3.1.7十八烷基键合硅胶吸附剂(C18):粒径范围为40 μm—60 μm。
3.2试剂配制3.2.1含1%甲酸的乙腈溶液:量取10 mL甲酸,加乙腈稀释至1000 mL,混匀。
3.2.2含0.1%甲酸的5 mmol/L乙酸铵溶液:称取0.3854 g乙酸铵,用水溶解并稀释至1000 mL,加入1 mL甲酸,混匀。
3.3标准品6-苄基腺嘌呤、4-氯苯氧乙酸、赤霉素、吲哚乙酸、吲哚丁酸、2,4-二氯苯氧乙酸、4-氟苯氧乙酸、异戊烯腺嘌呤、氯吡脲、多效唑、噻苯隆标准品,纯度均≥90%。
标准品的中文名称、英文名称、CAS登录号、分子式、相对分子质量详见附录A中的表A.1。
—22 —3.4标准溶液的配制3.4.1植物生长调节剂标准储备液(1 mg/mL):精密称取6-苄基腺嘌呤、4-氯苯氧乙酸、赤霉素、吲哚乙酸、吲哚丁酸、2,4-二氯苯氧乙酸、4-氟苯氧乙酸、异戊烯腺嘌呤、氯吡脲、多效唑、噻苯隆标准品(3.3)各10 mg,分别置于10 mL容量瓶中,用甲醇溶解并稀释至刻度,摇匀,制成浓度各为1 mg/mL标准贮备液,-20℃保存。
3.4.2混合标准中间液A(10 μg/mL):分别精密量取11种植物生长调节剂标准储备液(1 mg/mL)(3.4.1)各1 mL,置于同一100 mL容量瓶中,用甲醇稀释至刻度,摇匀,制成浓度均为10 μg/mL 的混合标准中间液A。


植物生长素相关知识点高二植物生长素是调节植物生长和发育的重要激素。
它们起着促进或抑制植物细胞分裂、膨大以及各个发育阶段的转变等作用。
本文将介绍高二学生应该了解的植物生长素相关知识点。
一、植物生长素的类型植物生长素主要包括:赤霉素(GA)、生长素(IAA)、细胞分裂素(CYT)、脱落酸(ABA)以及少量的赤霉素酸(GAA)等。
二、植物生长素的生理功能1. 生长素(IAA)生长素调节植物的细胞分裂和伸长,影响植物的高度增长和根系发育。
它还参与调控植物的光生物学和重力生物学反应。
2. 赤霉素(GA)赤霉素促进植物胚胎发育、幼苗生长和植物的开花过程。
它还调节植物细胞分裂和伸长,促进果实膨大。
3. 细胞分裂素(CYT)细胞分裂素参与植物的细胞分裂过程,调节植物器官的增长和分化。
4. 脱落酸(ABA)脱落酸参与调节植物的休眠、脱水、抗寒和抗逆等生理过程。
它还抑制种子的发芽和幼苗的生长。
三、植物生长素的运输和转运1. 植物生长素通过韧皮部(木质部和韧皮部)进行长距离的运输。
2. 植物生长素的转运主要通过细胞间和细胞内的转运蛋白完成。
四、外源植物生长素的应用1. 促进植物生长外源赤霉素和生长素的使用可以促进植物的生长和开花。
2. 抑制植物生长外源脱落酸可以抑制植物的生长,常用于调节植物的大小和形态。
3. 促进果实膨大外源赤霉素可以促进果实的膨大,增加产量。
五、植物生长素的检测方法1. 生化方法通过生物化学分析,如间接酶联免疫吸附实验(ELISA)等,可以测定植物生长素的含量。
2. 生理方法通过观察植物的生长状况、细胞分裂和伸长等现象,可以初步判断植物生长素的影响程度。
六、植物生长素的应用前景植物生长素在农林业生产中有重要的应用前景。
例如,利用生长素促进植物生长可以增加农作物的产量;利用生长素抑制杂草的生长可以提高农作物的纯度和品质。
总结:植物生长素是调节植物生长和发育的重要激素,包括生长素、赤霉素、细胞分裂素和脱落酸等。
确定食品中的植物生长调节剂残留量的新方法一、背景介绍植物生长调节剂(Plant Growth Regulators,PGRs)是一类能够调节植物生长发育,提高农作物产量和质量的化学物质。
在现代农业生产中,广泛使用的PGRs包括赤霉素、气体素、生长素等。
然而,PGRs如果未能正确使用或严格控制其标准化生产,会造成其在农产品中的残留,甚至可能对人体健康造成威胁。
因此,确立新的方法来确定食品中的PGRs残留量显得尤为必要。
二、相关研究及现状在既有的方法中,使用气相色谱法(Gas Chromatography,GC)、液相色谱法(High-performance Liquid Chromatography,HPLC)等对农产品中的残留物进行检测。
然而,这类方法的缺陷在于需要大量的时间和人力,且可能存在误差。
近年来,一些新的方法和技术正在应用于PGRs残留检测中,例如计算机视觉技术、激光光谱学等。
三、新方法的核心原理我们将探讨一种新的方法,该方法可以通过近红外光谱(Near-infrared Spectroscopy,NIRS)技术来确定食品中的PGRs残留量。
该技术是一种基于物质分子的振动和转动能量的非破坏性方法,通过分析被测物质吸收、散射近红外光信号的强度、频率等性质,来快速检测样品的属性。
四、新方法的实现步骤1. 样品准备:将待测物样品进行采样、预处理,使其样品介质均质化且不影响测量结果。
2. 近红外光谱测量:将准备好的样品放置在近红外光谱测量仪中,记录并累积多组样品近红外光谱数据。
3. 数据预处理:对测量到的光谱信号进行基线校正、分段和光谱分析处理,确保数据准确性和可信度。
4. 建立检测模型:将样品数据集分成训练集和预测集,利用机器学习等算法来建立模型,进一步深化模型效果。
5. 残留检测:将新样品光谱数据输入到已建立好的检测模型中,即可得到相应的残留数据,并进行数据分析和处理。
五、新方法的应用该方法在检测农产品中PGRs残留量上具有显著的优势。
植物中的赤霉素测定原理赤霉素是一种重要的植物生长素,对植物的生长、发育和生理代谢有着重要的影响。
测定赤霉素含量对于了解植物的生长状态、深入研究其生理代谢机制以及引导植物的农艺栽培具有重要的意义。
赤霉素的测定原理主要包括提取赤霉素、分离纯化、测定浓度三个步骤。
首先是赤霉素的提取。
赤霉素的提取主要通过溶剂法和生化法两种方法来实现。
溶剂法主要是将植物样品研磨成粉末,然后使用有机溶剂(如乙酸乙酯、甲醇等)进行提取。
在提取过程中,还可以加入一些辅助提取剂,如氢氧化钠、二氯甲烷等。
生化法是将植物材料经过一系列的生物化学反应,如酶解、水解、酶抑制等,来提取植物中的赤霉素。
无论是溶剂法还是生化法,提取过程中需要控制一些条件,如温度、时间、溶剂比例等,以保证提取的赤霉素的纯度和稳定性。
接下来是赤霉素的分离纯化。
提取出的赤霉素在种子、叶片、茎等植物组织中的含量相对较低,需要进行分离纯化才能实现精确的测定。
常用的方法有液体色谱法、气相色谱法、薄层层析法等。
液体色谱法是最常用的方法,它可以通过改变移动相的组成、调整流速和温度等参数,来实现赤霉素分离的选择性。
气相色谱法则将提取出的赤霉素转化为易挥发的衍生物,通过气相色谱柱进行分离。
薄层层析法是一种简单经济的分离方法,通过在薄层板上进行层析,利用固定相和流动相的相互作用,实现赤霉素的分离。
最后是赤霉素浓度的测定。
常用的测定方法有免疫分析法、酶联免疫吸附测定法(ELISA)、高效液相色谱法(HPLC)等。
免疫分析法是一种通过抗体与赤霉素结合来进行测定的方法,可以通过比色、荧光强度等信号来得出赤霉素的含量。
ELISA是一种常用的免疫分析方法,它可以通过特异性的抗体与赤霉素结合,再通过酶的作用,来产生比色或荧光信号,从而间接测定赤霉素的含量。
HPLC是一种高效液相色谱方法,常用于对赤霉素进行定量分析,通过调节流动相、控制流速和检测器等参数,可以实现赤霉素的分离和定量。
总的来说,赤霉素的测定原理包括提取赤霉素、分离纯化和测定浓度三个步骤。
玉米检测报告单1. 背景介绍玉米(学名:Zea mays)是一种重要的粮食作物,也是一种经济作物,广泛应用于动物饲料、食品加工、工业用途等领域。
为保证玉米的质量和安全性,进行玉米的检测是必要的。
本文档将介绍玉米检测的相关内容和结果。
2. 检测标准玉米的检测需要符合国家相关的标准和要求。
下面是一些常见的检测标准:•国家食品安全标准 GB2762-2017 玉米中赤霉素限量•国家食品安全标准 GB5009.34-2017 玉米中黄曲霉毒素限量•国家食品安全标准 GB23200-2018 玉米中农药最大残留限量3. 检测项目玉米的检测通常包括以下项目:3.1. 赤霉素检测赤霉素是一种自然存在于玉米中的激素,但过量的赤霉素会对人体健康造成一定的危害。
赤霉素的检测主要通过高效液相色谱法(HPLC)进行。
3.2. 黄曲霉毒素检测黄曲霉毒素是由黄曲霉菌产生的一类毒素,对人体有一定的毒性。
黄曲霉毒素的检测常使用液相色谱-质谱联用法(LC-MS/MS)或酶联免疫吸附测定法(ELISA)。
3.3. 农药残留检测玉米的种植过程中可能使用农药进行病虫害的防治,因此农药残留的检测也是重要的一项内容。
农药残留的检测方法多种多样,包括气相色谱法(GC)、液相色谱法(LC)等。
4. 检测结果根据以上的检测项目,对一批玉米的检测结果如下:•赤霉素含量:符合国家食品安全标准 GB2762-2017 的限量要求,未检出超标情况。
•黄曲霉毒素含量:符合国家食品安全标准 GB5009.34-2017 的限量要求,未检出超标情况。
•农药残留:符合国家食品安全标准 GB23200-2018 的农药最大残留限量要求,未检出超标情况。
5. 结论根据对该批玉米的多项检测结果分析,该批玉米符合国家相关标准的要求,可以安全使用于食品加工和饲料领域。
6. 建议为了确保玉米的质量和安全性,建议玉米生产企业加强对种植环境的管理,合理使用农药,并定期进行玉米的检测。
肥料中赤霉酸含量标准1.标题本标准规定了肥料中赤霉酸的含量要求、取样规则、试验方法以及判定规则等内容。
2.背景随着农业生产的发展,肥料在作物生长中的作用日益凸显。
赤霉酸作为一种植物生长调节剂,在肥料中起着调节作物生长、提高产量和改善品质的作用。
为了规范肥料市场,保障农民权益,制定本标准。
3.目的本标准的目的是规定肥料中赤霉酸的含量要求、取样规则、试验方法及判定规则,确保肥料中赤霉酸的有效含量及其稳定性,从而为农业生产提供可靠的保障。
4.范围本标准适用于含有赤霉酸成分的肥料,包括但不限于复合肥、掺混肥、有机肥等。
5.方法5.1取样规则:从每批次肥料中随机选取10个以上样品进行检测,每个样品重量不低于100克。
5.2试验方法:采用液相色谱法测定肥料中的赤霉酸含量。
具体步骤如下:(1)将肥料样品粉碎,过60目筛;(2)称取适量样品,加入甲醇溶液进行提取;(3)提取液进行过滤,滤液进行真空干燥;(4)干燥后的残渣用甲醇溶解,进行液相色谱分析;(5)根据色谱峰面积,计算赤霉酸的含量。
6.取样规则6.1取样人员应经过专业培训,具备取样知识和技能。
6.2取样时应选取有代表性的样品,确保样品数量足够,并详细记录取样地点、时间、批次等信息。
6.3取样后应及时进行试验,以保证样品的新鲜度和准确性。
7.试验方法按照第5章所述的试验方法进行操作,需注意的是,在进行液相色谱分析时,应使用适合的色谱柱和检测器,并根据具体的色谱条件进行参数设置。
此外,在试验过程中要进行空白试验和平行试验,以验证试验的准确性和可靠性。
8.判定规则根据第7章的试验结果,判定肥料中赤霉酸的含量是否符合本标准的要求。
如果肥料中赤霉酸的含量低于规定的最小值,则判定该肥料为不合格产品。
需要注意的是,判定结果应由专业人员进行审核和确认,以保证判定结果的准确性和公正性。
9.实施日期本标准自发布之日起生效实施日期可根据实际情况进行设定具体日期可参照相关法规或规定的要求进行设定。
专利名称:控制植物赤霉素合成和株型的基因突变位点检测引物和检测方法及应用
专利类型:发明专利
发明人:凌宏清,刘毅
申请号:CN202111666507.7
申请日:20211231
公开号:CN114182044A
公开日:
20220315
专利内容由知识产权出版社提供
摘要:控制植物赤霉素合成和株型的基因突变位点检测引物和检测方法及应用。
本发明首先公开了一个控制植物赤霉素合成和株型的基因突变位点,所述突变位点位于植物CPS基因的第2768位核苷酸,从鸟嘌呤(G)突变为腺嘌呤(A),导致CPS蛋白Terpenesynth结构域中的第326位缬氨酸(V)突变成蛋氨酸(M)。
所述突变位点直接影响植物的赤霉素合成量及株型,所述位点突变会导致植物体内赤霉素含量低,株型矮化、丛生。
本发明还公开了用于检测该突变位点的引物以及检测方法,所述突变位点和引物在植物赤霉素合成量调节及株型改造的辅助选择育种,以及通过基因编辑该位点达到植物赤霉素合成量调节及株型改造的应用。
申请人:中国科学院遗传与发育生物学研究所,江西省中国科学院庐山植物园
地址:100101 北京市朝阳区北辰西路1号院2号
国籍:CN
代理机构:天津耀达律师事务所
代理人:侯力
更多信息请下载全文后查看。
赤霉素检测方法
1、原理
试样经甲醇提取、浓缩并净化后,用高效液相色谱法检测,外标法定量。
2、试剂
以下试剂,除特殊说明外,均为分析纯。
1)甲醇:色谱纯。
2)冰乙酸。
3)赤霉素标准品。
4)0.6%冰乙酸溶液:准确称取0.6mL冰乙酸,加水并定容至100 mL。
5)0.1mg/mL赤霉素标准液:准确称取0.010g赤霉素标准品于100 mL容量瓶中,用流动相溶解并定容至刻度。
3、仪器
高效液相色谱仪:配紫外检测器。
分析天平:感量0.0001g一台。
超声波清洗器。
容量瓶:25mL、100mL。
微孔滤膜:0.45μm。
4、测定
4.1 样品制备
准确称取样品0.10g,置于25mL容量瓶中,加约20mL甲醇,在超声水浴中超声20min,用甲醇定容至刻度,放置4 h后经0.45μm滤膜过滤,备用。
4.2 标品处理
将配制的标准液经0.45μm滤膜过滤,过滤后所得滤液作为对照溶液。
4.3 测定
4.3.1色谱条件
色谱柱:C18色谱柱,150 mm×4.6 mm,5 μm,或性能相当者。
流动相:甲醇:0.6%冰乙酸溶液= 35:65。
紫外检测器:波长为211 nm。
柱温:30℃。
流速:1.0 mL/min。
进样体积:20 μL。
4.3.2 色谱分析
分别注入20 μL赤霉素标准液及试样溶液,按上述列出的条件进行液相色谱分析测定,记录峰面积,响应值均应在仪器检测的线性范围之内。
根据标准品的保留时间定性,外标法定量。
4.4结果计算
样品中赤霉素含量(X)以毫克每克(mg/g)表示,按下式计算:
式中:
X:样品中赤霉素含量,单位为毫克每克(mg/g)。
A2:样品峰面积。
c: 赤霉素标准液浓度数值,单位为毫克每毫升(mg/mL)。
V:试样体积,单位为毫升(mL)。
A1:标品峰面积。
M:样品质量,单位为克(g)。
5、方法定量检出限
本方法定量检出限为:2mg/g。