胰岛素系列产品临床文献资料-白皮本(最终版)
- 格式:doc
- 大小:338.50 KB
- 文档页数:24



常用胰岛素的特点及临床应用【中图分类号】r977.15 【文献标识码】a 【文章编号】1004-7484(2012)06-0304-01胰岛素是机体内唯一可以降低血糖的激素,也是唯一同时促进糖原、脂肪、蛋白质合成的激素。
作用机制属于受体酪氨酸激酶机制[1]。
胰岛素与靶细胞上的受体结合,就能促进细胞外的葡萄糖进入这些细胞,并转化为糖原储存起来,同时胰岛素还能抑制糖原重新分解为葡萄糖,使血糖降低,此外胰岛素还能促进蛋白质和脂肪的合成,防止脂肪和蛋白质向葡萄糖转化。
胰岛素分泌不足,都会造成血糖升高,甚至引起糖尿病。
1 胰岛素分类[2]1.1根据来源和制备工艺分类分为动物胰岛素、人胰岛素和胰岛素类似物。
药用动物胰岛素主要有猪胰岛素和牛胰岛素。
是猪或牛胰腺的提取纯化物。
1.2人合成胰岛素主要成分为半合成胰岛素及生物合成胰岛素,半合成胰岛素是用猪胰岛素作为原料进行修饰合成的,生物合成胰岛素为中性或可溶性单组分胰岛素,由重组dna技术生产制成。
1.3胰岛素类似物,目前临床常用的胰岛素均为胰岛素类似物,通过重组dna合成,对人胰岛素进行序列修饰的一种类似正常胰岛素分泌作用的物质,目前临床主要有,甘精胰岛素、赖脯胰岛素、门冬胰岛素等。
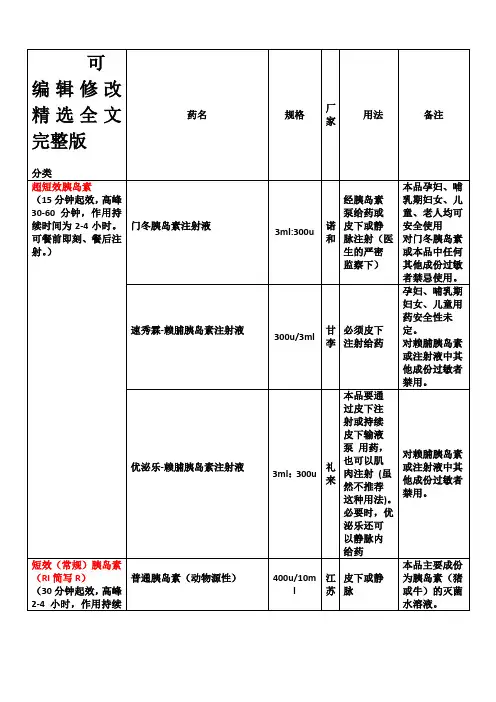
2 按起效时间分类的特点及临床应用[3] [4]胰岛素按照作用时间进行分类:超短效胰岛素、短效胰岛素、中效胰岛素、长效胰岛素。
2.1超短效胰岛素2.1.1药物品种超短效胰岛素均为胰岛素类似物。
包括门冬胰岛素和赖脯胰岛素2.1.2作用机制和特点普通短效的可溶性人胰岛素皮下注射后形成六聚体,与单体形成一定的聚合—解离平衡,释放到血液需要一定的时间。
门冬胰岛素注射到皮下后单聚体合成六聚体的倾向降低,能够快速释放入血,因此,与普通短效胰岛素相比,吸收速度快,起效迅速,作用持续时间短。
皮下注射门冬胰岛素后,10~20min起效,最大作用时间为注射后1~3h,降糖作用持续3~5h,赖脯胰岛素与门冬胰岛素的药理和药动学性质类似。


B y P e t e r X u前言新世纪伊始,世界科学家共同合作公布了人类基因组合的部分图谱,标志着生物技术又迈入了一个新阶段。
生物医药的发展与应用将对人类健康和生活产生深远的影响。
20世纪90年代以后,全球生物药品销售额以年均30%的速度增长,大大高于全医药行业年均不到10%的增长速度。
另外,生物药品销售额占整个医药行业销售额的比例也在不断提高,这个比例已从1995年的不足4%提高到2000年的9%。
目前大多数生物工程制药公司十几年来依然是营销赤字,但前景还是非常可观的,存在着巨大的盈利空间,这也是近几年来多家公司跻身生物药物的研发生产的原因之一。
综合目前真个生物技术药物的市场,市场占有率仍以EPO 为最大,占全球整个生物技术市场的28%。
其次为胰岛素占18%,干扰素及集落刺激因子各占15%,人生长激素占11%,纤维蛋白溶酶原活化剂占4%,其他药品类占9%。
目前,我国医药生物技术产业已初具规模。
自 1989年第一个拥有自主知识产权的基因工程药物重组干扰素α1b 获准投放市场以来,至今已有乙肝疫苗、白细胞介素、EPO 、G-CSF 等18种基因工程药物和疫苗获准上市。
我国生物技术药物产业作为后起之秀,正朝着科学的方向前进。
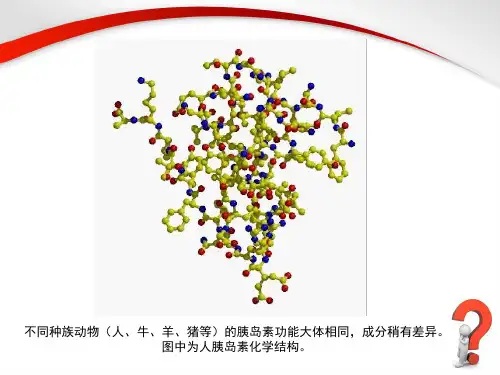
目前生物技术生产胰岛素的现状 胰岛素用于糖尿病的治疗历时已久,传统的方法是通过猪和牛胰岛提取的,这种传统的工艺不经提取的猪胰岛素量有限,更严重的是猪/牛胰岛素作为一种异源的蛋白质(两者要小相同,但与人胰岛素相比,猪胰岛素中有一个氨基酸不同,牛胰岛素有13个氨基酸不同)会刺激人体的免疫系统,产生严重的不良反应。
重组胰岛素产品Humulin ,的出现可谓是人类对抗糖尿病的一个福音。
B y P e t e r Xu1982年上市,是最早上市的生物技术药物,市场容量巨大。
人胰岛素的生产可谓是一波三折。
合成人胰岛素:合成具有商品化价值的人胰岛素是1982年以后开发成功的,最初是以猪胰岛素为起始原料生产,经半合成及氨基酸置换反应后得到人单组份胰岛素,这是通过分子筛反复层析得到的产品,其生物效价及纯度高,不良反应较少。


胰岛素—药物史系列6在全世界有超过3.8亿糖尿病患者;在亚洲四十岁以上的人群,十人中就有一人患有糖尿病;糖尿病在中国的发病率达到9.7%。
发现胰岛素以前,糖尿病治疗几乎没有有效的方法,胰岛素是现今治疗糖尿病最有效的药物。
这些事实都说明胰岛素的发现对于人类健康和社会进步是多么的重要,将其称为医学史上最伟大的成就之一也不为过。
1 糖尿病糖尿病是一种十分古老的疾病,公元前1550年,古埃及人书写在纸莎草上的文献上面,记载着一种多饮多尿的疾病。
这是考古学上可追溯的最早关于糖尿病的文字记录。
大约3000多年的时间里,世界各地的人们都在试图用他们各自的语言描述糖尿病。
古代中医把糖尿病称为“消渴病”,因为病人有多食多饮多尿和体重消减的症状,仿佛是饥渴所致。
公元前400年,中国的《黄帝内经》中就有“消渴”病的记载。
史记说司马相如“常有消渴疾”,因此被认为是中国历史上第一个确诊的糖尿病患者。
因为可以在患者的尿液里检测出葡萄糖,因此我们将其称为糖尿病。
糖尿病人血液中的葡萄糖没有被有效地分解,用以提供身体所需要的养分和能量。
一方面人体无法得到足够的营养和能量,体重下降,身体日益虚弱;另一方面体内的脏器和组织受到高血糖的腐蚀和侵害,逐渐丧失功能。
糖代谢的紊乱又进一步引起蛋白质、脂肪、水和电解质等一系列代谢紊乱综合征。
因为免疫功能减弱,糖尿病人容易患感冒、肺炎、肺结核等各种感染疾病,而且不易治愈。
一旦患上“糖尿病”,可能发生的并发症遍及全身。
在这些并发症中,出现率最高的是视网膜病变、肾病和神经障碍,并称为“糖尿病”的“三大特征并发症”。
糖尿病虽然被发现了上千年,但人类一直没有找到任何有效的治疗方法。
一百多年前,如果你得了糖尿病就等于判了死刑,不仅无药可救,而且有时候可能只剩下几个月的寿命了。
当时糖尿病患者不是死于酮症酸中毒,就是最终饿毙,悲惨的情状是现代人所不能想像的。
1869年保罗·兰格尔翰斯首次在显微镜下发现了胰岛,随后爱杜亚·拉基氏(Edouard Laguesse)提出胰岛可以分泌某种物质,可能与消化相关。

目录一、多中心、随机、开放、对照临床研究比较优思灵R和诺和灵R治疗糖尿病的有效性和安全性 (1)二、精蛋白人胰岛素注射液治疗糖尿病患者的安全性和有效性随机对照临床研究 (7)三、多中心、随机、开放、对照临床研究比较优思灵30R和诺和灵30R治疗糖尿病的有效性和安全性 (11)四、多中心、随机、开放、对照临床研究比较优思灵50R和诺和灵50R治疗糖尿病的有效性和安全性 (18)多中心、随机、开放、对照临床研究比较优思灵R和诺和灵R治疗糖尿病的有效性和安全性研究人员:四川大学华西医院主要研究者:田浩明重庆医科大学附属第二医院主要研究者:杨刚毅昆明医学院第二附属医院主要研究者:徐勉广西医科大学第一附属医院主要研究者:肖常青中国人民解放军白求恩国际和平医院主要研究者:朱旅云中国人民解放军北京军区总医院主要研究者:吕肖锋研究时间:2007年7月-2008年8月研究目的:研究珠海联邦制药股份有限公司研制的重组人胰岛素注射液(优思灵R)对糖尿病患者的疗效和安全性。
研究方法:多中心、阳性对照、1∶1随机、开放设计。
受试者数(计划和分析例数):计划入选病例220例,其中试验组与对照组各110例,实际入选病例211例,进入统计分析病例共211例。
入选标准:1) 签署知情同意书。
2) 年龄≥18岁,且≤65岁;男女不限。
3) 按照1999年WHO诊断标准的1型或2型糖尿病患者,糖化血红蛋白(HbA l C)≤13%且≥7.0%(1个月内的检查数据均有效),同时满足以下一项:空腹血糖(静脉)≤16.7且≥7.0mmol/L,或餐后2小时血糖≥11.1且≤25mmol/L,或餐后2小时以后血糖≥11.1且≤25mmol/L。
4) 2型糖尿病患者在筛选前使用一种或两种口服降糖药(除外胰岛素增敏剂)治疗,病情稳定,且药物剂量稳定1个月以上,血糖控制不佳者;或2型糖尿病患者在筛选前仅使用胰岛素治疗,病情稳定,且药物剂量稳定1个月以上,血糖控制不佳者;或新诊断的未用任何降糖药物的糖尿病患者;或1型糖尿病患者血糖控制不佳者。
排除标准:1) 在参加本试验前3个月内曾接受过其他研究药物。
2) 肝、肾功能受损,参照各医院当地实验室的正常值,血清ALT(谷丙转氨酶)超过参考范围上限2倍;Cr(肌酐)超过参考范围上限。
3) 体重指数(BMI)≤18或≥30kg/m2。
4) 在过去的5年内有药物滥用史及酒精依赖史。
5) 患者不愿意或不能够进行准确地血糖自我检测。
6) 患者不能够依从研究者决定的胰岛素治疗和糖尿病饮食。
7) 由研究者判断的出现反复发作的低血糖事件。
8) 现在使用全身糖皮质激素治疗。
9) 严重心脏病或心功能不全者。
如:失代偿性心衰(NYHAⅢ期及IV期);诊断为不稳定性心绞痛;既往12个月有心梗史等。
10) 严重的糖尿病及其他并发症:如慢性并发症如病程较长的痛性神经病变、视网膜病变眼底出血等;或急性并发症(如酮症酸中毒等)。
说明:如患者在筛选时并发酮症酸中毒,基线时如果已经纠正,可以入选。
11) 已知对试验药品或相关产品过敏。
12) 妊娠、哺乳或有意向妊娠,育龄期妇女未使用有效的避孕措施(是指宫内节育器、口服避孕药及阻碍措施)。
13) 任何其他的由研究者判定的明显情况或合并疾病:如内分泌、心脏、神经、肿瘤等疾患,其他胰腺疾病或经研究者判定未控制的高血压(血压≥180/110mmHg)。
14) 有精神病史者。
退出标准:1)出现明显不良事件,需中断治疗或影响继续治疗者(包括妊娠或有意向妊娠)。
2)反复发生严重低血糖事件,研究者认为要退出研究。
3)患者撤回知情同意。
4)受试者依从性差或不遵守试验步骤。
5)申办者中止试验。
6)其他。
受试药物的规格、批号、用法用量:优思灵R注射剂规格:100IU/ml, 3ml笔芯批号:20070802,有效期:24个月。
药物来源:珠海联邦制药股份有限公司中山分公司生产并提供用法用量: 每天三次,早中晚餐前15-30分钟内皮下注射。
起始剂量:建议每次4IU-8IU,或根据患者实际情况和研究者经验给予起始剂量。
使用后,前4周医生根据患者的血糖情况每周至少两次电话随访,指导患者调整胰岛素剂量,后8周内每周指导一次。
对照药物的规格、批号、用法用量:诺和灵R注射剂规格:100IU/ml, 3ml笔芯批号:TZF0016,有效期:30个月。
药物来源:诺和诺德生产,珠海联邦制药股份有限公司提供用法用量:同优思灵R注射剂。
评价标准主要疗效指标:(1)用药12周后,糖化血红蛋白(HbA1C)的变化。
次要疗效指标:(1)用药12周后,餐后2小时血糖的变化。
(2)用药12周后,空腹血糖的变化。
安全性评价指标:(1)研究依从性和治疗期间胰岛素用量。
(2)体格检查和生命体征的变化。
(3)实验室检查、ECG检查的变化。
(4)比较两组治疗药物的低血糖事件发生率。
(5)比较两组收集记录的其它不良事件,包括局部注射反应。
(6)治疗期间合并用药的情况。
(7)提前退出的情况。
统计方法统计分析数据集●全分析集(FAS)根据意向性分析(ITT)的基本原则,所有随机化并至少使用了一次试验药物的受试者将纳入FAS。
FAS中疗效相关部分的缺失数据采用最近一次观测数据结转(LOCF)的方法进行估计。
FAS是本次研究疗效评价的主要数据集。
●符合方案集(PPS)完成计划治疗与访视、没有明显影响疗效的违背方案情况的全部病例,构成本研究的符合方案集。
明显影响疗效的违背方案的情况在数据审核时最终确定,可以包括以下几种情况(但不限于这些情况):不符合入选标准,入选后存在干扰性治疗,依从性差,随访超出窗口期等。
PPS是本次研究疗效评价的次要数据集。
●安全性数据集(safety)经随机化分组,至少服用一次试验药物,具有用药后安性评价数据的病例,构成本研究的安全性人群。
一般原则所有的统计检验均采用双侧检验,P值小于或等于0.05将被认为所检验的差别有统计意义。
以治疗组间0.4% 的变化量作为非劣效性界限,即当优思灵R 与诺和灵R相差不超过0.4个百分点时,判断优思灵R非劣效于诺和灵R。
定量指标的描述将计算例数、均数、标准差、中位数、最小值、最大值。
分类指标的描述用各类的例数及百分数。
病例特征1、入组及完成情况总结各中心入组及完成病例数。
描述入组病例及安全性、有效性分析数据集的例数。
列出未进入PPS者清单。
2、一般信息与基线特征对患者的人口学资料、体格检查、疾病及疾病控制状况等进行统计描述。
根据变量的数字特征,采用t检验对两组的年龄、身高、体重、IBM、收缩压、舒张压、呼吸、心率、病程等定量数据进行基线比较;根据变量的数字特征,采用卡方检验/Fisher精确检验对两组的性别、糖尿病类型、疾病控制情况、体格检查等分类变量进行基线比较。
其中,患者年龄(岁)=(筛选日期-出生日期)/365.25病程(年)=(筛选日期-糖尿病诊断日期)/365.25 列出筛选前1个月内降糖药物治疗清单、筛选前1个月糖尿病并发症及伴随疾病清单。
疗效评价1、基线定义访视2(第0天)为基线。
对基线糖化血红蛋白、空腹血糖、餐后2小时血糖、胰岛素剂量等进行统计描述。
根据变量的数字特征,计算基线糖化血红蛋白、空腹血糖、餐后2小时血糖的例数、均数、标准差、中位数、最小值、最大值,采用成组t检验/Wilcoxon 秩和检验进行组间比较。
2、主要疗效评价描述糖化血红蛋白在基线、治疗结束时、12周末到基线的改变,以治疗和中心作为固定效应,糖化血红蛋白基线值作为协变量,用ANCOVA模型计算两组间差异的95%置信区间。
计算以治疗组间0.4%的变化量作为非劣性界限。
3、次要疗效评价∙描述餐后2小时血糖在基线、治疗结束时、12周末到基线的改变,以治疗和中心作为固定效应,糖化血红蛋白基线值作为协变量,用ANCOVA模型计算两组间差异的95%置信区间。
∙描述空腹血糖在基线、治疗结束时、12周末到基线的改变,以治疗和中心作为固定效应,糖化血红蛋白基线值作为协变量,用ANCOVA模型计算两组间差异的95%置信区间。
安全性评估1、研究依从性描述两组的研究时间、治疗时间、胰岛素剂量,采用成组t检验/Wilcoxon秩和检验进行组间比较。
描述两组依从性,采用卡方检验/Fisher精确检验/Wilcoxon秩和检验进行组间比较。
2、生命体征描述体征(血压、呼吸、心率)的变化,计算例数、均数、标准差、中位数、最小值、最大值,采用成组t检验/Wilcoxon秩和检验进行组间的比较。
3、体格检查描述筛选期与12周末各部位体格检查结果表格,出现异常的部位需列出。
4、实验室和ECG检查对实验室检查以治疗前后交叉表(根据正常值范围)的形式列出所有完成的检查项目。
出现异常值的并有临床意义的检查项目需列出。
5、低血糖事件治疗期间所有低血糖事件的种类、诱发因素、血糖自测情况将列表描述,同时计算自测血糖的例数、均数、标准差、中位数、最小值、最大值,采用成组t 检验/Wilcoxon秩和检验进行组间的比较。
6、其他不良事件治疗期间所有其他不良事件的种类、严重程度、发生频率及与研究药物的关系将列表描述。
对因不良事件而中止研究以及出现重度或严重不良事件的病例会加以特别的注明。
结果和结论本试验共随机化入组糖尿病患者211例,其中脱落病例2例。
经数据审核会议决定, 03中心89和04中心139号,基线与筛选时数值严重偏离;05中心184、210和212号严重违背方案,剔除该5例病例。
因此,完全符合方案病例204例。
两组患者基线时在人口学特征、病史、治疗史、糖化血红蛋白、空腹血糖和餐后2小时血糖等方面均有很好的可比性。
1、有效性结果主要疗效:试验结果显示:两组经过12周的治疗,优思灵R和诺和灵R的HbA l C分别由10.77%和10.33%下降至7.72%和7.62%,降幅分别为3.05%和2.72%,两组治疗前后HbAlc均显著下降(P<0.05)。
考虑中心与基线作用的协方差分析结果表明:两组变化差值(优思灵R- 诺和灵R)的最小二乘均数(95%可信区间)为0.03(-0.29,0.34),由于95%的可信区间的上限不超过0.4%,因此,可以认为优思灵R组的疗效非劣效于诺和灵R组,两组变化的差别无统计学意义(P>0.05)。
含有中心与治疗交互作用的协方差分析结果表明,治疗与中心的交互作用项无统计学意义(P>0.10),说明各中心之间的结果是一致的。
次要疗效:1)餐后2小时血糖试验结果显示:两组经过12周的治疗,优思灵R和诺和灵R的2hPBG分别下降5.77 mmol/L和5.26 mmol/L,两组治疗前后2HPBG均显著下降(P<0.05)。
考虑中心与基线作用的协方差分析结果表明,两组变化差值(优思灵R- 诺和灵R)的最小二乘均数(95%可信区间)为-0.37(-1.25,0.51),两组变化的差别无统计学意义(P>0.05),说明优思灵R与诺和灵R降低2HPBG的作用相似。