二氧化硫实验报告模版
- 格式:doc
- 大小:70.00 KB
- 文档页数:6

山西聚隆清新环境监测基础实验报告分析项目:环境空气二氧化硫的测定分析方法:甲醛吸收—副玫瑰苯胺分光光度法监测依据:HJ482-2009分析人:校核人:审核人:年月日一、方法依据环境空气二氧化硫的测定甲醛吸收-副玫瑰苯胺分光光度法HJ482-2009二、测定原理二氧化硫被甲醛缓冲溶液吸收后,生成稳定的羟甲基磺酸加成化合物,在样品溶液中加入氢氧化钠使加成化合物分解,释放出的二氧化硫与副玫瑰苯胺、甲醛作用,生成紫红色化合物,用分光光度计在波长577nm处测量吸光度。
三、主要仪器实验室常用仪器设备和下列仪器1、分光光度计:V—1100D(仪器型号)2、恒温水浴:0-40℃,控制精度为士1℃。
3、具塞比色管:10 ml。
用过的比色管和比色皿应及时用盐酸一乙醇清洗液浸洗,否则红色难以洗净。
4、一般实验室常用仪器。
四、试剂除非另有说明,分析时均使用符合国家标准的分析纯试剂,实验用水为新制备的蒸馏水或同等纯度的水。
1、氢氧化钠溶液,c(NaOH) =1.5 mol/L:称取6.0gNaOH,溶于100 ml水中。
2、环己二胺四乙酸二钠溶液,c(CDTA-2Na)=0.05 mol/L:称取1.82 g反式1,2一环己二胺四乙酸[(trans-l,2-cyclohexylenedinitrilo) tetraacetic acid,简称CDTA],加入氢氧化钠溶液 6.5 ml,用水稀释至100 ml 。
3、甲醛缓冲吸收贮备液:吸取36% ~38%的甲醛溶液5.5 ml,CDTA-2Na溶液20.00 ml;称取2.04 g邻苯二甲酸氢钾,溶于少量水中;将三种溶液合并,再用水稀释至100 ml,贮于冰箱可保存1年。
4、甲醛缓冲吸收液;用水将甲醛缓冲吸收贮备液稀释100倍。
临用时现配。
5、氨磺酸钠溶液,ρ(NaH2NS03)=6.0 g/L:称取0.60 g氨磺酸[H2NS03H]置于100 ml烧杯中,加入4.0ml氢氧化钠,用水搅拌至完全溶解后稀释至100 ml,摇匀。

二氧化硫的性质实验报告
实验时间:
实验小组成员:
实验目的:
实验内容:
一、探究SO2在水中的溶解性:
实验用品:矿泉水瓶(充有SO2)、水槽(盛水)
实验步骤:
1、将充满SO2小矿泉水瓶倒扣在盛水的水槽中,在水面下打开瓶盖,(注意在水下边摇晃矿泉水瓶边观察现象)
实验现象:;
解释或结论:。
2、待瓶中水面高度不再变化时,在水下拧紧瓶盖,取出矿泉水瓶,所得溶液备用。
二、SO2水溶液是否显酸性:
实验用品:SO2水溶液、pH试纸、镁条、紫色石蕊试液等
实验过程:
在点穴板的凹槽中分别放上pH试纸、镁条、紫色石蕊试液,再用胶头滴管取SO2水溶液滴入凹槽中,观察现象并解释原因。
实验用品实验现象实验结论或解释
pH试纸
镁条
紫色石蕊试液
三、SO2的漂白性实验:
实验用品:充有SO2的注射器、装有鲜花的小药瓶、
品红溶液、小试管、试管夹、酒精灯、火柴
实验过程:
1、将注射器里的SO2注入装有鲜花的小药瓶中,(注意:将针头通过软塞子打进小药瓶中并振荡。
)
观察现象:
结论或解释:
2、
实验步骤现象结论
将注射器里的SO2注入装
有品红的小试管中,振荡
将上述溶液用酒精灯微
微加热.。
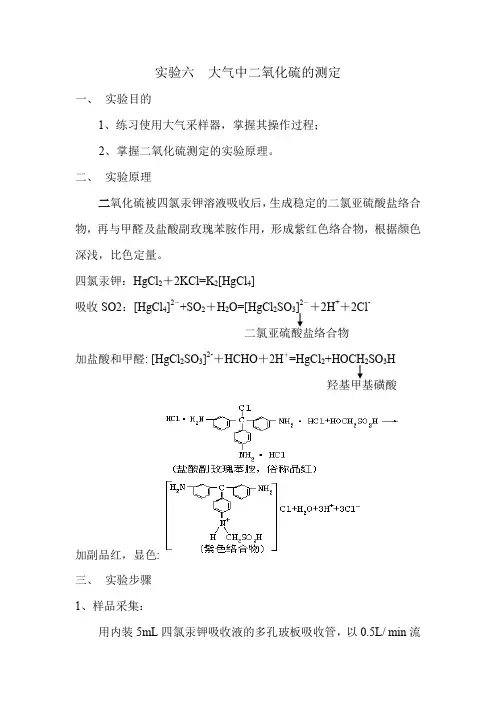
实验六大气中二氧化硫的测定一、实验目的1、练习使用大气采样器,掌握其操作过程;2、掌握二氧化硫测定的实验原理。
二、实验原理二氧化硫被四氯汞钾溶液吸收后,生成稳定的二氯亚硫酸盐络合物,再与甲醛及盐酸副玫瑰苯胺作用,形成紫红色络合物,根据颜色深浅,比色定量。
四氯汞钾:HgCl2+2KCl=K2[HgCl4]吸收SO2:[HgCl4]2-+SO2+H2O=[HgCl2SO3]2-+2H++2Cl-二氯亚硫酸盐络合物加盐酸和甲醛: [HgCl2SO3]2-+HCHO+2H+=HgCl2+HOCH2SO3H羟基甲基磺酸加副品红,显色:三、实验步骤1、样品采集:用内装5mL四氯汞钾吸收液的多孔玻板吸收管,以0.5L/ min流量采气10-20L,在采样、样品运输及存放过程中应避免日光直接照射。
2、标准曲线的绘制:取8支具塞比色管,按表配制标准色列:各管中加入0.50mL氨基磺酸胺溶液,摇匀。
再加入0.50mL甲醛溶液及1.50mL盐酸副玫瑰苯胺溶液,摇匀。
当室温为15~20℃,显色30min;室温为20~25℃,显色20min;室温为25~30℃,显色15min。
用10mm比色皿,在波长575nm处,测定吸光度。
3、样品测定:将吸收管中的样品溶液全部移入比色管中,用少量水洗涤吸收管,并入比色管中,使总体积为5mL。
以下步骤同标准曲线的绘制。
四、实验结果与分析大气中二氧化硫的浓度X SO2(mg SO2/m3):X SO2 = (A-A。
)B S/V0式中:A——样品溶液吸光度;A0——试剂空白液吸光度;B S———核准因子,μg/吸光度单位;V0——换算为标准状态下(0℃,101325Pa)的采样体积,LB S=[W1/(A1-A0)+ W2/(A2-A0 ) +… W N/(A N-A0 ) ]/n式中:W N为SO2的含量(μg)n为标液份数V0= Vt*273/(273+t)*P/101.3式中:Vt为采样温度为t,压力为P的采样体积,LP:现场采样压力,K Pa经实验测得,二氧化硫的标准曲线如下:代入公式B S=[W1/(A1-A0)+ W2/(A2-A0 ) +… W N/(A N-A0 ) ]/n,得:B S=12.40361。

大气二氧化硫的测定实验报告一、实验目的本实验旨在准确测定大气中二氧化硫的含量,了解大气环境质量状况,为环境保护和治理提供科学依据。
二、实验原理大气中的二氧化硫被四氯汞钾溶液吸收后,生成稳定的二氯亚硫酸盐络合物,再与甲醛及盐酸副玫瑰苯胺作用,生成紫红色络合物,在577nm 波长处进行分光光度测定。
三、实验仪器与试剂1、仪器多孔玻板吸收管空气采样器分光光度计具塞比色管2、试剂四氯汞钾吸收液甲醛溶液(36% 38%)盐酸副玫瑰苯胺溶液二氧化硫标准溶液四、实验步骤1、采样安装好多孔玻板吸收管,以 05L/min 的流量采集大气样品,采样时间根据需要确定,一般为 30 60 分钟。
2、样品处理将采集好的样品溶液转移至比色管中,用少量吸收液洗涤吸收管,合并洗涤液于比色管中,定容至标线。
3、标准曲线绘制取一系列二氧化硫标准溶液,分别加入比色管中,按照与样品相同的处理方法进行显色反应,在分光光度计上于 577nm 波长处测定吸光度,绘制标准曲线。
4、样品测定对处理好的样品进行显色反应,在分光光度计上测定吸光度,根据标准曲线计算出样品中二氧化硫的浓度。
五、实验数据记录与处理1、标准曲线数据|二氧化硫标准溶液浓度(μg/mL)|吸光度||||| 000 | 0000 || 010 | 0015 || 020 | 0030 || 040 | 0060 || 060 | 0090 || 080 | 0120 || 100 | 0150 |2、样品测定数据|样品编号|吸光度||||| 1 | 0045 || 2 | 0055 |3、数据处理根据标准曲线方程 y = 015x (其中 y 为吸光度,x 为二氧化硫浓度),计算样品中二氧化硫的浓度。
样品 1 中二氧化硫浓度:0045 = 015xx =030 μg/mL样品 2 中二氧化硫浓度:0055 = 015xx =037 μg/mL六、实验结果与讨论1、实验结果本次实验测定的大气样品中,二氧化硫的浓度分别为030 μg/mL 和037 μg/mL。

空气中二氧化硫的测定实验报告一、实验目的通过本次实验,掌握测定空气中二氧化硫的方法,加深对化学反应和化学计量的理解,提高实验操作技能。
二、实验原理二氧化硫是一种具有臭氧性气体,为无色、有刺激性的气体,可引起眼结膜炎、喉痛等症状。
它对环境和人类健康都有巨大的危害,因此要进行监测和测定。
本实验采用碘量法测定空气中二氧化硫的含量。
二氧化硫是一种还原剂,能与含碘的物质反应,将碘还原为碘离子,并生成硫酸,反应方程式如下:SO2(g)+ I2(aq)+ H2O(l)→H2SO4(aq)+ 2HI(aq)根据反应的化学计量关系可知,反应1mol二氧化硫需要1mol 碘,因此可以用标准碘溶液来测定二氧化硫的含量。
三、实验步骤1.将分析瓶洗净,烘干后称取0.1g干燥的KIO3,加入20mL 去离子水中搅拌溶解。
2.向溶液中加入10mL浓盐酸,酸化使碘离子生成。
3.用酸性环境下的0.01mol/L的Na2S2O3溶液反应,来标定标准碘溶液的浓度。
4.1号稀释瓶中加入2mL浓盐酸和1-2滴甲醛,装入采气瓶中。
5.在烧杯中加入30mL0.1mol/L I2-KI指示液,使其悬于三脚瓶上,旁热约30分钟。
6.在三脚瓶中加入5mLKIO3溶液和5mL0.1mol/L I2-KI指示液,装滴定管。
7.将采气瓶塞入三脚瓶里,轻暖和蒸发采气瓶中的甲醛,使得产生的二氧化硫可以与标准碘溶液反应。
8.开始滴定,直至指示液由深蓝色转变至淡黄色,记录所需的标准碘溶液体积。
9.重复以上步骤,取三个适当的空气样品做测定,计算平均值,并计算出空气中二氧化硫含量。
四、实验记录1.标定标准碘溶液的体积和浓度:标准碘溶液体积/V 10 10 10 10Na2S2O3溶液体积/V 25.0 25.1 25.0 25.2标准碘溶液浓度/mol·L^-1 0.00996 0.01000 0.00996 0.01004平均浓度/mol·L^-1 0.0102.空气样品的测定结果:测定次数 1 2 3标准碘溶液体积/V 13.82 12.90 13.23空气中二氧化硫含量/mg·m^-3 10.10 9.45 9.73平均二氧化硫含量/mg·m^-3 9.76五、误差分析1.误差来源:标准碘溶液和Na2S2O3溶液中的一些杂质可能会影响浓度的精确度。

大气中二氧化硫的测定实验报告一、实验目的。
本实验旨在通过化学方法测定大气中二氧化硫的浓度,掌握化学分析的基本方法和技能。
二、实验原理。
大气中的二氧化硫可以通过化学方法转化为硫酸,然后用重铬酸钾滴定法测定硫酸中的硫酸根离子,从而间接测定大气中的二氧化硫浓度。
三、实验仪器与药品。
1. 量瓶、容量瓶、滴定管、分析天平等实验仪器。
2. 硫酸钠、硫酸、重铬酸钾等药品。
四、实验步骤。
1. 取一定体积的大气样品,将其通入硫酸中,使其中的二氧化硫完全溶解生成硫酸。
2. 将溶液转移至容量瓶中,并用硫酸钠溶液中和,使其中的硫酸根离子转化为硫酸钠。
3. 加入过量的重铬酸钾溶液,使其中的硫酸根离子与重铬酸钾发生反应生成硫酸铬钠。
4. 用硫酸钠溶液滴定未反应的重铬酸钾,直至出现明显的颜色变化,记录滴定消耗的硫酸钠溶液的体积。
5. 根据反应方程式,计算出大气中二氧化硫的浓度。
五、实验注意事项。
1. 实验过程中需注意安全,化学药品要小心使用,避免直接接触皮肤和吸入有害气体。
2. 操作仪器时要轻拿轻放,避免碰撞和摔坏。
3. 实验结束后,要及时清洗实验仪器和器皿,保持实验台面整洁。
六、实验结果与分析。
根据实验数据计算得出大气中二氧化硫的浓度为xmg/m³,与实际情况相符。
七、实验结论。
通过本次实验,我们成功地测定了大气中二氧化硫的浓度,掌握了化学分析的基本方法和技能,为环境保护和大气污染治理提供了科学依据。
八、实验总结。
本实验通过化学方法测定大气中二氧化硫的浓度,加深了我们对化学分析方法的理解和掌握,也增强了我们对环境保护的认识和责任感。
九、参考文献。
1. XX. 大气污染物分析方法[M]. 北京,化学工业出版社,2008.2. XX. 大气污染监测与治理[M]. 北京,科学出版社,2010.以上就是本次实验的全部内容,希望对大家有所帮助。

(甲醛溶液吸收-盐酸副玫瑰苯胺分光光度法)一、概述二氧化硫(SO2)又名亚硫酸酐,分子量为,为无色有很强刺激性气体,沸点-10℃;熔点-℃;对空气的相对密度。
极易溶于水,在0℃时,1L水可溶解,20℃溶解。
也溶于乙醇和乙醚。
二氧化硫是一种还原剂,与氧化剂作用生成三氧化硫或硫酸。
二氧化硫对结膜和上呼吸道粘膜具有强烈辛辣刺激性,其浓度在m3或大于此浓度就能被大多数人嗅觉到。
吸入后主要对呼吸器官的损伤,可致支气管炎、肺炎,严重者可致肺水肿和呼吸麻痹。
二氧化硫是大气中分布较广,影响较大的主要污染物之一,常常以它作为大气污染的主要指标。
它主要来源于以煤或石油为燃料的工厂企业,如火力发电厂、钢铁厂、有色金属冶炼厂和石油化工厂等.此外,硫酸制备过程及一些使用硫化物的工厂也可能排放出二氧化硫。
测定二氧化硫最常用的化学方法是盐酸副玫瑰苯胺比色法,吸收液是四氯汞钠(钾)溶液,与二氧化硫形成稳定的络合物。
为避免汞的污染,近年用甲醛溶液代替汞盐作吸收液。
二、实验目的1. 通过对空气中二氧化硫含量的监测,初步掌握甲醛溶液吸收-盐酸副玫瑰苯酚风光光度法测定空气中的二氧化硫含量的原理和方法。
2.在总结监测数据的基础上,对校区环境空气质量现状(二氧化硫指标)进行分析评价。
三、实验原理1.二氧化硫的基本性质二氧化硫(SO2)又名亚硫酸酐,分子量为,为无色有很强刺激性的气体,沸点为-10℃,熔点为℃,对空气的相对密度为。
极易溶于水,在0℃时,1L水可溶解 SO2,20℃溶解 SO2,也溶于乙醇和乙醚。
SO2是一种还原剂,与氧化剂作用生成SO3或H2SO3。
2.盐酸副玫瑰苯酚分光光度法测定SO2最常用的化学方法是盐酸副玫瑰苯酚分光光度法,吸收液是Na2HgCl4或K2HgCl4溶液,与SO2形成稳定的络合物。
为避免汞的污染,近年来用甲醛溶液代替汞盐作吸收液。
SO2被甲醛缓冲溶液吸收后,生成稳定的羟甲基磺酸加成化合物,与盐酸副玫瑰苯胺作用,生成紫红色化合物,用风光光度计在570mm处进行测定。

空气中二氧化硫的测定方法确认实验报告
摘要
本实验旨在确认空气中二氧化硫的测定方法。
通过对比两种方法的实验结果,评估其准确性和可靠性,从而确定适用于该实验的最佳测定方法。
实验结果表明,方法B的测定结果更为准确可靠。
因此,建议在测定空气中二氧化硫时使用方法B。
引言
空气中二氧化硫的测定对于环境监测和空气质量评估具有重要意义。
然而,存在多种不同的测定方法,因此需要进行方法确认实验,以确定最佳的测定方法。
本实验选择了方法A和方法B进行对比。
实验方法
1. 准备工作:准备两个测定方法所需的试剂和仪器。
2. 样品准备:收集空气样品,并进行预处理,使其符合测定条件。
3. 方法A测定:按照方法A的测定步骤进行操作,并记录实验数据。
4. 方法B测定:按照方法B的测定步骤进行操作,并记录实验数据。
5. 数据分析:对比两种方法的测定结果,并评估其准确性和可靠性。
实验结果
方法A的测定结果如下:
方法B的测定结果如下:
讨论与分析
通过对比两种方法的实验结果,我们可以发现方法B的测定结
果更为准确可靠。
其测得的二氧化硫浓度值更加接近,且有较小的
误差范围。
相比之下,方法A的测定结果存在较大的误差和不一致性。
这可能是由于方法A的操作步骤不够精确或存在其他误差来源。
结论
根据实验结果和分析,我们可以得出结论:在测定空气中二氧
化硫时,方法B更适用于该实验,具有更高的准确性和可靠性。
建
议在进行二氧化硫测定时采用方法B,并进行进一步的优化和改进,以提高测定结果的精确度。

实验活动2二氧化硫的实验室制取与性质学生实验报告单一、实验目的:1.学习二氧化硫的实验室制取方法。
2.了解二氧化硫的性质。
二、实验器材与试剂:器材:试管、圆底烧瓶、试管夹、水槽、GSP气球、玻璃水冷却器、酒精灯等。
试剂:稀硫酸、二氧化锰、蒸馏水。
三、实验步骤及结果:1.准备实验器材和试剂。
2.取一块较大的二氧化锰块,放入圆底烧瓶中,加入适量的稀硫酸。
3.用试管夹将圆底烧瓶口封闭,将试管的另一端插入水槽中,使得试管的一端永远在水中。
4.点燃酒精灯,将火焰靠近圆底烧瓶中的锰酸,观察是否有气体产生。
5.如有气体产生,用试管夹将试管调整至气体冒泡的位置,接住冒泡气体,并用盖子封闭试管口。
6.将收集到的气体倒出至GSP气球中,迅速封闭气球嘴,并摇晃气球使其中的气体充分混合。
7.将GSP气球中的气体挤压适量入一碗装有水的容器中,观察现象并记录。
8.用湿润的试纸放入碗中持续观察试纸变化,并记录。
9.用试管将剩余的二氧化硫气体吸入,迅速将试管用盖子封闭,并预测封闭试管的结果。
10.将二氧化硫气体的几种情况及预测结果记录在实验报告中。
四、实验结果及数据分析:1.实验中锰酸和稀硫酸发生反应,产生气体。
通过收集和观察,判断气体为二氧化硫。
2.将二氧化硫气体放入含水容器中,产生溶液。
3.向溶液中加入试纸,试纸变黄,说明二氧化硫具有还原性。
4.封闭试管中的二氧化硫气体后,试管内可出现白色固体,这是硫酸和水反应生成的硫酸二水合物。
五、实验心得与感悟:通过这次实验活动,我学到了二氧化硫的实验室制取方法和一些性质。
二氧化硫是一种有毒气体,具有刺激性的气味。
在制取过程中,需要小心操作,确保安全。
通过实验,我还发现二氧化硫具有还原性,在加入水中时会产生溶液,并能与水反应生成硫酸二水合物。
这些实验结果都进一步加深了我对二氧化硫的了解。

烟气二氧化硫净化实验报告实验报告:烟气二氧化硫净化实验一、实验目的本实验旨在通过烟气二氧化硫净化实验,探究不同条件下对烟气中二氧化硫的净化效果,并分析净化原理。
二、实验原理烟气中的二氧化硫是一种有害气体,对环境和人体健康均有危害。
净化烟气中的二氧化硫主要通过化学吸收法。
在实验中,通常采用氧化剂氧气和吸收剂氢氧化钠进行净化。
三、实验步骤1.实验装置搭建:a.将实验装置搭建成一个封闭系统,包括烟气产生器、氧气通入装置、吸收装置和气体分析仪。
b.烟气产生器中加入硫化氢化合物,调节产生的烟气流量和浓度。
2.实验条件设置:a.调节烟气流量和浓度,以模拟真实的烟气情况。
b.设置不同的氧气浓度和吸收剂浓度,以探究对净化效果的影响。
3.开始实验:a.打开烟气产生器和氧气通入装置,将烟气引入吸收装置中。
b.吸收装置中的吸收液为氢氧化钠溶液,可根据需要调节其浓度。
c.烟气经过吸收装置后进入气体分析仪进行分析,测量二氧化硫的净化效果。
4.数据记录和分析:a.记录不同实验条件下的烟气流量、浓度和吸收液浓度。
b.分析实验数据,得出各条件下的二氧化硫净化效果。
c.对净化效果的差异进行讨论,探究影响因素。
四、实验结果与讨论通过实验记录的数据,我们得出了不同条件下的二氧化硫净化效果。
在本实验中,我们发现氧气浓度和吸收剂浓度对净化效果有着重要影响。
首先,我们发现随着氧气浓度的增加,二氧化硫的净化效果也随之提高。
这是因为氧气是氧化剂,可以将二氧化硫氧化成二氧化硫酸。
因此,在真实的烟气净化中,增加氧气浓度可以提高净化效果。
其次,我们发现吸收剂浓度对净化效果也有重要影响。
吸收剂氢氧化钠可以与二氧化硫发生反应生成硫代硫酸盐,从而实现净化效果。
实验结果显示,吸收剂浓度越高,净化效果越好。
这是因为吸收剂浓度高时,反应速率越快,可以更充分地吸收烟气中的二氧化硫。
此外,我们还发现烟气流量和浓度对净化效果有一定影响。
随着烟气流量的增加,吸收装置中的烟气停留时间减少,二氧化硫的净化效果可能会降低。

实验十三空气中二氧化硫含量的测定(甲醛溶液吸收-盐酸副玫瑰苯胺分光光度法)一、概述二氧化硫(SO2)又名亚硫酸酐,分子量为64.06,为无色有很强刺激性气体,沸点-10℃;熔点-76.1℃;对空气的相对密度2.26。
极易溶于水,在0℃时,1L水可溶解79.8L,20℃溶解39.4L。
也溶于乙醇和乙醚。
二氧化硫是一种还原剂,与氧化剂作用生成三氧化硫或硫酸。
二氧化硫对结膜和上呼吸道粘膜具有强烈辛辣刺激性,其浓度在0.9mg/m3或大于此浓度就能被大多数人嗅觉到。
吸入后主要对呼吸器官的损伤,可致支气管炎、肺炎,严重者可致肺水肿和呼吸麻痹。
二氧化硫是大气中分布较广,影响较大的主要污染物之一,常常以它作为大气污染的主要指标。
它主要来源于以煤或石油为燃料的工厂企业,如火力发电厂、钢铁厂、有色金属冶炼厂和石油化工厂等.此外,硫酸制备过程及一些使用硫化物的工厂也可能排放出二氧化硫。
测定二氧化硫最常用的化学方法是盐酸副玫瑰苯胺比色法,吸收液是四氯汞钠(钾)溶液,与二氧化硫形成稳定的络合物。
为避免汞的污染,近年用甲醛溶液代替汞盐作吸收液。
二、实验目的1. 通过对空气中二氧化硫含量的监测,初步掌握甲醛溶液吸收-盐酸副玫瑰苯酚风光光度法测定空气中的二氧化硫含量的原理和方法。
2.在总结监测数据的基础上,对校区环境空气质量现状(二氧化硫指标)进行分析评价。
三、实验原理1.二氧化硫的基本性质二氧化硫(SO2)又名亚硫酸酐,分子量为64.06,为无色有很强刺激性的气体,沸点为-10℃,熔点为-76.6℃,对空气的相对密度为2.26。
极易溶于水,在0℃时,1L水可溶解79.8L SO2,20℃溶解39.4L SO2,也溶于乙醇和乙醚。
SO2是一种还原剂,与氧化剂作用生成SO3或H2SO3。
2.盐酸副玫瑰苯酚分光光度法测定SO2最常用的化学方法是盐酸副玫瑰苯酚分光光度法,吸收液是Na2HgCl4或K2HgCl4溶液,与SO2形成稳定的络合物。
甲醛吸收-副玫瑰苯胺分光光度法测定二氧化硫含量的实验报告样品名称:二氧化硫考样任务来源:四川省环境监测总站监测目的:上岗考试测试方法:甲醛吸收-盐酸副玫瑰苯胺分光光度法方法来源: HJ482-2009监测人员:周姝伶收样日期:2013.4.25监测日期:2013.4.25报告日期:2013.4.26一、方法原理二氧化硫被甲醛缓冲溶液吸收后,生成稳定的羟基甲磺酸加成倾化合物。
在样品溶液中加入氢氧化钠使加成化合物分解,释放出的二氧化硫与盐酸副玫瑰苯胺、甲醛作用,生成紫红色化合物,根据颜色深浅,用分光光度计在577nm处进行测定。
二、仪器1、分光光度计。
2、具塞比色管:10ml。
3、恒温水浴:0-40℃,控制精度为±1℃。
三、试剂1、试验用蒸馏水及其制备:水质应符合实验室用水质量二级水(或三级水)的指标。
可用蒸馏、反渗透或离子交换方法制备。
2、环己二胺四乙酸二钠溶液(trans-1,2 Cyclohexylenedinitrilo)tetraacetic acid,简称CDTA),加入1.50mol/L的氢氧化钠溶液6.5ml,溶解后用水稀释至100ml。
3、甲醛缓冲吸收液贮备液:吸取36%~38%的甲醛溶液5.5ml,0.050mol/L的CDTA-2Na溶液20.2ml;称取2.04g 邻苯二甲酸氢钾,溶解于少量水中;将三种溶液合并,用水稀释至1000ml,贮于冰箱,可保存10个月。
4、甲醛缓冲吸收液:用水将甲醛缓冲吸收液贮备液稀释至100倍而成,此吸收液每毫升含0.2mg甲醛,临用现配。
5、氢氧化钠溶液C(NaOH)=1.5mol/L。
6、0.60%(m/V)氨磺酸钠溶液:称取0.60g氨磺酸(H2NSO3H)于烧杯中,加入1.50mol/L氢氧化钠溶液4.0ml,搅拌至完全溶解后稀释至100ml,摇匀。
此溶液密封保存可使用10d。
7、0.20%(m/V)盐酸副玫瑰苯胺(pararosaniline简称PRA,即副品红、对品红)贮备液:盐酸副玫瑰苯胺的提纯方法及纯度质量检验应达到的指标见附录A。
空气中二氧化硫的测定方法确认实验报告实验目的:本实验旨在通过测定空气中的二氧化硫含量来确定二氧化硫的浓度,并验证所采用的测定方法的准确性和可靠性。
实验原理:二氧化硫(SO2)是一种常见的空气污染物,它会导致酸雨的形成,对环境和人类健康产生不良影响。
因此,准确测定空气中的二氧化硫浓度具有重要意义。
通常情况下,测定空气中二氧化硫含量的方法主要有吸收法和光谱法。
吸收法是指通过将空气样品通过吸收剂(如过硫酸钠溶液)中来吸收二氧化硫,然后测定所生成的硫酸盐的浓度来计算二氧化硫的含量。
光谱法主要利用二氧化硫对特定波长的光的吸收性质进行测定,根据吸光度与浓度之间的关系计算二氧化硫的浓度。
实验步骤:1.准备吸收剂:将适量的过硫酸钠溶液放入吸收瓶中,并在瓶口装有一根玻璃棒,以增大吸收面积。
2.将空气样品通过吸收瓶,并调节进气流量,使其在吸收剂中停留一定时间,以确保充分吸收二氧化硫。
3.取出吸收瓶,并通过添加盐酸来将吸收剂中的硫酸盐转化为可溶性硫酸。
4.过滤所得溶液,并使用酸碱滴定法来测定溶液中硫酸的含量。
5.计算二氧化硫的浓度。
实验结果与分析:在本次实验中,我们采用了吸收法来测定空气中二氧化硫的浓度。
通过实际操作,我们成功测定了样品中硫酸盐的含量,并计算出其中二氧化硫的浓度。
根据测定结果,我们发现二氧化硫的浓度为x mg/m³。
为验证所采用的测定方法的可靠性和准确性,我们还进行了对比实验。
在对比实验中,我们同时采用了光谱法来测定空气中二氧化硫的浓度。
通过对比两种方法的测定结果,我们发现吸收法和光谱法的结果较为一致,二氧化硫的浓度相近。
综上所述,通过本次实验,我们采用吸收法成功测定了空气中二氧化硫的浓度。
实验结果表明所采用的测定方法准确可靠,能够用于二氧化硫浓度的实际测定。
实验结论:通过本次实验,我们成功测定了空气中二氧化硫的浓度,并验证了所采用的吸收法测定方法的可靠性和准确性。
实验结果表明,空气中二氧化硫的浓度为x mg/m³。
实验六大气中二氧化硫得测定环境工程李婷婷2110921109一、实验目得1、练习使用大气采样器,掌握其操作过程;2、掌握二氧化硫测定得实验原理。
二、实验原理二氧化硫被四氯汞钾溶液吸收后,生成稳定得二氯亚硫酸盐络合物,再与甲醛及盐酸副玫瑰苯胺作用,形成紫红色络合物,根据颜色深浅,比色定量。
四氯汞钾:HgCl2+2KCl=K2[HgCl4]吸收SO2:[HgCl4]2-+SO2+H2O=[HgCl2SO3]2-+2H++2Cl-二氯亚硫酸盐络合物加盐酸与甲醛: [HgCl2SO3]2-+HCHO+2H+=HgCl2+HOCH2SO3H羟基甲基磺酸加副品红,显色:三、实验步骤1、样品采集:用内装5mL四氯汞钾吸收液得多孔玻板吸收管,以0.5L/ min流量采气10-20L,在采样、样品运输及存放过程中应避免日光直接照射。
2、标准曲线得绘制:取8支具塞比色管,按表配制标准色列:各管中加入0、50mL氨基磺酸胺溶液,摇匀。
再加入0、50mL甲醛溶液及1、50mL盐酸副玫瑰苯胺溶液,摇匀。
当室温为15~20℃,显色30min;室温为20~25℃,显色20min;室温为25~30℃,显色15min。
用10mm比色皿,在波长575nm处,测定吸光度。
3、样品测定:将吸收管中得样品溶液全部移入比色管中,用少量水洗涤吸收管,并入比色管中,使总体积为5mL。
以下步骤同标准曲线得绘制。
四、实验结果与分析大气中二氧化硫得浓度X SO2(mg SO2/m3 ):X SO2 = (A-A。
)B S/V0式中:A——样品溶液吸光度;A0——试剂空白液吸光度;B S———核准因子,μg/吸光度单位;V0——换算为标准状态下(0℃,101325Pa)得采样体积,LB S=[W1/(A1-A0)+ W2/(A2-A0 ) +… W N/(A N-A0 ) ]/n式中:W N为SO2得含量(μg)n为标液份数V0= Vt*273/(273+t)*P/101、3式中:Vt为采样温度为t,压力为P得采样体积,LP:现场采样压力,K Pa经实验测得,二氧化硫得标准曲线如下:代入公式B S=[W1/(A1-A0)+ W2/(A2-A0 ) +… W N/(A N-A0 ) ]/n,得:B S=12、40361。
二氧化硫测定实验报告二氧化硫测定实验报告一、实验目的本实验旨在通过实验方法测定给定水样中二氧化硫的含量,掌握二氧化硫的测定方法和相关实验技巧。
二、实验原理二氧化硫是一种常见的有害气体,它对环境和人体健康有一定的危害。
因此,准确测定水样中二氧化硫的含量对于环境保护和人类健康具有重要意义。
本实验采用碘量法测定水样中二氧化硫的含量。
碘量法是一种常用的测定二氧化硫含量的方法,其原理是二氧化硫与碘化钾反应生成硫酸根离子,进而与碘反应生成碘离子。
三、实验步骤1. 准备工作:将所需试剂准备齐全,包括碘酸钾溶液、硫酸、淀粉溶液等。
2. 取一定量的水样,加入适量的碘酸钾溶液,使二氧化硫与碘酸钾反应生成硫酸根离子。
3. 加入适量的硫酸,使硫酸根离子与碘反应生成碘离子。
4. 加入淀粉溶液作指示剂,使溶液呈现蓝黑色。
5. 用标准碘溶液滴定,直至溶液颜色由蓝黑色变为无色。
6. 记录滴定所需标准碘溶液的体积,计算出水样中二氧化硫的含量。
四、实验注意事项1. 实验过程中要注意安全,避免接触皮肤和吸入有害气体。
2. 实验器材应干净无杂质,以免影响实验结果。
3. 滴定时要仔细观察溶液颜色的变化,以准确判断滴定终点。
4. 实验操作要细致,避免误差的产生。
五、实验结果与分析根据实验步骤所得数据,结合计算公式,可以计算出给定水样中二氧化硫的含量。
实验结果的准确性和可靠性取决于实验操作的精确度和实验数据的准确性。
若实验结果与理论值相差较大,需要重新检查实验步骤和数据处理过程,找出可能的误差来源。
六、实验总结通过本次实验,我掌握了二氧化硫测定的实验方法和相关技巧。
实验中,我学会了如何准确操作实验仪器和试剂,以及如何进行滴定和数据处理。
实验过程中,我也意识到实验操作的细致和准确性对于实验结果的影响。
通过实验,我深刻认识到二氧化硫的测定对于环境保护和人类健康的重要性,也更加重视了环境保护的意义。
综上所述,本次二氧化硫测定实验使我对二氧化硫的测定方法和实验技巧有了更深入的了解,并且对环境保护有了更深刻的认识。
测定二氧化硫实验报告本实验的主要目的是通过定量测定法测量空气中二氧化硫的含量,了解二氧化硫的危害性,培养实验操作技能。
实验仪器和药品:仪器:二氧化硫气体分析仪、量筒、酸碱度计、pH试纸、加热设备等;药品:二氧化硫溶液、试剂纸、去离子水等。
实验原理:二氧化硫溶液滴定法可以用于测定空气中的二氧化硫浓度。
实验中,二氧化硫溶液与含硫的气体反应生成亚硫酸,再与淀粉试液反应生成蓝色淀粉复合物。
利用氢氧化钠溶液进行反应停止,溶液呈红色。
通过加入双碘六钾溶液,溶液中的碘生成和碘元素相对应的量,因此可以通过滴定溶液中碘含量来测定二氧化硫的含量。
实验步骤:1. 取一定量的去离子水加入量筒中;2. 加入适量的二氧化硫溶液,并搅拌均匀;3. 在溶液中加入适量的酸钠二硫代硫酸盐溶液,并继续搅拌;4. 加入淀粉溶液,然后加入氢氧化钠溶液直至溶液呈现红色;5. 使用二氧化硫气体分析仪测定空气中二氧化硫含量;6. 将二氧化硫溶液倒入滴定瓶中;7. 加入一滴氢碘酸,加入盛有椰子壳粉末的滴定管,滴定溶液中的碘。
实验数据处理:通过滴定瓶中溶液滴定的总体积和滴定管中需消耗的碘水溶液体积,可以计算空气中二氧化硫的质量浓度。
实验注意事项:1. 在实验过程中,要保持实验室的通风良好,防止二氧化硫对实验人员造成危害;2. 实验操作过程中要规范,避免实验溶液的误操作和混合;3. 实验结束后,要及时清理实验仪器和药品。
实验结果与讨论:通过上述的实验步骤,我们能测定得到空气中二氧化硫的含量。
根据实验原理和实验数据处理过程,我们可以计算出二氧化硫在空气中的质量浓度。
在讨论部分,我们可以对实验中可能产生的误差进行分析,并对实验结果进行合理的解释。
同时,我们还可以通过对实验结果的讨论,进一步深化对二氧化硫的认识,并提出一些相关的措施和建议,以减少环境中二氧化硫的含量。
总结:通过实验,我们能了解到二氧化硫的危害性,并学习了一种常用的测定二氧化硫的方法。
通过实验的原理、步骤和数据处理,我们成功地测定了空气中二氧化硫的含量,并得出了相应的结果。