有机化学:第五章 手性分子与旋光异构
- 格式:ppt
- 大小:12.43 MB
- 文档页数:71







第五章立体化学基础
1. 概述:
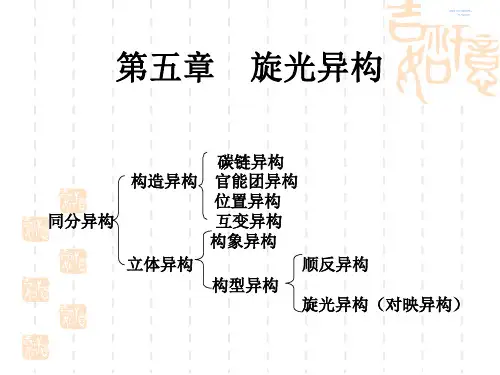
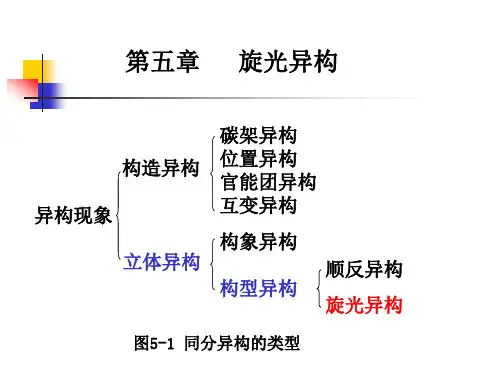
旋光异构与顺反异构都属于立体异构;
碳架异构,官能团异构和位置异构都属于构造异构;
立体异构和构造异构属于同分异构。
2. 右旋+d;左旋–l;
手性原子(即上面连有4个不同的原子或基团)是引起化合物产生手性最普遍的原因,但不能将是否含有手性原子作为产生手性分子的绝对条件,产生手性的必要和充分条件是分子与其镜像不能重叠(即分子的不对称性)。
有些分子虽然不含任何手性原子,但具有手性;
3. 凡具有对称面或对称中心,一定是非手性的,无对应异构体,无旋光性;
即无对称面又无对称中心的化合物,一定是手性化合物,具有旋光性。
4. 费歇尔投影式:与手性碳原子相结合的两个横键指向平面前方,两个竖键向后。
5. DL命名法:甘油醛,羟基在右边(费歇尔投影式中),右旋甘油醛,为D构型。
6. RS命名法:最次的放在后面,若剩下的由大到小顺时针为R;逆时针为S;
7. 赤藓糖:相同原子团在同侧为赤型;
苏阿糖:相同原子团在异侧为苏型;。
手性分子与旋光异构一个化合物的分子与其镜象不能互相叠合,这个分子就是手性分子(chiral molecule)。
手性分子与其镜象分子互为对映异构体(enantiomers)。
sp3杂化的碳是导致众多有机化合物具有手性的原因。
当一个sp3杂化的碳原子上连接了4个不相同的取代基时,就不再具有对称面,对称中心等对称因素而成为手性碳(chiral carbon)。
IUPAC命名原则规定了这两种构型的表示方法:对手性碳所连接的4个不同的原子或基团按照次序规则排序,然后将排在最后的基团置于远离观察者的位置,根据所看到的另3个基团的排列顺序进行命名。
如果是顺时针排列,则命名为“R”构型;如果是逆时针排列,则命名为“S”构型。
对于上式表示的分子,如果A > B > Y > X,则左边的结构表示的是“R”构型;右边的构型为“S”构型。
当一个分子中含有两个或两个以上手性碳原子时,由于每个手性碳原子都可以有R和S两种构型,因此含有n个手性碳原子分子的构型异构体数目为2n。
例如,2-氯-3-甲基戊醛,总共有4个构型异构体,其中两对为对映异构体(Ⅰ和Ⅱ,Ⅲ和Ⅳ)。
而Ⅰ与Ⅲ或Ⅳ,以及Ⅱ与Ⅲ或Ⅳ的关系,则为“非对映异构”(diastereomers)。
非对映异构体是指那些不互为镜像的立体异构体。
表示手性碳(分子)有多种表示方法,上述的表示方法称为楔型式,用实线表示在纸面上的键,用楔型“”表示指向纸面上方的基团,用虚线“”表示朝向纸面下方的键。
此外,还有一种常用的方法称为Fischer投影式。
这种方法用十字表示一个手性碳,竖线表示的基团朝向纸面下方,横线表示的基团朝向纸面上方,只有十字中心的碳原子在纸面上。
如果将上面的四个异构体表示为Fischer投影式,则如下图,可以看出这种结构表示方法更容易看出多个手性碳时的各构型之间的相互关系。
当一个化合物中含有两个相同的手性碳原子时,构型异构体数目将减少,例如酒石酸。