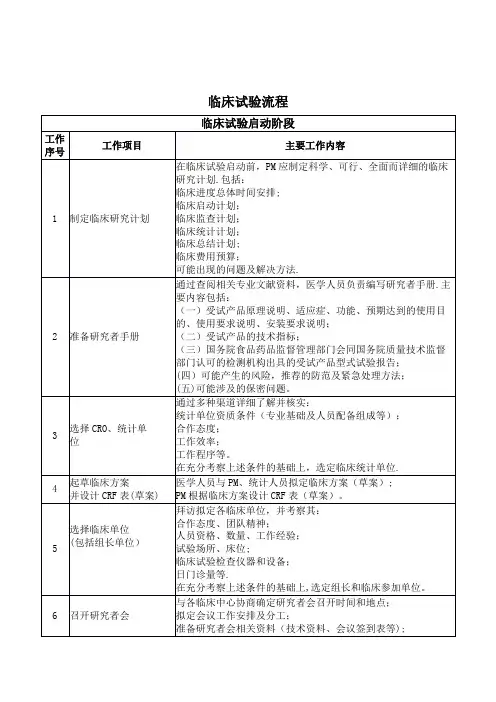
(完整word版)临床试验流程图
- 格式:doc
- 大小:40.51 KB
- 文档页数:2

临床试验过程详解文档1. 临床试验概述临床试验是指在人体进行的医学研究,以评估新药、治疗方法或医疗设备的安全性和有效性。
临床试验通常分为四个阶段,分别为I、II、III和IV期。
2. 临床试验阶段详解2.1 临床试验I期(初期阶段)目的:评估新药的安全性、耐受性和药代动力学特性。
主要研究内容:- 确定药物的剂量范围和最大耐受剂量。
- 观察药物对人体产生的不良反应。
- 了解药物在人体内的吸收、分布、代谢和排泄过程。
受试者人数:通常较小,一般为20-30人。
2.2 临床试验II期(中期阶段)目的:评估新药的疗效和进一步验证安全性。
主要研究内容:- 比较药物与安慰剂的疗效差异。
- 观察药物的副作用和不良反应。
- 确定药物的最佳给药方式和剂量。
受试者人数:通常为数十到数百人。
2.3 临床试验III期(后期阶段)目的:大规模验证新药的疗效和安全性,为药物上市提供充分证据。
主要研究内容:- 比较药物与现有治疗方法或安慰剂的疗效差异。
- 观察药物的长期疗效和安全性。
- 评估药物对患者生活质量的影响。
受试者人数:通常为数百到数千人。
2.4 临床试验IV期(市场监测阶段)目的:在药物上市后对其长期疗效和安全性进行监测。
主要研究内容:- 收集药物在广泛使用条件下的疗效和安全性数据。
- 监测药物的副作用和不良反应。
- 评估药物在不同人群中的用药情况和适用性。
受试者人数:不限制,涉及广泛的患者群体。
3. 临床试验流程3.1 临床试验设计- 确定研究目的、类型(随机对照试验、队列研究等)。
- 制定研究方案和统计分析计划。
3.2 临床试验招募- 通过各种途径招募受试者。
- 对受试者进行筛选,确保其符合纳入和排除标准。
3.3 临床试验实施- 按照研究方案进行试验,包括给药、观察和数据收集。
- 确保试验过程遵循伦理原则和法律法规。
3.4 临床试验数据分析- 收集、整理和分析临床试验数据。
- 评估药物的疗效和安全性。
3.5 临床试验报告和发表- 撰写临床试验报告,包括研究背景、方法、结果和结论。

研究生毕业课题解毒通络法治疗出血性中风病急性期临床评价病例报告表(Case Report Form )患者编号:患者组别:患者姓名缩写:联系方式:研究者姓名:研究者单位:填写说明在正式填写以下表格内容前,请认真阅读填写说明1、 筛选合格者填写病历报告表。
2、 表中凡有“□”的项,请在符合的条目上划“X”,如:匕不得留空。
3、 填写病例报告表一律使用钢笔或碳素笔,填写数据务必准确、清晰,数据禁止擦 除或涂抹,如有错误发生,可在错误处上方书写正确值,将错误值划上“一”, 修改者签名并加注日期,必要时说明理由。
举例:-99.6 90.4JL 09 07 10。
4、 患者姓名一律以拼音缩写,填写大写字母,四格填满。
四字姓名者,填写每字拼 音的第一个字母;三字姓名者填写三字首字母及第三字第二字母;两字姓名者填 写两字拼音前两字母。
5、 所有检查项目均须填写,因故未查或漏查,请填写 N D ”;具体用药剂量和时间不 明,请填写NK ”。
6、 观察表的每页均须填写患者编号、 患者姓名缩写,观察医生必须签署姓名和日期。
7、 验证期间应如实填写不良事件记录表。
8、 临床验证应严格按照临床验证方案要求进行。
验证不同时期需完成的检查和记录 的项目,请对照临床研究流程图执行。
入组筛选表举例:张红知情同意书尊敬的志愿受试者或委托人:我们正在进行一项中风病中医药治疗的临床研究工作,我们将进行解毒通络方治疗出血性中风急性期临床疗效评价的研究。
医生会跟你详细介绍本研究内容,如果您决定参加该研究,医生将根据研究需要对您进行评估是否符合参加本试验的条件,询问您相关问题,还将对您进行必要的检查,并在治疗过程中的不同时间点对您进行多次评估。
如果您同意,并符合本研究的入选条件,将被随机分到实验组(加用中药解毒通络方)及对照组的其中一组进行治疗观察。
无论是否使用解毒通络方对您的治疗我们都保证是及时、全面、合理的。
解毒通络方是我们在治疗中风病过程中长期总结的经验方,为更好的研究其临床疗效,仍需临床进一步评价,故非常感谢您对我们研究的配合与支持。


临床试验观察表(C R F)病例报告表(Case Report Form)受试者姓名:家庭地址:联系电话:试验中心名称:申办单位:延吉喜来健医疗器械有限公司在正式填表前请认真阅读下列填表说明病例报告表填写说明:1.筛选合格者填写病例报告表。
2.病例报告表填写务必准确、清晰,不得任意涂改,错误之处纠正时需用横线居中化出,并签署修改者姓名缩写及修改时间。
3.填写记录一律用钢笔或碳素签字笔。
4.患者姓名拼音缩写四个需填满,两字姓名填写两字拼音前两个字母;三字姓名填写三字首字母及第三字第二字母;四字姓名填写每个字的首字母。
5.表中凡有“□”的项,请在符合的条目上划“√”。
表格中所有栏目均应填写相应的文字或数字,不得留空。
6.所有检验项目因故未查或漏查,请填写ND;具体合并用药剂量和时间不明,请先写NK。
7.试验期间应如实填写合并用药记录表、不良事件记录表。
记录不良事件的发生时间、严重程度、持续时间、采取的措施和转归。
如有严重不良事件发生(包括临床验证过程中发生需住院治疗、延长住院时间、伤残、影响工作能力危及生命或死亡、导致先天畸形等事件),必须立即通知主要研究单位伦理委员会及申办单位。
8.临床试验应严格按照临床试验方案要求进行。
试验不同时期需完成的检查和需记录的项目,请对照临床流程图执行。
受试者知情同意书敬爱的患者:我们现在正在进行一项临床研究,该项临床研究是经吉林省药品监督管理局备案的,研究的目的是评价物理治疗的高科技产品----温热电位治疗仪的疗效和安全性。
温热磁疗仪是XXX医疗器械有限公司根据韩国专利技术研制生产的医疗器械,本治疗仪是通过XXXXXXXXXXXXXXXXXXXXXXXXXXXXXX机理,主要用于XXXXXXXXXXXXX治疗。
具有平衡机体阴阳,增强脏腑机能,促进新陈代谢,调节植物神经,改善心脑血管血液供应,促进血液循环,调节血管张力,降低血液粘稠度,防治动脉粥样硬化,促进组织的再生修复功能,增强机体免疫功能及消炎止痛等作用。

研究生毕业课题解毒通络法治疗出血性中风病急性期临床评价病例报告表(Case Report Form)患者编号:患者组别:患者姓名缩写:联系方式:研究者姓名:研究者单位:填写说明在正式填写以下表格内容前,请认真阅读填写说明1、筛选合格者填写病历报告表。
2、表中凡有“□”的项,请在符合的条目上划“×”,3、填写病例报告表一律使用钢笔或碳素笔,填写数据务必准确、清晰,数据禁止擦除或涂抹,如有错误发生,可在错误处上方书写正确值,将错误值划上“—”,修改者签名并加注日期,必要时说明理由。
举例:99.6 90.6CJL 09 07 10。
4、患者姓名一律以拼音缩写,填写大写字母,四格填满。
四字姓名者,填写每字拼音的第一个字母;三字姓名者填写三字首字母及第三字第二字母;两字姓名者填写两字拼音前两字母。
举例:张红李淑明欧阳小惠5、所有检查项目均须填写,因故未查或漏查,请填写“ND”;具体用药剂量和时间不明,请填写“NK”。
6、观察表的每页均须填写患者编号、患者姓名缩写,观察医生必须签署姓名和日期。
7、验证期间应如实填写不良事件记录表。
8、临床验证应严格按照临床验证方案要求进行。
验证不同时期需完成的检查和记录的项目,请对照临床研究流程图执行。
入组筛选表知情同意书尊敬的志愿受试者或委托人:我们正在进行一项中风病中医药治疗的临床研究工作,我们将进行解毒通络方治疗出血性中风急性期临床疗效评价的研究。
医生会跟你详细介绍本研究内容,如果您决定参加该研究,医生将根据研究需要对您进行评估是否符合参加本试验的条件,询问您相关问题,还将对您进行必要的检查,并在治疗过程中的不同时间点对您进行多次评估。
如果您同意,并符合本研究的入选条件,将被随机分到实验组(加用中药解毒通络方)及对照组的其中一组进行治疗观察。
无论是否使用解毒通络方对您的治疗我们都保证是及时、全面、合理的。
解毒通络方是我们在治疗中风病过程中长期总结的经验方,为更好的研究其临床疗效,仍需临床进一步评价,故非常感谢您对我们研究的配合与支持。

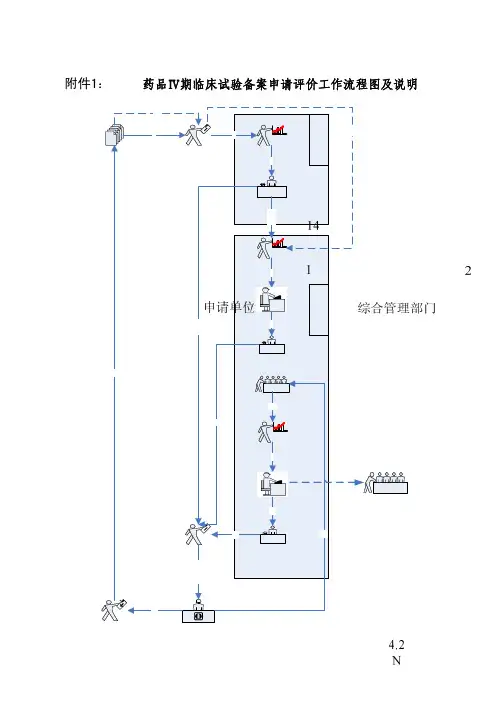
医学部临床研究流程图Ⅰ. 目的:建立临床试验的流程图,临床试验的SOP按此图制定。
Ⅱ. 范围:适用于所有临床试验SOP。
Ⅲ. 规程Ⅰ. 目的:为使项目管理人员有所参考,提高项目管理质量和效率,特撰写此总纲。
Ⅱ. 范围:医学部。
Ⅲ. 规程1、项目管理的定义:项目的管理者,在有限的资源约束下,运用系统的观点、方法和理论,对项目涉及的全部工作进行有效地管理。
即对项目的全过程进行计划、组织、指挥、协调、控制和评价,以实现项目的目标。
2、项目管理的内容包括以下9个部分:1、项目范围管理是为了实现项目的目标,对项目的工作内容进行控制的管理过程。
它包括范围的界定,范围的规划,范围的调整等。
2、项目时间管理是为了确保项目最终的按时完成的一系列管理过程。
它包括具体活动的界定,如:活动排序、时间估计、进度安排及时间控制等项工作。
3、项目成本管理是为了保证完成项目的实际成本、费用不超过预算成本、费用的管理过程。
它包括资源的配置,成本、费用的预算以及费用的控制等项工作。
4、项目质量管理是为了确保项目达到客户所规定的质量要求所实施的一系列管理过程。
它包括质量规划,质量控制和质量保证等。
5、项目人力资源管理是为了保证所有项目关系人的能力和积极性都得到最有效地发挥和利用所做的一系列管理措施。
它包括组织的规划、团队的建设、人员的选聘和项目的班子建设等一系列工作。
6、项目沟通管理是为了确保项目的信息的合理收集和传输所需要实施的一系列措施,它包括沟通规划,信息传输和进度报告等。
7、项目风险管理涉及项目可能遇到各种不确定因素。
它包括风险识别,风险量化,制订对策和风险控制等。
8、项目采购管理是为了从项目实施组织之外获得所需资源或服务所采取的一系列管理措施。
它包括采购计划,采购与征购,资源的选择以及合同的管理等项目工作。
9、项目集成管理是指为确保项目各项工作能够有机地协调和配合所展开的综合性和全局性的项目管理工作和过程。
它包括项目集成计划的制定,项目集成计划的实施,项目变动的总体控制等。

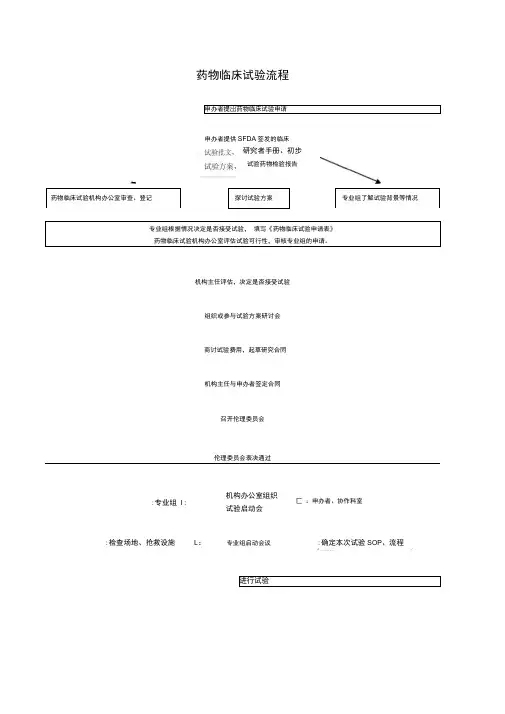
药物临床试验流程 申办者提岀药物临床试验申请
申办者提供SFDA 签发的临床
药物临床试验机构办公室审查、登记
探讨试验方案
专业组了解试验背景等情况
专业组根据情况决定是否接受试验, 填写《药物临床试验申请表》 药物临床试验机构办公室评估试验可行性,审核专业组的申请。
机构主任评估,决定是否接受试验
组织或参与试验方案研讨会
商讨试验费用,起草研究合同
机构主任与申办者签定合同
召开伦理委员会
伦理委员会表决通过
进行试验
:专业组 I :
机构办公室组织 试验启动会 匚 :申办者、协作科室
:检查场地、抢救设施
L : 专业组启动会议 :确定本次试验SOP 、流程 J _ _ _ _ _ _ -1
研究者手册、初步
试验药物检验报告
进行试验
机构办公室向申办者提交 CRF 第一联,退回试验用药物 项目负责人根据统计结果撰写小结 报告,组长单位撰写总结报告
机构办公室审核小结报告,最
后交申办者,小结报告归档
E
组长单位与申办者组织召开临床试验总结会
总结报告归档,与申办者办理相关手续
机构办公室提交财务报告,机构主任
审批,财务科发放劳务费或统一划帐 知情同意过程、签知情同意书 中期试验 协作会 试验数据记录 监查员、机构办公室的监查 <—[文件收集、归档 [ * "1 <3- 1项目负责人监督试验质量 <= 不良事件监查、处理、记录。
