凋落物PLFA取样和处理方法
- 格式:pdf
- 大小:113.18 KB
- 文档页数:2



凋落物和土壤前处理取样:每个次小区分别取1袋米老排凋落物和1袋杉木凋落物,每个网袋单独装入一个塑料袋;同时用土钻取网袋下面0-10cm土壤装入自封袋。
共36个网袋+36个土样。
网袋和土壤放在装有冰块的冰盒带回实验室。
凋落物前处理:1,混合:凋落物带回实验室后,用剪刀剪碎混合,分成三份,一份-20℃冷藏做PLFA,一份4℃保鲜做凋落物酶,另一份烘干称重计算分解速率。
2,脱水:把-20℃冷藏的凋落物放入冷冻干燥机脱水(-80℃),24小时左右3,粉碎:脱水之后的凋落物用球磨机粉碎,装入自封袋,封好袋口,-20℃冷冻。
4,运输:把凋落物和土壤样品装入放有冰块的大冰盒带到广州。
5,实验时每个样品用量为0.1g(华南植物园),其他程序与土壤PLFA一样。
土壤前处理:带回实验室的土壤人工挑拣出石子,细根等,然后混合放在-20℃冷冻带到广州。
具体实验步骤:1、凋落物样品用球磨机粉碎(<10 μm)2、称取冷冻干燥后的凋落物样品(250±1 mg)于玻璃离心管中(25 ml),用磷酸钾溶液(50 mmol l-1, pH 7.4)1.6 ml 、甲醇4 ml、氯仿 2 ml;3、涡旋30s,超声2 min,在37℃下温育30min,然后离心(800×g),将上层清液倒入50 ml分液漏斗中。
然后再重复浸提一次,合并两次上层清液。
4、向分液漏斗中再加入4 ml氯仿,4 ml水,然后轻轻的摇匀,放置整晚。
第二天5、收集分液漏斗中的下层清液(氯仿相),在氮气下吹干。
6、通过色谱硅胶小柱进行脂质分离:用氯仿(3×2 ml)洗脱中性脂质,用丙酮(3×2 ml)洗脱糖脂,这些全部丢弃。
最后用甲醇(3×2 ml)洗脱极性脂类,收集到玻璃试管中。
在氮气下吹干。
7、在剩余残留物中,加入2ml氢氧化钾(KOH),1 ml甲苯:甲醇(1:1,v/v),然后在37℃下温育30 min。

长期稻-稻-油菜轮作对土壤理化性质及微生物群落结构的影响杨敬林;李琳;胡德勇【摘要】为探究南方丘陵地区稻-稻-油菜轮作对土壤理化性质和微生物群落结构的影响,采用常规土壤农化分析和磷脂脂肪酸(PLFA)分析方法,以安仁县长期稻-稻-油菜轮作(DDY)和稻-稻连作(DD)土壤为研究对象,比较长期(30 a)DDY和DD处理后3个时期(早稻成熟期、晚稻成熟期、油菜成熟期)土壤理化性质和微生物群落结构的差异.结果表明,DDY处理土壤全氮、全磷含量及pH值均低于DD处理,其中,全氮含量在3个时期均差异显著,全钾含量增加但与DD处理差异不显著,有机质、碱解氮、速效磷、速效钾含量呈动态变化.轮作对土壤全氮含量影响较大,3个时期DDY处理全氮含量分别较DD处理降低50.76%、46.67%、49.62%.土壤微生物PLFA分析结果表明,与DD处理相比,DDY处理土壤微生物PLFA总量显著提高,3个时期分别提高19.69%、20.20%、49.12%,其中,DDY处理土壤细菌PLFA量显著增加,真菌PLFA量显著降低,真菌与细菌PLFA量比值显著降低.对土壤微生物PLFA进行主成分分析表明,轮作对微生物群落结构产生明显影响,2种种植方式主要影响土壤中细菌和真菌的数量.总之,长期稻-稻-油菜轮作促进了土壤全氮和全磷的分解,显著提高微生物生物量,尤其是细菌生物量,显著降低真菌生物量,提高两者的比值.%To explore the effect of rice-rice-rape rotation on soil physicochemical properties and microbial community structure in hilly area of southern China,the soil microbial biomass and composition of two kinds of different tillage systems[long rice-rice-rape rotation(DDY) and rice-rice continuous cropping(DD)] after 30 years of rotation were analyzed by PLFA marker spectrum analysis method,and the soil physicochemical properties during three periods(including the mature stages of early rice,late rice and oilseedrape) were studied.The results showed that compared with DD treatment,the contents of total N and total P and pH value of DDY treatment decreased,there was a significant defference for total N content,the total N content of DDY treatment significantly decreased by 50.76%,46.67%,49.62%;the total K content of DDY treatment increased,but the difference was not significant;the contents of organic matter,alkali-hydrolyzable N,available P,available K showed dynamic changes.Soil microbial PLFA marker test showed that compared with DD treatment,soil microbial PLFA amount of DDY treatment increased by 19.69%,20.20% and 49.12% at three different determination stages,respectively;the bacterial PLFA amount of DDY treatment increased,the fungi PLFA amount of DDY treatment decreased,and the ratio of fungi PLFA amount to bacteria PLFA amount of DDY treatment decreased.The principal component analysis of microbial PLFA showed that rotation obviously influenced the microbial community structure,the amount of bacteria and fungi were mainly affected by two tillage methods.Overall,the long term rice-rice-rape rotation promoted the decomposition of total N and P,significantly improved the microbial biomass,especialy bacteria,significantly decreased the fungal biomass,significantly increased the ratio of bacteria to fungi.【期刊名称】《河南农业科学》【年(卷),期】2017(046)009【总页数】6页(P45-49,61)【关键词】稻-稻连作;稻-稻-油菜轮作;土壤;微生物群落结构【作者】杨敬林;李琳;胡德勇【作者单位】湖南农业大学工学院,湖南长沙 410128;湖南师范大学数学与计算机科学学院,湖南长沙 410081;湖南农业大学工学院,湖南长沙 410128【正文语种】中文【中图分类】S154.3轮作是指同一块土地上有计划地按顺序轮种不同类型作物的复种形式,该栽培措施对改善土壤质地、促进作物生长和产量提高具有显著效应[1-3]。

PLFA 方法分为三个步骤,分别是提取、分离和甲酯化(1)提取:称2 g 干土加入4 mL 柠檬酸缓冲液(0.15 mol/L 二水柠檬酸三钠,0.15 mol/L 柠檬酸),5 mL 氯仿,10 mL 甲醇(柠檬酸缓冲液∶氯仿∶甲醇=0.8∶1∶2),轻微涡旋震荡30 s,超声处理2 min,25 ℃避光震荡2 h,4000 r/min离心10 min,将上清液转移到一个新的离心管中,重复操作取上清液(重复取的上清液放置于一个新的40 mL 的离心管中)。
每个离心管中各加入5 mL 柠檬酸缓冲液和5 mL 氯仿(柠檬酸缓冲液∶氯仿∶甲醇=0.9:1:1),震荡过夜,2500 rpm 离心20 min。
经过夜分离后,吸走上层(大约2/3)保留底层氯仿相,过处理定量滤纸(氯仿和甲醇混合液(2:1,V/V)浸泡处理),二者合并,在氮气流下吹干氯仿或者旋转蒸发(温度低于35 ℃)。
(2)分离:用0.5 mL 氯仿溶解,将氯仿加到硅胶柱顶部,过填充有活化硅胶(使用丙酮索氏提取硅胶6-8 h,120 ℃活化2 h)的玻璃管柱(高100 mm,直径6 mm),然后依次分别加入4×2.5 mL 氯仿、4×2.5 mL 丙酮、4×2.5 mL 甲醇(每次溶剂加入后自然洗脱至无液滴自然流下时真空抽干),收集甲醇相在氮气流下吹干。
(3)甲脂化:向吹干样品中加入1 mL 甲醇∶甲苯(1:1)和1 mL 0.2mol/LKOH 甲醇溶液(新鲜配制,甲醇不含水),手动摇晃 1 min,放入水浴35~36℃温浴15 min,后冷却到室温,依次加入2 mL 去离子水,0.3 mL 1 mol/LHAc,2 mL 正己烷,漩涡混合30 s,然后3000 r/min 离心10 min,重复提取(仅添加正己烷)一次,合并两次提取的正己烷相,加入甲脂化的C19:0 为内标,氮气流下吹干或者旋转蒸发,-20 ℃冷冻保存,在上机测定前用100 μL 正己烷(色谱纯)定容待测。


PLFA试剂及配制:3.1氯仿3.2甲醇3.3正己烷3.40.2 mol/L KOH 甲醇溶液:0.34g KOH溶于30ml甲醇;3.51M 冰醋酸:1.74ml冰醋酸溶于30 ml去离子水(现用现配);3.61:1 = 甲醇:甲苯(现用现配)(30ml);3.70.15M pH=4.0 柠檬酸缓冲液:准确称取20.66g柠檬酸,柠檬酸钠15.23g,加去离子水定容至1000ml。
3.8提取液-柠檬酸缓冲液:氯仿:甲醇=0.8:1:2(v/v/v)(约850ml)。
3.9硅胶柱(0.8克,100-200 目):于120℃烘干2小时进行活化,并于干燥器中保存;3.10 Nonadecanoic acid methyl ester (19:0, Sigma):190ug/ml;Supelcoe 37 Component FAME Mix:1000μg/ml;Supelcoe BAME (Bacterial Acid Methyl Esters) mix:1000μg/ml。
上GC前:取30μl 19:0脂肪酸甲酯+ 150μl 37Componet FAME s]定量标准。
仪器: 气相色谱一台;高纯N2;N2吹扫系统;真空干燥器;5ml衍生瓶;气谱上样瓶;150ul内插衬管;90ml带盖玻璃离心管;玻璃吸管;测定步骤:步骤1.所用有的器皿:去离子水和正己烷洗,玻璃管用锡箔纸包好,并编号;土壤样品冻干后,于干燥器中保存。
步骤2 从全土样品中提取脂肪酸第一天(6个样品+1个控制样+1个空白;每个样品三次重复)1.准确称取冻干土样5克,倒入50ml玻璃三角瓶●土壤样品重量应该准确记录●不同样品或处理编号应该一一对应,且应防止字迹被有机溶剂溶去。
2.用防毒面具:于每个样品管中加浸提液20ml;3.避光振荡2小时:小心放置以期达到最佳振荡效果。
4.25℃,2500 rmp离心10分钟。
5.尽可能于避光!:上清加入50ml具盖离心管中,于离心管外壁与盖上清楚地标记编号;6.并于土壤沉淀中再次加入浸提液12ml,充分振荡1小时;7.提取液再次离心,将上清合并;8.于合并的上清液中加入8.6ml柠檬酸缓冲液,10.6ml 氯仿;9.振荡离心管1分钟(盖子盖紧),定时放气(vent periodically);10.于黑暗(外加铝箔)中静置过夜,使两相分离;远离热源。

摘要:为探索马尾松(pinus massonana)凋落物在不同密度林分中微量元素的释放规律,以12 a生马尾松人工林为研究对象,采用网袋分解法,分析3种密度下马尾松凋落物分解过程中干质量损失率、4种微量元素含量和养分残留率变化。
结果表明,马尾松人工林凋落物残留率在不同密度间的变化趋势均相近,密度对残留率无显著影响。
不同月份残留率不同,11月至翌年1月迅速降低,然后减缓,春季和夏季加快降低,秋季又开始减缓。
凋落物中4种微量元素释放模式主要为“淋溶一富集一释放”(zn除外)。
经过1 a分解,各密度林分凋落物的干质量均损失过半;平均养分残留率从大到小为cu(84.9%)、fe(66.3%)、mn(55.9%)、zn(52.6%);凋落物中zn残留率随密度增大而减小,其他养分变化不明显。
关键词:马尾松;人工林;凋落物分解;养分释放森林凋落物是森林生态系统的重要组成部分,是森林生态系统物质循环的重要环节之一,作为连接植物与土壤的“纽带”,它不仅维持土壤肥力,保持植物再生长的养分可利用性,而且在促进森林生态系统正常的物质生物循环和养分平衡方面具有十分重要的作用。
凋落物分解是其养分释放的主要方式,其分解速度决定着生态系统中养分循环的快慢,在一定程度上决定着土壤养分有效性的高低。
因此,有关凋落物分解的研究相当活跃。
马尾松具有耐干旱、瘠薄、适应性强、速生、丰产、优质、综合利用程度高等特点,因此成为中国南方地区荒山绿化和用材造林的重要树种之一。
林分的凋落物分解状况将直接影响马尾松生长和林分质量,为此,研究凋落物中微量元素的变化规律对管理马尾松林地养分平衡和长期可持续发展有重要作用。
目前对马尾松凋落物分解规律的研究见诸报道,但未见有对其分解过程中微量元素释放规律的研究。
鉴于此,选取贵州省龙里林场12 a生马尾松人工林为研究对象,采用网袋分解法,研究马尾松凋落物在不同密度林分中的分解动态及fe、mn、zn、cu 4种微量元素的释放规律,对服务林业生产和生态恢复具有重要的指导意义。

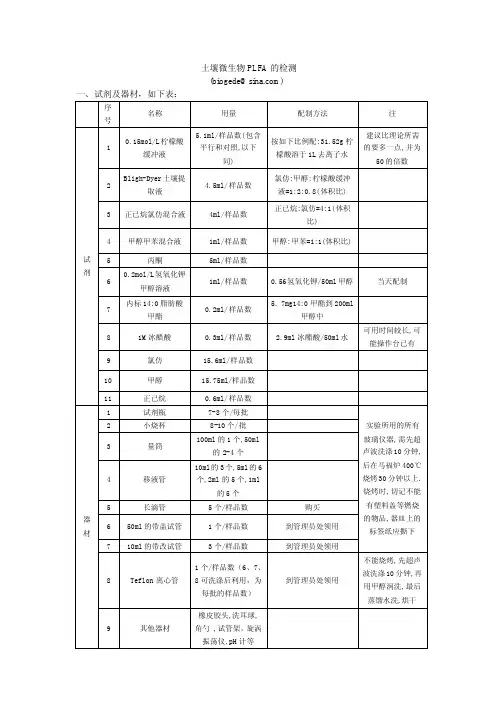
我的PLFA提取方法试剂:(每1土壤样品所需用量)1. 0.15 mol/L柠檬酸缓冲液:31.52g柠檬酸溶解于1L去离子水中,用NaOH调pH到4.0(保存时间为1周);2. Bligh-Dyer土壤提取液:氯仿:甲醇:柠檬酸缓冲液=1:2:0.8 (体积比) (保存时间为1周);3. 丙酮;4. 内标:19:0脂肪酸甲酯;5 60ug/mL的内标样十九烷酸nonadecanoic acid (C19:0,溶于甲醇)6试剂1 (NaOH:甲醇:蒸馏水=45g:150ml:150ml)(1×1ml)7 试剂2 (6N HCl:甲醇=325ml:275ml)(1×2ml)8 试剂3(正己烷:甲基叔丁醚=200ml:200ml)(1×9ml)9 试剂4 1.2% (w/v) NaOH (1×3ml)(所有玻璃仪器用前都要用正己烷清洗一遍并吹干。
)一、提取脂(extraction of soil lipids)称取2克土样,置于50mL三角烧瓶中,加入15mLBligh-dyer提取液,在摇床(约180左右)上摇2个小时。
然后3800rpm离心10min。
将上清液移入一干净的50mL 试管中。
再向三角瓶中加入7mL Bligh-dyer提取液,混匀,倒入离心管,置于涡旋混合仪上涡旋数秒,以超声波震荡提取(1-2min),如上离心10min,倒出上清液,即将两次上清液合并。
再向上清液中加入3.6mL柠檬酸缓冲液和4mL氯仿,剧烈涡旋振荡10秒左右,以锡箔纸封口,暗处静置过夜(时间不可过长)。
液体分为两相,膜脂分布于氯仿层(下层)中。
用长滴管吸出下层液体至10mL螺口管中,用氮气吹干,加1mL氯仿,-20℃保存。
二、过柱纯化(silicic acid chromatography)1、将硅胶柱固定于萃取架或者圆盘上,硅胶柱下面放好接废液的试管。
2、每个小柱用2.5mL 丙酮润洗2次(共5 mL),再用2.5mL氯仿润洗2次(共5 mL)。

第35卷第6期2021年12月水土保持学报J o u r n a l o f S o i l a n d W a t e rC o n s e r v a t i o nV o l .35N o .6D e c .,2021收稿日期:2021-06-04资助项目:福建省科技厅公益类重点项目(2019R 1002-4);福建省高等学校新世纪优秀人才支持计划项目(J 1-1253);国家自然科学基金青年基金项目(31800517) 第一作者:张磊(1996 ),男,硕士研究生,主要从事森林碳氮循环研究㊂E -m a i l :z h a n gl e i c 789@163.c o m 通信作者:刘小飞(1985 ),男,高级实验师,主要从事亚热带森林生态系统土壤碳动态和森林地下碳分配对全球变化循环研究㊂E -m a i l:x f l i u @f jn u .e d u .c n 改变凋落物和根系输入对米槠天然林土壤微生物群落的影响张磊1,2,贾淑娴1,2,李啸灵1,2,陆宇明1,2,林伟盛1,2,刘小飞1,2,郭剑芬1,2(1.福建师范大学地理科学学院,福州350007;2.湿润亚热带生态 地理过程教育部重点实验室,福州350007)摘要:伴随气候变化下亚热带地区米槠天然林净初级生产力变化,凋落物以及植物根系输入亦会发生改变,这将显著影响土壤微生物群落㊂于2019年7月在设置7年的米槠天然林植物残体添加和去除试验(t h e d e t r i t u s i n p u t a n d r e m o v a l t r e a t m e n t s ,D I R T )样地采集不同处理(对照㊁去除地上凋落物㊁去除地下根系㊁无凋落物输入㊁添加双倍地上凋落物)的2个土层土壤(0 10,10 20c m ),测定微生物磷脂脂肪酸(p h o s p h o l i p i d f a t t y a c i d ,P L F A )含量,计算各微生物群落比值以及多样性,进一步揭示凋落物和植物根系输入对亚热带米槠天然林土壤微生物群落组成和多样性的影响㊂结果表明:(1)不同处理下0 10c m 土层微生物磷脂脂肪酸含量约为10 20c m 土层的2倍;(2)地上凋落物变化均使得革兰氏阳性菌㊁阴性菌及放线菌等细菌含量出现不同程度的下降,但不会对丛枝菌根等真菌含量产生影响,而去除根系处理显著降低丛枝菌根真菌含量;(3)微生物群落S h a n n o n -w i e n e r ㊁S i m p s o n 多样性指数不受凋落物输入的影响,凋落物去除降低表层土壤微生物群落的M a r g a l e f 丰富度,提高P i e l o u 均匀度,表明0 10c m 土层微生物群落含量与分布状况受凋落物输入变化影响较大;(4)地下植物根系存在可提高真菌(如丛枝菌根真菌)含量,而地上凋落物输入主要改变细菌丰度以及群落结构㊂可溶性有机碳以及矿质氮是影响不同处理土壤微生物群落组成和多样性的主要因素㊂可见,凋落物和根系输入通过土壤理化性质的变化而影响了微生物群落,研究结果可为全面认识植物㊁土壤与微生物间的相互作用对森林生产力的影响提供科学依据㊂关键词:微生物群落;微生物多样性;磷脂脂肪酸;凋落物;根系中图分类号:S 154.3 文献标识码:A 文章编号:1009-2242(2021)06-0270-08D O I :10.13870/j.c n k i .s t b c x b .2021.06.037E f f e c t s o fL i t t e r a n dR o o t I n p u t sC h a n g i n g o nS o i lM i c r o b i a l C o m m u n i t yi na N a t u r a l C a s t a n o ps i s c a r l e s i i F o r e s t Z H A N GL e i 1,2,J I AS h u x i a n 1,2,L IX i a o l i n g 1,2,L U Y u m i n g 1,2,L I N W e i s h e n g 1,2,L I U X i a o f e i 1,2,G U OJ i a n f e n 1,2(1.C o l l e g e o f G e o g r a p h i c a lS c i e n c e ,F u j i a nN o r m a lU n i v e r s i t y ,F u z h o u 350007;2.K e y L a b o r a t o r y o f H u m i dS u b t r o p i c a lE c o -G e o g r a p h i c a lP r o c e s s e s ,M i n i s t r y o f Ed u c a t i o n ,F u z h o u 350007)A b s t r a c t :W i t h t he c h a n g e of n e t p r i m a r yp r o d u c t i v i t y i nan a t u r a l f o r e s t o f C a s t a n o ps i s c a r l e s i i i ns u b t r o p i c a l r e g i o nu n d e r c l i m a t e c h a n g e ,l i t t e r a n d p l a n t r o o t i n p u t sw i l l a l s o c h a n g e ,w h i c hw i l l s i g n i f i c a n t l y a f f e c t s o i l m i c r o b i a l c o mm u n i t y .I n t h i s s t u d y ,t h eD e t r i t u s I n p u t a n dR e m o v a lT r e a t m e n t s (D I R T )h a db e e n s e t u pi n an a t u r a l C .c a r l e s i i f o r e s t f o r s e v e n y e a r s .I n J u l y 2019,s o i l s o f t w o l a ye r s (0 10,10 20c m )i n d if f e r e n t t r e a t m e n t s (c o n t r o l ,r e m o v a l o f a b o v e -g r o u n d l i t t e r s ,r e m o v a l o f r o o t s ,n o i n p u t o f l i t t e r s ,a n da d d i t i o no f d o u b l e a b o v e -g r o u n d l i t t e r s )w e r e c o l l e c t e dt o m e a s u r em i c r o b i a l ph o s p h o li p i d f a t t y a c i d (P L F A )c o n t e n t s .T h e r a t i o a n dd i v e r s i t y o fm i c r o b i a l g r o u p sw e r ec a l c u l a t e dt of u r t h e r r e v e a l t h e i n f l u e n c i n g me c h a n i s m of l i t t e r a n d p l a n t r o o t i n p u t s o n s o i lm i c r o b i a l c o mm u n i t y c o m p o s i t i o n a n dd i v e r s i t y i n a s u b t r o pi c a l n a t u r a l C .c a r l e s i i f o r e s t .T h e r e s u l t s s h o w e d t h a t :(1)T h e P L F Ac o n t e n t o fm i c r o o r g a n i s m s i n t h e 0 10c ms o i l l a y e r f o r d i f f e r e n t t r e a t m e n t sw a sa b o u t t w i c e t h a t i nt h e10 20c ms o i l l a ye r .(2)T h ea d d i t i o no r r e m o v a l of l i t t e r s r e d u c e d t h e c o n t e n t s o fg r a m -p o s i t i v eb a c t e r i a ,g r a m -n e g a t i v eb a c t e r i a ,a c t i n o m y c e t e s a n do th e r b a c t e ri a t ov a r y i n g d e g r e e s ,b u t h a dn oe f f e c t o na r b u s c u l a rm y c o r r h i z a l f u n gi .T h e r o o t r e m o v a l r e d u c e d t h eP L F A Copyright©博看网 . All Rights Reserved.c o n t e n t o f a r b u s c u l a rm y c o r r h i z a l f u n g i s i g n i f i c a n t l y.(3)S h a n n o n-W i e n e ra n dS i m p s o nd i ve r s i t y i n d i c e sof t h em i c r o b i a l c o mm u n i t i e sw e r en o t a f f e c t e db y d i f f e r e n t t r e a t m e n t s.L i t t e r r e m o v a l r e d u c e d t h e r i c h n e s so f s o i lm i c r o b i a l c o mm u n i t y a n d i m p r o v e d t h e e v e n n e s s.T h e c o n t e n t a n d d i s t r i b u t i o n o fm i c r o b i a l c o mm u n i t y i n 0 10c ms o i l l a y e rw e r eg r e a t l y a f f e c t e db y th e c h a n g e o f li t t e r i n p u t.(4)P l a n t r o o t s i m p r o v e d t h e c o n t e n t o f f u n g i,w h i l e l i t t e r i n p u tm a i n l y c h a n g e db a c t e r i a l a b u n d a n c ea n ds t r u c t u r e.S o l u b l eo r g a n i cc a r b o na n d m i n e r a l n i t r o g e nw e r e t h em a i n f a c t o r s t h a t a f f e c t t h em i c r o b i a l c o mm u n i t y c o m p o s i t i o n a n dd i v e r s i t y.T h e r e f o r e,l i t t e ra n dr o o t i n p u t sa f f e c t e ds o i lm i c r o b i a lc o mm u n i t y t h r o u g ht h ec h a n g eo fs o i l p r o p e r t i e s.T h e r e s u l t s c a n p r o v i d eas c i e n t i f i cb a s i sf o ru n d e r s t a n d i n g t h ee f f e c t so f i n t e r a c t i o n sa m o n gp l a n t s,s o i l,a n d m i c r o o r g a n i s m s o n f o r e s t p r o d u c t i v i t y.K e y w o r d s:m i c r o b i a l c o mm u n i t y;m i c r o b i a l d i v e r s i t y;p h o s p h o l i p i d f a t t y a c i d;l i t t e r;r o o t伴随着全球气候变暖㊁氮沉降等气候变化的加剧,森林生态植被群落㊁物种构成以及植物本身的化学计量发生明显变化,导致凋落物以及根系输入的数量及质量亦相应发生改变[1]㊂在森林生态系统中,90%的净初级生产量是以地上或地下凋落物的形式归还到土壤中,凋落物不仅直接向土壤输入碳氮等营养元素,而且其数量㊁质量变化也改变土壤微环境,如温度㊁含水量以及p H等,进而间接改变土壤碳氮循环过程[2]㊂土壤微生物作为分解者在森林生态系统中积极参与物质循环和能量流动,是凋落物分解㊁土壤呼吸以及生物化学循环等过程的主要驱动因子之一[3]㊂土壤微生物通过对土壤有机质的矿化及积累,实现土壤有机质固定和植物对养分的吸收㊂在森林生态系统中,凋落物与根系及其分泌物是土壤微生物的主要碳源,凋落物和根系输入的细微变化导致微生物群落的快速响应[4]㊂卢胜旭等[5]对亚热带米槠人工林的研究中发现,凋落物输入变化导致微生物磷脂肪酸含量发生显著变化,且细菌㊁放线菌等受地上凋落物输入变化影响明显;Z h a o等[6]在温带樟子松人工林的研究中发现,地上凋落物输入减少并不会对土壤微生物量㊁群落结构以及功能状况产生影响,这可能是因为常绿阔叶林凋落物营养元素㊁碳氮含量相对较高,以及地下植物根系对土壤微生物影响差异等因素; W a n g等[7]在中亚热带杉木和马尾松混交林的研究中发现,根系去除引起的土壤微生物群落变化大于凋落物添加处理,其中放线菌主要受植物根系输入的影响;B r a n t等[8]在温带落叶栎林凋落物和根系输入试验中发现,根输入是导致土壤微生物群落发生变化的主要因素,去除根系增加了放线菌数量,减少了真菌的数量,两者均说明除地上凋落物外,地下植物根系输入变化也是影响土壤微生物含量以及结构的重要因素之一㊂综上所述,微生物对凋落物和根系输入变化的响应受地带差异㊁森林类型等因素影响具有一定的复杂性,且目前在亚热带常绿阔叶天然林中研究凋落物和植物根系输入变化对微生物影响相对较少㊂我国亚热带地区作为同纬度地区唯一的 绿洲 ,因其森林面积大㊁净初级生产力高以及生物多样性丰富受到广泛关注㊂米槠(C a s t a n o p s i sc a r l e s i i)是该地区主要的建群种与优势种,形成了稳定的顶级生态群落[9]㊂因此,本研究在亚热带米槠天然林内设置凋落物和根系添加与去除试验,根据不同土层(0 10, 10 20c m)土壤微生物各特征磷脂脂肪酸含量及土壤理化性质差异,对土壤微生物群落组成以及多样性进行研究,这对全面认识亚热带植物㊁土壤与微生物间的相互作用,以及土壤肥力固持㊁森林生产力提高等有重要意义㊂1材料与方法1.1研究区概况研究区位于福建省三明市格氏栲自然保护区(117ʎ28'E,26ʎ11'N),海拔305~315m,年平均降水量1630mm,平均气温19.5ħ㊂本保护区试验样地土壤是由砂岩发育而成的红壤㊂本研究区米槠天然林林龄约200年,人为干扰较少㊂该试验样地天然林的密度为1192h m2,2012年的群落调查表明,建群种为米槠(C a s t a n o p s i s c a r l e s i i),林下植被主要为华山姜(A l p i n i a c h i n e n s i s)㊁硃砂根(A r d i s i a c r e n a t a)㊁香花崖豆藤(M i l l e t t i ad i e l s i a n a)㊁桂北木姜子(L i t-s e a s u b c o r i a c e a)和狗脊(W o o d w a r d i a j a p o n i c a)等,总生物量为397.4t/h m2,平均树高为19.2m,平均胸径为22.13c m[10]㊂1.2D I R T样地设置本研究地于2012年6月在米槠天然林中随机布设3块20mˑ20m标准样地,每块标准样地内随机布设5个1mˑ1m的试验小区,5种处理,3个重复,共设置15个试验小区㊂具体试验设计为:对照处理(C T)是自然状态下正常凋落物输入状态;去除地下根系(N R)是在试验小区周围挖1m的壕沟并埋入0.1mm孔径尼龙网隔绝根系;去除地上凋落物(N L)是将1.5mˑ1.5m㊁孔径为2mm的尼龙网放置于试验小区上方,隔绝叶㊁枝等地上凋落物输入;无172第6期张磊等:改变凋落物和根系输入对米槠天然林土壤微生物群落的影响Copyright©博看网 . All Rights Reserved.凋落物输入处理(N I )是将去除地上与地下凋落物处理都应用于该试验小区;添加双倍凋落物处理(D L )是每月末将去除地上凋落物处理尼龙网上的凋落物均匀铺置于该试验小区㊂1.3 土壤样品采集2019年7月(湿季),在D I R T 处理各小区内采用 S 点取样法设置5个采样点㊂用直径为3c m 的土钻钻取0 10,10 20c m 土层土样,装入已灭菌的自封袋内后带回实验室㊂充分混合均匀土壤后去除肉眼可见的石块以及植物根系残体后,将土样过2mm 筛后分为3部分,部分保存于-20ħ冷冻箱,用于测定土壤磷酸脂肪酸(p h o s p h o l i p i d f a t t y ac id ,P L -F A );部分新鲜土壤过2mm 筛,测定可溶性有机碳㊁氮㊁硝态氮以及铵态氮;部分土壤室内自然风干后过0.149mm 筛,测定土壤碳氮含量等指标㊂1.4 土壤基本理化性质测定土壤含水率采用烘干法测定;土壤p H 采用便携式pH 计(S T A R T E R300,O H A U S ,美国)测定;全氮(t o t a l n i t r o g e n ,T N )与全碳(t o t a l c a r b o n ,T C )采用土壤碳氮元素分析仪(E l e m e n t a lA n a l y z e rV a r i oE L I I I ,德国)测定;土壤可溶性有机氮(d i s s o l v e do r g a n i cn i t r o g e n ,D O N )以及土壤可溶性有机碳(d i s s o l v e do r ga n i c c a rb o n ,D O C )冷水浸提后分别采用连续流动分析仪(S k a l a rS a n ++,荷兰)测定D O N 含量,D O N 含量是通过T N ңN H 4+NңN O 3- N 计算后获得,T O C 分析仪(T O C -V P H /C P N ,S h i m a d z u ,日本)测定D O C 浓度;土壤铵态氮和硝态氮(N H 4+ N 和N O 3- N)采用硫酸钾浸提后用连续流动分析仪(S k a l a r S a n ++,荷兰)测定㊂具体结果见表1㊂表1 不同凋落物和根系输入处理土壤化学性质土层深度/c m 处理p HNH 4+ N/(m g ㊃k g -1)N O 3- N/(m g ㊃k g -1)D O C/(m g ㊃k g -1)D O N/(m g ㊃k g -1)T N/(g ㊃k g -1)T C/(g ㊃k g -1)C/N C T4.11ʃ0.14A a 19.65ʃ0.57A a 7.26ʃ0.22A a 90.55ʃ3.88A a 4.69ʃ0.31A a 1.54ʃ0.04A a 21.48ʃ0.99B a 13.99ʃ0.99B a N R 4.15ʃ0.09A a 11.92ʃ0.67C a 4.08ʃ0.65B a 47.91ʃ1.39C a 1.65ʃ0.04C a 1.13ʃ0.1C a 19.36ʃ0.84C a 17.25ʃ0.97A a0 10N L 4.18ʃ0.05A a 10.14ʃ0.55D a 4.80ʃ0.10B a 36.54ʃ1.52D a 1.98ʃ0.08C a 1.12ʃ0.08C a 18.41ʃ0.56C a 16.52ʃ0.69A a N I 4.08ʃ0.07A b9.29ʃ0.92D a 1.99ʃ0.51C a 39.24ʃ3.15D a 1.95ʃ0.18C a1.14ʃ0.05C a 19.37ʃ0.21C a 17.05ʃ0.82A a D L4.12ʃ0.01A a 13.11ʃ0.01B a 4.18ʃ0.01B a 71.65ʃ0.01B a 2.90ʃ0.01B a 1.4ʃ0.01B a23.11ʃ0.01A a 16.54ʃ0.01A a C T4.11ʃ0.01B a 12.88ʃ0.01A b 2.80ʃ0.01A b 44.22ʃ0.01A b 1.90ʃ0.01B b0.8ʃ0.01B b12.48ʃ0.01B b 15.52ʃ0.01A aN R 4.17ʃ0.04A B a 8.37ʃ1.00C b 2.82ʃ0.55A b 36.05ʃ1.63B b 1.81ʃ0.59B a 0.85ʃ0.07B b 11.49ʃ0.49C b 13.50ʃ0.79B b 10 20N L 4.25ʃ0.03A a9.48ʃ0.47B C a 1.54ʃ0.64B b 30.77ʃ0.07C b 0.60ʃ0.41C b0.87ʃ0.04B b 13.41ʃ0.27B b 15.48ʃ0.47A a N I 4.22ʃ0.04A a 10.01ʃ0.34B a 0.70ʃ0.02C b 20.66ʃ0.32D b 1.67ʃ0.29B a0.89ʃ0.07B b 12.6ʃ0.36B b 14.19ʃ0.65B bD L4.25ʃ0.01A a 12.45ʃ0.01A a 2.30ʃ0.01A b 41.86ʃ0.01A b 2.80ʃ0.01A a1.02ʃ0.01A b 14.66ʃ0.01A b 14.43ʃ0.01A B bTn s ******************n sS**********************TˑSn s ********************* 注:T 为处理;S 为土层;T N 为总氮;D O N 为可溶性有机氮;n =3;表中数据为平均值ʃ标准差;不同大写字母表示不同处理间差异显著(P <0.05);不同小写字母表示不同土层间差异显著(P <0.05)㊂下同㊂1.5 磷脂脂肪酸测定磷脂脂肪酸测定是通过总脂提取㊁磷脂分离以及磷脂甲酯化提取出干燥的磷脂脂肪酸甲脂,后将200μL 含有19ʒ0甲酯的内标液将样品洗入G C 瓶,用气象色谱仪(A g i l e n t 6890N ,美国)进行特征磷脂脂肪酸的鉴定㊂计算采用19ʒ0内标法,每单位干土所含脂肪酸含量n m o l /g㊂主要的磷酸脂肪酸标记与对应微生物群落[11]见表2㊂表2 磷脂脂肪酸特征值标记物微生物群落类型磷脂脂肪酸标记物革兰氏阳性细菌(G P ,gr a m-p o s i t i v eb a c t e r i a )i 14ʒ0,i 15ʒ0,a 15ʒ0,i 16ʒ0,i 17ʒ0,a 17ʒ0革兰氏阴性细菌(G N ,g r a m-n e ga t i v eb ac t e r i a )16ʒ1ω9c ,16ʒ1ω7c ,c y 17ʒ0,18ʒ1ω7c ,18ʒ1ω5c ,c y19ʒ0丛枝菌根真菌(AM F ,a r b u s c u l a rm y c o r r h i z a l f u n gi )16ʒ1ω5c 放线菌(A C T ,a c t i n o m yc e t e s )10M e 16ʒ0,10M e 17ʒ0,10M e 18ʒ0真菌(f u n g i )18ʒ1ω9c ,18ʒ2ω6c细菌(b a c t e r i a)i 14ʒ0,i 15ʒ0,a 15ʒ0,i 16ʒ0,i 17ʒ0,a 17ʒ0,16ʒ1ω9c ,16ʒ1ω7c,c y 17ʒ0,18ʒ1ω7c ,18ʒ1ω5c ,c y19ʒ0G P /G N革兰氏阳性菌革兰氏阴性菌磷脂脂肪酸含量比值F /B真菌和细菌磷脂脂肪酸含量比值1.6 数据处理数据经过E x c e l 2010软件处理,用S P S S24.0软件进行统计分析㊂采用单因素方差分析(o n e -w a yA N O V A )检验不同处理指标之间的差异显著性(P =0.05)㊂采用双因素方差(t w o -w a y A N O V A )分析判断土层与处理间交互效应㊂采用独立样本T 检验对272水土保持学报 第35卷Copyright©博看网 . All Rights Reserved.土层间各指标进行显著性检验(P =0.05)㊂采用C a n o c o5.0软件,将不同土层土壤微生物群落构成作为响应因子,土壤基本理化性质作为环境因子做冗余分析并绘制图像㊂其余绘图由O r i gi n 2018软件完成㊂微生物种群多样性采用S h a n n o n -w i e n e r 多样性指数(H ')㊁P i e l o u 均匀度指数(J )㊁S i m ps o n 优势度(D )与M a r ga l e f 丰富度指数(R )[12-13],计算公式为:H '=ðni =0P i l n P i (i =1,2, ,n )J =H '/l n SM =(S -1)/l n ND =1-ΣP i 2式中:P i =N i /N ,N i 为第i 种特征磷脂脂肪酸含量;N 为特征磷脂脂肪酸含量总和;S 为同一样品检测出磷脂脂肪酸种数㊂2 结果与分析2.1 凋落物和根系输入变化中土壤磷脂脂肪酸含量由图1可知,不同土层之间的微生物P L F A s 含量差异显著,0 10c m 土层中各微生物群落P L F A s含量约为10 20c m 土层的2倍,说明土层深度对微生物群落结构影响显著(P <0.05)㊂ 注:T 为处理;S 为土层㊂图中不同大写字母表示不同处理间差异显著(P <0.05);不同小写字母表示不同土层间差异显著(P <0.05)㊂下同㊂图1 不同凋落物和根系输入处理土壤微生物磷脂脂肪酸含量在0 10c m 土层中,各凋落物和根系处理土壤微生物总P L F A s 含量以C T 处理的最高(32.98n m o l /g ),N I 处理的最低(21.15n m o l /g )(图1)㊂N R ㊁N L ㊁N I 处理土壤革兰氏阳性菌P L F A s 含量没有差异,但都显著低于C T 和D L 处理,说明去除凋落物或者根系对革兰氏阳性菌有明显影响(P <0.05)㊂N R 处理革兰氏阴性菌P L F A s 含量显著低于其余处理,说明根系可能是影响革兰氏阴性菌的因372第6期 张磊等:改变凋落物和根系输入对米槠天然林土壤微生物群落的影响Copyright©博看网 . All Rights Reserved.素之一㊂丛枝菌根真菌P L F A s 含量较低(0.57~0.75n m o l /g ),C T ㊁N L ㊁D L 处理丛枝菌根真菌P L -F A s 含量显著大于N R 和N I 处理㊂C T 处理放线菌P L F A s 含量最高(6.21n m o l /g ),而N R ㊁N L ㊁N I 3种处理P L F A s 含量显著低于其他处理,且三者之间没有显著差异,这与革兰氏阳性菌的变化趋势相同㊂真菌P L F A s 含量在N I 处理中明显低于其他处理,说明凋落物和根系去除影响真菌含量㊂在10 20c m 土层中,微生物总P L F A s 含量呈现D L >C T >N L >N I >N R 的变化趋势,且各处理间的差异显著(P <0.05)㊂D L 处理革兰氏阳性菌含量显著高于其余处理,而N R ㊁N L ㊁N I 处理间无显著差异㊂在革兰氏阴性菌P L F A s 含量中,D L ㊁C T 与N L 处理间没有显著差异,但三者显著大于N I 与N R 处理㊂丛枝菌根真菌P L F A s 含量在不同处理间具有明显差异,其中N R 处理含量最低(0.17n m o l /g ),C T 处理含量最高(0.31n m o l /g )㊂N R 处理放线菌含量显著低于其他处理,且N I 与N L 处理间无显著差异㊂N L 与D L 处理之间真菌P L F A s 含量没有明显差异;D L 处理细菌P L F A s 含量明显高于其他处理㊂处理和土层对各微生物P L F A s 含量有极显著影响(P <0.001)㊂同时,除革兰氏阴性菌外,其他各类微生物P L F A s 含量受处理和土层交互作用的影响显著㊂0 10c m 土层中,N R 处理革兰氏阳性菌与阴性菌比值(G PʒG N )显著大于其余处理㊂在0 10c m 土层中,真菌与细菌比值(F ʒB )在不同处理间差异显著,N I 处理比值仅为0.20,N R 为0.27,N L 为0.28,说明凋落物和根系输入变化对微生物群落结构影响较大,但并没有改变细菌在微生物群落结构中的主导地位㊂在10 20c m 土层中不同处理间G P ʒG N 比值没有显著差异㊂与C T 处理相比,去除凋落物或者根系处理F ʒB 比值有不同程度上升;同时,G P ʒG N 和F ʒB 受处理和土层交互作用的影响较低㊂2.2 凋落物和根系输入变化中土壤微生物多样性由表3可知,在0 10c m 土层中,不同处理间S h a n n o n -w i e n e r 多样性指数㊁S i m p s o n 多样性指数没有显著差异,但M a r g a l e f 丰富度指数差异显著,其中D L 处理显著大于其余处理,C T 与N R 处理指数次之,N L 处理指数最低㊂P i e l o u 均匀度指数在处理间差异显著,呈现N I >N L>N R>C T>D L 的变化趋势,凋落物或根系去除处理均匀度指数显著大于双倍凋落物添加处理㊂在10 20c m 土层中,C T 处理S h a n n o n -w i e n e r 多样性指数和S i m p s o n 多样性指数明显低于其他处理;N R 与N I 处理中M a r g a l e f 丰富度指数显著低于其他处理,这表明在该土层植物根系对微生物丰富度的影响较强㊂P i e l o u 均匀度指数呈现与M a r g a l e f 丰富度指数相反的变化趋势,说明N I 处理中检测出的P L F A s 种数较少且含量均匀㊂另外,M a r ga l e f 丰富度指数分别受处理和土层的影响非常显著(P <0.001),处理和土层的交互作用对S i m ps o n 和S h a n n o n -w i e n e r 多样性指数以及M a r g a l e f 丰富度㊁P i e l o u 均匀度均有显著影响(P <0.05)㊂表3 不同凋落物和根系输入处理土壤微生物多样性指数土层深度/c m处理S h a n n o n -w i e n e r 指数S i m ps o n 指数M a r ga l e f 指数P i e l o u 指数C T 2.5015ʃ0.0279A a 0.9022ʃ0.0043A a 4.9770ʃ0.1982B b 0.8601ʃ0.0027D a N R 2.4740ʃ0.0643A a 0.8961ʃ0.0071A a 4.8779ʃ0.1892B C b 0.8858ʃ0.0124C b 0 10N L 2.5163ʃ0.0184A a 0.9036ʃ0.0035A a 4.6768ʃ0.0795D b 0.9076ʃ0.0066B b N I2.4570ʃ0.0240A b 0.8950ʃ0.0022A b 4.2615ʃ0.0577C b0.9310ʃ0.0091A b D L 2.4736ʃ0.0208A b 0.8958ʃ0.0043A a 5.2728ʃ0.1649A b 0.8453ʃ0.0019E b C T2.4441ʃ0.0293B a 0.8880ʃ0.0043B b 5.9466ʃ0.0870A a 0.8815ʃ0.0106C b N R 2.5213ʃ0.0206A a 0.9029ʃ0.0035A a 5.4321ʃ0.1238B a 0.9830ʃ0.0080A a 10 20N L 2.5156ʃ0.0173A a 0.9021ʃ0.0033A a 5.8281ʃ0.0432A a 0.9289ʃ0.0064B aN I2.5569ʃ0.0468A a 0.9080ʃ0.0059A a 5.2451ʃ0.0484B a0.9968ʃ0.0182A a D L 2.5197ʃ0.0100A a0.9004ʃ0.0011A a5.8156ʃ0.2069A a0.9023ʃ0.0103C aTn s *******S*n s ******TˑS**********2.3 凋落物和根系输入变化处理中影响土壤微生物的主要因素通过冗余分析(R D A )(图2)可知,不同处理间的聚类效应较好㊂在0 10c m 土层中,轴1解释了微生物P L F A s 含量变化的81.27%,轴2解释了微生物P L F A s 含量变化的6.54%㊂在该土层的环境影响因子中,D O C 解释度最高,达到72.00%(P =0.002),主要影响放线菌以及革兰氏阳性菌P L F A s 含量,其次为N O 3- N ,解释度为9.7%(P =0.004)㊂在10 20c m 土层中,轴1解释了微生物P L F A s 含量变化的85.25%,轴2解释了微生物P L F A s 含量变化的2.53%;NH 4+ N 是该土层中主要的环境影响472水土保持学报 第35卷Copyright©博看网 . All Rights Reserved.因素,解释度为65.00%(P=0.002),其与细菌㊁放线菌以及总微生物P L F A s含量相关性最强,T C解释度也达到14.7%(P=0.004)㊂另外,在本研究中,去除凋落物或者植物根系处理均出现在与主要影响因子相反的方向,而对照或添加凋落物处理则与主要影响因子同向,这表明4种环境变量主要影响不同处理土壤微生物含量及多样性,特别是D O C 以及矿质氮㊂注:G P为革兰氏阳性菌;G N为革兰氏阴性菌;AM F为丛枝菌根真菌;A C T为放线菌;B a c t e r i a为细菌;F u n g i为真菌;D O C为可溶性有机碳;D O N为可溶性有机氮;T C为总碳;T N为总氮㊂图2凋落物和根系输入变化下土壤磷脂脂肪酸冗余分析3讨论3.1凋落物和根系输入变化对土壤微生物群落组成的影响磷脂脂肪酸作为微生物细胞膜的关键组成部分,不同种类的微生物可以合成不同生物标记的磷脂脂肪酸㊂本研究中,0 10c m土层微生物P L F A s含量约为10 20c m土层的2倍,这主要是因为土壤表层(0 10c m)凋落物以及植物根系丰富,土壤有机质含量高(表1),因而该层P L F A s含量更高㊂相对C T处理,去除凋落物或者根系处理表层(0 10c m)土壤总P L F A s㊁革兰氏阳性菌㊁革兰氏阴性菌㊁细菌以及放线菌含量均有不同程度下降,如邹秉章[14]在对杉木人工林的间伐和套种试验中发现,相对真菌而言,革兰氏阳性菌等细菌属于富营养微生物,它们主要以新鲜输入的有机质作为可利用底物㊂土壤表层凋落物以及根系的去除使得土壤中构成微生物结构碳和氮磷等新鲜输入的营养物质缺失,而细菌作为r-策略生物无法获得底物,整个种群规模也会出现不同程度的下降㊂真菌作为k-策略生物与细菌生存策略相反,具有需营养量㊁需水量㊁敏感性低的特征,且能构成较为完整的菌丝网络,降低对外部新鲜输入营养物质(如可溶性有机质)的依赖需求㊂N R与N I处理真菌P L F A s含量显著低于N L处理,是因为植物根系一方面促进有机碳的固定,另一方面植物根系也与特定真菌形成共生关系[15],去除植物根系(N R㊁N I)导致丛枝菌根真菌等真菌失去相应的依附结构,数量以及活性也因此降低,这也表明真菌受根系影响较大㊂一般认为,G PʒG N值高有机碳可利用度低,对揭示土壤有机碳利用状况具有关键作用㊂本研究中,仅有0 10c m土层N R处理显著大于其他处理,F a-n i n等[16]在对瑞典北部某小岛进行树根移除有时也发现,去除植物根系增加G PʒG N比值,这与本研究结果一致㊂有研究[17]也表明,植物根际周围及分泌物含有糖类等易分解物质,可作为微生物生长的底物,去除根系使得土壤中β-葡萄糖苷酶等分解碳的酶活性下降[18],微生物碳源代谢功能下降,碳可利用性也降低㊂在N L处理中FʒB值明显高于其他处理,这与吴君君[2]在亚热带人工针叶林D I R T试验结果相似㊂在前期研究[19]结果中发现,保留根系处理中惰性碳含量显著高于其他处理,易分解碳输入减少,惰性碳比重上升㊂真菌相对细菌更倾向于利用土壤中的难降解物质(木质素㊁纤维素),因此真菌比细菌更容易获得代谢底物㊂另外,细菌种群基数大而真菌种群基数小,进而影响各处理比值㊂α多样性指数常用来指示植物或微生物的种数以及数量状况㊂在本研究中,S h a n n o n-W i e n e r㊁S i m p s o n多样性指数在不同处理以及土层之间并无572第6期张磊等:改变凋落物和根系输入对米槠天然林土壤微生物群落的影响Copyright©博看网 . All Rights Reserved.明显变化,这表明凋落物和根系输入变化并不会对微生物群落的多样性造成显著影响,这可能是由于本研究地米槠林龄在200年以上,植被以及微生物群落演替都达到顶级状态,凋落物输入变化并不会对微生物多样性造成显著影响㊂而表层土壤M a r g a l e f丰富度指数在不同处理之间差异显著,添加凋落物处理显著大于去除凋落物或者植物根系处理,这表明凋落物输入量以及类型变化影响微生物各种群丰富度㊂桑昌鹏等[20]在对滨海沙地进行凋落物和根系去除试验也发现,凋落物以及根系输入变化会导致不同类型微生物群落萎缩㊂另外,0 10c m土层M a r g a l e f指数明显低于10 20c m土层,这可能是因为本研究中各土层微生物种数无明显差异,而P L F A s含量差异显著㊂在0 10c m土层中,P i e l o u均匀度指数在不同处理间差异显著,这可能是由于N I处理缺少凋落物和植物根系新鲜物质输入,表层土壤易受到凋落物的直接影响,温度㊁含水量等微环境发生变化㊂同时,添加双倍凋落物处理有机质输入增多,土壤中易分解碳氮比例上升,可能衍生更多不同种类微生物㊂另外,与韩世忠等[21]在福建省建瓯和武夷山米槠天然林土壤微生物研究相比,本研究多样性指数和丰富度指数均有不同程度下降,这可能与土壤有机质含量多寡等基本理化性质有关㊂在韩世忠等[21]的研究中两地的有机质含量(有机碳㊁总氮)以及p H均大于本文,这可能是因为丰富的有机质可以为微生物提供活性底物,另外低p H的酸性土壤对微生物生长产生生理胁迫,特别是胞外酶活性降低使微生物失去分解的主要来源㊂G e i s s e l e r等[22]也发现,在中性土壤中细菌群落多样性丰富,而在酸性土壤中较低,且p H与P L-F A具有显著的正相关关系㊂3.2凋落物和根系输入变化对土壤微生物的影响因素分析R D A分析表明,在0 10c m土层中,可溶性有机碳(D O C)是影响该土层微生物种群的重要因素㊂D O C主要通过枯枝落叶层的淋溶以及植物根系分泌物周转产生,是微生物营养物质以及能量的主要来源㊂本研究中凋落物和根系输入变化导致作为微生物底物呼吸的关键成分D O C发生显著变化(表1),从而对整个微生物群落组成产生影响㊂同时,根据D O C化学结构等因素可将D O C分为疏水性和亲水性,虽然被吸附的D O C移动性差,被微生物利用能力仅为可流动D O C的1/5[23],但疏水性D O C所占比值大,同时疏水性D O C的吸附能力强,大量D O C 被截留在土壤表层[24],导致表层土壤D O C浓度显著大于底层,因此D O C为表层土壤微生物群落组成变化的主要影响因素㊂另外,真菌与D O C的相关性最低(图2),这是因为真菌主要通过利用难分解物质为主,而对不稳定碳化合物的敏感度低,如葡萄糖㊁氨基酸等㊂在10 20c m土层中,T C是次要影响因素㊂全球1m土层内土壤有机碳(S O C)含量约为总碳的60%以上[25],而S O C经过微生物分解后被其获取成为自身能源,满足生长需求,进而影响微生物群落㊂矿质氮主要是铵态氮(N H4+ N)和硝态氮(N O3- N),在0 10c m土层中,N O3- N为次要影响因素,而在10 20c m土层中,N H4+ N是影响微生物群落组成的主要因素㊂N H4+ N是我国南方无机氮的主要成分[26],同时我国南方地区也是全球三大氮沉降地区之一,因此植物凋落物及根系分泌物的氮含量高,本研究也发现,凋落物和根系输入变化对矿质氮含量产生显著影响(表1),这与卢胜旭等[5]在亚热带米槠人工林的研究结果一致㊂这主要是因为氮有效性增加促进微生物活性提高,以及数量增加,促进微生物代谢功能增强;W e i等[27]也认为,一定量NH4+ N的添加会导致团聚体中革兰氏阳性菌数量的增加,而N O3- N的增多则促进革兰氏阴性菌含量增加㊂4结论在植物残体的添加与去除试验中发现,地上与地下凋落物的添加与去除对微生物群落组成以及多样性产生显著影响㊂不同处理下细菌含量显著大于真菌含量,说明凋落物的添加与去除并不会改变该地区细菌的主导地位㊂添加或去除凋落物使得革兰氏阳性菌等细菌出现不同程度的下降;相比对照,去除根系㊁去除凋落物以及无凋落物输入处理土壤细菌含量分别下降28.7%,21.1%和29.0%㊂凋落物添加与去除并不会对丛枝菌根真菌等真菌产生显著影响,但去除根系处理相比对照则降低33.3%的丛枝菌根真菌以及17.1%的真菌㊂微生物群落多样性没有受到凋落物添加或去除的影响,凋落物去除降低表层土壤微生物群落的丰富度而提高均匀度,且含有凋落物的处理土壤微生物丰富度与均匀度大,说明凋落物影响表层土壤微生物群落多样性㊂由此可见,亚热带常绿阔叶林中植物根系输入主要对真菌数量以及结构产生影响,而地上凋落物输入主要影响细菌丰度,但具体影响机制仍需进一步的研究㊂另外,可溶性有机碳以及矿质氮是影响微生物群落结构的主要因素㊂因此,植物残体的添加与去除可能直接导致土壤672水土保持学报第35卷Copyright©博看网 . All Rights Reserved.。
土壤PLFA测定方法一、原理:Phospholipid fatty acids (PLFAs) are exclusively present in the membranes of all living cells. The PLFA profile of the soil microbial community reflects both species composition and relative species abundance. Phospholipids decompose rapidly on cell death (by hydrolysis of the phosphate group by cellular enzymes) therefore it is assured that only the living cells are studied.PLFA profiles are determined using a modification of the method described by Frostegard et al (1991), as based on the method described by Bligh and Dyer (1952) and White et al (1979).N.B.(注意事项)Avoid excessive exposure to light throughout this method, especially from fluorescent lights, as light degrades phospholipids. (易被光解,故后续操作用锡纸包裹)Glassware should be ion and organic free. Dirty glassware should be immersed in hot water with phosphate detergent (Decon) and rinsed deionised water. The dry glassware can then be either wrapped in aluminum foil and heated at 450ºC for 4 hrs or alternatively rinsed in methanol then chloroform and dried. Alternatively use new sterile glass media bottles throughout.The needles of the sample concentrator should be washed in methanol before use. (氮吹仪针头,用前用正己烷擦拭)Fatty Acid Methyyl Esters (FAMEs) can be quantified by using nonadecanoic acid as an internal standard(定量用内标). A FAME standard supplied by Supelco is used for quality assurance of the GC run.附表:试验用药品、仪器清单。
PLFA 的提取和鉴定实验原理和目的PLFA 原理磷脂脂肪酸(PLFA)是活体微生物细胞膜的重要组分, 不同类群的微生物可通过不同的生化途径合成不同的PLFA 。
一些PLFA 可作为分析微生物量和微生物群落结构变化的“生物标记”。
传统上微生物多样性研究多依赖于培养方法和显微技术,即采用选择性培养基从样品中分离出纯菌株后进行鉴定,获得可培养微生物的种类和数量信息。
但该方法存在以下缺点:(1)许多微生物是不可培养的,分离鉴定到的微生物只占微生物总数很少一部分,因此,通过该传统方法只能得到微生物群落信息的极小部分(2)只能了解可培养的极少数微生物数量和群落结构,具有选择性且不能对大多数微生物定量研究(3)对于微生物群体相互作用研究的贡献很小。
目前,磷脂脂肪酸(PLFA)分析被广泛地应用于微生物多样性研究。
磷脂是所有生物活细胞重要的膜组分,在真核生物和细菌的膜中磷脂分别占约50%和98%。
PLFA 是磷脂的构成成分,它具有结构多样性和生物特异性, PLFA 的存在及其丰度可揭示特定生物或生物种群的存在及其丰度。
磷脂在细胞死亡后快速降解(厌氧条件下约需2 d,而好氧条件下约需12~16 d)。
故用以表征微生物群落中“存活”的那部分群体。
总之,通过对PLFA 的定量测定可完成对了解微生物活细胞生物量的测定。
通过根据PLFA 分析的种类了解土壤、肠态微生物群落结构。
实验步骤样品的采集和预处理实验所需仪器和试剂:聚四氟乙烯试管,涡旋器,玻璃试管,马弗炉两个,烧杯正己烷1.用2-3毫升正己烷清洗聚四氟乙烯试管,(清洗时需涡旋震动),再将它们放入马弗炉里干燥,玻璃试管处理同上(每6支试管换液一次)2.将采集的粪样放入聚四氟乙烯管中进行液氮处理,干燥3.磨碎样品混匀,置于-20摄氏度的冰箱中。
第一天所需药品与器材:震荡器,离心机,移液管,玻璃试管,抽吸器,氯仿,磷缓冲液,甲醇,沙子,1.将50支试管分为5组编号A-E ,每组10支编号1-10,并做如下处理(准确称量):2.在通风环境下将3.6 mL 的磷缓冲液,4mL 的氯仿和8mL 的甲醇分别加入试管中(需3个5-10mL 的移液管)3.在避光的条件下,震荡1个小时,用最大功率。
土壤PLFA测定方法一、原理:Phospholipid fatty acids (PLFAs) are exclusively present in the membranes of all living cells. The PLFA profile of the soil microbial community reflects both species composition and relative species abundance. Phospholipids decompose rapidly on cell death (by hydrolysis of the phosphate group by cellular enzymes) therefore it is assured that only the living cells are studied.PLFA profiles are determined using a modification of the method described by Frostegard et al (1991), as based on the method described by Bligh and Dyer (1952) and White et al (1979).N.B.(注意事项)Avoid excessive exposure to light throughout this method, especially from fluorescent lights, as light degrades phospholipids. (易被光解,故后续操作用锡纸包裹)Glassware should be ion and organic free. Dirty glassware should be immersed in hot water with phosphate detergent (Decon) and rinsed deionised water. The dry glassware can then be either wrapped in aluminum foil and heated at 450ºC for 4 hrs or alternatively rinsed in methanol then chloroform and dried. Alternatively use new sterile glass media bottles throughout.The needles of the sample concentrator should be washed in methanol before use. (氮吹仪针头,用前用正己烷擦拭)Fatty Acid Methyyl Esters (FAMEs) can be quantified by using nonadecanoic acid as an internal standard(定量用内标). A FAME standard supplied by Supelco is used for quality assurance of the GC run.附表:试验用药品、仪器清单。
凋落物和土壤前处理
取样:每个次小区分别取1袋米老排凋落物和1袋杉木凋落物,每个网袋单独装入一个塑料袋;同时用土钻取网袋下面0-10cm土壤装入自封袋。
共36个网袋+36个土样。
网袋和土壤放在装有冰块的冰盒带回实验室。
凋落物前处理:
1,混合:凋落物带回实验室后,用剪刀剪碎混合,分成三份,一
份-20℃冷藏做PLFA,一份4℃保鲜做凋落物酶,另一份烘干称重计算分解速率。
2,脱水:把-20℃冷藏的凋落物放入冷冻干燥机脱水(-80℃),24小时左右
3,粉碎:脱水之后的凋落物用球磨机粉碎,装入自封袋,封好袋口,-20℃冷冻。
4,运输:把凋落物和土壤样品装入放有冰块的大冰盒带到广州。
5,实验时每个样品用量为0.1g(华南植物园),其他程序与土壤PLFA 一样。
土壤前处理:带回实验室的土壤人工挑拣出石子,细根等,然后混合放在-20℃冷冻带到广州。
具体实验步骤:
1、凋落物样品用球磨机粉碎(<10 μm)
2、称取冷冻干燥后的凋落物样品(250±1 mg)于玻璃离心管中(25 ml),用磷酸钾溶液(50 mmol l-1, pH 7.4)1.6 ml 、甲醇4 ml、氯仿 2 ml;
3、涡旋30s,超声2 min,在37℃下温育30min,然后离心(800×g),将上层清液倒入50 ml分液漏斗中。
然后再重复浸提一次,合并两次上层清液。
4、向分液漏斗中再加入4 ml氯仿,4 ml水,然后轻轻的摇匀,放置整晚。
第二天
5、收集分液漏斗中的下层清液(氯仿相),在氮气下吹干。
6、通过色谱硅胶小柱进行脂质分离:用氯仿(3×2 ml)洗脱中性脂质,用丙酮(3×2 ml)洗脱糖脂,这些全部丢弃。
最后用甲醇(3×2 ml)洗脱极性脂类,收集到玻璃试管中。
在氮气下吹干。
7、在剩余残留物中,加入2ml氢氧化钾(KOH),1 ml甲苯:甲醇(1:1,v/v),然后在37℃下温育30 min。
参考文献:
Prior to analysis, frozen samples were ground with a Wiley Mill to pass through a 40-mesh screen.
(From:Temporal dynamics of microbial communities on decomposing leaf litter of 10 plant species in relation to decomposition rate: SBB) Subsamples for PLFA and enzyme assays were frozen (-20C) until analysis. (From: SARAH E. HOBBIE)
LFAs were extracted from 0.5 g freeze-dried residues(Petra Marschner; SBB)。