化学平衡常数与转化率及习题(学生)
- 格式:doc
- 大小:189.50 KB
- 文档页数:9

课时跟踪检测(三十二) 化学平衡常数及转化率的计算(应用课)一、单项选择题1.反应:Fe(s)+CO 2(g)FeO(s)+CO(g),700 ℃时平衡常数为1.47,900 ℃时平衡常数为2.15。
下列说法正确的是( )A .升高温度,该反应的正反应速率增大,逆反应速率减小B .该反应的化学平衡常数表达式为K =c (FeO )·c (CO )c (CO 2)·c (Fe )C .该反应的正反应是吸热反应D .增大CO 2浓度,平衡常数增大解析:选C A 项,升高温度,正、逆反应速率均增大,错误;B 项,固体物质浓度视为常数,不列入平衡常数的表达式,该反应的化学平衡常数表达式为K =c (CO )c (CO 2),错误;C 项,温度升高,K 增大,则该反应的正反应为吸热反应,C 正确;D 项,平衡常数只与温度有关,与浓度无关,增大反应物浓度,平衡常数不变,错误。
2.大量实验事实表明,对于可逆反应:m A(g)+n B(g)p (C)+q (D),在一定温度下,无论反应物的起始浓度如何,反应达到平衡状态后,将各物质的物质的量浓度代入表达式:K =c p (C )·c q (D )c m (A )·c n (B )[c p (C)表示物质C 的物质的量浓度的p 次方]。
得到的结果是一个定值。
我们把这个常数叫作该反应的化学平衡常数。
这个式子叫化学平衡常数表达式。
依据你的理解下列可逆反应平衡常数表达式错误的是( )选项化学方程式 平衡常数表达式 A 2NO 2N 2O 4K =c (N 2O 4)c (NO 2) B NO 212N 2O 4K =c 12(N 2O 4)c (NO 2) C2Fe 3++Fe 3Fe 2+K =c 3(Fe 2+)c 2(Fe 3+) DBr 2+H 2O H ++Br -+HBrO K =c (H +)·c (Br -)·c (HBrO )c (Br 2) 解析:选A 2NO 2N 2O 4的平衡常数表达式K =c (N 2O 4)c 2(NO 2),故A 错误。

高三化学四大平衡常数及转化率一、电离平衡常数(K a、K b)二、水解平衡常数(K h)【习题】1、(1)常温下,将a mol·L-1CH3COONa溶于水配成溶液,向其中滴加等体积的b mol·L-1的盐酸使溶液呈中性(不考虑盐酸和醋酸的挥发),用含a和b的代数式表示醋酸的电离常数K a=________。
(2)在一定条件下,可用甲醇与CO反应生成醋酸消除CO污染。
常温下,将a mol·L-1的CH3COOH与b mol·L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数K a=________(用含a和b的代数式表示)。
2、(1)已知25 ℃时,NH3·H2O的电离平衡常数K b=1.8×10-5mol·L-1,该温度下1 mol·L-1的NH4Cl溶液中c(H+)=________ mol·L-1。
(已知 5.56≈2.36)(2)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡________移动(填“向左”、“向右”或“不”)。
试计算溶液中c SO2-3c HSO-3=________。
(常温下H2SO3的电离平衡常数K a1=1.0×10-2,K a2=6.0×10-8)3、已知:25℃时某些弱酸的电离平衡常数。
下面图像表示常温下稀释CH3COOH、HClO两种酸的稀溶液时、溶液pH随加水量的变化,下列说法正确的是()CH3COOH HClO H2CO3K a=1.8×10-3Ka=3.0×10-8K a1=4.1×10-7 K a2=5.6×10-11A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)B. 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32-C. 图像中a点酸的总浓度大于b点酸的总浓度D. 图像中a、c两点处的溶液中相等(HR代表CH3COOH或HClO)三、水的离子积常数1、题型特点常考点:(1)计算温度高于室温时的K W;(2)利用K W的大小比较温度的高低;(3)利用K W=c(H+)·c(OH-)进行c(H+)与c(OH-)的相互换算;(4)溶液pH、水电离的c(H+)或c(OH-)的计算。

化学平衡常数练习一、单选题1.在一密闭容器中,反应aX(g)+bY(g)cZ(g)达到平衡时平衡常数为K1;在温度不变的条件下向容器中通入一定量的X和Y气体,达到新的平衡后Z的浓度为原来的1.2倍,平衡常数为K2,则K1与K2的大小关系是()A.K1<K2B.K1=K2C.K1>K2D.无法确定2.在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)⇌Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:温度/℃25 80 230平衡常数5×104 2 1.9×10-5下列说法不正确的是( )A.上述生成Ni(CO)4(g)的反应为放热反应B.在25 ℃时,反应Ni(CO)4(g)⇌Ni(s)+4CO(g)的平衡常数为2×10-5C.在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v正>v逆D.在80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol·L-13.在一定温度下,改变反应物中n(SO2),对反应2SO2(g)+O2(g)⇌2SO3(g)ΔH<0的影响如图所示,下列说法正确的是( )A .反应b 、c 点均为平衡点,a 点未达到平衡且向正反应方向进行B .a 、b 、c 三点的平衡常数K b >K c >K aC .上述图象可以得出SO 2的含量越高得到的混合气体中SO 3的体积分数越高D .a 、b 、c 三点中,a 点时SO 2的转化率最高 4.下列关于化学平衡常数的说法中,正确的是( ) A .可以用化学平衡常数来定量描述化学反应的限度B .在平衡常数表达式中,反应物浓度用起始浓度表示,生产物浓度用平衡浓度表示C .平衡常数的大小与浓度、压强、催化剂有关D .化学平衡发生移动,平衡常数必定发生变化5.在一定温度下,向2L 体积固定的密闭容器中加入1molHI ,发生反应:2HI(g)⇌H 2(g)+I 2(g) ∆H>0,测得2H 的物质的量随时间变化如表,下列说法正确的是( )t /min123()2n H /mol0.060.10.1A .2 min 内的HI 的分解速度为0.0511mol L min --⋅⋅B .该温度下,平衡时HI 的转化率为10%C .该温度下的平衡常数为1K ,温度升高10℃后平衡常数为2K ,则K 1>K 2D .达平衡后其他条件不变,压缩容器体积,平衡不移动,()c HI 不变6.关于 C(s)+H 2O(g)CO(g)+H 2(g)的平衡常数(K)书写形式,正确的是( )A .K=22c(C)c()c(CO)c O (H H )B .K=22c(CO)c()c(C)c(H H O)C .K=22c(CO)c()c(H H O)D .K=22c()c(C O O)c(H H )7.吸热反应N 2(g )+O 2(g )2NO (g ),在2000℃时,K =6.2×10-4。

2024届全国高考(新高考)化学复习历年真题好题专项(化学平衡常数及转化率计算)练习1.[2022ꞏ广东卷]恒容密闭容器中,BaSO 4(s )+4H 2(g )⇌BaS (s )+4H 2O (g )在不同温度下达平衡时,各组分的物质的量(n )如图所示。
下列说法正确的是( )A.该反应的ΔH <0B.a 为n (H 2O )随温度的变化曲线C.向平衡体系中充入惰性气体,平衡不移动D.向平衡体系中加入BaSO 4,H 2的平衡转化率增大2.[2022ꞏ海南卷]某温度下,反应CH 2===CH 2(g )+H 2O (g )⇌CH 3CH 2OH (g )在密闭容器中达到平衡。
下列说法正确的是( )A.增大压强,v 正>v 逆,平衡常数增大B.加入催化剂,平衡时CH 3CH 2OH (g )的浓度增大C.恒容下,充入一定量的H 2O (g ),平衡向正反应方向移动 D.恒容下,充入一定量的CH 2===CH 2(g ), CH 2===CH 2(g )的平衡转化率增大3.[2023ꞏ专题模块测试]K 、K a 、K w 分别表示化学平衡常数、电离常数和水的离子积常数,下列判断正确的是( )A.在500 ℃、20 MPa 条件下,在5 L 密闭容器中进行合成氨的反应,使用催化剂后K 增大B.室温下K (HCN )<K (CH 3COOH ),说明CH 3COOH 的电离程度一定比HCN 的大 C.25 ℃时,pH 均为4的盐酸和NH 4I 溶液中K w 不相等D.2SO 2+O 2 催化剂△2SO 3达平衡后,改变某一条件时K 不变,SO 2的转化率可能增大、减小或不变4.[2023ꞏ湖南师大附中高三月考]N 2O 5是一种新型硝化剂,一定温度下发生反应2N 2O 5(g )⇌4NO 2(g )+O 2(g ) ΔH >0,T 1温度下的部分实验数据如下表所示。
t /s 0 500 1 000 1 500c (N 2O 5)/(molꞏL -1) 5.00 3.52 2.50 2.50下列说法正确的是( )A .该反应在任何温度下均能自发进行B .T 1温度下的平衡常数为K 1=125,1 000 s 时N 2O 5(g )转化率为50%C .其他条件不变时,T 2温度下反应到1 000 s 时测得N 2O 5(g )浓度为2.98 molꞏL -1,则T 1<T 2D .T 1温度下的平衡常数为K 1,T 2温度下的平衡常数为K 2,若T 1>T 2,则K 1<K 25.[2023ꞏ福建福州质检]在1 L 的密闭容器中充入2 mol N 2和7 mol H 2,发生反应N 2+3H 2⇌2NH 3,保持其他条件不变,相同时间内测得NH 3的浓度与温度的关系如图所示。

专题41化学平衡常数及计算1.【2022年辽宁卷】某温度下,在1L 恒容密闭容器中2.0mol X 发生反应2X(s)Y(g)+2Z(g) ,有关数据如下:时间段/min 产物Z 的平均生成速率/-1-1mol L min⋅⋅0~20.200~40.150~60.10下列说法错误的是A .1min 时,Z 的浓度大于-10.20mol L ⋅B .2min 时,加入0.20mol Z ,此时正逆v (Z)<v (Z)C .3min 时,Y 的体积分数约为33.3%D .5min 时,X 的物质的量为1.4mol2.【2022年江苏卷】用尿素水解生成的3NH 催化还原NO ,是柴油机车辆尾气净化的主要方法。
反应为32224NH (g)+O (g)+4NO(g)4N (g)+6H O(g) ,下列说法正确的是A .上述反应ΔS<0B .上述反应平衡常数()()()()46224432c N c H O K=c NH c O c (NO)⋅⋅⋅C .上述反应中消耗31mol NH ,转移电子的数目为232 6.0210⨯⨯D .实际应用中,加入尿素的量越多,柴油机车辆排放的尾气对空气污染程度越小3.(2021·湖南真题)已知:()()()A g 2B g 3C g + 0H ∆<,向一恒温恒容的密闭容器中充入1molA 和3molB 发生反应,1t 时达到平衡状态I ,在2t 时改变某一条件,3t 时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。
下列说法正确的是A .容器内压强不变,表明反应达到平衡B .2t 时改变的条件:向容器中加入C C .平衡时A 的体积分数ϕ:(II)(I)ϕϕ>D .平衡常数K :(II)(I)<K K 4.(2020·浙江高考真题)5 mL 0.1mol ⋅L −1KI 溶液与1 mL 0.1mol ⋅L −1FeCl 3溶液发生反应:2Fe 3+(aq )+2I −(aq )⇌2Fe 2+(aq )+I 2(aq ),达到平衡。

化学平衡常数练习一、单选题1.在一密闭容器中,反应aX(g)+bY(g)cZ(g)达到平衡时平衡常数为K1;在温度不变得条件下向容器中通入一定量得X与Y气体,达到新得平衡后Z得浓度为原来得1、2倍,平衡常数为K2,则K1与K2得大小关系就是( )A.K1<K2ﻩB.K1=K2ﻩC.K1〉K2D。
无法确定2.在300 mL得密闭容器中,放入镍粉并充入一定量得CO气体,一定条件下发生反应:Ni(s)+4CO(g)⇌Ni(CO)4(g),已知该反应平衡常数与温度得关系如下表:下列说法不正确得就是( )A.上述生成Ni(CO)4(g)得反应为放热反应B。
在25 ℃时,反应Ni(CO)4(g)⇌Ni(s)+4CO(g)得平衡常数为2×10-5C.在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均为0、5 mol·L-1,则此时v正>v逆D.在80 ℃达到平衡时,测得n(CO)=0、3 mol,则Ni(CO)4得平衡浓度为2 mol·L-13.在一定温度下,改变反应物中n(SO2),对反应2SO2(g)+O2(g)⇌2SO3(g) ΔH<0得影响如图所示,下列说法正确得就是()A。
反应b、c点均为平衡点,a点未达到平衡且向正反应方向进行B.a、b、c三点得平衡常数Kb>K c〉K aC.上述图象可以得出SO2得含量越高得到得混合气体中SO3得体积分数越高D.a、b、c三点中,a点时SO2得转化率最高4。
下列关于化学平衡常数得说法中,正确得就是()A。
可以用化学平衡常数来定量描述化学反应得限度B.在平衡常数表达式中,反应物浓度用起始浓度表示,生产物浓度用平衡浓度表示C.平衡常数得大小与浓度、压强、催化剂有关D.化学平衡发生移动,平衡常数必定发生变化5.在一定温度下,向2L体积固定得密闭容器中加入1molHI,发生反应:2HI(g)⇌H2(g)+I2(g) ∆H>0,测得得物质得量随时间变化如表,下列说法正确得就是()1 2 3A。
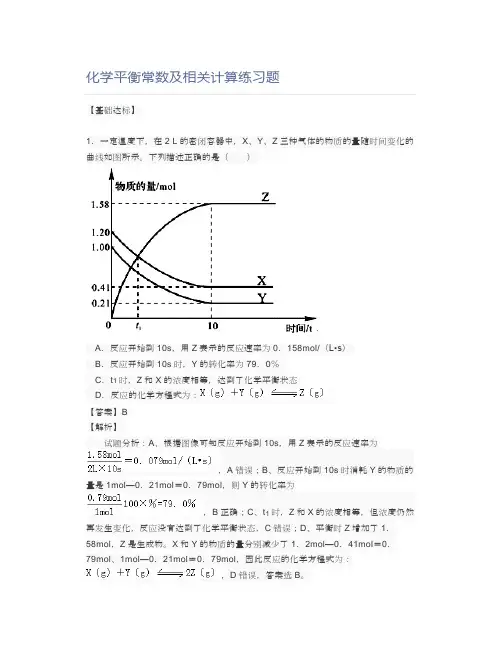
化学平衡常数及相关计算练习题【基础达标】1.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。
下列描述正确的是()A.反应开始到10s,用Z表示的反应速率为0.158mol/(L•s)B.反应开始到10s时,Y的转化率为79.0%C.t1时,Z和X的浓度相等,达到了化学平衡状态D.反应的化学方程式为:【答案】B【解析】试题分析:A、根据图像可知反应开始到10s,用Z表示的反应速率为,A错误;B、反应开始到10s时消耗Y的物质的量是1mol—0.21mol=0.79mol,则Y的转化率为,B正确;C、t1时,Z和X的浓度相等,但浓度仍然再发生变化,反应没有达到了化学平衡状态,C错误;D、平衡时Z增加了1.58mol,Z是生成物。
X和Y的物质的量分别减少了1.2mol—0.41mol=0.79mol、1mol—0.21mol=0.79mol,因此反应的化学方程式为:,D错误,答案选B。
考点:考查平衡状态判断及有关计算2.下列关于平衡常数的说法正确的是()A.改变外界条件使化学平衡状态改变时,平衡常数也一定改变B.改变条件,反应物的转化率增大,平衡常数一定增大C.若一个可逆反应的平衡常数很大,则反应会在较短的时间内完成D.已知2NO2 N2O4正反应的平衡常数为K1,逆反应的平衡常数为K2,则K1=1/K2【答案】D【解析】试题分析:A、平衡常数只受温度的影响,温度不变,平衡常数不变,故错误;B、平衡常数只受温度的影响,温度变则平衡常数改变,故错误;C、平衡常数表示平衡进行的程度,不能说明反应速率快,故错误;D、K1=c(N2O4)/c2(NO2),逆反应的平衡常数K2=c2(NO2)/c(N2O4),是倒数的关系,故正确。
考点:考查影响平衡常数的因素、应用等知识。
3.3mol A和2.5molB混合于2L密闭容器中,发生的反应:后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1 mol/(L•min),下列结论不正确的是()A.A的平均反应速率为0.15mol/(L•min)B.平衡时,A的转化率为20%C.平衡时,C的浓度为0.25 mol/LD.容器内的起始压强和平衡压强之比为11:10【答案】B【解析】试题分析:达到平衡时压强变小,说明正反应方向是物质的量减少的,故x=1,开始:3 2.500变化:3a a a2a V(D)=2a/(2×5)mol/(L•min)=0.1mol/(L•min)平衡:3-3a 2.5-a a2a解得:a=0.5A、A的平均反应速率为3×0.5/(2×5)mol/(L•min)=0.15mol/(L•min),故说法正确;B、A的转化率3a/3×100%=50%,故说法错误;C、C(C)=a/2mol•L-1=0.25mol•L-1,故说法正确;D、压强之比等于物质的量之比,5.5:(3-3a+2.5-a+a+2a)=5.5:5=11:10,故说法正确。

化学平常常数、转化率、化学反应速率练习题一、单选题1.已知分解1mol H 2O 2放出热量98kJ 。
在含少量I -的溶液中,H 2O 2分解的机理为: H 2O 2+I -→H 2O+IO - 慢, H 2O 2+IO -→H 2O+O 2+I - 快下列有关该反应的说法正确的是( ) A.反应速率与I -浓度有关 B.IO -也是该反应的催化剂 C.反应活化能等于98kJ·mol -1D.v (H 2O 2)=v (H 2O)=v (O 2)2.氨催化氧化法制硝酸的原理为()()3245NH g O g +()()246NO g H O g +。
在浓氨水中通入空气,将赤热铂丝插入氨水中引发反应后铂丝保持红热状态至反应停止。
下列说法正确的是( ) A.上述反应在较高温度下才能自发进行 B.该反应的正反应活化能小于逆反应活化能C.该反应中,断裂化学键的总键能大于形成化学键的总键能D.若3NH 和2O 的混合气发生上述反应,气体通入足量水中,剩余气体一定是2O 3.能表示H 2(g)+ I 2(g) 2HI(g)已经达到平衡状态的标志是( )①c(H 2)=c(I 2)=c(HI)时 ②c(H 2):c(I 2):c(HI)=1:1:2时③c(H 2)、c(I 2)、c(HI)不再随时间而改变 ④单位时间内生成nmol H 2的同时生成2nmol HI ⑤单位时间内生成n mol H 2的同时生成n mol I 2 ⑥反应速v(H 2)=v(I 2)=1/2v(HI)⑦一个H-H 键断裂的同时有两个H-I 键断裂 ⑧温度和体积一定时,容器内压强不再变化 ⑨温度和体积一定时,混合气体的颜色不再变化⑩温度和压强一定时,混合气体的密度不再变化⑪条件一定,混合气体的平均相对分子质量不再变化A .③④⑦⑨⑩B .③④⑦⑨C .②③④⑦⑨D .②③④⑥⑦⑨4.反应 Fe (s )+CO 2(g )⇌FeO (s )+CO (g ),ΔH >0,下列措施中能使平衡时c (CO )/c (CO 2)增大的是( ) A .升高温度B .增大压强C .充入一定量 C OD .再加入一些铁粉5.一定条件下,密闭容器中:N 2(g )+3H 2(g )⇌2NH 3(g )下列说法正确的是( )A .其它条件不变,增加氮气物质的量,氮气转化率降低,氢气转化率升高B .增加铁触媒(催化剂)的接触面积,可提高氢气的平衡转化率C.达到平衡时,氢气和氨气的浓度比一定为3:2D.用氮气和氢气分别表示该反应的速率时,数值相同6.对可逆反应 2A(s)+3B(g)⇌C(g)+2D(g)△ H<0,在一定条件下达到平衡,下列有关叙述正确的是()①增加 A 的量,平衡向正反应方向移动②升高温度,平衡向逆反应方向移动,v 正减小③缩小容器体积,平衡不移动,v 正、v 逆增大④增大 B的浓度,v 正>v 逆⑤加入催化剂,平衡向正反应方向移动。

高考化学——化学平衡(转化率、平衡常数练习)1.(08年山东理综·14)高温下,某反应达到平衡,平衡常数)H ()CO ()O H ()CO (222c c c c K ⋅⋅=。
恒容时,温度升高,H 2浓度减小。
下列说法正确的是A .该反应的焓变为正值B .恒温恒容下,增大压强,H 2浓度一定减小C .升高温度,逆反应速率减小D .该反应的化学方程式为CO +H 2O CO 2+H 22.(08年宁夏理综·12)将固体NH 4I 置于密闭容器中,在一定温度下发生下列反应: ①NH 4I(s)NH 3(g)+HI(g);②2HI(g)H 2(g)+I 2(g)达到平衡时,c (H 2)=0.5mo l ·L -1,c (H I )=4mo l ·L -1,则此温度下反应①的平衡常数为A .9B .16C .20D .253.(07年高考海南化学卷·16) (6分)PCl 5的热分解反应为:PCl 5(g)PCl 3(g)+Cl 2(g)(1) 写出反应的平衡常数表达式:(2) 已知某温度下,在容积为10.0 L 的密闭容器中充入2.00 mol PCl 5,达到平衡后,测得容器内PCl 3的浓度为0.150 mol/L 。
计算该温度下的平衡常数。
4.(08年上海化学·25)在2L 密闭容器内,800℃时反应:2NO(g)+O 2(g)2NO 2(g)体(1= 。
已知:300C K ︒>350C K ︒,则改反应是 热反应。
(2)右图中表示NO 2的变化的曲线是 。
用O 2表示从0~2 s 内该反应的平均速率v = 。
(3)能说明该反应已达到平衡状态的是 。
a .v (NO 2)=2v (O 2)b .容器内压强保持不变c .v 逆(NO)=2v 正(O 2)d .容器内密度保持不变(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。

专项练习:化学平衡常数、平衡转化率一、选择题1. 下列关于化学平衡常数的说法正确的是( ) A. 在任何条件下,化学平衡常数不变B. 当改变反应物的浓度时,化学平衡常数会发生改变C. 化学平衡常数K 与温度、反应物浓度、体系的压强都有关D. 由化学平衡常数K 可以推断一个可逆反应进行的程度2. 已知可逆反应223N (g)3H (g)2NH (g)−−−−→+←−−−−高温、高压催化剂,其平衡常数表达式正确的是( ) A. ()()()223N H NH c c K c ⋅=B. ()()()3223N H NH c c K c ⋅=C. ()()()23322NH N H c K c c =⋅ D. ()()()3322NH N H c K c c =⋅3. 将固体NH 4I 置于密闭容器中,在一定温度下发生下列反应:①NH 4I(s) 221N (g)O (g)2NO(g)110K -+=⨯ NH 3(g)+HI(g);①2HI(g) 221N (g)O (g)2NO(g)110K -+=⨯H 2(g)+I 2(g)达到平衡时,c (H 2)=0.5 mol·L -1,c (HI)=4 mol·L -1,则此温度下反应①的平衡常数为( )A. 9B. 16C. 20D. 25 4. 某温度时,反应2231SO (g)O (g)SO (g)2+的平衡常数50K =。
在同一温度下,反应3222SO (g)2SO (g)O (g)+的平衡常数1K 应为( )A. 2500B. 100C. 4410-⨯D. 2210-⨯5. 在25 ①时,密闭容器中X 、Y 、Z 三种气体的初始浓度和平衡浓度如下表:下列说法错误的是( )A. 反应达到平衡时,X 的转化率为50%B. 反应可表示为X +3Y221N (g)O (g)2NO(g)110K -+=⨯ 2Z ,其平衡常数为1 600 C. 增大压强,平衡常数增大D. 改变温度可以改变此反应的平衡常数6. 298K 时,各反应的平衡常数如下: ①30221N (g)O (g)2NO(g)110K -+=⨯ ②2281222H (g)O (g)2H O(g)210K +=⨯③922232CO (g)2CO(g)O (g)410K -+=⨯则该温度下,NO 、2H O 、2CO 这三种化合物分解释放氧气的倾向最大的是( ) A. ①B. ②C. ③D. 无法判断7. 在一个6 L 的密闭容器中放入3 mol X 和2 mol Y ,在一定条件下发生反应4X(g)+3Y(g)221N (g)O (g)2NO(g)110K -+=⨯2Q(g)+n R(g),达到平衡后,容器内的压强比原来增加5%,X 浓度减小13,则反应方程式中的n 值是( )A. 3B. 4C. 5D. 68. 将4 mol 2SO 与2 mol 2O 充入4L 的密闭容器中,在一定条件下反应达到平衡:2232SO (g)O (g)2SO (g)+,测得平衡时3SO 的浓度为10.5mol L -⋅。

化学平衡与化学平衡常数、转化率及相关计算1某温度下,在容积为2L的密闭容器中,X(g)、Y(g)、Z(g)三种物质的物质的量随时间变化的曲线如图所示,已知4min时改变了一个条件。
下列说法错误的是()A.反应进行到a点时,Z的转化率为14%B.该反应的化学方程式为2Z(g)+Y(g) 3X(g)C.该温度下,反应的平衡常数为2564D.4min时改变的条件是压缩体积答案:D解析:本题主要考查化学反应速率与平衡,侧重考查学生对基础知识的应用能力。
由图像中各物质的变化趋势,X为生成物,Y、Z为反应物,根据方程式的计量数之比等于各物质的物质的量变化之比,3min时反应达到平衡,△Y=0.2mol,△Z=0.4mol,△X=0.6mol,则该反应方程式为2Z (g)+Y(g) 3X(g)。
A.列三段式:2Z(g)+Y(g) 3X(g)起始(mol) 2.0 1.20.4转化(mol)0.280.140.42a点(mol) 1.72 1.060.82,则Z的转化率=0.282.0×100%=14%,A正确;B.由图像中各物质的变化趋势,X为生成物,Y、Z为反应物,根据方程式的计量数之比等于各物质的物质的量变化之比,3min时反应达到平衡,△Y=0.2mol,△Z=0.4mol,△X=0.6mol,则该反应方程式为2Z(g)+Y(g) 3X(g),B正确;C.列三段式:2Z(g)+Y(g) 3X(g)起始(mol) 2.0 1.20.4转化(mol)0.40.20.6a点(mol) 1.6 1.0 1.0,则反应的平衡常数K=1mol2L 1.6mol2L1mol2L()3()2×()=2564,C正确;D.压缩体积,Z(g)的物质的量不会瞬间增大且平衡不会移动,D项错误。
2研究催化剂对2NH3 [解析失败]N2+3H2反应速率的影响。
恒温、恒容时,c(NH3)随时间的变化如下。
下列说法不正确的是()A.使用催化剂Ⅰ,0~20min 的平均反应速率v (N 2)=1.00×10-5mol ·L -1·min -1B.使用催化剂Ⅱ,达平衡后容器内的压强是初始时的116倍C.相同条件下,使用催化剂Ⅱ可使该反应的活化能降低更多,反应更快D.相同条件下,使用催化剂Ⅱ可使该反应的化学平衡常数更大答案:D解析:A .使用催化剂Ⅰ,0~20min 的平均反应速率v (N 2)=2.40mol ·L -1-2.00mol ·L -12×20min=1.00×10-5mol ·L -1·min -1,A 正确;B .根据压强之比等于物质的量之比,列三段式:2NH 3 [解析失败]N 2+3H 2初始(mol ·L -1) 2.4000转化(mol ·L -1)2.001.003.00平衡(mol ·L -1)0.40 1.00 3.00则P (平衡)P (初始)=n 总(平衡)n 总(初始)=0.4V +1.00V +3.00V 2.4V =116,B 正确;C .相同条件下,使用催化剂Ⅱ时60min 达到平衡,说明使用催化剂Ⅱ时的反应速率>使用催化剂Ⅰ时的反应速率,C 正确;D .使用催化剂,不影响平衡,所以相同条件下,使用催化剂Ⅱ和使用催化剂Ⅰ该反应的化学平衡常数一样,D 错误;3NO x 的排放来自汽车尾气,研究利用反应C (s )+2NO (g ) N 2(g )+CO 2(g )△H =-34.0kJ ∙mol -1,用活性炭可对其进行吸附。
高二化学可逆反应平衡判断、平衡常数转化率练习题学校:注意事项: 2、请将答案正确填写在答题卡上第1卷一、单选题1.一定条件下,向容积为2 L 的密闭容器中充入1 mol CO 2和3 mol H 2,发生如下反应:()()()()2232CO g +3H g CH OH g +H O g ,5 min 后反应达到平衡时C(CH 3OH)为0.2 mol·L -1。
CO 2(g)的平衡物质的量浓度c(CO 2)与温度关系如图所示。
下列说法错误的是 ( )A.0~5 min,CO 2的平均反应速率为0.04 mol·(L·min) -1反应B.()()()()2232CO g +3H g CH OH g +H O g <0H ∆的C.在T 2 ℃时,若反应处于状态D,则一定有V 正<V 逆D.若T 1 ℃、T 2 ℃时的平衡常数分别为K 1、K 2,则K 1>K 2 2.已知:8NH 3(g) +6NO 2(g)7N 2(g) +12H 2O(l) H ∆<0。
相同条件下,向2 L 恒容密闭容器内充入一定量的NH 3和NO 2,分别选用不同的催化剂进行已知反应(不考虑NO 2和N 2O 4之间的相互转化),反应生成N 2的物质的量随时间的变化如图所示。
下列说法错误的是( )A.在催化剂A 的作用下,0 ~4 min 内 ()-1-13NH 1.0 mol L min v ⋅=⋅B.若在恒容绝热的密闭容器中反应,当容器内温度不变时,说明反应已经达到平衡C.不同催化剂作用下,该反应的活化能由大到小的顺序是()()()C B A a a a E E E >>D.升高温度可使容器内气体颜色加深3.向一绝热的刚性容器中加入反应物X 2(g)和Y(s),仅发生反应:3X 2(g) +2Y(s) 2Z 2(g) ∆H = akJ • mol -1 。
化学平衡常数及转化率的计算 经典习题1.只改变一个影响化学平衡的因素,平衡常数K 与化学平衡移动的关系叙述不正确的是( )A .K 值不变,平衡可能移动B .平衡向右移动时,K 值不一定变化C .K 值有变化,平衡一定移动D .相同条件下,同一个反应的方程式的化学计量数增大2倍,K 值也增大两倍 答案 D解析 因改变压强或浓度引起化学平衡移动时,K 值不变,A 项和B 项均正确;K 值只与温度有关,K 值发生了变化,说明体系的温度改变,则平衡一定移动,C 项正确;相同条件下,同一个反应的方程式的化学计量数增大2倍,K 值应该变为K 2原,D 项错误。
2.一定温度下,在一个容积为1 L 的密闭容器中,充入1 mol H 2(g)和1 mol I 2(g),发生反应H 2(g)+I 2(g)2HI(g),经充分反应达到平衡后,生成的HI(g)占气体体积的50%,该温度下,在另一个容积为2 L 的密闭容器中充入1 mol HI(g)发生反应HI(g)12H 2(g)+12I 2(g),则下列判断正确的是( )A .后一反应的平衡常数为1B .后一反应的平衡常数为0.5C .后一反应达到平衡时,H 2的平衡浓度为0.25 mol·L -1D .后一反应达到平衡时,HI(g)的平衡浓度0.5 mol·L -1 答案 B解析 前一反应达平衡时[H 2]=[I 2]=0.5 mol·L -1,[HI]=1 mol·L -1,则平衡常数K 1=[HI]2[H 2][I 2]=120.5×0.5=4,而后一反应的平衡常数K 2=[][][]112222H I HI =1K 1=0.5,A 项错误,B 项正确;设后一反应达平衡时[H 2]=x mol·L -1,则平衡时[I 2]=x mol·L -1,[HI]=(0.5-2x ) mol·L -1,K 2=11220.52⋅-x x x=0.5,解得x =0.125,故平衡时[HI]=0.25 mol·L -1,C 、D 项错误。
化学平衡常数练习一、单选题1.在一密闭容器中,反应aX(g)+bY(g)cZ(g)达到平衡时平衡常数为K1;在温度不变的条件下向容器中通入一定量的X和Y气体,达到新的平衡后Z的浓度为原来的1。
2倍,平衡常数为K2,则K1与K2的大小关系是( )A.K1〈K2B.K1=K2C.K1>K2D.无法确定2.在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)⇌Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:温度/℃25 80 230平衡常数5×104 2 1。
9×10-5下列说法不正确的是( )A.上述生成Ni(CO)4(g)的反应为放热反应B.在25 ℃时,反应Ni(CO)4(g)⇌Ni(s)+4CO(g)的平衡常数为2×10-5C.在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均为0。
5 mol·L-1,则此时v正>v逆D.在80 ℃达到平衡时,测得n(CO)=0。
3 mol,则Ni(CO)4的平衡浓度为2 mol·L-13.在一定温度下,改变反应物中n(SO2),对反应2SO2(g)+O2(g)⇌2SO3(g)ΔH〈0的影响如图所示,下列说法正确的是()A.反应b、c点均为平衡点,a点未达到平衡且向正反应方向进行B.a、b、c三点的平衡常数K b>K c>K aC.上述图象可以得出SO2的含量越高得到的混合气体中SO3的体积分数越高D.a、b、c三点中,a点时SO2的转化率最高4.下列关于化学平衡常数的说法中,正确的是( )A.可以用化学平衡常数来定量描述化学反应的限度B.在平衡常数表达式中,反应物浓度用起始浓度表示,生产物浓度用平衡浓度表示C.平衡常数的大小与浓度、压强、催化剂有关D.化学平衡发生移动,平衡常数必定发生变化5.在一定温度下,向2L体积固定的密闭容器中加入1molHI,发生H的物质的量随时间变化反应:2HI(g)⇌H2(g)+I2(g) ∆H>0,测得2如表,下列说法正确的是( )t/min 1 2 3()n H/mol0.060.10.1 2A .2 min 内的HI 的分解速度为0.0511mol L min --⋅⋅B .该温度下,平衡时HI 的转化率为10%C .该温度下的平衡常数为1K ,温度升高10℃后平衡常数为2K ,则K 1>K 2D .达平衡后其他条件不变,压缩容器体积,平衡不移动,()c HI 不变 6.关于 C (s )+H 2O (g)CO (g )+H 2(g)的平衡常数(K)书写形式,正确的是( )A .K=22c(C)c()c(CO)c O (H H )B .K=22c(CO)c()c(C)c(H H O)C .K=22c(CO)c()c(H H O)D .K=22c()c(C O O)c(H H )7.吸热反应N 2(g )+O 2(g )2NO (g ),在2000℃时,K =6。
考点12 化学平衡常数及转化率思维导图考点一 化学平衡常数【例1】(2020·天津北大宝坻附属实验学校高二月考)已知相同温度下:H 2 (g)+I 2 (g) 2HI (g)的平衡常数为K 1;1/ 2 H 2 (g) + 1/ 2 I 2 (g)HI (g) 的平衡常数为K 2; 则 K 1;K 2 的关系为 ; ;A .K 1=2K 2B .K 1=K 2 2C .K 1=K 2D .K 1= 1/ 2 K 2【答案】B【解析】化学平衡常数通常表示为各生成物平衡浓度的幂之积除以各反应物平衡浓度的幂之积,所以H 2 (g)+I 2 (g)2HI (g)的平衡常数K 1= 222HI c c c I H ()()();1/ 2 H 2 (g) + 1/ 2 I 2 (g)HI (g) 的平衡常数为K 2=1122HI I2?H2c c c ()()(),所以K 1=K 22,故答案选B;考点:化学平衡常数的计算常见考法【举一反三】1.(2020·盂县第三中学校高三月考)关于平衡常数K,下列说法中正确的是A.加入催化剂或增大反应物浓度,K值将增大B.K越大,反应速率越大C.对任一给定的可逆反应,温度升高,K值增大D.对可逆反应,K值越大,反应物的转化率越高【答案】D【解析】A.K只与温度有关,加入催化剂或增大反应物浓度,温度未变,则K值不变,A说法错误;B.K越大,反应进行的程度越大,与反应速率无关,B说法错误;C.对任一给定的可逆反应,正反应吸热,温度升高,K值增大;正反应放热,温度升高,K值减小,C说法错误;D.对可逆反应,K值越大,反应进行的程度越大,反应物的转化率越高,D说法正确;答案为D。
2.(2020·全国高二课时练习)某温度下,反应SO2(g)+12O2(g)SO3 (g) 的平衡常数K1=50,在同一温度下,反应2SO3(g)2SO2(g) +O2(g)的平衡常数K2的值为()A.2500B.4×10-4C.100D.2×10-2【答案】B【解析】某温度下;SO2(g)+12O2(g)SO3 (g) 的平衡常数K1=50,所以相同温度下2SO2(g)+O2(g);2SO3 (g) 的平衡常数K=(K1)2=502=2500,在同一温度下;反应2SO3(g);2SO2(g)+O2(g)的平衡常数K2=1÷K=1÷2500=4×10−4,故选B。
化学平衡常数与转化率及习题(学生)化学平衡常数与转化率一、化学平衡常数1、概念:在一定温度下,对于一个可逆反应aA+bB cC+dD达到平衡后,生成物浓度以其计量系数的幂次方的乘积和反应物浓度以其计量系数的幂次方的乘积之比是一个常数。
用K表示。
即:K=C c(C)C d(D)C a(A)C b(B)单位:(mol/L)(c+d-a-b)2、意义:平衡常数是衡量一个可逆反应在一定温度下反应程度的化学量。
平衡常数越大,反应进行越彻底,转化率就越高。
平衡常数越小,反应进行越不彻底,转化率越低。
3、特征:平衡常数在一定温度下是一个常数,不随浓度、压强、催化剂的改变而改变。
只随温度的改变而改变,也就是说,平衡常数只是温度的函数。
4、注意:①对于固体和纯液体,改变用量不改变浓度,所以,固体和纯液体不列入平衡常数的表达式中。
例如:C (s)+H 2O(g) CO(g) +H2 (g),K= C(CO)·C(H2) C(H2O)例如:CH 3COO-(aq)+H2O(l) CH3COOH (aq)+OH-(aq) K= C(CH3COOH)·C(OH-)C(CH3COO-)②对于溶液中进行的可逆反应,实际不参加反应的离子不列入平衡常数的表达式。
例如:FeCl 3+3KSCN Fe(SCN)3+3KCl K=C[Fe(SCN)2+] C(Fe3+)·C(SCN-)③平衡常数的表达式与方程式书写有关。
可以联立几个方程式确定一个新反应的平衡常数。
逆反应的平衡常数是正反应的平衡常数的倒数。
方程式乘一个系数,平衡常数变为原平衡常数以该系数的幂次方;方程式相加,是原平衡常数相乘;方程式相加,是原平衡常数相除。
例如:CH 3COOH CH3COO-+H+K a= C(CH3COO-)·C(H+) C(CH3COOH)H 2O H++OH-K w= C(H+)·C(OH-)CH 3COO-(aq)+H2O(l) CH3COOH (aq)+OH-(aq)K h= C(CH3COOH)·C(OH-)C(CH3COO-)=K wK a二、平衡常数的运用1、用于相同温度下比较反应进行程度。
K值越大,反应进行越彻底。
对于弱酸,K a越大,酸性越强;对于弱碱,K b越大,碱性越强;对于盐类水解,K h越大,水解越彻底。
2、用于与浓度商一起判断平衡移动的方向。
浓度商:在一定温度下,对于一个可逆反应aA+bB cC+dD,任意时刻,生成物浓度以其计量系数的幂次方的乘积和反应物浓度以其计量系数的幂次方的乘积之比叫浓度商。
判断方向:①Q c>K,平衡朝逆反应进行;②Q c=K,恰好达到平衡状态,平衡不移动;③Q c<K,平衡朝正反应方向移动。
3、用于判断反应的能量特征,即判断正反应是吸热反应还是放热反应。
①若升高温度,K值增大,则说明平衡朝正反应方向移动,正反应是吸热反应。
②若升高温度,K值减小,则说明平衡朝逆反应方向移动,正反应是放热反应。
4、用于计算不同浓度下可逆反应的转化率:同一温度下的同一可逆反应,不同浓度下,可能有不同转化率,但平衡常数相同。
可以通过平衡常数相等建立方程,计算比较转化率。
三、转化率1、概念:转化率是可逆反应中,反应物反应的物质的量占该反应物物质的量的分数。
用α表示。
即:α=n(反应)n(总)×100%2、意义:转化率也用来表示反应的进行程度。
在相同温度条件下,相同浓度的的反应物转化率越高,反应进行越彻底。
3、特征:转化率不仅与温度有关,还与浓度、压强有关。
所以用转化率说明进行程度时,没有平衡常数科学。
只有在同温度同浓度的条件下,才能正确比较不同反应的进行程度。
4、注意:①在电离平衡中,电离度相当于电离平衡的转化率;在水解平衡中,水解度相当于水解平衡的转化率。
②同一个反应,在相同的条件下,若正反应的转化率为α,则逆反应的转化率就为(1—α)。
③一般来说,加入一种反应物,另一种反应物的转化率增大,自身的转化率降低。
四、强化练习化学反应速率高考题1、(2013四川理综, 6,6分) 在一定温度下, 将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中, 发生反应X(g) +Y(g) 2Z(g)ΔH< 0, 一段时间后达:t/min 2 4 7 9n(Y)/mol0.12 0.11 0.10 0.10A. 反应前2 min的平均速率v(Z) =2.0×10-3 mol/(L·min)B. 其他条件不变, 降低温度, 反应达到新平衡前v(逆) > v(正)C. 该温度下此反应的平衡常数K=1.44D. 其他条件不变, 再充入0.2 mol Z, 平衡时X的体积分数增大2、(2012福建, 12,6分) 一定条件下, 溶液的酸碱性对TiO2光催化染料R降解反应的影响如下图所示。
下列判断正确的是()A. 在0~50 min之间, pH=2和pH=7时R的降解百分率相等B. 溶液酸性越强, R的降解速率越小C. R的起始浓度越小, 降解速率越大D. 在20~25 min之间, pH=10时R的平均降解速率为0.04 mol·L-1·min-13、(2012上海, 18,4分) 为探究锌与稀硫酸的反应速率[以v(H2) 表示], 向反应混合液中加入某些物质, 下列判断正确的是()A. 加入NH4HSO4固体, v(H2) 不变B. 加入少量水, v(H2) 减小C. 加入CH3COONa固体, v(H2) 减小D. 滴加少量CuSO4溶液, v(H2) 减小4、(2011安徽, 9,6分) 电镀废液中Cr2O72-可通过下列反应转化成铬黄(PbCrO4): Cr2O72- (aq) +2Pb2+(aq) +H2O(l) 2PbCrO4(s) +2H+(aq)ΔH< 0该反应达平衡后, 改变横坐标表示的反应条件, 下列示意图正确的是()5、(2012广东, 31,16分) 碘在科研与生活中有重要应用。
某兴趣小组用0.50 mol·L-1 KI、0.2%淀粉溶液、0.20 mol·L-1 K2S2O8、0.10 mol·L-1 Na2S2O3等试剂, 探究反应条件对化学反应速率的影响。
已知: S2O82-+2I-2SO42-+I2(慢)I2+2 S2O32-2I-+S4O62- (快)(1) 向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液, 当溶液中的耗尽后, 溶液颜色将由无色变为蓝色。
为确保能观察到蓝色, S2O32-与S2O82-初始的物质的量需满足的关系为: n(S2O32-) ∶n(S2O82-) 。
:实验序号体积V/mLK2S2O8溶液水 KI溶液N a2S2O3溶液淀粉溶液①10.0 0.0 4.0 4.0 2.0②9.0 1.0 4.0 4.0 2.0③8.0 V x 4.0 4.0 2.0表中V x=, 理由是。
(3) 已知某条件下, 浓度c(S2O82-) -反应时间t的变化曲线如下图, 若保持其他条件不变, 请在坐标图中, 分别画出降低反应温度和加入催化剂时c(S2O82-) -t的变化曲线示意图(进行相应的标注) 。
(4) 碘也可用作心脏起搏器电源—锂碘电池的材料。
该电池反应为: 2Li(s) +I2(s)2LiI(s)ΔH已知: 4Li(s) +O2(g) 2Li2O(s)ΔH14LiI(s) +O2(g) 2I2(s) +2Li2O(s)ΔH2则电池反应的ΔH=; 碘电极作为该电池的极。
化学平衡高考题1、(2013重庆理综, 7,6分) 将E和F加入密闭容器中, 在一定条件下发生反应: E(g) +F(s) 2G(g) 。
忽略固体体积, 平衡时G的体积分数(%) 随温度和压强压强/MPa体积分数/%温度/℃1.0 2.0 3.0810 54.0 a b915 c 75.0 d1 000 e f 83.0②915 ℃、2.0 MPa时E的转化率为60%③该反应的ΔS> 0④K(1 000 ℃) > K(810 ℃)上述①~④中正确的有()A. 4个B. 3个C. 2个D. 1个2、(2013安徽理综, 11,6分) 一定条件下, 通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s) +CO(g) MgO(s) +CO2(g) +SO2(g)ΔH> 0该反应在恒容的密闭容器中达到平衡后, 若仅改变图中横坐标x的值, 重新达到平衡后, 纵坐标y随x变化趋势合理的是()选项x yA 温度容器内混合气体的密度B CO的物质的量CO2与CO的物质的量之比C SO2的浓度平衡常数KD MgSO4的质量(忽略体积) CO的转化率3、(2013北京理综, 11,6分) 下列实验事实不能用平衡移动原理解释的是()A.B.t/℃25 50 100K W/10-141.01 5.47 55.0C.D.c(氨水)0.1 0.01/(mol·L-1)pH 11.1 10.6一定条件下存在反应: CO(g) +H2O(g) CO2(g) +H2(g), 其正反应放热。
现有三个相同的2 L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ, 在Ⅰ中充入1 mol CO和1 mol H2O, 在Ⅱ中充入1 mol CO2和1 mol H2, 在Ⅲ中充入2 mol CO和2 mol H2O, 700 ℃条件下开始反应。
达到平衡时, 下列说法正确的是()A. 容器Ⅰ、Ⅱ中正反应速率相同B. 容器Ⅰ、Ⅲ中反应的平衡常数相同C. 容器Ⅰ中CO的物质的量比容器Ⅱ中的多D. 容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于15、(2013全国理综, 7,6分) 反应X(g) +Y(g) 2Z(g)ΔH< 0, 达到平衡时, 下列说法正确的是()A. 减小容器体积, 平衡向右移动B. 加入催化剂, Z的产率增大C. 增大c(X), X的转化率增大D. 降低温度, Y的转化率增大6、(2012安徽, 9,6分) 一定条件下, 通过下列反应可实现燃煤烟气中硫的回收: SO2(g) +2CO(g) 2CO2(g) +S(l)ΔH< 0若反应在恒容的密闭容器中进行, 下列有关说法正确的是()A. 平衡前, 随着反应的进行, 容器内压强始终不变B. 平衡时, 其他条件不变, 分离出硫, 正反应速率加快C. 平衡时, 其他条件不变, 升高温度可提高SO2的转化率D. 其他条件不变, 使用不同催化剂, 该反应的平衡常数不变7、(2012四川, 12,6分) 在体积恒定的密闭容器中, 一定量的SO2与1.100 mol O2在催化剂作用下加热到600 ℃发生反应: 2SO2+O22SO3; ΔH< 0。