4缓冲溶液的配制与pH值的测定
- 格式:docx
- 大小:18.62 KB
- 文档页数:3

酸碱反应与缓冲溶液实验报告一、实验目的1、加深对酸碱反应本质的理解,掌握酸碱中和反应的基本原理。
2、学习使用 pH 计测量溶液的 pH 值,掌握 pH 计的操作方法。
3、了解缓冲溶液的性质和作用,掌握缓冲溶液的配制方法。
4、通过实验数据的处理和分析,培养科学研究的能力和严谨的科学态度。
二、实验原理1、酸碱反应酸碱反应的本质是质子(H⁺)的转移。
在水溶液中,酸给出质子成为共轭碱,碱接受质子成为共轭酸。
例如,盐酸(HCl)与氢氧化钠(NaOH)的反应:HCl +NaOH → NaCl + H₂O,盐酸给出质子(H⁺)与氢氧化钠中的氢氧根离子(OH⁻)结合生成水,剩余的钠离子(Na⁺)和氯离子(Cl⁻)形成氯化钠(NaCl)。
2、酸碱中和滴定酸碱中和滴定是利用酸碱之间的定量反应来测定酸或碱溶液浓度的方法。
通常使用一种已知浓度的标准溶液(称为滴定剂)来滴定未知浓度的溶液(称为待测液),通过测量滴定过程中溶液 pH 的变化,确定滴定终点,从而计算出待测液的浓度。
3、 pH 计pH 计是用于测量溶液 pH 值的仪器。
它基于能斯特方程,通过测量电极系统的电位差来确定溶液的 pH 值。
4、缓冲溶液缓冲溶液是一种能够抵抗少量强酸、强碱或稀释的影响,保持溶液pH 值相对稳定的溶液。
缓冲溶液通常由弱酸及其共轭碱或弱碱及其共轭酸组成。
例如,醋酸(CH₃COOH)和醋酸钠(CH₃COONa)组成的缓冲溶液,当加入少量强酸时,醋酸钠与酸反应,消耗氢离子;当加入少量强碱时,醋酸与碱反应,消耗氢氧根离子,从而保持溶液 pH 值相对稳定。
三、实验仪器与试剂1、仪器pH 计、酸式滴定管、碱式滴定管、移液管、容量瓶、锥形瓶、烧杯、玻璃棒等。
2、试剂01000 mol/L 盐酸标准溶液、01000 mol/L 氢氧化钠标准溶液、未知浓度的醋酸溶液、酚酞指示剂、甲基橙指示剂、醋酸钠固体等。
四、实验步骤1、酸碱中和滴定(1)用移液管准确移取2500 mL 未知浓度的醋酸溶液于锥形瓶中,加入 2 滴酚酞指示剂。

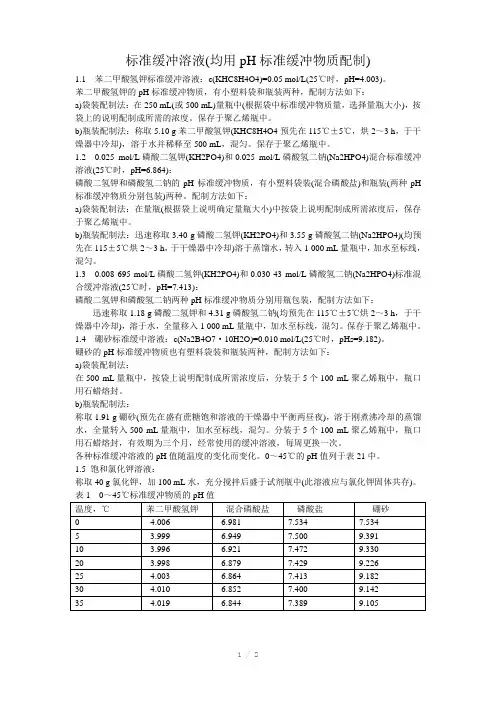
标准缓冲溶液(均用pH标准缓冲物质配制)1.1 苯二甲酸氢钾标准缓冲溶液:c(KHC8H4O4)=0.05 mol/L(25℃时,pH=4.003)。
苯二甲酸氢钾的pH标准缓冲物质,有小塑料袋和瓶装两种,配制方法如下:a)袋装配制法:在250 mL(或500 mL)量瓶中(根据袋中标准缓冲物质量,选择量瓶大小),按袋上的说明配制成所需的浓度。
保存于聚乙烯瓶中。
b)瓶装配制法:称取5.10 g苯二甲酸氢钾(KHC8H4O4预先在115℃±5℃,烘2~3 h,于干燥器中冷却),溶于水并稀释至500 mL,混匀。
保存于聚乙烯瓶中。
1.2 0.025 mol/L磷酸二氢钾(KH2PO4)和0.025 mol/L磷酸氢二钠(Na2HPO4)混合标准缓冲溶液(25℃时,pH=6.864):磷酸二氢钾和磷酸氢二钠的pH标准缓冲物质,有小塑料袋装(混合磷酸盐)和瓶装(两种pH 标准缓冲物质分别包装)两种。
配制方法如下:a)袋装配制法:在量瓶(根据袋上说明确定量瓶大小)中按袋上说明配制成所需浓度后,保存于聚乙烯瓶中。
b)瓶装配制法:迅速称取3.40 g磷酸二氢钾(KH2PO4)和3.55 g磷酸氢二钠(Na2HPO4)(均预先在115±5℃烘2~3 h,于干燥器中冷却)溶于蒸馏水,转入1 000 mL量瓶中,加水至标线,混匀。
1.3 0.008 695 mol/L磷酸二氢钾(KH2PO4)和0.030 43 mol/L磷酸氢二钠(Na2HPO4)标准混合缓冲溶液(25℃时,pH=7.413):磷酸二氢钾和磷酸氢二钠两种pH标准缓冲物质分别用瓶包装,配制方法如下:迅速称取1.18 g磷酸二氢钾和4.31 g磷酸氢二钠(均预先在115℃±5℃烘2~3 h,于干燥器中冷却),溶于水,全量移入1 000 mL量瓶中,加水至标线,混匀。
保存于聚乙烯瓶中。
1.4 硼砂标准缓中溶液:c(Na2B4O7·10H2O)=0.010 mol/L(25℃时,pHs=9.182)。

常见缓冲溶液配制方法缓冲溶液是一种能够维持溶液酸碱性质相对稳定的溶液。
常见的缓冲溶液配制方法主要包括四种:酸碱对配制、酸碱配制、水解配制和氧化还原配制。
下面将详细介绍这四种配制方法以及常用的缓冲体系。
一、酸碱对配制酸碱对配制是以两种酸碱的共存为基础实现的。
常用的酸碱对包括:醋酸与醋酸钠对、琼脂酸与琼脂酸钠对、乙酸与乙酸-乙酸钠对等。
以醋酸和醋酸钠为例:1.根据所需的pH值,计算所需的酸碱物质的摩尔量比例,使用化学计算方法可以得到这个比例。
2.首先,在一定体积(如100mL)的蒸馏水中加入醋酸的量,根据计算结果。
3.然后,在同样的蒸馏水中加入醋酸钠的量,根据计算结果。
在加入醋酸钠之前,需要校对酸碱物质的总体积是否是所需的目标体积,如果不是,可以再加入适量的蒸馏水进行调整。
4.经过充分搅拌混合后,缓冲溶液就制备好了。
最后,根据需求进行PH值校准。
二、酸碱配制酸碱配制是指利用单一酸或碱的酸碱性质与反应物种数之间的关系,通过精确配比计算得出所需的缓冲体系,使溶液能够保持所需的酸碱性质稳定。
常见的酸碱配制方法有:乙酸钠-盐酸、蒸馏水盐酸-碳酸钠等。
以乙酸钠-盐酸为例:1. 根据所需的pH值,计算所需的酸碱物质的摩尔量比例。
根据缓冲溶液配制公式 pKa=pH-log([A-]/[HA]),可以反推得到[HA]/[A-]的比例,其中[A-]代表酸根离子的浓度,[HA]代表不电离酸的浓度。
2.根据计算结果和所需体积,将乙酸钠溶液添加到蒸馏水中,同时滴加适量的盐酸溶液以调整pH值。
3.增加或减少乙酸钠和盐酸的量,直到所需的pH值达到要求。
三、水解配制水解是指酸碱反应中一种物质在水中发生分解产生酸和碱的反应。
通过精确配比计算得出所需的缓冲体系,既可以保持所需的酸碱性质稳定,又可以实现水解反应的产物稳定。
常见的水解配制方法有:磷酸盐缓冲液、硼酸缓冲液、胸腺嘧啶缓冲液等。
以硼酸缓冲液为例:1.将一定体积(如100mL)的蒸馏水倒入容器中。

在化学实验中,pH值是一个非常重要的参数,它可以反映溶液的酸碱性。
而在进行酸碱试剂的配制和实验过程中,我们经常会用到缓冲液,用来维持溶液的酸碱度。
ph4.01标准缓冲液就是其中一种常用的缓冲液之一。
那么,ph4.01标准缓冲液的配制是怎样的呢?接下来,我们将从深度和广度两个方面来对ph4.01标准缓冲液的配制进行全面评估和探讨。
一、深度探讨1. 相关概念的介绍我们需要了解什么是ph4.01标准缓冲液。
ph4.01标准缓冲液是一种用于校准酸碱度计的标准溶液,其pH值被准确地设定为4.01。
这种缓冲液在酸碱实验中具有重要的应用价值。
2. 缓冲液的配制原理在深入探讨ph4.01标准缓冲液的配制之前,我们需要了解缓冲液的配制原理。
缓冲液的配制是通过选择适当的酸和盐(或碱)以及确定它们的摩尔比来实现的。
在配制ph4.01标准缓冲液时,我们需要选择合适的酸和碱来控制溶液的pH值。
3. ph4.01标准缓冲液的配制方法接下来,让我们详细介绍ph4.01标准缓冲液的配制方法。
我们需要准备一定量的特定酸和盐,按照一定的摩尔比进行混合并加入适量的溶剂,然后进行搅拌和调节pH值,最终得到所需的标准缓冲液。
4. 实验注意事项和应用范围我们需要总结ph4.01标准缓冲液配制过程中需要注意的事项和该缓冲液的应用范围。
这些内容对于我们在实际操作中避免错误并且更好地应用缓冲液具有重要意义。
二、广度探讨在广度方面,我们还可以从ph4.01标准缓冲液的配制过程中可能遇到的问题、缓冲液保存方法和其他相关缓冲液的比较等方面展开讨论,以达到对这一主题全面理解的目的。
ph4.01标准缓冲液的配制是一个涉及化学知识和实验操作的复杂过程,需要我们全面深入地掌握和理解。
只有通过对该主题的深度和广度全面探讨,我们才能更好地掌握ph4.01标准缓冲液的配制方法和实验应用,从而更好地开展化学实验工作。
在我看来,ph4.01标准缓冲液作为酸碱度计的校准标准溶液,在化学实验中具有非常重要的作用。

实验2 缓冲溶液的配制与pH 值的测定一、实验目的1、理解缓冲溶液的定义及其特点。
2、理解缓冲溶液的缓冲原理。
3、掌握溶液的粗略配制方法和缓冲溶液的配制方法。
3、学习pH 计的使用方法。
二、实验原理在共轭酸碱对组成的混合溶液中加入少量强酸或强碱,溶液的pH 值基本上无变化,这种具有保持溶液pH 值相对稳定性能的溶液称为缓冲溶液。
缓冲溶液的特点是在适度范围内既能抗酸、又能抗碱,抵抗适度稀释或浓缩。
常见的缓冲体系有:HAc-NaAc 、NH 3-NH 4Cl 、Na 2B 4O 7·10H 2O-Na 2CO 3、KH 2PO 4- Na 2HPO 4等。
对于弱酸HB及其共轭碱B -组成的缓冲溶液:b ac c HB pKa pH B c HB c HB pKa pH B c HB c Ka H c B O H O H HB lg )()()(lg)()()()(32-=-==+⇔+--+-+θθθ对于弱碱B 及其共轭酸BH +组成的缓冲溶液:一般配制缓冲溶液时,常使c b =c a ,此时缓冲容量最大,缓冲能力最强。
三、实验用品1、仪器PB-10酸度计、电子天平(常数双杰JJ600)2、器材5mL 量筒(1个)、10mL 量筒(1个)、50mL 烧杯(10个)、标签纸、玻璃棒(1根)3、试剂浓氨水(28%)、NH 4Cl (s )、冰醋酸(99%)、NaAc (s )、KCl (3mol·L -1)标准缓冲溶液(pH6.86;pH4.01)四、实验内容1、溶液的粗略配制(1)0.1mol·L -1NH 4Cl 溶液的配制用精度为0.01g 的电子天平称取0.27g 固体NH 4Cl ,倒入50mL 带有刻度的洁净烧杯中,加入少量去离子水搅拌使其完全溶解后,用去离子水稀释至刻度,贴上标签,备用。
ab bc c pK pOH lg -=θ(2)0.1mol·L-1氨水溶液的配制用5mL量筒量取0.38mL浓氨水(28%),倒入50mL带有刻度的洁净烧杯中,加入少量去离子水搅拌使其完全溶解后,用去离子水稀释至刻度,贴上标签,备用。

实验三酸度计的使用及缓冲溶液的配制和性质检测
一. 实验目的
1.学习酸度计的使用方法
2. 学习缓冲溶液的配制并试验其缓冲作用
2
二. 实验原理
酸度计采用电势比较法进行溶液酸度测定。
测定时将两支电极(指示、参比)与被测溶液组成化学电池,根据电池电动势与溶液中H+活度的关系进行测量。
指示电极为pH玻璃电极,其头部球泡由敏感薄膜制成,仅对H+敏感;参比电极在测量过程中其电势基本保持不变,常用甘汞电极。
也可采用复合电极,即将pH玻璃电极和Ag-AgCl参比电极复合在一起。
3
弱酸和其共轭碱的水溶液,或弱碱和其共轭酸的水溶液,能抵抗外来少量酸、碱或稀释的影响而使其pH值保持稳定,具有这种缓冲作用的溶液——缓冲溶液
弱酸及其共轭碱组成的缓冲溶液:
pH = pKa + lg {[共轭碱]/[弱酸]}
弱碱及其共轭酸组成的缓冲溶液:
pH =p -pKb + lg {[碱]/[共轭酸]}
K
W
5
三. 实验内容
1 酸度计的标定
2 缓冲溶液的配制及其pH 值的测定
3 试验缓冲溶液的缓冲作用
W K HAc: pKa=4.76
NH 3H 2O: pKb=4.75
p =14
五. 思考题
用酸度计测量溶液pH值的操作要点?
8
考核
酸度计的校正及溶液pH测定。

pH计校准方法和标准缓冲液配置本文分享pH计校准所需工具、标准缓冲液配置方法,以及pH计校准方法、步骤及开展pH计校准工作的注意事项。
掌握这些pH计校准技能,对仪表人用好酸度计实惠多多。
pH计的应定期检定校准,使精密度和准确度符合要求。
怎么校准,或者说是怎样校正酸度计。
以下是昌晖仪表制造有限公司整理出来的资料。
有直接用配置好的标准缓冲液校准,有的需要自己配置标准缓冲液再校准,下面就看看这两种不同的前提,相同的校准方法步骤,供需要的朋友参考。
pH计校准所需工具/原料标准缓冲液(应选择与供试液pH值接近的标准缓冲液),目前标准溶液有7种,在我国一般使用以下3种溶液:(pH值在25时)①邻苯二甲酸氢钾(KHC8H4O4)4.003pH;0.05M②混合磷酸盐(Na2HPO4):磷酸二氢钾和磷酸氢二钠混合盐溶液6.864 pH;0.025M③硼砂(Na2B4O7·10H2O)9.182 pH:0.01M这三种标准缓冲液的配置方法如下:①pH4,邻苯二甲酸氢钾标准缓冲液精密称取在115±5干燥2-3小时的邻苯二甲酸氢钾[KHC8H4O4]10.12g,加水使溶解并稀释至1000ml。
②pH7,磷酸盐标准缓冲液(pH7.4)精密称取在115±5干燥2-3小时的无水磷酸氢二钠4.303g与磷酸二氢钾1.179g,加水使溶解并稀释至1000ml。
另补充:磷酸盐标准缓冲液(pH6.8)精密称取在115±5干燥2-3小时的无水磷酸氢二钠3.533g与磷酸二氢钾3.387g,加水使溶解并稀释至1000ml。
③pH9,硼砂标准缓冲液精密称取硼砂[Na2B4O7·10H2O]3.80g(注意:避免风化),加水使溶解并稀释至1000ml,置聚乙烯塑料瓶中,密塞,避免与空气中二氧化碳接触。
pH计校准步骤/方法1、实验室使用的pH计校准方法①常用的实验室PH计仪器校正时,要把仪器的斜率调到最大,并拨开电极上部的橡胶塞,使小孔露出,否则在进行校正时,会产生负压,泞致溶液不能正常进行离子交换,会使测量数据不准确。

竭诚为您提供优质文档/双击可除缓冲溶液的配制与性质实验报告篇一:《缓冲溶液的配制与性质》实验一缓冲溶液的配制和性质、溶液ph值测定【实验目的】1.2.3.4.5.学习缓冲溶液及常用等渗磷酸盐缓冲溶液的配制方法。
加深对缓冲溶液性质的理解。
强化吸量管的使用方法。
学习使用phs-2c型酸度计。
培养环境保护意识。
【预习作业】1.一般性溶液与缓冲溶液有什么不同?2.缓冲溶液的性质有哪些?3.如何衡量缓冲溶液的缓冲能力大小?缓冲溶液的缓冲能力与什么因素有关?4.实验是如何设计以验证缓冲溶液所具有的性质及缓冲容量的影响因素的,设计时有哪些注意事项?5.该如何检测缓冲溶液的ph值是否发生改变?是否均需要用ph计?6.本实验属定量测定还是定性测定或半定量测定?【实验原理】普通溶液不具备抗酸、抗碱、抗稀释作用。
缓冲溶液通常是由足够浓度的弱酸及其共轭碱、弱碱及其共轭酸或多元酸的酸式盐及其次级盐组成的,具有抵抗外加的少量强酸或强碱、或适当稀释而保持溶液ph值基本不变的作用。
本实验通过将普通溶液和配制成的缓冲溶液对加入酸、碱或适当稀释前后ph数值的变化来探讨缓冲溶液的性质。
根据缓冲溶液中共轭酸碱对所存在的质子转移平衡:-hb?b+h3o+缓冲溶液ph值的计算公式为:ph?pKa?lg[b][hb]-?pKa?lg[共轭碱][共轭酸]?pKa?lg缓冲比式中pKa为共轭酸解离常数的负对数。
此式表明:缓冲溶液的ph值主要取决于弱酸的pKa值,其次决定于其缓冲比。
需注意的是,由上述公式算得的ph值是近似的,准确的计算应该用活度而不应该用浓度。
要配制准确ph值的缓冲溶液,可参考有关手册和参考书上的配方,它们的ph值是由精确的实验方法确定的。
缓冲容量(β)是衡量缓冲能力大小的尺度。
缓冲容量(β)的大小与缓冲溶液总浓度、缓冲组分的比值有关。
β=2.303[hb]×[b][b]×=2.303×-1+缓冲比[hb]+[b]--缓冲溶液总浓度越大则β越大;缓冲比越趋向于1,则β越大,当缓冲比为1时,β达极大值。


ph=4的缓冲溶液配制方法缓冲溶液是一种能够维持溶液pH值相对稳定的溶液。
在实验室和许多生物学、化学和医学研究中,配制pH=4的缓冲溶液是非常常见的。
下面将介绍一种常见的方法来配制pH=4的缓冲溶液。
配制pH=4的缓冲溶液需要选择一个具有适当pKa值的酸和它的共轭碱,以便在溶液中维持所需的pH值。
常见的用于配制pH=4的缓冲溶液的酸包括柠檬酸、琥珀酸、乙酸等,这些酸具有适当的pKa值,使其能够在pH=4时处于酸性状态。
下面是一种用柠檬酸和柠檬酸钠配制pH=4缓冲溶液的方法:1.准备所需的实验器材和试剂,包括一定量的柠檬酸和柠檬酸钠,去离子水等。
2.准备一定体积的去离子水,将其加入一个干净的容器中。
3.使用天平称取所需量的柠檬酸。
根据所需浓度和溶液体积,确定所需的柠檬酸量。
4.将柠檬酸加入容器中的水中,并搅拌均匀。
保持搅拌直到溶液完全溶解。
5.使用天平称取所需量的柠檬酸钠。
根据所需浓度和溶液体积,确定所需的柠檬酸钠量。
6.将柠檬酸钠加入溶液中,并再次搅拌均匀。
保持搅拌直到溶液完全溶解。
7.使用pH计测量溶液的pH值。
如果溶液的pH值不是4,则需要调整。
8.调整溶液的pH值。
可以使用酸或碱来调整溶液的pH值。
根据具体情况,可添加少量的盐酸或氢氧化钠等来进行调整。
9.继续搅拌溶液,直到达到所需的pH=4。
10.使用pH计再次测量溶液的pH值,确保溶液的pH为4。
11.将溶液转移到干净的容器中,并用适当的密封方式保存。
以上是一种用柠檬酸和柠檬酸钠配制pH=4缓冲溶液的方法。
根据实验需要,还可以选择其它适当的酸和碱来调整和配制pH=4缓冲溶液。
常用缓冲溶液的配制方法
1.甘氨酸–盐酸缓冲液(0.05mol/L)
毫升
24
Na2HPO4·2H2O分子量=178.05,0.2mol/L溶液含35.01克/升。
C4H2O7·H2O分子量=210.14,0.1mol/L溶液为21.01克/升。
????
22
7.磷酸盐缓冲液
毫升。
2472
硼酸H 2BO 3,分子量=61.84,0.2M 溶液为12.37克/升。
硼砂易失去结晶水,必须在带塞的瓶中保存。
克/升。
2472
硼酸H2BO3,分子量=61.84,0.2M溶液为12.37克/升。
硼砂易失去结晶水,必须在带塞的瓶中保存。
12.甘氨酸–氢氧化钠缓冲液(0.05M)
1)pH4,邻苯二甲酸氢钾标准缓冲液:
精密称取在115±5℃干燥2~3小时的邻苯二甲酸氢钾[KHC8H4O4]10.12g,加水使溶解并稀释至
1000ml。
2)pH7,磷酸盐标准缓冲液(pH7.4):
精密称取在115±5℃干燥2~3小时的无水磷酸氢二钠4.303g与磷酸二氢钾1.179g,加水使溶解并
稀释至1000ml。
另补充:磷酸盐标准缓冲液(pH6.8)精密称取在115±5℃干燥2~3小时的无水磷酸氢二钠3.533g与磷酸二氢钾3.387g,加水使溶解并稀释至1000ml。
3)pH9,硼砂标准缓冲液:
精密称取硼砂[Na2B4O7·10H2O]3.80g(注意:避免风化),加水使溶解并稀释至1000ml,置聚乙烯
塑料瓶中,密塞,避免与空气中二氧化碳接触。
缓冲溶液的配制和PH计校正溶液配置方法缓冲溶液是由一种酸和一种碱或它们的盐所组成的溶液,能够稳定pH值。
缓冲溶液通常用于实验室的化学分析、生物学实验和工业生产中。
下面是一种常见的缓冲溶液的配制方法:1.选择合适的酸和碱:首先要根据需要稳定的pH值选择合适的酸和碱。
常用的酸包括盐酸、硫酸和醋酸,常用的碱包括氢氧化钠和氢氧化铵。
2.确定理论浓度:根据所需缓冲溶液的体积和理论浓度,计算所需的酸和碱的摩尔量。
3.酸和碱的配制:将所需量的酸和碱分别加入不同的容器中,并用去离子水稀释,直至达到理论浓度。
4.混合酸和碱:将酸和碱的溶液缓慢地倒入一个干净的容器中,同时搅拌,直到达到所需pH值。
5.最后的稳定性调整:如果溶液的pH值不稳定,可以使用其他酸或碱来调整pH值,直到稳定。
PH计校正溶液配置方法:pH计是一种用于测量溶液酸碱性的仪器,它需要定期校正以保证测量的准确性。
下面是一种常见的pH计校正溶液的配置方法:1.选择标定溶液:根据pH计的测量范围和需求,选择两个标定溶液。
一般来说,一种标定溶液应该是酸性的(pH值低于7),另一种标定溶液应该是碱性的(pH值高于7)。
常用的酸包括盐酸和硫酸,常用的碱包括氢氧化钠和氢氧化铵。
2.确定理论浓度:根据所需标定溶液的体积和理论浓度,计算所需的酸和碱的摩尔量。
3.酸和碱的配制:将所需量的酸和碱分别加入不同的容器中,并用去离子水稀释,直至达到理论浓度。
4.调整pH值:使用pH计测量标定溶液的实际pH值,如果与预期值不相符,使用其他酸或碱来调整pH值,直到达到所需的实际pH值。
5.校正pH计:按照pH计的使用说明书,将pH计插入标定溶液中,根据pH计的操作步骤进行校正。
6.记录和保管:记录标定溶液的批号、浓度和pH值,并妥善保存,以备后续校正或参考。
在配制缓冲溶液和pH计的校正溶液时,注意使用精密的仪器和试剂,并严格按照操作规程进行操作,以保证实验的精确性和准确性。
要配制 pH 4 的缓冲溶液,可以使用以下步骤:
1. 选择一个适合的酸和其共轭碱对作为缓冲体系。
例如,可以选择乙酸(酸)和乙酸钠(共轭碱)。
2. 计算所需的物质的量。
根据缓冲溶液的体积和所选酸的pKa 值,可以确定所需的物质的量。
以乙酸和乙酸钠为例,可以使用哈登 - 侯赛尔方程来计算所需物质的量。
3. 准备所需的溶剂。
根据缓冲溶液的体积,准备足够的溶剂,例如水。
4. 将酸和共轭碱物质分别溶解在溶剂中。
分别将乙酸和乙酸钠溶解在准备好的溶剂中,以得到相应浓度的溶液。
5. 混合酸和共轭碱溶液。
将溶解好的乙酸和乙酸钠溶液混合在一起,搅拌均匀。
6. 测量溶液的 pH 值。
使用 pH 计或酸碱指示剂测量溶液的 pH 值,确保其接近目标 pH 值 4。
7. 如有需要,可以通过添加少量的酸或共轭碱来微调溶液的 pH 值,直至达到所需的 pH 4。
8. 最后,将溶液过滤或消毒(如果需要),然后储存在适当的容器中。
请注意,这只是一种基本的配制缓冲溶液的方法。
具体的配方和步骤可能会根据具体需求和实验条件而有所变化。
建议在操作前参考相关的实验方法或咨询专业人士以获取更准确的指导。
ph4.0醋酸盐缓冲液配制方法(最新版3篇)篇1 目录1.介绍 PH4.0 醋酸盐缓冲液2.阐述配制 PH4.0 醋酸盐缓冲液的方法3.提供注意事项篇1正文PH4.0 醋酸盐缓冲液是一种常用的生物缓冲液,主要用于生物实验中,尤其是对于 pH 敏感的实验。
它的稳定性和精确的 pH 值,使得它在生物实验中具有广泛的应用。
下面,我们将详细介绍如何配制 PH4.0 醋酸盐缓冲液。
首先,我们需要准备以下材料:醋酸钠、醋酸和蒸馏水。
然后,按照以下步骤进行配制:1.计算所需的醋酸钠和醋酸的质量。
这需要根据所需的缓冲液体积和醋酸钠的浓度来确定。
例如,如果我们需要制备 1 升的 PH4.0 醋酸盐缓冲液,那么我们需要大约 3.18 克的醋酸钠和 0.59 克的醋酸。
2.称量所需的醋酸钠和醋酸。
请确保称量的准确性,这将直接影响到缓冲液的 pH 值。
3.将醋酸钠和醋酸加入到蒸馏水中。
注意,应该先将醋酸钠加入到水中,然后再加入醋酸。
这是因为醋酸钠的溶解速度较慢,如果先加入醋酸,可能会导致醋酸钠无法完全溶解。
4.搅拌混合物,直到醋酸钠和醋酸完全溶解。
此时,你将得到一个无色或淡黄色的透明溶液,这就是 PH4.0 醋酸盐缓冲液。
在配制过程中,有几个注意事项需要提醒大家:1.蒸馏水的质量对于缓冲液的稳定性和精确度非常重要,因此,应尽可能使用高质量的蒸馏水。
2.醋酸钠和醋酸的称量需要准确,否则可能会影响到缓冲液的 pH 值。
3.配制过程中,应尽量避免缓冲液的污染,例如,尽量减少容器和工具的接触,避免使用带有杂质的容器等。
通过以上步骤,你就可以成功地配制出 PH4.0 醋酸盐缓冲液。
篇2 目录1.介绍 PH4.0 醋酸盐缓冲液2.阐述 PH4.0 醋酸盐缓冲液的配制方法3.总结篇2正文PH4.0 醋酸盐缓冲液是一种常用的生物缓冲液,能够在生物实验中提供稳定的酸碱环境。
它的主要成分是醋酸和醋酸钠,能够在水中溶解形成缓冲液。
配制 PH4.0 醋酸盐缓冲液的方法如下:首先,需要准备一定比例的醋酸和醋酸钠。
缓冲溶液的配制和性质实验目的1.掌握缓冲溶液的配制方法,加深对其性质的理解。
2.掌握刻度吸管、滴管的使用方法。
3.了解pH 计测定溶液pH 的原理,学会使用pH 计。
实验原理缓冲溶液是由弱酸及其盐或弱碱及其盐组成。
对于由弱酸及其盐组成的缓冲体系,其的浓度比配制溶液,就可得到不同pH 的缓冲溶液。
必须指出,由上述公式算得的pH 是近似值,精确的计算应用活度而不应用浓度。
缓冲溶液中具有抗酸及抗碱成分,所以加入少量酸或碱其pH 变化不大。
当稀释缓冲溶液时,酸和盐的浓度比不变,故适当稀释对pH 影响不大。
缓冲容量是衡量缓冲能力大小的尺度。
它的大小与缓冲剂浓度、缓冲组分比值有关。
缓冲剂浓度越大,缓冲容量越大;缓冲组分比值为1∶1 时,缓冲容量最大。
pH 计测定溶液的pH 值是一种比较精确而又快速的方法(电位法)。
pH 计的指示电极( 常用玻璃电级)和参比电极( 常用甘汞电极)与待测溶液组成一原电池:玻璃电极∣待测溶液(pHx)‖甘汞电极甘汞电极的电极电势稳定不变,而玻璃电极的电极电势与待测液的pH 有关,因此通过测定电池的电动势便可求得待测液的pH。
E x = 甘-( 玻- 0.059pH x)因玻不确定,故先用已知pH 的标准液代替待测液测定电池电动势以求算玻,这称为定位或校正。
E s = 甘-( 玻- 0.059pH s)两式相减便可求得pH x 。
RT0.059 由 2.303 F 换算所得,该数值随温度而变。
在pH 计上可通过温度补偿器加以校准。
器材和药品1.器材pH 计、刻度吸管、50mL 烧杯、试管。
2.药品HAc( 0.1mol·L -1),NaAc(0.1mol·L-1),NH 3·H2O(0.1mol·L-1),pH=10 的NaOH,NaOH(0.1mol·L-1),NH4Cl(0.1mol·L-1),HCl(0.1mol·L-1),pH=5 的HCl ,pH 广泛试纸,邻苯二甲酸氢钾(0.05mol · L -1,pH=4.01) ,硼酸(0.01mol·L-1,pH=9.18) 。
实验三缓冲溶液的配制与pH值的测定
1.实验目的
(1)掌握缓冲溶液的配制原理和方法;
(2)熟悉有关缓冲溶液配制的计算公式;
(3)了解缓冲溶液的有关性质;
(4)学习用pH计测定溶液的pH值;
2.实验原理
在一定程度上能抵抗外加少量酸、碱或稀释,而保持溶液pH值基本不变的作用称为缓冲作用。
具有缓冲作用的溶液称为缓冲溶液。
缓冲溶液一般是由共轭酸碱对组成的,例如弱酸及其盐,或弱碱及其盐,以及多元弱酸的酸式盐及其次级盐。
如果缓冲溶液由弱酸及其盐(例如HAc-NaAc)组成,则
HAc ⇌+ + Ac-
当加入少量酸时,平衡左移,氢离子浓度几乎不变;同样,当加入少量碱时,平衡右移,氢离子浓度也几乎不变。
在缓冲溶液中,氢离子浓度与pH值的计算公式可表示为:
[H+]≈K a⨯c酸/c盐
pH=p K a-lg c酸/c盐
可以看出,溶液稀释时,质子酸及其盐的浓度等同地变小,其比值不变,氢离子浓度也不变。
因此,由于缓冲溶液中具有抗酸成分和抗碱成分,所以加入少量强酸或强碱,或被稀释时,其溶液的pH值基本上是不变的。
缓冲容量是衡量缓冲溶液缓冲能力大小的尺度。
缓冲容量的大小与缓冲组分浓度和缓冲组分的比值有关。
缓冲组分浓度越大,缓冲容量越大;缓冲组分比值为1:1时,缓冲容量最大。
使用缓冲溶液时,常选用质子酸的pK a与所配pH值接近的缓冲体系,质子酸及其盐的总浓度在0.01~0.1 mol·L-1,质子酸及其盐的浓度比值在0.1~10范围。
在实际工作中,常常需要配制一定pH值的缓冲溶液。
3.实验仪器与试剂
Delta-320pH计,试管,量筒(100 mL,10mL),烧杯(100 mL,500 mL),吸量管(10 mL)等。
HAc(0.1 mol·L-1,1 mol·L-1),NaAc(0.1 mol·L-1,1 mol·L-1),NaH2PO4(0.1 mol·L-1),Na2HPO4(0.1 mol·L-1),NH3·H2O(0.1 mol·L-1),NH4Cl(0.1 mol·L-1),HCl(0.1 mol·L-1),NaOH(0.1 mol·L-1,1 mol·L-1),pH=4的HCl,pH=10的NaOH,pH=4.00标准缓冲溶液,pH=6.86标准缓冲溶液, pH=9.18标准缓冲溶液,甲基红溶液,广泛pH试纸,精密pH试纸,吸水纸等。
4.实验步骤
(1)缓冲溶液的配制与pH值的测定
按照表3.3-1,通过计算配制三种不同pH值的缓冲溶液。
然后用精密pH试纸和pH计分别测定它们的pH值。
比较理论计算值与两种测定方法实验值是否相符(溶液留作后面实验用)。
(2)缓冲溶液的性质
①取3支试管,依次加入蒸馏水,pH=4的HCl溶液,pH=10的NaOH溶液各3 mL,
用pH试纸测其pH值。
然后向各管加入5滴0.1 mol·L-1 HCl,再测其pH值。
用相同的方法,试验5滴0.1 mol·L-1 NaOH对上述三种溶液pH值的影响。
将结果记录在表1.3-1中。
②取3支试管,依次加入自己配制的pH=4.0、pH=7.0、pH=10.0的缓冲溶液各3 mL。
然后向各管加入5滴0.1 mol·L-1 HCl,测其pH值。
用相同的方法,试验5滴0.1mol·L-1 NaOH 对上述三种缓冲溶液pH值的影响。
将实验结果记录在表3.3-1中。
表3.3-1 缓冲溶液的配置与pH值的测定
③取4支试管,依次加入pH=4.0的缓冲溶液,pH=4的HCl溶液,pH=10.0的缓冲溶液,pH=10的NaOH溶液各l mL,用精密pH试纸测定各管中溶液的pH值。
然后向各管中加10 mL水,混匀后再用精密pH试纸测其pH值,考查稀释对上述四种溶液pH值的影响。
将实验结果记录于表3.3-2中。
通过以上实验结果,说明缓冲溶液的什么性质?
表3.3-2 缓冲溶液的性质
(3)缓冲溶液的缓冲能力
①缓冲容量与缓冲组分浓度的关系
取两支大试管,在一管中加入0.1 mol·L-1 HAC和0.1 mol·L-1 NaAc各3 mL,另一管中加入1 mol·L-1 HAc和1 mol·L-1 NaAc各3 mL,混匀后测定两管内溶液的pH值(是否相同)?在两管中分别滴人2滴甲基红指示剂,溶液呈何色?(甲基红在pH<4.2时呈红色,pH>6.3时呈黄色=。
然后在两管中分别逐滴加入l mol·L-1 NaOH溶液(每加入1滴NaOH均需摇匀),直至溶液的颜色变成黄色。
记录各管所滴人NaOH的滴数,说明哪一管中缓冲溶液的缓冲容量大。
②缓冲容量与缓冲组分比值的关系
取两支大试管,用吸量管在一管中加人0.1 mol·L-1 NaH2PO4和Na2HPO4各10 mL,另一管中加入2 mL 0.1 mol·L-1 NaH2PO4和18 mL 0.1 mol·L-1 Na2HPO4,混匀后用精密pH试纸分别测量两管中溶液的pH值。
然后在每管中各加入1.8 mL 0.1 mol·L-1 NaOH,混匀后再用精密pH试纸分别测量两管中溶液的pH值。
说明哪一管中缓冲溶液的缓冲容量大。
5.思考题
(1)在NH3·H2O-NH4Cl溶液中加入少量的强酸或强碱,为什么溶液的pH值基本上保持不变?
(2)根据你实验的结果,欲配制一定体积pH=3.20的缓冲溶液,选择下列三对缓冲对中的那一对为最佳?HCOOH-HCOONa、HAc-NaAc、NaH2PO4-H3PO4。
(假定每种溶液的浓度均为0.1mol·L-1.)
(3)硼砂(Na2B4O5(OH)4 ·8H2O)溶液是否具有缓冲作用,为什么?
(李志强编)。