水饱和蒸气压的实验测定
- 格式:ppt
- 大小:755.50 KB
- 文档页数:15

饱和蒸汽压的测定的实验报告实验名称:饱和蒸汽压的测定实验目的:测量不同温度下的饱和蒸汽压,探究其变化规律,了解水的蒸发过程。
实验原理:饱和蒸汽压是指液体蒸发到一定程度时,与外界保持动态平衡时的蒸汽压强度。
在一定温度下,液体与蒸汽之间的这种平衡成为饱和状态,此时液体内部还有未蒸发的分子,但是已经达到了与空气中水分子蒸发相等的蒸汽压强度。
饱和温度的升高会使液体内部更多分子脱离表面蒸发,从而使蒸汽压增大。
实验器材:烧杯、温度计、热水浴、挂钩、弹簧秤、水。
实验步骤:1、将烧杯中加满水后用挂钩扣到弹簧秤上,测量其质量并记录下来。
2、在热水浴中加热烧杯,记下开始加热时的温度,并持续加热直到水沸腾,此时温度保持不变,可用温度计测量并记录下来。
3、记下水沸腾时的弹簧秤读数,用其减去起始重量,即得水的蒸发量。
4、重复实验步骤1-3并记录不同温度下水的蒸发量和弹簧秤读数。
5、利用实验得到的数据,根据公式P = PP/P计算出不同温度下的饱和蒸汽压。
实验数据记录:温度/℃质量/g 弹簧秤读数/N 蒸发量/g 饱和蒸汽压/Pa20 100.2 0.22 0 030 100.2 0.26 0.7 105440 100.2 0.30 1.3 194650 100.2 0.33 2.1 313860 100.2 0.38 3.1 4641实验结果分析:根据实验结果,可得到以下结论:1、随着温度的升高,饱和蒸汽压不断增大,增长速度逐渐加快。
2、在30-60℃范围内,每10℃饱和蒸汽压的增长约为1000 Pa。
3、实验数据与理论曲线存在小差距,可归因于实际操作中可能存在的误差差异。
实验结论:本实验通过测量不同温度下水的蒸发量和弹簧秤读数,计算出了不同温度下水的饱和蒸汽压。
实验结果表明,随着温度的升高,饱和蒸汽压呈现增长趋势,增长速度逐渐加快。
同时,实验数据还与理论曲线存在差距,可对实际误差进行进一步研究。

实验报告课程名称:大学化学实验(P)指导老师:____ 滕启文_ __实验名称:液体饱和蒸汽压的测定实验类型:____ 同组学生姓名:__________一、实验目的和要求(必填)二、实验内容和原理(必填)三、主要仪器设备(必填)四、操作方法和实验步骤五、实验数据记录和处理六、实验结果与分析(必填)七、讨论、心得液体饱和蒸气压的测定(动态法)一、实验目的1. 加深理解饱和蒸气压、活度系数和渗透系数等概念。
2. 学习测定液体饱和蒸汽压的方法,了解蒸汽压数据的应用。
3. 理解蒸气压降低、沸点升高等溶液性质及稀溶液的依数性。
4. 熟悉温度计的露茎校正法。
5. 了解数字式真空测压仪,熟悉福廷式气压计的使用方法及校正方法,初步掌握真空试验技术。
二、实验原理在某一温度下,封闭系统中的液体,有动能较大的分子从液相跑到气相,也有动能较小的分子从气相回到液相,当二者的速率相等时,就达到了动态平衡。
此时,气相中的蒸气密度不再改变,因而具有一定的饱和蒸汽压。
当液体的饱和蒸汽压与液体上方的压力相等时液体就会沸腾,此时温度就是沸点。
纯液体和定组成溶液的饱和蒸汽压是温度的单值函数,蒸汽压p随温度T的变化可用Clausius-Clapeyron方程表示:dlnp dT =∆vap H mRT2(式1)式中:△vapH m是液体的摩尔气化焓;R是摩尔气体常量。
假定△vapH m与温度无关,积分式1,有lnp=−∆vap H mRT+C(式2)式中:C为积分常数,与压力p的单位有关。
若以ln p对于1/T作图得到一直线,由直线的斜率可以求出该液体的气化摩尔焓,实现由易测量数据求算南侧量数据的目的。
在应用中常用Antoine方程描述饱和蒸汽压与温度的关系:lnp=A−BT−C(式3) 式中:A、B、C均为Antoine常量。
此时可以估算不同温度时的摩尔气化焓和气化熵∆vap H m=BRT2(T−C)2(式4)∆vap S m=∆vap H mT =BRT(T−C)2(式5)测量蒸汽压的方法可分为动态法和静态法两大类,静态法(等压计法)直接测定待测液体在指定温度时的蒸汽压,即固定T测定P得到蒸汽压方程;动态法(沸点计法)是指测定待测液体在指定压力下的沸点,即固定P测定T得到蒸汽压方程。

液体饱和蒸汽压的测定-实验报告液体饱和蒸汽压的测定实验报告一、实验目的1、明确液体饱和蒸汽压的定义及其实用意义。
2、掌握静态法测定液体饱和蒸汽压的原理和方法。
3、学会使用气压计和恒温槽等实验仪器。
4、通过实验数据处理,求得所测液体在不同温度下的饱和蒸汽压,并绘制出蒸气压温度曲线,计算出液体的平均摩尔汽化热。
二、实验原理在一定温度下,液体与其蒸汽达到平衡时的压力称为该温度下液体的饱和蒸汽压。
当液体的蒸汽压与外界压力相等时,液体便沸腾。
静态法测定液体饱和蒸汽压是在一定温度下,直接测量处于平衡状态时的蒸汽压力。
假设被测量液体的蒸汽压为 p,实验装置中所加的外压为 p 外,当 p = p 外时,液体发生沸腾。
此时,外压 p 外的大小就等于液体的饱和蒸汽压 p。
克劳修斯克拉贝龙方程表示了液体饱和蒸汽压与温度的关系:ln(p/p) =ΔvapHm/(R·T) + C其中,p 为液体在温度 T 时的饱和蒸汽压,p为标准大气压,ΔvapHm 为液体的摩尔汽化热,R 为摩尔气体常数,T 为热力学温度,C 为积分常数。
通过测定不同温度下液体的饱和蒸汽压,并以 ln(p/p) 对 1/T 作图,可得一直线,其斜率为ΔvapHm/(R),从而可求得液体的摩尔汽化热ΔvapHm。
三、实验仪器与试剂1、仪器饱和蒸汽压测定装置一套,包括等压计、稳压瓶、温度计、恒温槽、气压计。
真空泵及附件。
2、试剂无水乙醇(分析纯)。
四、实验步骤1、装置安装将等压计、稳压瓶、温度计等按实验装置图连接好。
检查装置的气密性,确保系统无漏气现象。
2、装样洗净等压计,烘干后在等压计的 U 形管内加入适量的无水乙醇。
3、排除系统内的空气打开真空泵,抽气至等压计内的液体沸腾 3 5 分钟,以排除系统内的空气。
关闭真空泵,观察等压计内的液面,若液面在数分钟内保持不变,则表明系统内的空气已排尽。
4、测定不同温度下的饱和蒸汽压开启恒温槽,调节温度至某一设定值,并保持恒温。
液体饱和蒸汽压测量一、实验目的1、测定去离子水在不同温度下的饱和蒸气压。
2、求出所测温度范围内去离子水的平均摩尔气化焓。
二、实验原理在一定温度下,纯物质气液相达到平衡时的蒸气压为纯物质的饱和蒸气压。
纯物质的饱和蒸气压与温度有关。
将气相视为理想气体时,对有气相的两相平衡(气-液、气-固),可用Clausius-Clapeyron方程表示为:dln(p/Pa)dT=∆vapHmRT2如果温度范围变化小∆vapHm可近似看做常数,对上式积分得:ln(p/pa)=-∆vapHmRT+C由上式可知,ln(p/Pa)与1T为直线关系:由实验测出p、T值,以ln(p/Pa)对1/T作图得一直线,从直线斜率可求出所测温度范围内液体的平均摩尔气化焓。
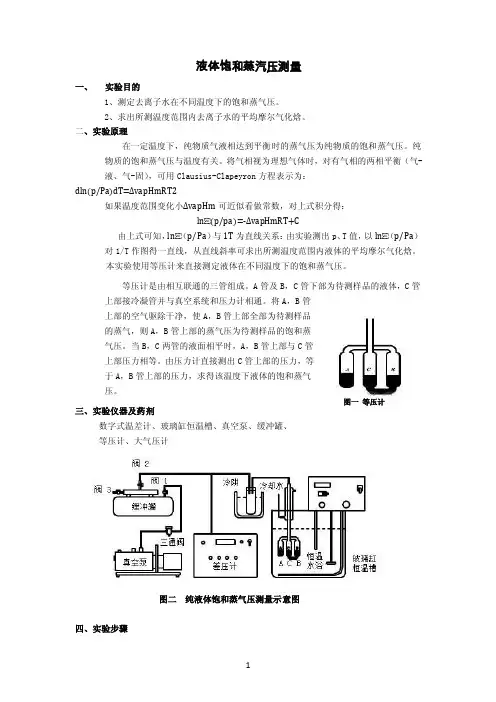
本实验使用等压计来直接测定液体在不同温度下的饱和蒸气压。
等压计是由相互联通的三管组成。
A管及B,C管下部为待测样品的液体,C管上部接冷凝管并与真空系统和压力计相通。
将A,B管上部的空气驱除干净,使A,B管上部全部为待测样品的蒸气,则A,B管上部的蒸气压为待测样品的饱和蒸气压。
当B,C两管的液面相平时,A,B管上部与C管上部压力相等。
由压力计直接测出C管上部的压力,等于A,B管上部的压力,求得该温度下液体的饱和蒸气压。
图一等压计三、实验仪器及药剂数字式温差计、玻璃缸恒温槽、真空泵、缓冲罐、等压计、大气压计图二纯液体饱和蒸气压测量示意图四、实验步骤1、熟悉实验仪器和装置,按上图所示组装仪器,水浴锅中去离子水不能低于刻度线,冷阱中加入冰水。
2、打开三通阀使得真空泵接大气,打开真空泵电源。
3、检漏:压力计上的冷凝管通冷却水。
打开三通阀并通大气,打开真空泵。
关阀1,开阀2、3,使系统同大气,待差压计示数稳定后按置零按钮,示数变为零。
关阀3,真空泵与系统相通,缓慢开阀1,系统减压。
当压力表读数为-40 ~-50kPa时,关阀1,封闭系统。
观察压力表读数,如果压力表示数在5min中内基本不变或者变幅小于0,2kPa/min则可以判断系统没有漏气,否则系统漏气需要分段检查(此时不要打开恒温水浴锅的加热和搅拌装置,体系内气压对温度很敏感,这样很容易使得示数不稳定而不利于判断。

测定饱和蒸汽压实验报告
实验目的:
通过测定不同温度下饱和水蒸气的压强,探究水蒸气的物理特性,了解水蒸气与温度、压强之间的关系。
实验原理:
饱和水蒸气是指在一定温度下,水的液态和气态达到平衡状态时所含的水汽的最大量,此时的水蒸气与液态水的物质量比例为1:1。
由于水蒸气的压强与温度之间的关系具有一定的规律性,因此可以通过实验测定饱和水蒸气的压强并绘制P-T图。
实验过程:
1.准备试验设备,将压力计连接到真空泵和水箱上,并完成漏气测试。
2.将水箱内的水加热,使其在试管中不断蒸发,并通过压力计测量不同温度下水蒸气的压强。
3.将得到的压强和温度数据进行统计整理,绘制P-T图。
实验结果:
实验结果表明,水蒸气的压强与温度之间呈正比关系,即随着温度的升高,水蒸气的压强也相应增加。
而且在饱和状态下,
水蒸气的压强与温度之间呈非常明显的对数关系。
实验结论:
本实验通过测定不同温度下饱和水蒸气的压强得出了水蒸气的物理特性以及水蒸气与温度、压强之间的关系。
饱和水蒸气的压强与温度呈正比关系,而在饱和状态下呈对数关系。
该实验结果对于深入研究水蒸气的物理性质具有重要意义。

实验四 纯液体饱和蒸汽压的测定一、实验目的1. 掌握用静态法测定乙醇在不同温度下的饱和蒸汽压。
2. 学会用图解法求被测液体在实验温度围的平均摩尔汽化热与正常沸点。
二、实验原理在一定温度下,与纯液体处于平衡状态时的蒸气压力,称为饱和蒸气压这里的平衡状态是指动态平衡。
在某一温度下,被测液体处于密闭真空容器中,液体分子从表面逃逸而成蒸气,蒸气分子又会因碰撞而凝结成液相,当两者的速率相同时,就达到了动态平衡,此时气相中的蒸气密度不再改变,因而具有一定的饱和蒸气压。
当液体处于沸腾状态时,其上方的压力即为其饱和蒸气压。
温度不同,分子从液体逃逸的速度不同,因此饱和蒸气压不同。
饱和蒸气压与温度的关系可用克-克方程来表示:2ln{p }vap m H d dT RT *∆= (2-1)式中 p *——液体在温度T 时的饱和蒸气压,Pa ;T ——热力学温度,K ;Δvap H m ——液体的摩尔汽化热,J ·mol -1;R ——摩尔气体常,8.314 K -1·mol -1。
如果温度的变化围不大,Δvap H m 视为常数,可当作平均摩尔汽化热。
对式(2-1)进行积分得:ln vap mH p C RT *-∆=+ (2-2)式中c 为积分常数,此数与压力p *的单位有关。
此式表示在一定温度围,液体饱和蒸气压的对数值与温度的倒数成正比。
如果测定出液体在各温度下的饱和蒸气压,以lnp*对1/T作图,可得一条直线,根据直线斜率可求出液体的平均摩尔汽化热。
当外压为101.325kPa时,液体的蒸气压与外压相等时的温度称为该液体的正常沸点。
在图中,将该直线外推到压力为常压时的温度,即为液体的正常沸点。
测定液体饱和蒸气压的方法有三种,分别为动态法、静态法和饱和气流法。
动态法是指在连续改变体系压力的同时测定随之改变的沸点;静态法是指在密闭体系中改变温度而直接测定液体上方气相的压力;饱和气流法是在一定的液体温度下,采用惰性气体流过液体,使气体被液体所饱和,测定流出的气体所带的液体物质的量而求出其饱和蒸气压。

实验七液体饱和蒸气压的测定一实验目的1. 学会用饱和蒸气压计测定乙醇在不同温度下的蒸气压。
2. 学会用图解法求算乙醇的摩尔气化热和正常沸点。
二实验原理纯物质的饱和蒸气压是指在一定温度下,气-液两相平衡时蒸气的压力。
当液体的饱和蒸气压与外界压力相等时,液体便沸腾,此时的温度成为液体的沸点。
液体的沸点随外压的变化而变化,若外压为标准压力(101325Pa),则液体沸点就称为正常沸点。
蒸发1摩尔液体所吸收的热量,即为该温度下该液体的摩尔气化热(焓)。
根据热力学知识,液体饱和蒸气压随温度变化的定量关系可用克劳修斯-克拉贝龙(Clausius-Clapeyron)方程表示:=(9-1)式中P为液体在温度T时饱和蒸气压,为摩尔气化热(焓),R为气体常数是8.314J·K-1·mol-1。
在温度变化较小的范围内,可视为与温度无关的常数,积分(9-1)式得:ln=-+C (9-2)C为积分常数。
由式(9-2)可知,ln与成线性关系,直线斜率A = - 因此可通过作图求出。
测定饱和蒸气压的方法主要有以下三种:1. 饱和气流法:在一定温度和压力下,把干燥气体缓慢地通过被测液体,使气流为该液体的蒸气所饱和。
然后可用某物质将气流吸收,知道了一定体积的气流中蒸气的重量。
便可计算蒸气压。
此法一般适用于蒸气压比较小的液体。
2. 静态法:在某一温度下,直接测量饱和蒸气压,测定时要求体系内无杂质气体,此法一般适用于蒸气压比较大的液体。
3. 动态法:在不同外界压力下,测定液体的沸点。
本实验采用静态法,用一个球管与一个U型管相连,构成了实验测定装置,其外形如图9-1所示。
球a中盛有被测液体,故称之为样品池,U形管bc部分以被测液体作为封闭液,这一部分称为等压计。
测定时先将a与b之间的空气抽净,然后从c的上方缓慢放入空气,使等压计bc两端的液面平齐,且不再发生变化时,则ab之间的蒸气压即为此温度下被测液体的饱和蒸气压,因为此饱和蒸气压与c上方的压力相等,而c上方的压力可由压力计直接读出。


姓名: 班级: 学号: 实验日期:课程名称:物理化学实验实验题目:液体饱和蒸汽压的测定一、实验目的①了解用静态法测定异丙醇在不同温度下蒸气压的原理。
②学会用图解法求解其所在测温度范围内的平均摩尔蒸发热。
③了解真空泵、恒温槽及气压计的构造并掌握其使用方法。
二、实验原理一定温度下,在一真空的密闭容器中,液体很快与其蒸气建立动态平衡,即蒸汽分子向液面凝结和液体分子从表面上逃逸的速度相等,此时液面上的蒸汽压力就是液体在此温度是的饱和蒸汽压液体与其蒸气达到平衡时蒸气的压力,称为这种液体在该温度时的饱和蒸气压。
饱和蒸汽压与温度的关系可用克劳修斯—克拉贝龙方程式来表示。
2ln RT H dTpd m vap ∆=式中Δvap H m 是该液体的摩尔蒸发热,在温度变化范围不大时,它可以作为常数。
积分上式得:为横坐标作图可得一直线,此直线的斜率即为 饱和蒸气压。
测量方法是调节外压与液体蒸汽压相等,此法一般用于蒸汽压比较大的液体。
动态法是在不同外界压力下,测定液体的沸点。
本实验采用静态法测定乙醇的饱和蒸汽压与温度的关系,实验装置见图3.1.通常一套真空体系装置由四部分构成:一是机械泵、缓冲储气罐部分,用以生产真空;二是正空的测量部分,包括DP-A 精密数字压力计;三是蒸馏瓶部分;四是温度测量部分,包括SWQ 智能数字恒温控制器、SYP 玻璃恒温水浴。
三、仪器与试剂1.仪器DP-A 型精密数字压力计一台;SWQ 型智能数字恒温控制器一台;缓冲储气罐一台;SYP 型玻璃恒温水浴一台;U 型等压计一个、球形冷凝管一支。
实验装置如图3.1所示。
2.试剂无水乙醇。
四、实验步骤(一)缓冲储气罐的气密性检查及使用方法1.缓冲储气罐的气密性检查2.缓冲储气罐的使用方法(二)精密数字压力计的气密性检查及使用方法1.预压及气密性的检查2.采零3.测试4.关机(三)实验仪器的链接(四)静态法测乙醇的饱和蒸汽压1.装样2.检漏3.测定五、注意事项1.先开启冷却水,然后才能抽气。

华南师范大学实验报告学生姓名学号专业年级、班级课程名称物理化学实验实验项目纯液体饱和蒸气压的测定—静态法实验类型□验证□设计■综合实验时间年月日实验指导老师实验评分一、实验目的1.明确纯液体饱和蒸汽压和蒸汽压的概念及其与温度的关系,加深对劳修斯-克拉贝龙(Clausius-Clapeyron)方程式的理解。
2.掌握静态法测定纯液体饱和蒸汽压的原理及方法,并学会用图解法求纯液体的平均并学会由图解法求其平均摩尔气化热和正常沸点。
3.了解数字式低真空侧压仪=,熟悉常用的气压计的使用及校正的方法,初步掌握真空实验技术。
二、实验原理在一定温度下(距离临界温度较远时),纯液体与其蒸气达平衡时的蒸气压称为该温度下液体的饱和蒸气压,简称为蒸气压。
蒸发一摩尔液体所吸收的热量称为该温度下液体的摩尔气化热。
液体的饱和蒸气压与温度的关系用克劳修斯-克拉贝龙方程式表示:式中,R为摩尔气体常数;T为热力学温度;Δvap H m为在温度T时纯液体的摩尔气化热。
在温度变化范围不大时,Δvap H m可以近似作为常数,积分上得:由此式可以看出,以ln p对作图,应为一直线,直线的斜率为m= ,由斜率可求算液体的Δvap H m=-Rm当液体的饱和蒸汽压登月外界压力时,液体沸腾,此时的温度即为该液体的沸点,当外压为1atm(1.01325kPa)时,液体的沸点成为正常沸点。
测定液体饱和蒸气压的方法很多。
本实验采用静态法,是指在某一温度下,直接测量饱和蒸气压,此法一般适用于蒸气压比较大的液体。
实验所用仪器是纯液体饱和蒸气压测定装置,如图Ⅲ-3-1所示。
平衡管由A球和U型管B、C组成。
平衡管上接一冷凝管5,以橡皮管与压力计相连。
A内装待测液体,当A球的液面上纯粹是待测液体的蒸气,而B管与C管的液面处于同一水平时,则表示B管液面上的(即A球液面上的蒸气压)与加在C管液面上的外压相等。
此时,体系气液两相平衡的温度称为液体在此外压下的沸点。

纯液体饱和蒸汽压的测定实验报告数据1. 实验背景与目的咱们今天要聊的,是一项关于纯液体饱和蒸汽压的测定实验。
这听起来可能有点拗口,但说白了,就是我们要搞明白,当液体处于蒸汽和液体平衡的状态时,它的蒸汽压力到底有多大。
这就像是在厨房里煮水,水蒸气“哔哔”冒出来的压力到底是啥,咱们得用科学的方法给它量个准。
要知道,液体的饱和蒸汽压其实是个很重要的物理量。
它不仅告诉我们液体的挥发性,还对很多实际应用有影响,比如化学反应的速率、溶液的沸点,甚至天气预报。
没错,连你早晨出门是否带伞都可能跟它有关呢。
咱们这实验的目的就是通过具体的数据测量,把这些抽象的东西具体化,让大家对这种“气压”有个清晰的了解。
2. 实验原理与方法2.1 实验原理想象一下,一瓶水里加了点小气泡,等它们消失后,水面上就会有一层“气膜”在不停地和水里的液体交换。
这层气膜的压力就是咱们要测的“饱和蒸汽压”。
简单来说,就是液体表面和上方的气体之间达成了一种平衡状态,气体的压力也就固定了。
为了测量这个压力,咱们通常用到的实验装置有个叫“蒸汽压计”的玩意儿。
它就像是一个小小的测量仪器,能精准地把蒸汽压的数值给我们报上来。
记住,这个压力值跟液体的温度、物质的种类都有关系,所以在做实验的时候,一定要把这些因素都考虑进去。
2.2 实验方法话说回来,实验过程其实不复杂,咱们需要的就是一套设备和一点耐心。
首先,得准备好一个密封的容器,里面装上纯液体,比如水或酒精,然后用蒸汽压计把容器密封好。
接着,调节温度,让液体达到某个稳定的温度,再把测量结果记录下来。
比如说,如果我们要测水的饱和蒸汽压,可以把水加热到不同的温度,比如20度、30度、40度,然后记录下各个温度下的蒸汽压值。
这样一来,我们就能看到,随着温度的升高,蒸汽压是如何变化的。
最后,用图表把这些数据整理出来,画出温度和蒸汽压的关系曲线,就能一目了然了。
3. 实验结果与讨论3.1 实验数据好了,咱们现在来看下实验数据。
华南师范大学实验报告课程名称 物理化学实验 实验项目 饱和蒸汽压的测定【实验原理】在封闭体系中,当液相的蒸发速度与相应气相的凝聚速度相等时,体系达到动态平衡,此时的蒸气压为该温度下的饱和蒸气压,液体的饱和蒸气压等于外压时的温度为液体的沸点,因此沸点是随外压变化的,当外压为101325Pa 时,称之为正常沸点。
每蒸发1mol 液体所需的热量称该温度下的摩尔汽化热。
克拉贝龙-克劳修斯方程描述了饱和蒸气压,温度与摩尔汽化热之间的关系:d d vap mln p T H RT =∆2它是克拉贝龙方程式的简化形式,可以根据该式测定液体的饱和蒸气压。
饱和蒸汽压是液体工质最基本的物性参数之一, 是化工、生产、科研、设计过程中的重要基础数据,所以掌握通常测量饱和蒸气压的方法具有很大的实际意义。
液体饱和蒸汽压的测量方法主要有三种:静态法,动态法和饱和气流法。
动态法是指在不同外界压力下, 测定液体的沸点, 又称沸点法。
动态法与其它两种方法相比具有操作简单,结果比较准确的优点,适用于蒸气压不太高的液体。
本实验采用动态法来测量水的饱和蒸气压,并由此得到水的正常沸点和摩尔汽化热。
在封闭体系中,液体很快和它的蒸气达到平衡。
这时的蒸气的压力称为液体的饱和蒸气压。
蒸収一摩尔液体需要吸收的热量,即为该温度下液体的摩尔汽化热。
它们的关系可用克拉贝龙-克劳修斯方程表示:d d vap mln p T H RT=∆2若温度改变的区间不大,∆H 可视为为常数(实际上∆H 与温度有关)。
积分上式得:ln 'P A HRT =-∆或 log P A BT=-常数A A ='.2303,B H R =∆vap m 2303.。
(3)式表明log P 与1T有线性关系。
作图可得一直线,斜率为-B 。
因此可得实验温度范围内液体的平均摩尔汽化热∆H 。
∆vap m H RB =2303.当外压为101.325kP a (760mmHg)时,液体的蒸汽压与外压相等时的温度称为液体的正常沸点。
液体饱和蒸气压的测定实验报告液体饱和蒸气压的测定实验报告引言:液体饱和蒸气压是指在一定温度下,液体与其蒸汽达到平衡时的蒸汽压强。
测定液体饱和蒸气压有着重要的科学意义和实际应用价值。
本实验旨在通过测定饱和水蒸气压与温度之间的关系,探究饱和蒸气压与温度的定量关系。
实验原理:根据饱和水蒸气压与温度之间的关系,我们可以利用饱和蒸气压计算液体的沸点、热力学性质以及在工业生产中的应用。
根据克劳修斯-克拉佩龙方程可以得到液体饱和蒸气压与温度之间的关系式:lnP=A-B/T,其中P为饱和蒸气压,T为温度,A和B为常数。
实验步骤:1. 实验前准备:将装有水的锥形瓶倒置于水槽中,确保水面高于瓶口,使瓶内的水与外界形成密封空间。
2. 测量温度:使用温度计测量水槽中的温度,并记录下来。
3. 测量液面高度:用毛细管连接水槽和锥形瓶内的空气,通过调节水槽中的水位,使水从毛细管中流出,直到液面与毛细管平齐。
记录下液面高度。
4. 重复以上步骤,分别在不同温度下进行测量,并记录数据。
实验数据:温度(摄氏度)液面高度(cm)饱和蒸气压(kPa)20 3.2 2.330 4.1 4.540 5.0 7.250 5.9 11.060 6.8 16.0数据处理与分析:根据实验数据,我们可以绘制出温度与饱和蒸气压之间的关系曲线。
通过对数据的拟合,可以得到A和B的值,并进一步计算出液体的沸点等热力学性质。
实验结论:通过本实验的测量与分析,我们得到了液体饱和蒸气压与温度之间的定量关系。
这对于研究液体的热力学性质、计算沸点以及工业生产中的应用都有着重要的意义。
同时,本实验也展示了实验操作的重要性和数据处理的方法。
实验的不确定性:在进行实验过程中,存在一些不确定因素可能会对实验结果产生影响。
例如,温度计的精度、水槽中水的温度均匀性以及液面高度的测量误差等。
为了提高实验的准确性,我们可以采取多次测量取平均值的方法,并尽量减小实验误差。
进一步研究:在今后的研究中,可以进一步探究不同液体的饱和蒸气压与温度之间的关系,并研究不同因素对饱和蒸气压的影响。
液体饱和蒸气压的测定的实验报告
液体饱和蒸气压是指液体与其蒸气在平衡状态下的压力,是该温度下液体的属性之一。
液体饱和蒸气压与温度有关系,随着温度的升高,液体饱和蒸气压也会升高。
热力学测量法是通过测量液体饱和蒸气和空气的混合气体的压
力差来计算液体饱和蒸气压的,其原理基于热力学第一定律。
气压法是通过测量液体与蒸气间在毛细玻璃管内的高度差来计算液体饱和
蒸气压的,其原理基于毛细现象。
实验步骤:
1.使用热力学测量法:将装有液体的圆筒浸入恒温水槽中,等待液体和水温度达到平衡。
将液体与空气混合气体通入压力计中,记录压力差,并计算液体饱和蒸气压。
2.使用气压法:将毛细玻璃管插入液体中,观察液体上升高度并记录。
将毛细玻璃管的一端放入水中,使管内空气与水蒸气平衡,再次观察液体上升高度并记录。
通过计算两次高度差和水的密度,计算液体饱和蒸气压。
实验结果:
使用热力学测量法得到液体饱和蒸气压为P1=×××,使用气压法得到液体饱和蒸气压为P2=×××。
实验结论:
本实验通过热力学测量法和气压法两种方法测量了液体的饱和
蒸气压,并得到了较为精确的结果。
液体饱和蒸气压与温度有关系,
在不同温度下实验得到的结果会有所差异。
液体饱和蒸汽压的测定实验报告一、实验目的1.掌握测定液体饱和蒸汽压的方法和原理。
2.了解温度对饱和蒸汽压的影响。
二、实验原理液体与其蒸气处于平衡时,液体饱和蒸汽的压强称为饱和蒸汽压,它与温度有关。
通过测定不同温度下液体的饱和蒸汽压,可以绘制出饱和蒸汽压与温度的关系曲线。
实验选用饱和蒸汽压力-温度关系较为简单、可靠的水。
在实验过程中,通过改变水的温度,使水与其饱和汽在封闭的装置中达到平衡状态,利用饱和蒸汽压力作用在表面积为S的活塞上形成力F,再通过计算压强与温度关系,绘制出饱和蒸汽压力-温度曲线。
三、实验设备1.带刻度的装置(由一根毛细玻璃管、一根玻璃制封装管和一个活塞组成)2.高温恒温槽3.温度计4.水槽5.压力计(真空计)四、实验步骤1.检查实验装置是否完好,毛细玻璃管是否通畅。
2.将实验设备放入恒温槽内,通过调节恒温槽的温度,使温度达到设定值。
3.选择一个温度值,待装置温度稳定后,用水或玻璃棒将毛细玻璃管中的水填充至刻度线处。
4.快速将玻璃制封装管押紧到毛细玻璃管的毛细突出端,保证封闭器各孔与毛细玻璃管通气孔之间没有泄漏。
5.用压力计通过封装管上的压力计接头连通,关掉活塞处的阀门。
6.压力计读数即为液体的饱和蒸汽压强。
7.记录温度和饱和蒸汽压强的数值。
8.根据实验步骤(3-7),取几组不同的温度值,每次测定时使温度稳定后记录数据。
五、实验结果和数据处理根据实验步骤记录得到的一组数据如下表所示:温度(℃),饱和蒸汽压强(kPa)-------,---------------20,2.3440,7.8260,19.3180,43.86100,101.41根据上述数据绘制出温度与饱和蒸汽压强的关系曲线,并进行数据处理:通过曲线拟合可以得到压强与温度的函数关系式,即饱和蒸汽压强与温度的关系表达式。
六、实验分析通过实验得到的饱和蒸汽压强与温度的关系曲线,可以发现随着温度的升高,饱和蒸汽压强也随之上升。
饱和蒸汽压测定实验报告实验名称:饱和蒸汽压测定实验实验目的:通过实验测定不同温度下水的饱和蒸汽压力,并绘制出饱和蒸汽压力随温度变化的曲线。
实验原理:饱和蒸汽压是指在一定温度下,液体和气体之间达到平衡时,气体对液体的压强值,即液体的饱和气压。
饱和蒸汽压的随温度变化的曲线称为饱和蒸汽压力-温度曲线。
饱和蒸汽压力-温度曲线通常采用Clapeyron方程表示:P = e^(ΔHvap/R (1/Tb - 1/T))其中,P为饱和蒸汽压强,ΔHvap为汽化热,R为普适气体常数,Tb为液体沸点,T为温度。
实验步骤:1. 在实验室中取一烧杯,注入约100ml的蒸馏水,并进行加热。
2. 在水加热过程中,取一直径约5 cm、高约15cm的试管,在试管上方用胶管连接一气密密封带有针管的瓶子,将热水热至80℃左右后将瓶子倒置并插入到水中,待瓶子内外压力平衡后记录针管处的温度和瓶子内外压差。
3. 重复第二步,分别在不同温度下记录压差和温度值。
4. 根据实验数据计算不同温度下水的饱和蒸汽压力值,并绘制出饱和蒸汽压力随温度变化的曲线。
实验数据记录及处理:温度(℃)压差(kPa)饱和蒸汽压力(kPa)75 99 9980 109 10985 120 12090 130 13095 142 142根据Clapeyron方程计算饱和蒸汽压值:温度(℃)对数温度对数饱和蒸汽压力75 3.9120 4.595180 3.8741 4.691385 3.8360 4.787590 3.7977 4.883195 3.7591 4.9804绘制出饱和蒸汽压力随温度变化的曲线:实验结论:通过本实验的数据计算和曲线绘制,得出以下结论:1. 随着温度升高,饱和蒸汽压力呈现明显的增加趋势;2. 实验数据符合Clapeyron方程,证明了饱和蒸汽压力的计算公式的正确性;3. 本实验结果可用于各种相关工程领域的设计和实践中。
纯液体饱和蒸汽压的测量实验报告HUA system office room 【HUA16H-TTMS2A-HUAS8Q8-HUAH1688】一、目的要求1. 明确纯液体饱和蒸气压的定义和汽液两相平衡的概念,深入了解纯液体饱和蒸气压与温度的关系公式——克劳修斯-克拉贝龙方程式。
2. 用数字式真空计测量不同温度下环己烷的饱和蒸气压。
初步掌握真空实验技术。
3. 学会用图解法求被测液体在实验温度范围内的平均摩尔气化热与正常沸点。
二、实验原理通常温度下(距离临界温度较远时),纯液体与其蒸气达平衡时的蒸气压称为该温度下液体的饱和蒸气压,简称为蒸气压。
蒸发1mol液体所吸收的热量称为该温度下液体的摩尔气化热。
液体的蒸气压随温度而变化,温度升高时,蒸气压增大;温度降低时,蒸气压降低,这主要与分子的动能有关。
当蒸气压等于外界压力时,液体便沸腾,此时的温度称为沸点,外压不同时,液体沸点将相应改变,当外压为1atm (101.325kPa )时,液体的沸点称为该液体的正常沸点。
液体的饱和蒸气压与温度的关系用克劳修斯-克拉贝龙方程式表示为:2mvap d ln d RTH T p ∆= 式中,R 为摩尔气体常数;T 为热力学温度;m H vap ∆为在温度T 时纯液体的摩尔气化热。
假定m H vap ∆与温度无关,或因温度范围较小,m H vap ∆可以近似作为常数,积分上式,得:C TR H p +⋅∆-=1ln m vap其中C 为积分常数。
由此式可以看出,以ln p 对1/T 作图,应为一直线,直线的斜率为vap mH R∆-,由斜率可求算液体的vap m H ∆。
三、仪器、试剂蒸气压测定装置 1套 循环式真空泵 1台精密数字压力计 1台 数字控温仪 1只无水乙醇(分析纯)四、实验步骤1.读取室内大气压2.安装仪器:将待测液体(本实验是无水乙醇)装入平衡管,之后将平衡管安装固定。
3.抽真空、系统检漏4排气体:先设定温度为20℃,之后将进气阀打开,调压阀关闭,稳定后,关闭进气阀,置零,打开冷却水,同时打开真空泵和调压阀(此时调压阀较大)。