8.5.2沉淀溶解平衡常数及其应用
- 格式:pptx
- 大小:779.63 KB
- 文档页数:4






考点一沉淀溶解平衡及应用1.沉淀溶解平衡(1)沉淀溶解平衡的概念在一定温度下,当难溶强电解质溶于水形成饱和溶液时,溶解速率和生成沉淀速率相等的状态。
(2)溶解平衡的建立固体溶质溶解沉淀溶液中的溶质①v溶解>v沉淀,固体溶解②v溶解=v沉淀,溶解平衡③v溶解<v沉淀,析出晶体(3)溶解平衡的特点(4)影响沉淀溶解平衡的因素①内因难溶电解质本身的性质,这是决定因素。
②外因以AgCl(s)Ag+(aq)+Cl-(aq) ΔH>0为例外界条件移动方向平衡后c(Ag+) 平衡后c(Cl-) K sp升高温度正向增大增大增大加水稀释正向不变不变不变加入少量AgNO3逆向增大减小不变通入HCl 逆向减小增大不变通入H2S 正向减小增大不变(5)电解质在水中的溶解度20 ℃时,电解质在水中的溶解度与溶解性存在如下关系:2.沉淀溶解平衡的应用(1)沉淀的生成①调节pH法如:除去NH4Cl溶液中的FeCl3杂质,可加入氨水调节pH至7~8,离子方程式为Fe3++3NH3·H2O===Fe(OH)3↓+3NH+4。
②沉淀剂法如:用H2S沉淀Cu2+,离子方程式为H2S+Cu2+===CuS↓+2H+。
(2)沉淀的溶解①酸溶解法如:CaCO3溶于盐酸,离子方程式为CaCO3+2H+===Ca2++H2O+CO2↑。
②盐溶液溶解法如:Mg(OH)2溶于NH4Cl溶液,离子方程式为Mg(OH)2+2NH+4===Mg2++2NH3·H2O。
③氧化还原溶解法如:不溶于盐酸的硫化物Ag2S溶于稀HNO3。
④配位溶解法如:AgCl溶于氨水,离子方程式为AgCl+2NH3·H2O===[Ag(NH3)2]++Cl-+2H2O。
(3)沉淀的转化①实质:沉淀溶解平衡的移动(沉淀的溶解度差别越大,越容易转化)。
②应用:锅炉除垢、矿物转化等。
深度思考1.下列方程式:①AgCl(s)Ag+(aq)+Cl-(aq)、②AgCl===Ag++Cl-、③CH3COOH CH3COO-+H+各表示什么意义?答案①AgCl的沉淀溶解平衡;②AgCl是强电解质,溶于水的AgCl完全电离;③CH3COOH的电离平衡。

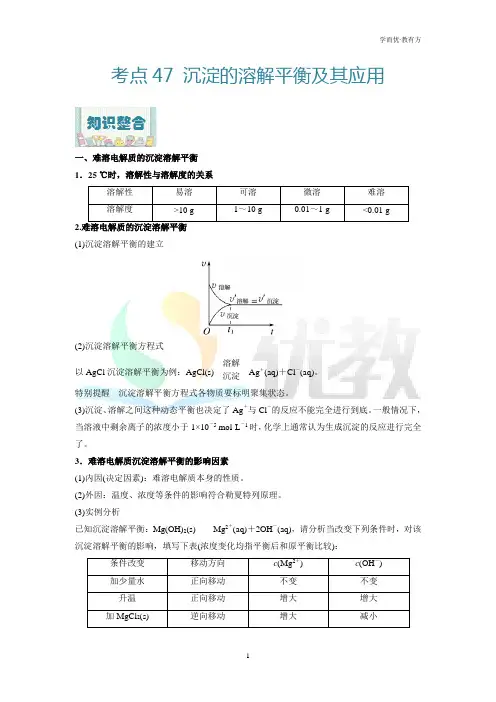
考点47 沉淀的溶解平衡及其应用一、难溶电解质的沉淀溶解平衡1.25 ℃时,溶解性与溶解度的关系溶解性易溶可溶微溶难溶溶解度>10 g 1~10 g 0.01~1 g <0.01 g 2.难溶电解质的沉淀溶解平衡(1)沉淀溶解平衡的建立(2)沉淀溶解平衡方程式以AgCl沉淀溶解平衡为例:AgCl(s)溶解沉淀Ag+(aq)+Cl-(aq)。
特别提醒沉淀溶解平衡方程式各物质要标明聚集状态。
(3)沉淀、溶解之间这种动态平衡也决定了Ag+与Cl-的反应不能完全进行到底。
一般情况下,当溶液中剩余离子的浓度小于1×10-5 mol·L-1时,化学上通常认为生成沉淀的反应进行完全了。
3.难溶电解质沉淀溶解平衡的影响因素(1)内因(决定因素):难溶电解质本身的性质。
(2)外因:温度、浓度等条件的影响符合勒夏特列原理。
(3)实例分析已知沉淀溶解平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq),请分析当改变下列条件时,对该沉淀溶解平衡的影响,填写下表(浓度变化均指平衡后和原平衡比较):条件改变移动方向c(Mg2+) c(OH-)加少量水正向移动不变不变升温正向移动增大增大加MgCl2(s) 逆向移动增大减小加盐酸正向移动增大减小加NaOH(s) 逆向移动减小增大特别提醒大多数电解质溶解度随温度的升高而增大,但有许多例外,如Ca(OH)2,温度越高,溶解度越小。
二、溶度积常数1.概念难溶电解质的沉淀溶解平衡常数称为溶度积常数,简称溶度积,符号为K sp,K sp的大小反映难溶电解质在水中的溶解能力。
2.表达式A mB n(s)m A n+(aq)+n B m-(aq)K sp=c m(A n+)·c n(B m-)。
如:Fe(OH)3(s)Fe3+(aq)+3OH-(aq)K sp=c(Fe3+)·c3(OH-)。
3.影响因素溶度积K sp值的大小只与难溶电解质本身的性质和温度有关。



微专题四大平衡常数的计算与应用1(2023·辽宁·统考高考真题)某废水处理过程中始终保持H2S饱和,即c H2S=0.1mol⋅L-1,通过调节pH使Ni2+和Cd2+形成硫化物而分离,体系中pH与-lg c关系如下图所示,c为HS-、S2-、Ni2+和Cd2+的浓度,单位为mol⋅L-1。
已知K sp NiS>K sp(CdS),下列说法正确的是 A.K sp(CdS)=10-18.4B.③为pH与-lg c HS-的关系曲线C.K a1H2S=10-14.7=10-8.1 D.K a2H2S【答案】D【解析】已知H2S饱和溶液中随着pH的增大,H2S的浓度逐渐减小,HS-的浓度增大,S2-浓度逐渐增大,则有-lg c(HS-)和-lg(S2-)随着pH增大而减小,且相同pH相同时,HS-浓度大于S2-,即-lg c(HS-)小于-lg(S2-),则Ni2+和Cd2+浓度逐渐减小,且K sp NiS>K sp(CdS),即当c(S2-)相同时,c(Ni2+)>c(Cd2+ ),则-lg c(Ni2+)和-lg(Cd2+)随着pH增大而增大,且有-lg c(Ni2+)小于-lg(Cd2+),由此可知曲线①代表Cd2+、②代表Ni2+、③代表S2-,④代表HS-,据此分析结合图像各点数据进行解题。
A.由分析可知,曲线①代表Cd2+、③代表S2-,由图示曲线①③交点可知,此时c(Cd2+)=c(S2-)=10-13mol/L ,则有K sp CdS =c Cd 2+ ∙c S 2- =10-13mol/L ×10-13mol/L =10-26,A 错误; B .由分析可知,③为pH 与-lg c S 2- 的关系曲线,B 错误;C .由分析可知,曲线④代表HS -,由图示曲线④两点坐标可知,此时c (H +)=10-1.6mol/L 时,c (HS -)=10-6.5mol/L ,K a 1H 2S =c H + ∙c HS - c H 2S =10-1.6mol/L ×10-6.5mol/L 0.1mol/L =10-7.1或者当c (H +)=10-4.2mol/L 时,c (HS -)=10-3.9mol/L ,K a 1H 2S =c H + ∙c HS - c H 2S=10-4.2mol/L ×10-3.9mol/L 0.1mol/L =10-7.1,C 错误;D .已知Ka 1Ka 2=c (H +)c (HS -)c (H 2S )∙c (H +)c (S 2-)c (HS -)=c 2(H +)∙c (S 2-)c (H 2S ),由曲线③两点坐标可知,当c (H +)=10-4.9mol/L 时,c (S 2-)=10-13mol/L ,或者当c (H +)=10-6.8mol/L 时,c (S 2-)=10-9.2mol/L ,故有Ka 1Ka 2=c 2(H +)c (S 2-)c (H 2S )=(10-4.9mol/L )2×10-13mol/L 0.1mol/L =(10-6.8mol/L )2×10-9.2mol/L0.1mol/L =10-21.8,结合C 项分析可知Ka 1=10-7.1,故有K a 2H 2S =10-14.7,D 正确;故答案为D 。