第二章 水中一般污染物及其测定方法
- 格式:ppt
- 大小:794.50 KB
- 文档页数:42




如何检测水的污染程度水温水的物理化学性质与水温密切相关.水中溶解性气体(如氧.二氧化碳等)的溶解度.水中生物和微生物活动.非离子氨.盐度pH值以及其它溶质都受水温变化的影响.色度纯水为无色透明.清洁水在水层浅时应为无色.深层为浅蓝绿色.天然水中存在腐殖质.泥土.浮游生物.铁和锰等金属离子.均可使水体着色.纺织.印染.造纸.食品.有机合成工业的废水中.常含有大量的染料.生物色素和有色悬浮微粒等.因此常常是使环境水体着色的主要污染.有色废水常给人以不愉快感.排入环境后又使天然水着色.减弱水体的透光性.影响水生生物的生长.水的色度单位为度.即在每升溶液中含有2mg六水合氯化钴(Ⅱ)(相当于0.5mg钴)和1mg铂(以六价氯铂(Ⅳ)酸的形式)时产生的颜色为1度.臭无臭无味的水虽不能保证其不含污染物.但有利于使用者对水质的信任.水中产生臭的一些有机物和无机物.主要是由于生活污水工业废水污染.天然物质分解.或微生物.生物活动的结果.某些物质只要存在零点几微克/升即可察觉.然而.很难鉴定产臭物质的组成. 返回浊度浊度是由于水中含有泥沙.粘土.有机物.无机物.浮游生物和微生物等悬浮物质所造成的.不仅沉积速度慢而且很难沉积.由于生活中铁和锰的氢氧化物引起的浊度是十分有害的.必须用特殊的方法才能除去.天然水经过混凝.沉淀和过滤等处理.可使水变得清澄. 返回透明度透明度是指水样的澄清程度.洁净的水是透明的.水中存在悬浮物质和胶体时.透明度便会降低.通常地下水的透明度较高.由于供水和环境条件不同.其透明度可能不断变化.透明度与浊度相反.水中悬浮物越多.其透明度就越低.pH值pH值是水中氢离子活度的负对数.PH=-lgαH+.天然水的pH值多在6-9范围内.这也是我国污水排放标准中pH值控制范围.pH值不仅与水中溶解物质的溶解度.化学形态.特性.行为和效应有密切关系.而且对水中生物的生命活动有着重要影响.残渣残渣分为总残渣.可滤残渣和不可滤残渣三种.总残渣是水或污水在一定温度下蒸发.烘干后残留在器皿中的物质.包括[不可滤残渣"(即截留在滤器上的全部残渣.也称为悬浮物)和[可滤残渣"(即通过滤器的全部残渣.也称为溶解性固体).悬浮物可影响水体的透明度.降低水中藻类的光合作用.限制水生生物的正常运动.减缓水底活性.导致水体底部缺氧.使水体同化能力降低.矿化度矿化度是水中所含无机矿物成分的总量.经常饮用低矿度的水会破坏人体内碱金属和碱土金属离子的平衡.产生病变.饮水中矿化度过高又会导致结石症.矿化度是水化学成分测定的重要指标.用于评价水中总含盐量.是农田灌溉用水适用性评价的主要指标之一.常用于天然水分析中主要被测离子总和的质量表示.电导率电导率是以数字表示溶液传导电流的能力.纯水电导率很小.当水中含无机酸.碱或盐时.电导率增加.电导率常用于间接推测水中离子成分的总浓度.水溶液的电导率取决于离子的性质和浓度.溶液的温度和粘度等.电导率随温度变化而变化.温度每升高1℃.电导率增加约2%.通常规定25℃为测定电导率的标准温度.氧化还原电位对于一个水体来说.往往存在着多个氧化还原电对.是一个相当复杂的体系.其氧化还原电位则是多个氧化物质与还原物质发生氧化还原的综合结果.氧化还原电位对水环境中污染物的迁移转化具有重要意义.水体中氧化的类型.速率和平衡.在很大程度上决定了水中主要溶质的性质.酸度酸度是指水中能与强碱发生中和作用的全部物质.亦即放出H+或经过水解能产生H+的物质的总量.地表水中.由于溶入CO2或由于机械.选矿.电镀.农药.印染.化工等行业排放的含酸废水的进入.致使水体的pH值降低.由于酸的腐蚀性.破坏了鱼类及其他水生生物和农作物的正常生存条件.造成鱼类及农作物等死亡.含酸废水可腐蚀管道.船舶.破坏建筑物.因此.酸度是衡量水体变化的一项重要指标.碱度与碱度相反.碱度是指水中能与强酸发生中和作用的全部物质.亦即能接受质子H+的物质总量.水中的碱度来源较多.地表水的碱度基本上是碳酸盐.重碳酸盐及氢氧化物含量的函数.所以总碱度被当作这些成分浓度的总和.碱度指标常用于评价水体的缓冲能力及金属在其中的溶解性和毒性.是对水和废水处理过程控制的判断性指标.若碱度是由于过量的碱金属盐类所形成.则碱度又是确定这种水是否适宜灌溉的重要依据.二氧化碳二氧化碳在水中主要以溶解气体分子的形式存在.但也有很少一部分与水作用形成碳酸.可同岩石中的碱性物质发生反应.并可通过沉淀反应变为沉淀物而从水中除去.在水和生物体之间的生物化学交换中.二氧化碳占有独特地位.溶解的碳酸盐化合态与岩石圈.大气圈进行均相.多相的碳酸反应.对于调节天然水的pH和组成起着重要作用.地表水中的二氧化碳主要来源水和底质中有机物的分解.以及水生物的呼吸作用.亦可从空气中吸收.因此其含量可间接指示出水体遭受有机物污染的程度.2.有机污染综合指标及营养盐溶解氧天然水的溶解氧含量取决于水体与大气中氧的平衡.溶解氧的饱和含量和空气中氧的分压.大气压力.水温有密切关系.清洁地表水溶解氧一般接近饱和.由于藻类的生长.溶解氧可能过饱和.水体受有机.无机还原性物质污染时溶解氧降低.当大气中的氧来不及补充时.水中溶解氧逐渐降低.以至趋近于零.此时厌氧菌繁殖.水质恶化.导致鱼虾死亡.废水中溶解氧的含量取决于废水排出前的处理工艺过程.一般含量较低.差异很大.鱼类死亡事故多由于大量受纳污水.使水中耗氧性物质增多.溶解氧很低.造成鱼类窒息死亡.因此溶解氧是评价水质的重要指标之一.化学需氧量化学需氧量.是指在规定条件下.使水样中能被氧化的物质氧化所需耗用氧化剂的量.化化学需氧量反映了水中受还原性物质污染的程度.水中还原物质包括有机物.亚硝酸盐.亚铁盐.硫化物等.水被有机物污染是很普遍的.因此化学需氧量也作为有机物相对含量的指标之一.但只能反映能被氧化的有机物污染.不能反映多环芳烃.PCB.二恶英类等的污染状况.水样的化学需氧量.可由于加入氧化剂的种类及浓度.反应溶液的酸度.反应温度和时间.以及催化剂的有无而获得不同的结果.因此.化学需氧量亦是一个条件指标.对于污水.我国规定用重铬酸钾法.其测得的值称为化学需氧量.高锰酸盐指数高锰酸盐指数.是指在酸性或碱性介质中.以高锰酸钾为氧化剂.处理水样时所消耗的量.高锰酸盐指数和CODcr都被称为化学需氧量.只是在不同条件下测得的值.因此.高锰酸盐指数常被称为地表水体受有机物污染物和还原性无机物质污染程度的综合指标.生化需氧量生活污水与工业废水中含有大量各类有机物.当其污染水域后.这些有机物在水体中分解时要消耗大量溶解氧.从而破坏水体氧的平衡.使水质恶化.因缺氧造成鱼类及其它水生生物的死亡.水体中所含的有机物成分复杂.难以一一测定其成分.人们常常利用水中有机物在一定条件下所消耗的氧来间接表示水体中有机物的含量.生化需氧量即属于这类的重要指标之一.总有机碳(TOC) 总有机碳.是以碳的含量表示水体中有机物总量的综合指标.由于TOC的测定采用燃烧法.因此能将有机物全部氧化.它比BOD5或COD更能直接表示有机物的总量.因此常常被用来评价水体中有机物污染的程度.磷磷在地壳中的重量百分含量约为0.118%.磷在自然界都以各种磷酸盐的形式出现.磷存在于细胞.骨骼和牙齿中.是动植物和人体所必需的重要组成部分.正常时人每天需要从水和食物中补充1.4g磷.但都是以各种无机态磷酸盐或有机磷化合物形式吸收.磷以单质磷形式存在于水和废水中时.将对环境带来危害.黄磷是重要的化工原料.在其生产过程中.用水喷洗融炉的废气冷却后产生对环境危害极大的[磷毒水".这种污水含有大量可溶和悬浮态的元素磷.元素磷属剧毒物质.进入生物体内可引起急性中毒.人摄入的致死量为1mg/kg.因此.元素磷是一种不可忽视的污染物.总磷在天然水和废水中.磷几乎都以各种磷酸盐的形式存在.它们分为正磷酸盐.缩合磷酸盐(焦磷酸盐.偏磷酸盐和多磷酸盐)和有机结合的磷(如磷脂等).它们存在于溶液总.腐殖质粒子中或水生生物中.一般天然水中磷酸盐含量不高.化肥.冶炼.合成洗涤剂等行业的工业废水及生活污水中常含有较大量磷.磷是生物生长必需的元素之一.但水体中磷含量过高(如超过0.2mg/L).可造成藻类的过度繁殖.直至数量上达到有害的程度(称为富营养化).造成湖泊.河流透明度降低.水质变坏.磷是评价水质的重要指标.凯氏氮凯氏氮是指凯氏法测得的含量.它包括了氨氮和在此条件下能被转化为铵盐而测定的有机氮化合物.此类有机氮化合物主要是指蛋白质.氨基酸.核酸.尿素以及大量合成的.氮为负三价的有机氮化合物.它不包括叠氮化合物.联氮.偶氮.腙.硝酸盐.亚硝酸盐.硝基.亚硝基.腈.肟和半卡巴腙类的含氮化合物.由于一般水中存在的有机氮化合物多为前者.因此.在测定凯氏氮和氨氮后.其差值即称为有机氮.测定有机氮或凯氏氮.主要是为了了解水体受污染状况.尤其是在评价湖泊和水库的富营养化时.是一个有重要意义的指标.总氮大量生活污水.农田排水或含氮工业废水排入水体.使水中有机氮和各种无机氮化合物含量增加.生物和微生物的大量繁殖.消耗了水中溶解氧.使水体质量恶化.湖泊.水库中含有超标的氮.磷类物质时.造成浮游植物繁殖旺盛.出现富营养化状态.因此.总氮是衡量水质的重要指标之一.硝酸盐氮水中硝酸盐氮是在有氧环境下.亚硝氮.氨氮等各种形态的含氮化合物中最稳定的氮化合物.亦是含氮有机物经无机作用最终的分解产物.亚硝酸盐可经氧化而生成硝酸盐.硝酸盐在无氧环境中.亦可受微生物的作用而还原为亚硝酸盐.水中的硝酸盐氮含量相差悬殊.从数十微克/升至数十毫克/生.清洁的地下水含量很低.受污染的水体.以及一些深层地下水中含量较高.造革废水.酸洗废水.某些生化处理设施的出水和农田排水可含大量的硝酸盐.摄入硝酸盐或.经肠道中微生物作用转变成亚硝酸盐而出现中毒作用.水中硝酸盐氮含量达数十毫克/升时.可致婴儿中毒.亚硝酸盐氮亚硝酸盐氮是氮循环的中间产物.不稳定.根据水环境条件.可被氧化成硝酸盐.也可被还原成氨.亚硝酸盐可使人体正常的血红蛋白(低铁血红蛋白)氧化成为高铁血红蛋白.发生高铁血红蛋白症.失去血红蛋白在体内输送氧的能力.出现组织缺氧的症状.亚硝酸盐可与仲胺类反应生成具致癌性的亚硝胺类物质.在pH值较低的酸性条件下.有利于亚硝胺类的形成.氨氮氨氮以游离氨或铵盐形式存在于水中.两者的组成比取决于水的pH值和水温.当pH值偏高时.游离氨的比例较高.反之.则铵盐的比例高.水温则相反.水中的氨氮来源主要为生活污水中含氮有机物受微生物作用的分解产物.某些工业废水.如焦化废水和合成氨化肥厂等.以及农田排水.此外.在无氧环境中.水中存在的亚硝酸盐亦可受微生物作用.还原为氨.在有氧环境中.水中氨亦可转变为亚硝酸盐.甚至继续转变为硝酸盐.测定水中各种形态的氮化合物.有助于评价水体受污染和[自净"状况.鱼类对水中氨氮比较敏感.当氨氮含量高时会导致鱼类死亡。

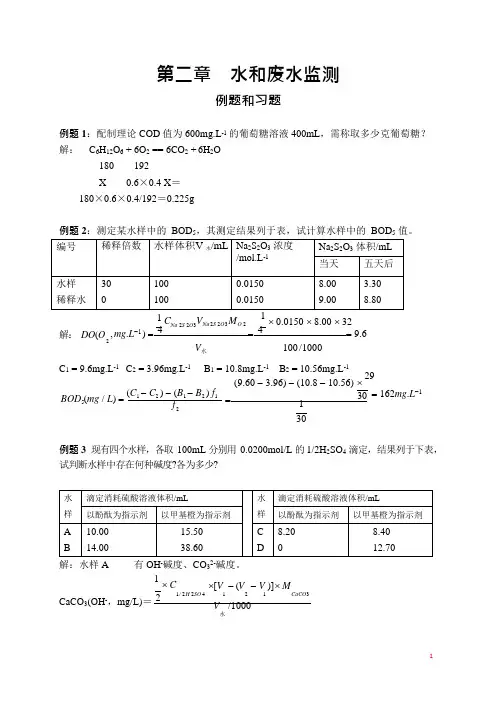
3 第二章 水和废水监测例题和习题例题 1:配制理论 COD 值为 600mg.L -1 的葡萄糖溶液 400mL ,需称取多少克葡萄糖? 解: C 6H 12O 6 + 6O 2 == 6CO 2 + 6H 2O180 192 X0.6×0.4 X =180×0.6×0.4/192=0.225g例题 2:测定某水样中的 BOD 5,其测定结果列于表,试计算水样中的 BOD 5 值。
1 C Na 2S 2O 3VN a 2S 2O 3 M O 2 ⨯ 0.0150 ⨯ 8.00 ⨯ 32 解: DO (O , mg .L -1 ) = 4= 4 = 9.6 V 水 100 /1000C 1 = 9.6mg.L -1 C 2 = 3.96mg.L -1B 1 = 10.8mg.L -1 B 2 = 10.56mg.L -1(9.60 - 3.96) - (10.8 - 10.56) ⨯ 29BOD (mg / L ) = (C 1 - C 2 ) - (B 1 - B 2 ) f 1 = 30 = 162mg .L -1 f 21 30例题 3 现有四个水样,各取 100mL 分别用 0.0200mol/L 的 1/2H 2SO 4 滴定,结果列于下表,试判断水样中存在何种碱度?各为多少?解:水样 A有 OH -碱度、CO 2-碱度。
1 ⨯ C ⨯[V - (V - V )]⨯ M CaCO 3(OH -,mg/L)=2 1 / 2 H 2SO 4 1 2 1 V /1000CaCO 3水2533 3 3 3 3 3 3 3 V 水 1⨯ 0.0200 ⨯[10.00 - (15.50 - 10.00)]⨯100 = 2 =45mg/L100 /1000CaCO (CO 2-,mg/L)= C 1 / 2 H 2SO 4⨯ (V 2 - V 1 ) ⨯ M CaCO 333 /1000 = 0.0200 ⨯ (15.50 - 10.00) ⨯100=110mg/L100 /1000 同理计算: 水样 B 有 CO 2-碱度、HCO 2-碱度。


常见水污染物检测方法教案设计一、教学目标1.理解水污染物的类型和来源;2.掌握水污染物的常见检测方法;3.能够了解水污染物检测的相关规范和标准;4.能够独立设计和执行水污染物检测实验。
二、教学内容1.水污染物的类别和来源;2.检测水质的方法:物理法、化学法、生物法等;3.检测污染物的常见参数:pH值、COD、BOD、氨氮等;4.检测污染物的标准和规范:国家标准GB 3838和行业标准等;5.实验设计及操作流程:样品处理方法、实验器材和仪器操作等。
三、教学方法1.讲授方法:采用幻灯片和多媒体资料辅助讲解教学内容;2.实验演示法:给学生示范,引导学生掌握实验操作技能;3.交互式教学法:通过问答、讨论等形式,加强师生互动;4.实验操作法:学生独立进行实验,掌握实验操作流程和技能。
四、教学评价1.课后作业:要求学生认真复习教学内容,完成相关作业;2.实验成果报告:学生自主完成实验并编写实验报告,要求按照标准格式撰写;3.期末考试:综合测试学生对本课程的掌握程度和运用能力。
五、课时安排1.第一节课:水污染物的类别和来源,常见污染物参数;2.第二节课:水污染物的检测方法和相关规范和标准;3.第三节课:实验操作流程和技能讲解;4.第四节课:学生进行实验操作,老师现场指导;5.第五节课:实验成果报告撰写指导和课堂讨论。
六、教学效果1.提高学生对水污染物检测的理解和认识,增强环保意识;2.掌握了水污染物检测的相关知识和技能;3.提高了学生科学实验的能力和实践操作能力;4.在期末考试中得到了满意的成绩,反映了教学效果良好。
七、教学反思1.教学内容全面、实用性强,符合时代发展需求;2.实验器材和仪器设备需更新和完善;3.学生实验操作中出现了一些问题,需要进行及时指导;4.教学反思后,将继续优化课程内容和教学方法,提高教学效果和质量。

常见饮用水污染物的检测与分析近年来随着水资源的日益紧缺以及水污染的日益加重,普通百姓对于我们每天饮用的水越来越关注,水质问题已经成为我们社会发展的重要问题之一。
而作为普通百姓,我们需要了解的就是饮用水中可能存在的污染物和相关的检测方法,这对我们的健康有着至关重要的作用。
一、常见饮用水污染物分类和来源饮用水中可能存在的污染物非常广泛,其来源也千差万别,但目前依然有一些被认为比较常见的几类污染物:1、有机物污染物有机物污染物主要来源于生活垃圾和农业、畜牧业等生产生活活动中排放的废水。
这类污染物通常包括有机氯化合物、有机氟化合物、溶解性有机物和挥发性有机物等。
由于多数有机物难以分解,所以这类污染物特别危害饮用水的安全性。
2、无机盐污染物无机盐污染物通常来自于地下水和地表水中的饱和性化合物,如硝酸盐、硫酸盐等。
此外,在煤矿、冶金和纺织等工业中,还可能生成一定量的重金属离子,如铵、铜等金属离子。
3、微生物污染物这类污染物主要来源于化粪池、下水道等排水系统。
在大多数地区,生活污水的处理能力严重不足,一般来讲很多污水会通过自然力量进入到水源里面,导致水源污染。
较常见的微生物污染物有细菌、病毒、寄生虫和霉菌等。
二、饮用水污染物的检测方法为了确保饮用水的安全,我们需要及时地对饮用水污染物进行检测和分析,而检测的方法也因污染物种类不同而有所不同。
以下是一些常见污染物的检测方法:1、有机物污染物检测方法为了检测有机物污染物的存在,通常需要使用气相色谱法、液相色谱法等技术。
这些技术可以对化合物的成分进行检测和分析,但是由于技术原因,检测费用相对较高。
2、无机盐污染物检测方法其中包括了一些维生素或矿物质类物质、化学化合物等,可以通过颜色、气味和味道来判断检测结果。
此外,高效液相色谱法等技术也可以进行测试。
3、微生物污染物检测方法为了检测微生物污染物的存在,可以通过统计学方法、细胞培养法等技术进行检测。
细胞培养法可以进行特定微生物数量的检测,而统计学方法则可以对大量微生物的数量进行检测和分析。

简析水样中有机污染物的测定摘要:水中有机物已成为我国水体的主要污染物之一,严重威胁着人类的生活和健康。
所以如何精准的测定有机物是去除有机物的前提和关键。
关键词:水中有机物;有机物测定;有机物危害引言水中的有机污染物已经成为我国水体的主要污染物之一。
水中有机物分为两部分,一部分来自于自然环境,比如:森林草原地区经常会存在天然的有机化合物——腐殖酸;另一部分则是来自于人类活动当中,比如污水的排放、垃圾渗滤液以及各种农药的使用。
1水中有机物的危害天然的有机物质如腐殖酸在水中可与消毒剂中的氯反应,产生——三氯甲烷(致癌物质)等。
同时,持久性化学物、内分泌干扰物以及保健药物、各类药品、化妆品等合成有机物,在自然界中难以降解,对人类生长、生殖、影响人类激素、降低免疫力,甚至严重的会干扰神经系统,从而影响人类行为导致失控。
就目前的自来水处理技术而言,难以对残留在水中的有机物进行去除,很有可能会随着饮用水进入人体或动物体内,造成不好的结果和影响。
2水中有机物的类别水中有机物主要分为两类,一类是挥发性有机污染物(VOCs),另一类是半挥发性有机污染物(SVOCs)。
挥发性有机污染物指的是室温下饱和蒸气压超过133.32Pa,沸点在25-50℃,以蒸气形式存在空气中的一类有机物。
学者按照其化学结构的不同,分为烷烃类、芳烃类、烯烃类、卤代烃类、酯类、醛类、酮类和其他。
这类物质通常具有毒性,对人体危害大。
半挥发性有机物指的是13.3-10.5Pa,沸点在170-350℃,在气相和空气中的固相颗粒物之间形成一定的平衡。
它主要包含二恶英类、多环芳烃、有机农药类、氯代苯类、多氯联苯类、吡啶类、喹啉类、硝基苯类、邻苯二甲酸酯类、亚硝基胺类、苯胺类、苯酚类、多氯萘类和多溴联苯类等化合物。
这些有机化合物在环境空气中主要以气态或者气溶胶两种形态存在。
这类化合物会造成人体的慢性中毒,引起癌症,会直接影响到生殖和中枢神经系统,甚至死亡。

常见的水中有机污染物(COD)测定方法:
(1)重铬酸钾法:
实验试剂:硫酸银—硫酸溶液,重铬酸钾标准溶液,硫酸亚铁铵标准溶液,苯二甲酸氢钾标准溶液,1,10–菲绕啉指示剂溶液,试亚铁灵指示剂等。
在水样中加入已知量的重铬酸钾溶液,并在强酸介质下以银盐作催化剂,经沸腾回流后,以试亚铁灵为指示剂,用硫酸亚铁铵滴定水样中未被还原的重铬酸钾,由消耗的硫酸亚铁铵的量换算成消耗氧的质量浓度。
(2)高锰酸盐指数:
1.定义:高锰酸盐指数指以高锰酸钾溶液为氧化剂测得的化学耗氧量,该指数常被作为反映地表水受有机物和还原性无机物污染程度的综合指标。
2.酸性高锰酸钾法:
酸性介质中,水样中加入一定量的高锰酸钾溶液,并在沸水浴上加热反应,剩余的高锰酸钾用过量的草酸钠还原,再用高锰酸钾溶液回滴过量的草酸钠,通过计算求出高锰酸盐指数值。
3.碱性高锰酸钾法:
与上述过程基本一致,将使用硫酸的地方换成用50%氢氧化钠溶液0.5mL即可。
碱性条件下,高锰酸钾的氧化能力弱,此时不能氧化水中的氯离子。
注意:无论是高锰酸钾法还是重铬酸钾法测定的都是水样中的还原性物质,但并没有完全氧化水中所有的还原性物质,所以只是一个参考值,而且二者没有明显的相关。
乳化液废水处理节能环保高效清洗 13年品牌,循环过滤,污水处理药剂。
根据文中提到的有机污染物为您推荐
乳化液废水处理方案。
选择产品品质,优化处理工艺。
推荐性价比高,经久耐用,一键去油滤杂。
除臭杀菌,切削液乳化液废液回收,循环利用,特种污水处理。
水体中污染物的分析与检测方法料:光学检测技术、电子检测技术、质谱检测技术等。
本文将就水体中污染物的分析与检测方法作一阐述。
一、光学检测技术光学检测技术是指应用光学理论的方法对水体中存在的污染物进行检测的技术手段。
此种技术相对比较简单、直观和易操作,被广泛应用。
其中,UV(紫外线)分光光度法、色度法和荧光法是应用较多的光学检测技术。
1. UV分光光度法利用水体中溶解有机物对紫外光谱的吸收作用进行检测污染物。
紫外区吸收曲线的变化量与水中污染物的浓度成正相关。
此种技术需要先制备提取液,将水体中污染物提取到有机溶剂中,再进行紫外测定。
UV分光光度法简单、灵敏度高、快捷,因此常被运用于水体中有机污染物的检测。
但是,此检测技术仅能检测紫外吸收较强的有机物,对一些低浓度有机物和无机污染物的检测效果较差,且需要大量溶液制备和消耗环境大量有机试剂。
2. 色度法色度法是指利用污染物造成水体颜色发生变化的工艺。
污染物含有不同颜色的化合物,通过测量颜色深度以计算污染物质量浓度的方法。
此技术迅速、方便、适合于在现场进行检测。
因此,特别是在对水中有色溶解物质的检测具有效应用。
3. 荧光法荧光法是利用污染物吸收光子后发出的发射光来检测污染物质的一种方法。
荧光法可以通过污染物的特定扫描,对特定污染物进行高灵敏度的检测,尤其是有机污染物的检测。
荧光法采用的荧光物质零散,而且在实验过程中有一定的操作难度,自然条件对荧光物质具有影响,因此有一偏强的专业性。
荧光法是一种广泛应用于液体、气体、固体等领域的技术。
二、电子检测技术电子检测技术是通过检测污染物在电子电势趋势下的变化来检测污染物的技术手段。
包括电导率检测法、电化学检测法、荧光检测法、接头检测法等。
1. 电导率检测法电导率检测法是利用水体中离子等质量导电的特性,在浓度相同溶液中,电导率具有可比性。
通过检测水体电导率,计算所含离子浓度以及污染物含量等参数。
电导率检测法可以便捷、稍有成本,且能够实时反映水体的水质状况。
水质化验基础知识目录第一章水污染基础知识 (1)一、污染物与污染指标 (1)二、污水水质指标、污泥指标代码及含义 (1)第二章化验基础知识 (1)第一节化验仪器及其它 (1)一、常用化验器皿的材质 (1)二、常用化验器皿的用途 (2)三、玻璃器皿的清洗 (2)四、洗涤液的配制与使用 (2)五、玻璃仪器的干燥 (3)六、玻璃仪器的使用和保管 (3)七、试液的使用与保存 (3)第二节常用仪器的操作 (3)一、滴定管的使用 (3)二、移液管和吸量管(通称吸管)的使用 (5)三、容量瓶的使用 (5)四、干燥器的使用 (6)五、托盘天平的使用 (6)第三节一般试液浓度的表示方法 (6)第四节质量控制和数据处理 (7)一、分析化学中的误差 (7)二、有效数字及运算规则 (7)第五节化验操作常规及事故预防处理 (7)一、化验试剂的操作常规 (7)二、实验室安全常识及常规事故处理 (8)第六节水样的采集、保存及材质的选择 (9)一、水样的采集 (9)二、水样保存 (9)三、容器材质的选择 (9)第七节污水处理站采样点和监测项目 (9)第三章水质监测分析方法 (9)一、化学需氧量(COD) (9)二、五日生化需氧量(BOD) (11)三、氨氮(NH3-N) (14)四、溶解氧(DO) (18)五、悬浮物(SS) (20)六、PH的测定 (20)七、污泥水分的测定 (21)八、碱度 (21)1第一章水污染基础知识一、污染物与污染指标废水中的污染物种类繁多,根据对环境造成污染危险的不同,废水中的污染物大致可分为以下几个类别:固体污染物、需氧污染物、毒性污染物、营养污染物、生物污染物、感官污染物、酸碱污染物、油类污染物、热污染物及其它污染物等。
除PH、温度、细菌总数及大肠菌群、臭味及色度、浊度、放射性物质外,其余污染物指标的单位均用mg/l。
二、污水水质指标、污泥指标代码及含义1、BOD 生化需氧量:水中有机污染物被好氧微生物分解时所需的氧量称为生化需氧量(以mg/L为单位)。