美国FDA药物审批PPT
- 格式:ppt
- 大小:287.50 KB
- 文档页数:37


FDA新药审批流程简述FDA(美国食品药品监督管理局)负责监管并审批新药的上市。
下面将对FDA新药审批流程进行简述。
1.阶段Ⅰ临床试验:新药首先在健康志愿者身上进行,评估药物的安全性和耐受性,并确定药物的剂量范围。
2.阶段Ⅱ临床试验:新药在患者身上进行,评估药物的疗效和副作用。
试验时间较长,研究人员需要收集更多的数据,以确定新药的安全性和效力。
3.阶段Ⅲ临床试验:新药在大规模患者群体身上进行,以证明其疗效和安全性是否持久有效,并与现有的治疗方法进行比较。
4.新药申请:药企将试验结果提交给FDA,并申请新药上市批准。
包括药物的数据和试验结果,使用方法等。
FDA会评估申请材料。
5.NDA审批:NDA(新药申请)包括对药物研究的细节、试验结果等的描述。
FDA对NDA进行评估,确定药物是否符合上市标准。
此过程可能需要数月或数年。
6.审查:FDA将药物进行详细审查,并与药企进行沟通,以充分了解药物的性质和潜在的风险。
7.审查会议:FDA可能会召开药物审查会议,邀请专家、学者和公众就药物的疗效和风险发表意见。
8.确认上市:如果FDA认为新药符合上市标准,将发出批准通知,允许药企将新药投入市场销售。
以上是FDA新药审批流程的简要概述。
在流程中,FDA扮演着保障公众健康和安全的角色,确保新上市的药物是安全有效的。
FDA New Drug Approval Process OverviewThe FDA (U.S. Food and Drug Administration) is responsible for regulating and approving new drugs for market. The following is an overview of the FDA's new drug approval process.1. Phase I Clinical Trials: The new drug is first tested on healthy volunteers to assess its safety and tolerability and determine the dosage range.5. NDA Approval: The NDA (New Drug Application) includes a detailed description of the drug's research, trial results, etc. The FDA evaluates the NDA to determine if the drug meets the approval standards. This process can take months or years.7. Review Meetings: The FDA may hold drug review meetings where experts, scholars, and the public are invited to provide opinions on the drug's efficacy and risks.9. Post-Market Surveillance: The FDA continues to monitor the drug's safety and effectiveness, collects feedback from the market, and takes necessary actions, including further research and updating warning labels.The above is a brief overview of the FDA's new drug approval process. Throughout the process, the FDA plays a crucial role insafeguarding public health and safety, ensuring that newly marketed drugs are safe and effective.。

FDA新药审批流程简述FDA(美国食品药品监督管理局)是负责监督和管理美国食品和药品安全的联邦机构。
它负责确保市场上的药品是安全有效的,并且符合严格的审批标准。
新药审批是FDA的主要职责之一,它是一个复杂且漫长的过程,通常包括以下几个步骤:1.提交新药申请(NDA)首先,药物制造商需要通过NDA向FDA提交有关新药的完整资料。
这些资料通常包括药物的化学成分、制造工艺、药理学研究、临床试验数据以及用于治疗的适应症等信息。
此外,还需要提供药物的质量、安全和有效性的证据。
2.评估申请文件一旦FDA收到NDA,会对申请文件进行评估。
这个过程通常包括对文件的完整性和合规性的审查,例如核实所有必需的资料是否齐全。
如果缺少必要的信息,FDA可能会要求制造商提供补充材料。
3.优先审批对于一些药物,FDA可能会给予优先审批待遇。
例如,对于治疗一些严重疾病的新药,FDA可能会加快审批速度,以符合患者的迫切需求。
4.临床试验阶段一旦FDA确认NDA文件完整无误,药物制造商可以开展临床试验。
临床试验是评估药物疗效和安全性的关键步骤,通常分为三个阶段(I、II、III)。
这些试验需要遵守严格的方案和伦理规定,以确保患者的安全和药物的有效性。
5.申请审核委员会的审查在临床试验结束后,药物制造商将向FDA提交试验结果,并要求FDA审核审查委员会对其进行审查。
审查委员会是由FDA专家组成的独立机构,他们会仔细评估试验结果以及相关数据和文献,并发表意见。
这些意见对于FDA的最终决策具有重要影响。
6.申请批准在经过临床试验和审查后,FDA将根据收集到的数据和顾问委员会的意见,决定是否批准新药上市。
如果FDA认为药物的风险和益处之间的平衡是积极的,它将批准新药,并颁发批准证书。
7.监督上市后安全性一旦新药获得批准,FDA对其进行监督,以确保其安全性和真实性。
制造商需要持续向FDA提供有关药物的安全性和有效性的信息。
此外,FDA还通过药物安全盛会进行监测,并与制造商和医疗专业人员合作,收集和分析有关药物的副作用和其他安全问题的信息。


药品及生物制品的分析方法和方法验证指导原则目录1.介绍...................... (1)2.背景..................... .. (2)3.分析方法开发. ..................... . (3)4.分析程序内容.............................................. ......... ..................................... .. 3A.原则/范围 (4)B.仪器/设备............................................. . (4)C.操作参数.............................................. .. (4)D.试剂/标准............................................. . (4)E.样品制备.............................................. .. (4)F.标准对照品溶液的制备............................................ .. (5)G.步骤......... ....................................... (5)H.系统适应性..... (5)I.计算 (5)J.数据报告 (5)5.参考标准和教材............................................ (6)6分析方法验证用于新药,仿制药,生物制品和DMF (6)A.非药典分析方法............................................. (6)B.验证特征 (7)C.药典分析方法............................................. .. (8)7.统计分析和模型 (8)A.统计 (8)B.模型 (8)8.生命周期管理分析程序 (9)A.重新验证 (9)B.分析方法的可比性研究............................................ . (10)1.另一种分析方法............................................... .. (10)2.分析方法转移的研究 (11)C.报告上市后变更已批准的新药,仿制药,或生物制品 (11)9.美国FDA方法验证............................................... . (12)10.参考文献前言本指导原则草案,定稿后,将代表美国食品和药物管理局(FDA)目前关于这个话题目前的想法。



FDA新药审批流程美国的新药审批可以说是世界上最严格和规范的,作为一个公司通常需要花费5亿美元资金,用 12到15年的时间才能将一个新药从试验室走入市场。
在5000个临床前化合物中大约只有5个化合物可以进入临床试验(Clinical Trials),而这5个化合物中只有一个才能被批准用于临床治疗病人,成为真正的药物。
从一个实验室发现的新化合物发展成为一个治疗疾病的药物,需要经过如下开发阶段:一、临床前试验将一个新发现的化合物经过实验室和动物试验,证明该化合物针对特定目标疾病具有生物活性,并且要评估该化合物的安全性。
二、新药临床研究申请当一个化合物通过了临床前试验后,需要向FDA提交新药临床研究申请,以便可以将该化合物应用于人体试验。
如果在提交申请后30天内FDA没有驳回申请,那么该新药临床研究申请即被视为有效,可以进行人体试验。
新药临床研究申请需要提供先前试验的材料;以及计划将在什么地方,由谁以及如何进行临床试验的说明;新化合物的结构;投药方式;动物试验中发现的所有毒性情况;该化合物的制造生产情况。
所有临床方案必须经过机构审评委员会(Institutional Revuew Board,IRB)的审查和通过。
每年必须向FDA 和IRB 汇报一次临床试验的进程和结果。
三、一期临床试验这一阶段的临床试验一般需要征集20-100名正常和健康的志愿者进行试验研究。
试验的主要目的是提供该药物的安全性资料,包括该药物的安全剂量范围。
同时也要通过这一阶段的临床试验获得其吸收、分布、代谢和排泄以及药效持续时间的数据和资料。
四、二期临床试验这一期的临床试验通常需要征集100-500名相关病人进行试验。
其主要目的是获得药物治疗有效性资料。
五、三期临床试验这一期的临床试验通常需1000-5000名临床和住院病人,多在多个医学中心进行,在医生的严格监控下,进一步获得该药物的有效性资料和鉴定副作用,以及与其他药物的相互作用关系。

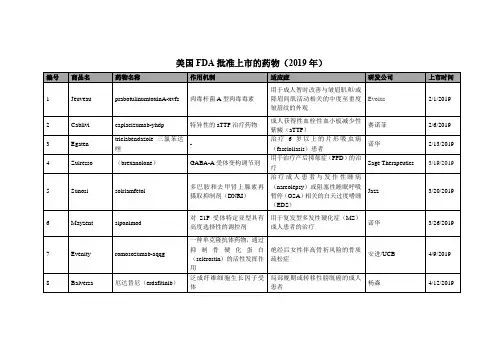
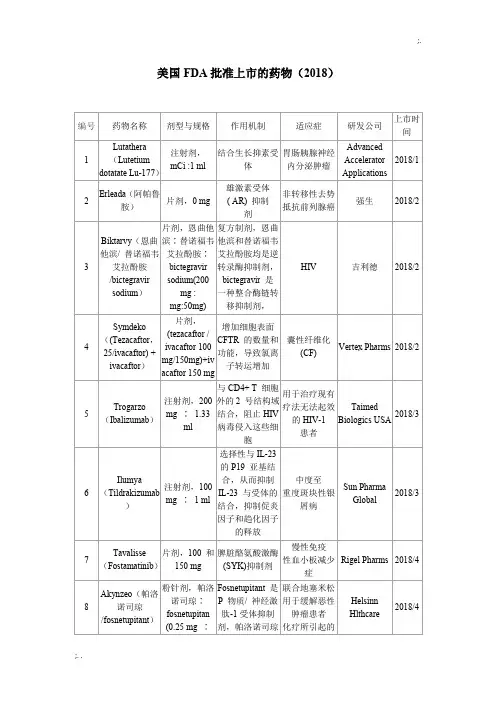
美国食品和药物管理局(FDA)批准上市的靶向抗肿瘤药物---表1 FDA批准的单抗药物名称靶点获批适应症/获批时间Rituximab(Mabthera)利妥昔单抗美罗华CD20非霍奇金淋巴瘤/1997年Trastuzumab(Herceptin)曲妥珠单抗(赫赛汀)HER2(ERBB2/neu)乳腺癌/1998年胃癌/2010年Bevacizumab(Avastin)贝伐珠单抗(安维汀)VEGF结直肠癌/2004年非小细胞肺癌/2006年肾癌/2009年脑癌/2009年Cetuximab(Erbitux)西妥昔单抗(爱必妥)EGFR(HER1/ERBB1)头颈部鳞状细胞癌/2006年KRAS野生型结直肠癌/2009年Panitumumab(Vectibix)帕尼单抗(维克替比)EGFR(HER1/ERBB1)KRAS野生型结直肠癌/2006年Ipilimumab(Yervoy)CTLA-4黑素瘤/2011年Obinutuzumab(Gazyva)CD20慢性淋巴细胞白血病/2013年Ado-trastuzumabemtansine(Kadcyla)/T-DM1HER2 (ERBB2/neu)HER2阳性的晚期(转移性)乳腺癌/2013年Ramucirumab(Cyramza)VEGF晚期胃癌或胃食管连接部腺癌收起表2 FDA批准的小分子靶向抗肿瘤药物名称靶点获批适应症/获批时间Imatinib(Gleevec)伊马替尼(格列卫)KIT,PDGFR,ABL多种恶性血液病/2001年胃肠道间质肿瘤/2002年Gefitinib(Iressa)吉非替尼(易瑞沙)EGFR非小细胞肺癌/2003年Erlotinib (Tarceva)厄洛替尼(特罗凯)EGFR (HER1/ERBB1)非小细胞肺癌/2004年胰腺癌/2005年Crizotinib克唑替尼(赛可瑞)ALK, METALK阳性的非小细胞肺癌/2011年Bosutinib(Bosulif)博舒替尼ABL慢性髓细胞白血病/2012年Cabozantinib (Cometriq)卡博替尼FLT3, KIT, MET, RET, VEGFR2 甲状腺髓样癌/2012年Axitinib(Inlyta)阿昔替尼KIT, PDGFRβ, VEGFR1/2/3肾癌/2012年Dasatinib(Sprycel)达沙替尼(施达赛)ABL慢性髓细胞性白血病/2006年急性淋巴细胞白血病/2006年Sorafenib(Nexavar)索拉非尼(多吉美)VEGFR, PDGFR, KIT, RAF肾癌/ 2005年肝癌/2007年甲状腺癌/2013年Sunitinib(Sutent)舒尼替尼(索坦)VEGFR, PDGFR, KIT, RET胃肠道间质肿瘤/2006年肾癌/2006年胰腺神经内分泌肿瘤/2011年Lapatinib(Tykerb)(泰立沙)HER2 (ERBB2/neu), EGFR (HER1/ERBB1)HER2阳性乳腺癌/2007年Nilotinib(Tasigna)尼洛替尼(达希纳)ABL慢性髓细胞性白血病/2007年Temsirolimus (Torisel)替西罗莫司mTOR肾癌/2007年Everolimus (Afinitor)依维莫司(飞尼妥)mTOR肾癌/2009年肾移植后预防器官排斥/2010年室管膜下巨细胞星形细胞瘤与结节性硬化症/2010年胰腺神经内分泌肿瘤/2011年与依西美坦联用治疗乳腺癌/2012年肝脏移植手术后预防器官排斥/2013年Pazopanib(Votrient)帕唑帕尼VEGFR, PDGFR, KIT肾癌/2009年Ponatinib(Iclusig)ABL, FGFR1-3, FLT3, VEGFR2慢性髓细胞性白血病/2012年急性淋巴细胞白血病/2012年Regorafenib (Stivarga)瑞戈非尼KIT, PDGFRβ, RAF, RET, VEGFR1/2/3结直肠癌/2012年胃肠道间质瘤/2013年Ruxolitinib(Jakafi)JAK1/2骨髓纤维化/2011年Tofacitinib托法替尼JAK3风湿性关节炎/2012年Vandetanib (Caprelsa)凡德他尼EGFR (HER1/ERBB1), RET, VEGFR2 甲状腺髓样癌/2011年Vemurafenib (Zelboraf)维罗非尼BRAFBRAF V600突变的黑素瘤/2011年Dabrafenib(Tafinlar)达拉非尼BRAFBRAF V600突变的黑素瘤/2013年Trametinib(Mekinist)曲美替尼MEK1,MEK2BRAF V600突变的黑素瘤/2013年Afatinib(Gilotrif)阿法替尼EGFR,HER2非小细胞肺癌/2013年Ibrutinib(Imbruvica)依鲁替尼BTK套细胞淋巴瘤/2013年慢性淋巴细胞白血病/2014年。
中美药品注册审批制度比较研究随着全球医药产业的快速发展,药品注册审批制度在各国药品监管体系中的地位日益重要。
中美两国作为全球最大的药品市场之一,其药品注册审批制度对药品研发、生产和上市具有重大影响。
本文旨在比较中美药品注册审批制度的异同,探讨其影响,为完善我国药品注册审批制度提供借鉴和参考。
国内外学者针对中美药品注册审批制度进行了一系列研究。
这些研究主要集中在制度框架、审批流程、监管机构等方面。
然而,大多数研究仅某一方面的比较,缺乏对整体框架和最新改革的系统分析。
中美药品注册审批制度在申请要求方面存在一定差异。
美国食品药品监督管理局(FDA)对药品申请人的资格没有特殊要求,但申请人需提交完备的技术资料、临床试验报告等相关文件。
而中国药品审评中心(CDE)则对申请人资格有严格的规定,同时要求申请人提交相关证明文件和临床试验报告等资料。
美国FDA的药品审批流程包括申请、审评、审批、上市后监测等多个环节。
在审评环节,FDA采用科学、公开、透明的审评标准,对药品的安全性、有效性和质量进行全面评估。
而中国CDE的药品审批流程相对简单,主要包括申请、审评、审批三个环节,但在审批环节中缺乏明确的审评标准和公开透明的机制。
美国药品注册审批制度由FDA负责,其独立于政府其他部门,具有较高的权威性和专业性。
中国药品注册审批制度则由CDE负责,隶属于国家药品监督管理局,独立性相对较低。
中美药品注册审批制度的差异对两国药品产业的发展产生了一定影响。
美国药品注册审批制度在促进新药创新、保障药品质量和安全方面具有显著优势,而中国药品注册审批制度在简化程序、提高审评效率方面具有一定优势。
然而,两国制度也存在一些问题,例如审批流程繁琐、监管机构独立性不足等。
为完善我国药品注册审批制度,可采取以下对策:完善相关法律法规,加大对药品产业的扶持力度,鼓励药品创新。
本文比较了中美药品注册审批制度的异同,发现两国在申请要求、审批流程和监管机构方面存在一定差异。