2021届高三化学一轮复习——氯、溴、碘的制备与性质(知识梳理及训练)
- 格式:docx
- 大小:350.47 KB
- 文档页数:9


2024年新人教版高考化学一轮复习讲义(新高考版)第21讲卤族元素 溴、碘单质的提取复习目标1.掌握卤素单质的性质及卤素离子的检验。
2.掌握卤素单质的提取。
内容索引考点一 卤素单质的性质及X-的检验考点二 从海水资源中提取卤素单质真题演练 明确考向课时精练><卤素单质的性质及X-的检验1.卤族元素卤族元素又称卤素,位于元素周期表的第ⅦA 族,价电子排布为n s 2n p 5。
必备知识2.溴、碘单质物理性质比较性质Br 2I 2颜色色 色状态液体_____溶解性①在水中溶解度不大;②易溶于有机溶剂 特性易 、有毒①易;②使淀粉溶液______深红棕紫黑固体挥发升华变蓝3.氯、溴、碘单质化学性质比较与水反应X2+H2O ___________氯、溴、碘与水反应由到____与碱反应(NaOH)2NaOH+X2===____________________氧化性①Cl2 Br2 I2,还原性:Cl- Br- I-;②氯、溴、碘与氢气化合由到;③I2与Fe反应只生成FeI2,其他卤素单质可将Fe氧化为+3价HX+HXO易难NaX+NaXO+H2O>><<易难4.氟的特殊性(1)氟无正化合价。
2H2O+2F2===4HF+O2(2)F2能与水反应放出O2,化学方程式:_______________________。
(3)在HX中,HF的熔、沸点最高,氢氟酸是弱酸,能腐蚀玻璃。
5.卤素离子的检验方法(1)AgNO 3溶液——沉淀法色沉淀,则有Cl -色沉淀,则有Br -色沉淀,则有I -白浅黄黄(2)置换——萃取法有机层呈红棕色或橙红色,表明有______紫色、浅紫色或紫红色,表明有___Br -I -(3)氧化——淀粉法检验I-蓝色溶液,表明有I-鉴别NaCl 溶液、NaBr 溶液、NaI 溶液可以选用的试剂是(填序号)。
①碘水、淀粉溶液 ②氯水、CCl 4 ③溴水、苯 ④硝酸、AgNO 3溶液 ⑤氯水、苯 ⑥CCl 4、淀粉溶液应用举例②④⑤1.卤素气态氢化物的水溶液都是强酸溶液( )2.浓H 2SO 4能干燥HCl ,所以浓硫酸也能干燥HBr( )3.加碘盐能使淀粉变蓝( )4.清洗碘升华实验所用试管的操作是先用酒精清洗,再用水清洗( )5.液溴易挥发,在存放液溴的试剂瓶中应加水封( )6.用加热的方法可将NaHCO 3中混有的少量碘除去( )7.可用F 2与NaCl 溶液反应产生Cl 2,检证F 2的氧化性大于Cl 2()×√×××√×1.某小组用如图所示装置比较氯、溴、碘单质的氧化性强弱(夹持仪器已略去,气密性已检查)。

高三化学一轮复习——氯溴碘的综合复习 核心知识梳理 1.卤素单质性质的相似性 (1)都能与大多数金属反应,如2Fe +3Br 2===2FeBr 3,但I 2与Fe 反应生成FeI 2。
(2)都能与H 2反应生成HX :X 2+H 2===2HX(X 代表Cl 、Br 、I ,下同)。
(3)都能与水反应:X 2+H 2O HX +HXO(F 2例外)。
(4)都能与碱溶液反应:X 2+2NaOH===NaX +NaXO +H 2O(F 2例外)。
2.卤素单质的递变性颜色―――――――――――――――――→F 2淡黄绿色 Cl 2黄绿色 Br 2深红棕色 I 2紫黑色逐渐加深熔、沸点―――――――――――→ 气体 气体 液体 固体 逐渐升高密度―――――――――→逐渐增大氧化性―――――――――→与H 2化合由易到难逐渐减弱还原性(X -)―――――――――→逐渐增强3.卤素单质的特殊性(1)Br 2是常温下唯一呈液态的非金属单质;液溴易挥发且有毒,通常用水液封保存。
(2)I 2易升华,淀粉遇I 2变蓝。
(3)Br 2和I 2都可被某些有机溶剂(如四氯化碳、苯)萃取。
(4)F 无正价,F 2与水剧烈反应:2F 2+2H 2O===4HF +O 2。
4.卤素离子的检验方法(1)AgNO 3溶液——沉淀法未知液―――――――――――――――→滴加AgNO 3溶液和稀硝酸生成⎩⎪⎨⎪⎧ 白色沉淀,则有Cl -淡黄色沉淀,则有Br-黄色沉淀,则有I -(2)置换——萃取法未知液―――――――――→加适量新制饱和氯水振荡――――――――――――→加入CCl 4(下层)或汽油(上层)振荡有机层呈⎩⎪⎨⎪⎧红棕色或橙红色,表明有Br -紫色、浅紫色或紫红色,表明有I - (3)氧化——淀粉法检验I -未知液――――――――――――――→加入适量新制饱和氯水(或双氧水)振荡―――→淀粉溶液振荡蓝色溶液,表明有I - 问题拓展(1)氰[(CN)2]的结构简式为N ≡C—C ≡N ,其化学性质与卤素(X 2)很相似,化学上称之为拟卤素,其氧化性介于Br 2和I 2之间。

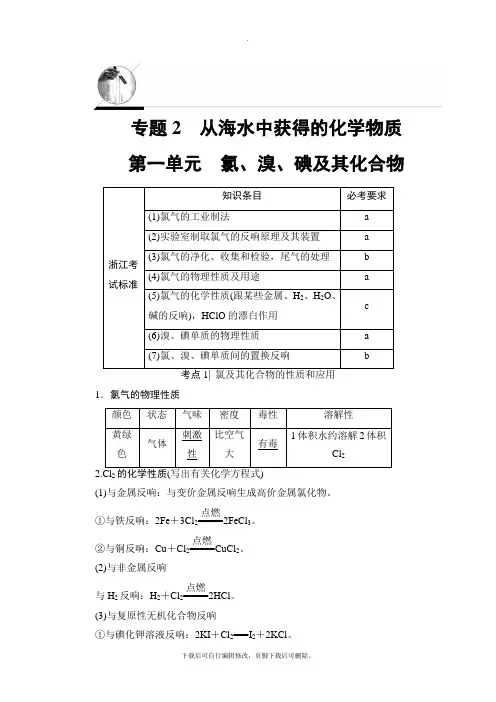
专题2 从海水中获得的化学物质 第一单元 氯、溴、碘及其化合物浙江考试标准知识条目必考要求(1)氯气的工业制法a (2)实验室制取氯气的反响原理及其装置a (3)氯气的净化、收集和检验,尾气的处理b (4)氯气的物理性质及用途a (5)氯气的化学性质(跟某些金属、H 2、H 2O 、碱的反响),HClO 的漂白作用 c (6)溴、碘单质的物理性质 a (7)氯、溴、碘单质间的置换反响b1.氯气的物理性质颜色 状态 气味 密度 毒性 溶解性黄绿色气体刺激性比空气大有毒1体积水约溶解2体积Cl 22(1)与金属反响:与变价金属反响生成高价金属氯化物。
①与铁反响:2Fe +3Cl 2=====点燃2FeCl 3。
②与铜反响:Cu +Cl 2=====点燃CuCl 2。
(2)与非金属反响与H 2反响:H 2+Cl 2=====点燃2HCl 。
(3)与复原性无机化合物反响①与碘化钾溶液反响:2KI +Cl 2===I 2+2KCl 。
②与SO 2水溶液反响:Cl 2+SO 2+2H 2O===H 2SO 4+2HCl 。
③与FeCl 2溶液反响:离子方程式为2Fe 2++Cl 2===2Fe 3++2Cl -。
(4)与水反响:溶于水的氯气局部与水反响。
离子方程式为Cl 2+H 2OH ++Cl -+HClO 。
新制氯水中含有的粒子有H 2O 、Cl 2、HClO 、H +、Cl -、ClO -、OH -。
(5)与碱反响:与NaOH 溶液反响。
离子方程式为Cl 2+2OH -===Cl -+ClO -+H 2O 。
3.次氯酸和次氯酸盐的性质 (1)次氯酸(2)漂白液和漂白粉①漂白液和84消毒液的有效成分均为NaClO ,其漂白原理为:漂白液与酸性物质反响生成HClO 。
②漂白粉的主要成分为Ca(ClO)2和CaCl 2,其有效成分为Ca(ClO)2,其中Ca(ClO)2水解使溶液呈碱性,其水解离子方程式为ClO -+H 2O HClO +OH -。



氯、溴、碘及其化合物知识点总结一、氯气的性质1、实验室制法(1)反应原理:MnO 2+4HCl (浓)上=MnCl 2+C121+2H 2O(2)除杂气体:制得的氯气中有氯化氢杂质,常用饱和食盐水洗气。
有时要制得干燥的氯气,可以用浓硫酸洗气来除去水蒸气。
(3)收集方法:氯气可以用向上排空气法或排饱和食盐水法收集。
(4)尾气吸收:氯气有毒,有毒气体必须加以吸收,防止污染空气。
一般用氢氧化钠溶液吸收多余的氯气:Cl 2+2NaOH^=NaCl +NaClO +H 2O2、氯气的性质1. 物理性质通常情况下氯气是呈黄绿色的气体,密度比空气大,有刺激性气味,有毒,易液化, 能溶于水(在常温下1体积水约溶解2体积的氯气)。
注意:在实验室里闻氯气气味时,必须十分小心,采用正确的闻气味方法,即用手在瓶口轻轻扇动,仅使极少量的氯气飘进鼻孔。
在实验室中闻其他气体的气味时,也应采用这种方法。
2. 化学性质氯气是一种化学性质很活泼的非金属单质,能与多种金属和非金属直接化合,还能跟许多化合物发生反应,潮湿的氯气还具有漂白性。
<1>与金肩的反应:2NafCI 2==2NaCIf 产生召畑』2Fe+3CI 2=^2FeCI 3f 产生棕養邑畑丿洼鑫:JF<FeCl z 匀表侏备厲庆念*对生成,舍每砖CUH -CI 2==CUCI 2r 产主释黄色畑/C2)与非金屈的反应:HCIde.于水呑捋列誥咳。
工狂上普用此方鎂*1陋盘验刁、结t 氣气廷一科化孝也簌彳艮逶汝的非全属单烦>能与多齐全属升井全属直按化^令召说明:①纯净的H 2在Cl 2中可以安静地燃烧,发出苍白色火焰,在瓶口处有白雾生成。
② H 2和Cl 2混合后光照或点燃都可能爆炸。
③ 工业上制取HC1就是利用H 2在Cl 2中燃烧来制取的。
(3)氯气与水反应①氯气溶于水后可得到氯水02+日20=^HC1+HC1OH 2ICI 2=^2HCI新制的氯水中存在:Cl2(氯水呈黄绿色)、H2O、HClO(氯水有漂白性)、CIO-、H+、Cl-久置氯水中存在:HCl说明:I.氯水显酸性,放置一段时间后酸性增强,其原因是Cl2+H2o^=HC1+HC102HC1O光照2HC1+O2使氯气转化为盐酸,氢离子浓度增大。


氯、溴、碘及其化合物 考点一 氯气的性质与制法(一)氯气的性质和制法 1.氯气的物理性质颜色 状态 气味 密度 毒性 溶解性黄绿色 气体刺激性比空气大有毒1体积水溶解约2体积Cl 22.从氯的原子结构认识氯气的化学性质——氧化性(1)与金属反应:与变价金属反应生成高价金属氯化物。
①与铁反应:2Fe +3Cl 2=====点燃2FeCl 3。
②与铜反应:Cu +Cl 2=====点燃CuCl 2。
(2)与非金属反应与H 2反应:H 2+Cl 2=====点燃或光照2HCl 。
(3)与水反应氯气与水反应的化学方程式:Cl 2+H 2O HCl +HClO 。
(4)与碱反应(完成下列化学方程式)①与烧碱反应:Cl 2+2NaOH===NaCl +NaClO +H 2O 。
②制取漂白粉:2Cl 2+2Ca(OH)2===CaCl 2+Ca(ClO)2+2H 2O 。
漂白粉的主要成分是Ca(ClO)2、CaCl 2,有效成分是Ca(ClO)2。
注意 氯水能漂白某些有色物质是因为其中HClO 具有漂白性,而这种漂白性源于该物质具有强氧化性,同理,NaClO 和Ca(ClO)2的漂白原理也是如此。
3.氯气的制法 (1)工业制取①原料:工业上通常用电解饱和食盐水的方法制取Cl 2,称为氯碱工业。
②反应原理:2NaCl +2H 2O=====通电2NaOH +Cl 2↑+H 2↑。
(2)实验室制取实验室通常用浓盐酸与二氧化锰共热制取Cl 2。
反应原理→用强氧化剂(如KMnO 4、K 2Cr 2O 7、KClO 3、MnO 2等)氧化浓盐酸MnO 2+4HCl(浓)=====△MnCl 2+Cl 2↑+2H 2O制备装置类型→固体+液体――→△气体净化方法→用饱和食盐水除去HCl 气体,再用浓H 2SO 4除去水蒸气 收集方法→向上排空气法或排饱和食盐水法 尾气吸收→用强碱溶液(如NaOH 溶液)吸收验满方法⎩⎪⎨⎪⎧(1)将湿润的淀粉-KI 试纸靠近盛Cl 2的瓶口,观察到试纸立即变蓝,则证明已集满(2)将湿润的蓝色石蕊试纸靠近盛Cl 2的瓶口,观察到试纸立即发生先变红后褪色的变化,则证明已集满(3)实验室制取Cl 2时,常常根据氯气的 颜色判断是否收集满(3)注意事项①必须用浓盐酸,稀盐酸不反应。
2021届高三化学一轮复习——氯、溴、碘的制备与性质核心知识梳理一、卤素单质的相似性、递变性和特殊性 1.相似性(1)都能与大多数金属反应:2Fe +3X 2=====点燃2FeX 3(I 2除外)。
(2)都能与H 2反应生成HX 。
(3)都能与H 2O 反应:X 2+H 2OHX +HXO(F 2、I 2除外)。
(4)都能与碱液反应:X 2+2NaOH===NaX +NaXO +H 2O(F 2、I 2除外)。
2.递变性F 2 Cl 2 Br 2 I 2颜色:――――――――――――――――――→浅黄绿色 黄绿色 深红棕色 紫黑色逐渐加深 熔、沸点:―――――――――――――――→气体 气体 液体 固体逐渐升高 密度:―――――――――――――――→逐渐增大 水溶性:――――――――――――――――→反应 溶解 溶解 微溶逐渐减小 氧化性:―――――――――――――→ (与H 2化合或与水反应由易到难)逐渐减弱 还原性(X -):―――――――――――――――→逐渐增强 3.特殊性(1)Br 2是常温下唯一呈液态的非金属单质;液溴易挥发且有毒,通常用水液封保存。
(2)I 2易升华,淀粉遇I 2显蓝色;I 2易与Na 2S 2O 3溶液反应:I 2+2S 2O 2-3===2I -+S 4O 2-6,用于通过滴定实验(以淀粉溶液为指示剂)来定量测定碘的含量。
(3)Br 2和I 2都可被某些有机溶剂(如四氯化碳)萃取。
(4)氟元素无正价,F 2与H 2O 发生置换反应生成O 2(2F 2+2H 2O===4HF +O 2),F 2与Xe 、Kr 等稀有气体反应生成白色氟化物。
二、Cl 2、Br 2、I 2之间的置换氯、溴、碘单质的氧化性强弱是Cl 2>Br 2>I 2,阴离子的还原性强弱是Cl -<Br -<I -,因此能发生如下反应:Cl 2+2Br -===2Cl -+Br 2; Cl 2+2I -===2Cl -+I 2; Br 2+2I -===2Br -+I 2。
三、海水中提取溴、碘 1.海水提溴 (1)流程海水――→蒸发浓缩富含Br -的海水――――→H 2SO 4酸化Cl2含Br 2的溶液 通热空气和↓水蒸气吹出(2)发生反应的化学方程式依次为 2NaBr +Cl 2===Br 2+2NaCl ; Br 2+SO 2+2H 2O===2HBr +H 2SO 4; 2HBr +Cl 2===2HCl +Br 2。
2.海水提碘 (1)流程工业生产中,氧化剂用Cl 2,而实验室中,氧化剂用H 2O 2(还可用MnO 2等),加入氧化剂后用CCl 4萃取得到粗碘。
(2)分别写出Cl 2、H 2O 2与滤液反应的离子方程式: Cl 2+2I -===I 2+2Cl -; 2I -+H 2O 2+2H +===I 2+2H 2O 。
四、卤素离子的检验 1.银盐法未知液―――――――→加入AgNO 3溶液振荡、静置⎩⎪⎨⎪⎧产生白色沉淀产生淡黄色沉淀产生黄色沉淀―――――→再加稀HNO 3振荡⎩⎪⎨⎪⎧白色沉淀不溶解,有Cl -淡黄色沉淀不溶解,有Br -黄色沉淀不溶解,有I -2.置换—萃取法未知液―――――――→加适量新制氯水振荡――――――→加入CCl 4或汽油振荡有机层呈⎩⎪⎨⎪⎧橙色或橙红色,有Br -紫色或浅紫、紫红色,有I - 卤素单质在不同溶剂中的颜色:常温下 水 苯 CCl 4 汽油 乙醇 F 2 浅黄绿色 强烈反应 反应 反应 反应 反应 Cl 2 黄绿色 淡黄绿色 黄绿色 黄绿色 黄绿色 黄绿色 Br 2 深红棕色 黄→橙 橙→橙红 橙→橙红 橙→橙红 橙→橙红 I 2 紫黑色深黄→褐浅紫→紫紫→深紫浅紫红→紫红棕→深棕课堂检测 1、判断题(1)海水提溴的过程中不发生氧化还原反应(×)(2)碘易升华,可用加热升华法除去NH 4Cl 中混有的I 2(×)(3)实验室保存少量液溴时常加少量水液封,并用玻璃塞密封,不能用橡胶塞(√) (4)类比Fe 与Cl 2反应,可知Fe 与I 2反应产物为FeI 3(×) (5)可以用淀粉溶液检验加碘食盐中的KIO 3(×) (6)CCl 4可用于鉴别溴水和碘水(√)(7)用湿润的淀粉碘化钾试纸鉴别Br 2(g)和NO 2(×)(8)HF 、HCl 、HBr 、HI 的热稳定性依次减弱,还原性依次减弱,水溶液的酸性也依次减弱(×) (9)制碘水,通常把I 2溶解在KI 溶液中,因为I 2+I-I -3,增大其溶解度(√)(10)已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。
玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后。
图中指定的颜色依次为①黄绿色②橙色③蓝色④白色(√)2.(2020·合肥调研)实验室中,从海带中提取I2的实验流程如下图所示,下列说法中不正确的是()A.操作①用到的玻璃仪器有烧杯、玻璃棒、漏斗B.操作②中需加入氧化剂C.可以用四氯化碳或酒精代替苯作萃取剂D.蒸馏I2的苯溶液可获取I2并回收苯答案C3.碘在食盐中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如图所示转化关系,根据图示转化关系推测下列说法中不正确的是()A.可用KI淀粉试纸和食醋检验加碘盐中是否含有碘B.由图可知氧化性的强弱顺序为Cl2>I2>IO-3C.足量Cl2能使湿润的KI淀粉试纸变白,其原因可能是5Cl2+I2+6H2O===2HIO3+10HCl D.途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10N A答案:B4、实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:Na2SO3溶液Cl2↓↓含碘废液→还原―→操作X―→氧化―→富集―→…―→I2↓CCl4(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式____________________________________________________________________________________;该操作将I2还原为I-的目的是_____________________________________________________ ______________________________________________________________________________。
(2)操作X的名称为____________。
(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40 ℃左右反应(实验装置如图所示)。
实验控制在较低温度下进行的原因是______________________________________________ ________________________________________________________________________;锥形瓶里盛放的溶液为____________。
(4)已知:5SO2-3+2IO-3+2H+===I2+5SO2-4+H2O某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO-3中的一种或两种。
请补充完整检验含碘废水中是否含有I-、IO-3的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;______________________________________________ ______________________________________________________________________________。
实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液。
答案.(1)SO2-3+I2+H2O===2I-+SO2-4+2H+使CCl4中的碘进入水层(2)分液(3)使氯气在溶液中有较大的溶解度(或防止I2升华或防止I2进一步被氧化)NaOH溶液(4)从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,若溶液变蓝,则说明废水中同时存在I-和IO-3,若不变蓝则另从水层取少量溶液于两支试管中,加盐酸酸化,其一滴加FeCl3溶液,若溶液变蓝,说明废水中含有I-,若溶液不变蓝,说明废水中不含有I-;另一支试管滴加Na2SO3溶液,若溶液变蓝,说明废水中含有IO-3,若溶液不变蓝,说明废水中不含有IO-35. .(2019·河北衡水中学调研)查阅资料知:Br2的沸点为58.8 ℃,密度为3.119 g·cm-3,微溶于水,有毒。
Ⅰ.(1)常温下,单质溴通常呈________态,保存时通常在盛溴的试剂瓶中加入少量________。
Ⅱ.工业生产中,海水提取溴常用热空气吹出法。
其生产流程如下:淡化海水――→通入Cl 2低浓度溴水――――――――→通入热空气吹出Br 2用X 吸收含Br -的溶液―――→通入Cl 2Br 2的浓溶液―→液溴某化学实验小组模拟该法设计了如下实验装置(夹持装置略去)从浓缩的海水中提取液溴。
实验步骤如下:①关闭活塞b 、d ,打开活塞a 、c ,向A 中缓慢通入Cl 2至反应结束; ②关闭a 、c ,打开b 、d ,向A 中鼓入足量热空气; ③关闭b ,打开a ,再通过A 向B 中通入足量的Cl 2; ④将B 中所得液体进行蒸馏,收集液溴。
(2)当观察到A 中液面上方出现____________(实验现象)时即可判断步骤①中反应已经结束。
(3)X 试剂可以是________(填字母,下同),尾气处理选用________。
a .H 2Ob .饱和食盐水c .氢氧化钠溶液d .饱和Na 2SO 3溶液B 中X 试剂发生反应的离子方程式为_______________________________________________ ________________________________________________________________________。
(4)蒸馏时应该选择________________(填序号),操作中应控制的关键实验条件为________________________________________________________________________。
Ⅲ.该实验小组利用制得的单质溴研究H2与Br2生成HBr的反应,实验装置如下:(5)E装置可用来检验反应产物HBr,则D装置的作用是____________________。