物质的分类 -教学设计
- 格式:doc
- 大小:262.50 KB
- 文档页数:3


《物质的分类及转化》物质分类,井然有序在我们生活的这个世界里,物质的种类繁多、形态各异。
从我们日常所见的桌椅板凳,到肉眼无法直接观测的微观粒子,物质无处不在。
为了更好地理解和研究这些物质,科学家们根据物质的性质和特点进行了分类,使得原本看似杂乱无章的物质世界变得井然有序。
首先,让我们来了解一下物质分类的基本方法。
最常见的分类方式是根据物质的组成和性质进行划分。
从组成上来看,物质可以分为纯净物和混合物。
纯净物是指由一种物质组成的,具有固定的组成和性质。
比如说,氧气(O₂)、水(H₂O)等都是纯净物。
而混合物则是由两种或两种以上的物质混合而成,其组成和性质不固定。
例如,空气就是一种混合物,它包含了氮气、氧气、二氧化碳等多种气体。
在纯净物中,又可以进一步分为单质和化合物。
单质是由同种元素组成的纯净物,像金属单质铁(Fe)、铜(Cu),以及非金属单质氧气(O₂)、氮气(N₂)等。
化合物则是由不同种元素组成的纯净物,比如水(H₂O)、二氧化碳(CO₂)等。
从性质的角度出发,物质可以分为金属、非金属、酸、碱、盐等。
金属通常具有良好的导电性、导热性和延展性,如铁、铜、铝等。
而非金属的性质则与金属有很大的不同,比如碳(C)、硫(S)等,它们一般不具有金属的那些特性。
酸、碱、盐是化合物中的重要类别。
酸在水溶液中能够电离出氢离子(H⁺),具有酸性。
常见的酸有盐酸(HCl)、硫酸(H₂SO₄)等。
碱在水溶液中能够电离出氢氧根离子(OH⁻),具有碱性。
像氢氧化钠(NaOH)、氢氧化钙(Ca(OH)₂)都是常见的碱。
盐则是由金属离子(或铵根离子)和酸根离子组成的化合物,如氯化钠(NaCl)、碳酸钠(Na₂CO₃)等。
物质的分类并非是孤立的,它们之间还存在着相互转化的关系。
这种转化在化学反应中表现得尤为明显。
例如,金属单质可以与氧气发生氧化反应生成金属氧化物。
铁在空气中生锈,就是铁(Fe)与氧气(O₂)反应生成了氧化铁(Fe₂O₃)。

《物质的分类》说课稿(实用版)编制人:__________________审核人:__________________审批人:__________________编制单位:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的实用资料,如职业道德、时事政治、政治理论、专业基础、说课稿集、教资面试、综合素质、教案模板、考试题库、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor.I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, this shop provides you with various types of practical materials, such as professional ethics, current affairs and politics, political theory, professional foundation, lecture collections, teaching interviews, comprehensive qualities, lesson plan templates, exam question banks, other materials, etc. Learn about different data formats and writing methods, so stay tuned!《物质的分类》说课稿《物质的分类》说课稿开场白:各位评委好,我是XXX号考生,今天我说课的内容是高中化学必修1第二章第一节《物质的分类》的第一课时,下面开始我的说课,根据新课标的理论我将以教什么,怎样教,为什么这样教为设计思路,从教材分析,学情分析,教学目标,教学重难点等几个方面进行说明,首先说一下我对教材的认识。

《物质的分类》第一课时教案一、教学目标:1、知识与技能①学会用简单的分类方法(交叉分类法、树状分类法)根据物质的组成和性质对物质进行分类;②学习酸碱盐的定义和认识酸碱盐2、过程与方法①学生学会运用观察、比较、归类的方法,抓住事物的特征、个性,把握事物间的共性,对收集的信息进行科学的、系统的研究,发现其变化规律。
3、情感、态度和价值观①学生认识分类的科学方法对于化学科学研究和化学学习的重要性;②通过简单的分类法的学习,学生可以进一步体验到“掌握方法比死记硬背更有效”。
二、教学重难点:1、教学重点初步学会根据物质的组成和性质对物质进行分类2、教学难点:酸、碱、盐二、教学过程:关系表示出来?那么,这又是什么分类法?我们把这种对同类物质进行再分类的方法叫做树状分类法。
可能有同学就纳闷了,为什么把它称为树状分类法?因为我们可以把它写成树的形状,因此叫做树状分类法。
同学们,是不是物质只能分类到这里了?我还可以根据是否具有酸碱性对氧化物进行再分类。
如,能够与碱反应生成盐和水的氧化物就称为酸性氧化物,这类氧化物大多是非金属氧化物,比如CO 2、SO 2、SO 3等;能够与酸反应生成盐和水的氧化物就是碱性氧化物,大多数是金属氧化物,比如CuO 、CaO 、BaO 等;而两性氧化物就是既能与酸又能与碱都反应生成盐和水的氧化物,比较典型的就是Al 2O 3;既不能与酸又不能碱反应的是不成盐氧化物,比如H 2O 、CO 、NO 等。
在这里可能有些同学不懂什么是酸碱盐,我们来继续学习 酸:电离时产生的阳离子全部是氢离子的化合物; 碱:电离时产生的阴离子全部是氢氧根离子的化合物; 盐:酸根离子和金属离子共同作用所形成的化合物。
一元酸:分子中有一个氢离子的酸 二元酸:分子中有两个氢离子的酸弱碱:是难溶于水不能发生完全电离的碱,一般属于不活泼金属形成的碱,如Al(OH)3、Cu(OH) 2 正盐:既不含能电离的氢离子,又不含氢氧根离子的盐 ,如NaCl酸式盐:酸跟碱反应时,若酸中的氢离子部分被中和,生成的盐中除了金属阳离子和酸根离子外,还有氢离子存在刚才,我们说在交叉分类法里,物质的类别之间存在部分交叉,那么树状分类法里的物质类别之间存在交叉吗?【学生】不存在。

学习目标1.明确混合物.纯净物、单质、化合物、氧化物、酸、碱、盐、无机物、有机物等概念之间的并列及从属关系;2.能依据物质的组成和性质,对常见物质进行简单分类;3.知道分类标准不同,物质的类别也不同。
4.能较好的掌握和理解复分解反应的概念及其应用。
学习重难点1.宏观物质的简单分类和知识体系的建立;2.单质、化合物、氧化物、酸、碱、盐等概念的理解。
3.深入理解和掌握复分解反应的概念及其应用。
物质的分类一.混合物和纯净物二.单质和化合物1.单质:由同种元素组成的纯净物叫做单质,例如金属单质、非金属单质和稀有气体等。
2.化合物:含有不同种元素的纯净物叫做化合物。
例如氧化物、酸、碱、盐等。
氧化物:是指由两种元素组成且其中一种是氧元素的化合物。
如干冰、水、生石灰等。
注:① 由同种元素组成的物质不一定是单质,例如:O 2和O 3组成的混合物,C 和C 60组成的混合物。
② 含有氧元素的化合物不一定是氧化物,如:H 2SO 4 ,Na 2CO 3【练习】请在空格中填写物质的类别 (1)在化合反应中,生成物一定是 ,而不可能是 。
(2)在分解反应中,生成物可能是 或 ,但反应物一定是 。
(3)在置换反应中,生成物一定是 和 ,反应物也一定是 和 。
(4)在复分解反应中,生成物一定是 ,反应物也一定是 。
基础过关1.某物质经分析只有一种元素,该物质不可能是( )A.单质B.化合物C.纯净物D.由分子构成的物质 2.金属钛(Ti )是航空.宇航等方面的重要原料,在生产钛的过程中,可用镁和四氯化钛(TiCl 4)在加热条件下制取,则四氯化钛属于……………………( )A.金属B.化合物C.混合物D.氧化物3.科学家用计算机模拟后确认,60个N 原子结合成N 60分子,下列关于N 60的叙述正确的是( )A.N 60是一种新型化合物B.N 60和N 2性质完全相同C.一个N 60分子中有30个N 2分子D.N 60和N 2混合形成的是混合物混合物 纯净物 定义两种或多种物质混合而成的物质叫混合物。
《物质的分类》教案黑板上。
此活动中学生能快速得到分类方案,反映出学生能较好地掌握了从组成和性质角度对物质进行分类的思维方法。
通过其中一组的分类图,对比讲解单一分类法和树状分类方法。
对两种分类方法进行对比理解后,设置疑问:氧化物能否进行再分类吗?老师从组成角度引导学生得出:金属氧化物、非金属氧化物,从性质角度引导学生得出酸性氧化物和碱性氧化物,这部分作为新知识点进行讲解(不成盐氧化物、两性氧化物等此次课中不做介绍),环节三中将会用到。
活动2:对交叉分类的学习:同学找出Na2CO3、Na2SO4、K2CO3、K2SO4这4张卡片,老师引导学生对这些物质进行重新分类,在此过程中,让学生得出钠盐、钾盐、碳酸盐和硫酸盐这样的结论,用实际的例子学习交叉分类法。
[合作探究]如果根据酸的分子里是否含有氧原子,可以把酸分成含氧酸和无氧酸两类;根据酸分子电离时所能生成的氢离子的个数,可以把酸分成一元酸、二元酸、三元酸等。
让学生用盐酸、硝酸、氢硫酸、硫酸制作一张交叉分类图。
通过对以上分类方法的学习和练习,学生在不知不觉中完善了物质分类的框架。
环节三:预测未知物性质,实验论证,联系生活解决实际问题在学习了分类方法、完善分类框架后,学生已经具备运用分类方法预测未知物性质的知识结构。
老师希望学生能运用这些的知识和方法,尝试解决生产、生活中的实际问题。
首先通过图片和数据让学生感受酸雨的危害,而酸雨的防治也是世界性的课题。
老师帮学生回顾环节二学的碱性氧化物和酸性氧化物的定义,然后老师让学生观看SO2能使澄清石灰水变浑浊的实验视频,并提出如何有效吸收煤燃烧产生的SO2气体,从而减少酸雨的发生的探究问题;学生开始积极讨论并给出了方案,即用碱液吸收,并说出思维过程:CO2、SO2都能使澄清石灰水变浑浊,通过二氧化碳使澄清石灰水变浑浊得方程式,得二氧化碳是酸性氧化物,所以类比二氧化硫也为酸性氧化物,老师在给予学生充分的肯定后,讲解二酸性氧化物的通性。

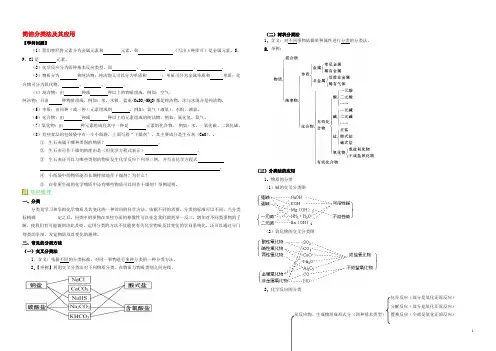
简洁分类法及其应用【学问回顾】(1)我们曾经将元素分为金属元素和元素,如(写出4种即可)是金属元素,S、P、Cl是元素。
(2)化学反应分为四种基本反应类型,即、、、。
(3)物质分为和纯洁物;纯洁物又可以分为单质和;单质可分为金属单质和单质;化合物可分为氧化物、、、。
(4)混合物:由种或种以上的物质组成,例如:空气。
纯洁物:只由种物质组成,例如:水、水银、蓝矾(CuSO4•5H2O)都是纯洁物,冰与水混合是纯洁物。
(5)单质:由同种(或一种)元素组成的,例如:氧气(液氧)、水银、液氯。
(6)化合物:由种或种以上的元素组成的纯洁物,例如:氯化氢、氨气。
(7)氧化物:由种元素组成且其中一种是元素的化合物,例如:水、一氧化碳、二氧化碳。
(8)有些食品的包装袋中有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰(CaO)。
①生石灰属于哪种类别的物质?。
②生石灰可作干燥剂的理由是(用化学方程式表示)。
③生石灰还可以与哪些类别的物质发生化学反应?列举三例,并写出化学方程式。
④小纸袋中的物质能否长期持续地作干燥剂?为什么?⑤在你所生疏的化学物质中还有哪些物质可以用作干燥剂?举例说明。
一、分类分类是学习和争辩化学物质及其变化的一种常用的科学方法,依据不同的需要,分类的标准可以不同。
当分类标精确定之后,同类中的事物在某些方面的相像性可以挂念我们做到举一反三,增加对不同类事物的了解,使我们有可能做到由此及彼。
运用分类的方法不仅能使有关化学物质及其变化的学问系统化,还可以通过分门别类的争辩,发觉物质及其变化的规律。
二、常见的分类方法(一)交叉分类法1.含义:依据不同的分类标准,对同一事物进行多种分类的一种分类方法。
2.【举例】利用交叉分类法对下列物质分类,在物质与物质类别之间连线。
(二)树状分类法1.含义:对不同事物依据某种属性进行分类的分类法。
2.举例:(三)分类法的应用1.物质的分类(1)碱的交叉分类图(2)氧化物的交叉分类图2.化学反应的分类化合反应(部分是氧化还原反应)分解反应(部分是氧化还原反应)从反应物、生成物组成形式分(四种基本类型)置换反应(全部是氧化还原反应)复分解反应(全不是氧化还原反应)非氧化还原反应从有无电子转移分非氧化还原反应化学反应离子间发生反应生成沉淀、气体、难电离的物质离子反应从是否有离子参与分离子间发生氧化还原反应分子反应不行逆反应从反应进行的程度分可逆反应放热反应从反应的热效应分吸热反应题组一常见分类方法的应用1.下列交叉分类法正确的是 ( )2.下列物质分类的正确组合是 ( )碱酸盐酸性氧化物A 纯碱盐酸烧碱二氧化硫B 烧碱硫酸食盐一氧化碳C 苛性钠醋酸石灰石水D 苛性钾碳酸苏打三氧化硫3.依据物质的树状分类法和交叉分类法,HNO3应属于 ( )①酸②氢化物③氧化物④含氧酸⑤难挥发性酸⑥一元酸⑦化合物⑧混合物A.①②③④⑤⑥⑦ B.①④⑥⑦ C.①⑧ D.①④⑤⑥4.物质的分类法是化学争辩的重要方法之一。

物质的分类_教案教案:物质的分类教学目标:1.了解物质的分类方法;2.掌握物质的常见分类;3.能够通过实例判断物质的分类。
教学重点:1.物质的分类方法;2.物质的常见分类。
教学难点:1.物质的具体分类;2.实例判断物质的分类。
教学过程:Step 1: 导入新知识1.引导学生回顾前面学过的物质的定义,物质是由不同的化学元素组成的。
2.提问学生,你们知道物质是如何分类的吗?Step 2: 探究物质的分类方法1.引导学生思考,我们可以根据哪些特征将物质进行分类?3.让学生以小组为单位,进行讨论,总结自己对物质分类的方法。
Step 3: 物质的常见分类1.引导学生回答物质的组成为分类方法,通过物质的组成可以将其分为两大类,是什么?2.引导学生回答物质的性质为分类方法,通过物质的性质可以将其分为三大类,是什么?Step 4: 整理归纳物质的分类1.以PPT形式展示物质的分类表格。
2.让学生将物质分类表格填写完整。
3.学生用自己的语言整理归纳物质的分类方法。
Step 5: 实例判断物质的分类1.以幻灯片的形式展示一系列物质的图片。
2.让学生依据所学的分类方法判断这些物质属于哪一类。
3.请学生互相讨论并给出自己的答案。
4.展示正确答案,并解释判断的原因。
Step 6: 课堂练习1.出示一些物质的描述,让学生判断它们属于哪一类。
2.学生个人完成,然后相互交流,订正答案。
Step 7: 拓展延伸1.以PPT形式展示一些特殊的物质,如合金、聚合物等,并解释它们的特点和分类。
2.让学生进行思考和讨论,为这些特殊的物质找到合适的分类方法。
Step 8: 小结回顾1.让学生总结物质的分类方法和常见分类。
2.提问学生一些关于物质分类的问题,检查学生的掌握情况。
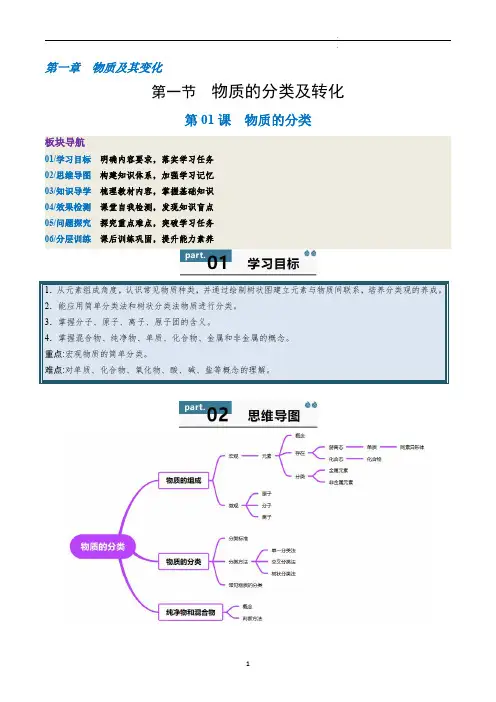
第一章物质及其变化第一节物质的分类及转化第01课物质的分类板块导航01/学习目标明确内容要求,落实学习任务02/思维导图构建知识体系,加强学习记忆03/知识导学梳理教材内容,掌握基础知识04/效果检测课堂自我检测,发现知识盲点05/问题探究探究重点难点,突破学习任务06/分层训练课后训练巩固,提升能力素养1.从元素组成角度,认识常见物质种类,并通过绘制树状图建立元素与物质间联系,培养分类观的养成。
2.能应用简单分类法和树状分类法物质进行分类。
3.掌握分子、原子、离子、原子团的含义。
4.掌握混合物、纯净物、单质、化合物、金属和非金属的概念。
重点:宏观物质的简单分类。
难点:对单质、化合物、氧化物、酸、碱、盐等概念的理解。
知识点一物质的组成1.宏观上物质是由元素组成的,微观上物质是由分子、原子或离子构成的。
①分子:保持物质化学性质的最小微粒。
②原子:化学变化中的最小微粒。
③离子:带电荷的原子或原子团。
④原子团:在许多化学反应里,作为一个整体参加反应,如同一个原子一样的原子集团。
2.元素:具有相同核电荷数的一类原子的总称。
元素在自然界的存在形式有游离态和化合态。
①游离态:元素以单质形式存在的状态。
②化合态:元素以化合物形式存在的状态。
3.元素与物质的关系元素――组成单质:只由一种元素组成的纯净物。
化合物:由多种元素组成的纯净物。
4.原子与物质的关系5.同素异形体(1)概念:同种元素形成的不同单质叫同素异形体。
(2)形成方式①原子个数不同,如O 2和O 3;②原子排列方式不同,如金刚石和石墨。
(3)性质差异物理性质差别较大,化学性质相似,同素异形体之间的转化属于化学变化。
【特别提醒】①物质的组成可概括为“宏观一素(元素)、微观六子(原子、分子、离子、质子、中子、电子)”。
②由原子或离子构成的单质和化合物均用化学式表示。
③几乎所有的酸都是共价化合物,都有确定的分子式。
④只含一种元素的物质不一定是单质,如如O 2和O 3组成的混合物,只含一种元素的纯净物才是单质。
第二章 化学物质及其变化第一节 物质的分类(共2课时) 第1课时 简单分类法及其应用【教学目标】1.学会从多种角度、依据不同标准对物质进行分类;2.知道“交叉分类法”和“树状分类法”这两种常用的分类方法,能根据需要选择并制作分类图。
3.能够根据反应物、生成物的种类和类别把化学反应分为:化合反应、分解反应、置换反应和复分解反应。
【重点难点】学会从组成和性质的角度对常见物质进行分类【教学过程】【思考】走进超市,“超市”中琳琅满目的商品,为什么大家能迅速挑出自己所需要的商品?超市里根据物品的功能和性能将物品分为食品区、生活用品区等,再将食品区分为熟食品区、水果区、零售区等,通过分类后顾客可以轻松购物。
【提问】生活中也有很多分类的例子,请大家结合生活中的体验列举几个分类的例子,并说一说这样分类有什么好处呢?【交流】图书馆的书籍是分类放置的,马路上的车道是分类的、网络中的信息分类、QQ 好友的分类等等。
分类让是我们的生活变得更加便捷,生活更有条理,秩序。
在我们接触的事物中,应用分类方法的例子很多,分类不是目的,只是一种手段,能够提高人们工作、学习的效率,使人们更快、更便捷地达到目的。
那么在化学的科学研究中要不要运用分类的方法呢?【引入】到目前为止,发现和合成的化学物质已经超过3000万种,说到化学反应,那就更多了。
所以说分类法对学习化学起着不可替代的作用。
它不仅把化学物质及其变化规律系统化,还可以分门别类地研究这些物质及其变化规律。
【思考与交流】1.请尝试对你所学过的化学物质和化学反应进行分类,并与同学交流。
2.请从其他方面收集一些应用分类法的例子,讨论对它们进行分类的目的和意义。
(1)对物质进行分类(2)对氧化物的分类(3)对化学反应的分类【归纳】不论是对化学物质还是对化学反应所进行的分类,都是依据一定的分类标准。
分类标准不同,则有不同的分类方法。
也就是说:将物质进行分类,关键是找出分类的“标准”,而“标准”不是唯一的,所选的“标准”不同,分类结果页不同。
《物质的分类(第一课时)》教学设计
一、教学分析
1.内容分析
本课时选自人教版必修1第2章第一节,属于典型的化学核心观念知识。
第一章已经从化学研究手段学习了化学实验验观和定量分析观,这一章旨在从化学学科观念(元素观、分类观、转化观、离子反应观、氧化还原观)出发,引领学生后面进一步学习元素化合物知识。
因此,本节内容的主要功能与价值在于:
1). 将已有较为零散的生活经验和知识和已有知识上升到较为系统的化学思想方法——元素观、分类观、转化观;
2).元素观、分类观可以帮助我们快速寻找、认识纷繁多样的化学物质;
3).分类观可以帮助我们高效学习、研究陌生物质的性质;
4).丰富对物质认识的角度,为元素化合物知识的学习提供重要视角。
2.课标及学情分析
课程目标:能根据物质的组成和性质对物质进行分类。
学生已有知识:1).对物质的初步分类;
2).生活中的分类及其作用(感性认识)。
学生已有能力:1).能利用分类法解决生活中的一些实际问题;
2).初步的分析、归纳、表达能力。
学生可能的发展障碍点:1).熟练地根据物质性质及组成对物质进行多角度分类;
2).元素观、分类观、转化观的形成和应用。
二、教学目标
(一)知识与技能
1. 了解树状分类法和交叉分类法;
2. 初步认识较为系统的核心分类;
3. 复习、整理酸类物质的通性。
(二)过程与方法(重难点)
1. 能从物质的组成和性质对物质进行多角度分类;
2. 熟悉从类别角度预测、学习物质性质的一般步骤;
3. 初步掌握不同类别物质间相互转化的方法。
(三)情感态度价值观
1.通过讨论活动,认识到分类的关键在于制定标准,制定标准的关键在于分析组成和性质差别;
2. 通过探究活动,体验从分类角度寻找、认识、研究物质性质的过程
三、教学策略
问题及任务驱动、小组合作、情境创设
四、教学过程。