第七章分子结构
- 格式:ppt
- 大小:1.52 MB
- 文档页数:100

分⼦结构与晶体结构第七章分⼦结构与晶体结构第⼀节离⼦键⼀、离⼦键的形成和特征1、离⼦键的形成电负性I1或Y1(KJ/mol)电离能很⼩的⾦属原⼦:Na 0.9 496K 0.8 419电⼦亲合能很⼤的⾮⾦属原⼦:Cl 3.0 -348.8O 3.5 -141电负性相差⼤的元素相遇,⼀失电⼦,⼀得电⼦,它们之间以静电引⼒相结合,形成离⼦键。
④:阳阴离⼦间具有静电引⼒,两原⼦的电⼦云间存在排斥⼒,两原⼦核间存在相互排斥⼒,当两原⼦接近到⼀定距离,引⼒=斥⼒,(此时整个体系能量最低),形成离⼦键。
2、离⼦键的特征①本质:阴、阳离⼦间的静电引⼒②⽆⽅向性、饱和性只要空间允许,尽可能多地吸引带相反电荷的离⼦(任何⽅向,尽可能多)。
但总体来说,有⼀定⽐例。
⼆、离⼦的特性1、离⼦的电荷离⼦化合物AmBn:A n+,B m-+n﹥+3,很少见2、离⼦的电⼦层结构简单阴离⼦的电⼦构型,⼀般与同周期希有⽓体原⼦电⼦层构型相同。
简单的阳离⼦构型:3、离⼦半径将阴阳离⼦看成是保持着⼀定距离的两个球体。
d = r+ + r-单位:pm(10-12m)规律:①同⼀元素:负离⼦半径>原⼦半径>正离⼦半径低价负离⼦半径>⾼价负离⼦半径低价正离⼦半径>⾼价正离⼦半径例:②同⼀周期从左到右,阳离⼦:正电荷数↑,半径↓阴离⼦:负电荷数↓,半径↓③同⼀主族电荷数基本相同,从上到下,半径↑(∵电⼦层增加)离⼦半径↓,离⼦间引⼒↑,离⼦键强度↑,熔、沸点↑,硬度↑第⼆节共价键理论1916年,路易斯提出共价键理论。
靠共⽤电⼦对,形成化学键,得到稳定电⼦层结构。
定义:原⼦间借⽤共⽤电⼦对结合的化学键叫作共价键。
对共价键的形成的认识,发展提出了现代价键理论和分⼦轨道理论。
⼀、价键理论(电⼦配对法)1、氢分⼦共价键的形成和本质(应⽤量⼦⼒学)当两个氢原⼦(各有⼀个⾃旋⽅向相反的电⼦)相互靠近,到⼀定距离时,会发⽣相互作⽤。
每个H原⼦核不仅吸引⾃⼰本⾝的1s电⼦还吸引另⼀个H原⼦的1s电⼦,平衡之前,引⼒>排斥⼒,到平衡距离d,能量最低:E0﹤2E,形成稳定的共价键。


第七章分子结构和晶体习题解答(7)思考题1.举例说明下列概念的区别:离子键与共价键、共价键与配位键、σ键和Л键、极性键和非极性键、极性分子与非极性分子、分子间力与氢键。
1.离子键是得到电子的阴离子与失去电子的阳离子的强烈静电吸引作用;共价键是原子间通过共用电子对(或电子云重叠)而形成的相互吸引作用,无阴、阳离子;配位键也是共价键中的一种,只不过共用的一对电子有一个原子提供。
σ键是各自电子云用密度最大的一头相互重叠,以使重叠体积最大,两原子间形成共价键时首先肯定以σ键成键,但两原子间只能形成σ键一次。
Л键是在原子间已形成一根σ键后,其余原子轨道以“肩并肩”在侧面重叠的成键方式,其重叠体积比σ键要小,但两原子间根据各自的单电子数可形成几个Л键。
极性键是两不同原子间形成共价键时,由于两原子的电负性不同,吸引公用电子对的作用不同,使某一端带有部分正电荷,另一端带有部分负电荷,这就是极性键;若两相同的原子间形成共价键,由于彼此电负性相同,吸引共用电子对的能力相同,公用电子对不偏向任何一个原子,两原子不带“净”电荷,没有“正”或“负”的一端,即非极性键。
极性分子是整个分子中正、负电荷重心不重合,使分子一端带部分正电荷,为正极,另一端带部分负电荷,为负极。
分子之间由于偶极间的相互作用力为分子间力。
氢键是氢原子与电负性大、半径小的原子形成共价键后,由于氢原子唯一的电子被其他原子吸引到离氢原子核较远的地方,氢原子几乎成了“裸露”的质子,有很强的正电场,吸引另一电负性大、半径小的原子的孤对电子,形成了一种作用力,这个作用力本质上还是分子间作用力,但比一般的分子间力强。
2.离子键是怎样形成的?离子键的特征和本质是什么?为什么离子键无饱和性和方向性?2.离子键是失电子的金属阳离子和德电子的非金属阴离子通过静电引力形成的。
离子键的特征是无方向性、无饱和性。
其本质是正、负点电荷间的静电引力。
点电荷产生的电场向空间各个方向均匀传播,每一个在其电场中的异号电荷都会受到它的吸引作用,在理论上它可吸引无数个异号电荷,所以离子键无饱和性;由于点电荷产生的电场向空间各个方向的传播是均匀的,只要距离相等,不管在哪个方向,受到的作用里是一样的,这就是离子键的无方向性。

第七章高分子的结构习题与思考题1.高分子的结构有何特点高分子结构可以分为哪些结构层次各结构层次包括哪些内容它们对聚合物的性能会产生什么影响特点:①链式结构:结构单元103-105数量级②链的柔顺性:内旋转产生非常多的构象③多分散性,不均一性,长短不一。
④结构单元间的相互作用对其聚集态结构和物理性能有着十分重要的影响。
⑤凝聚态结构的复杂性:包括晶态、非晶态,球晶、串晶、单晶、伸直链晶等。
⑥可填加其它物质改性。
分为:链结构和聚集态结构。
内容:链结构分为近程结构和远程结构。
近程结构主要涉及分子链化学组成、构型、构造;远程结构主要涉及分子链的大小以及它们在空间的几何形态。
聚集态结构包括晶态、非晶态、液晶态、取向态结构及织态结构等。
影响:高分子结构中各个结构层次不是孤立的,低结构层次对搞结构层次的形成具有较大影响,近程结构决定了高分子的基本性能,而聚集态结构直接影响高分子的使用性能。
2.写出线型聚异戊二烯的各种可能构型。
顺式1,4-加成反式1,4-加成 1,2-加成全同立构 1,2-加成间同立构1,2-加成无规立构 3,4-加成全同立构 3,4-加成间同立构 3,4-加成无规立构3.名词解释(1)构型:是指分子中由化学键所固定的原子在空间的几何排列。
(2)构象:由于分子中的单键内旋转而产生的分子在空间的不同形态(3)链柔性:高分子链能够通过内旋转作用改变其构象的性能(4)内聚能密度::单位体积的内聚能,CED = ?E/Vm。
内聚能是克服分子间作用力,把1mol 液体或固体分子移至分子引力范围之外所需的能量(5)结晶形态:试样中结晶部分所占的质量分数(质量结晶度xcm)或者体积分数(体积结晶度xcv)。
(6)取向:聚合物取向是指在某种外力作用下分子链或其他结构单元沿着外力作用方向择优排列(7)液晶:一些物质的结晶结构受热熔融或被溶剂溶解后,表观上虽然变成了具有流动性的液体物质,但结构上仍然保持着晶体结构特有的一维或二维有序排列,形成一种兼有部分晶体和液体性质的过渡状态4.聚合物的构型和构象有何区别假若聚丙烯的等规度不高,能否通过改变构象的方法来提高其等规度全同立构聚丙烯有无旋光性构型是指分子中由化学键所固定的原子在空间的几何排列。


第七章 分子结构的测定方法的原理及应用7.1 分子光谱基本内容分子光谱乃是对分子所发出的光或被分子所吸收的光进行分光所得到的光谱。
原子光谱为线状光谱,而分子光谱为带状光谱。
一. 分子光谱的分类极其所在的波段 1. 分子内部运动的三种方式及能量1).电子相对于原子核的运动 能量为Ee,能级差为1~20eV 2). 各原子核的相对振动运动 能量为Ev 能级差为0.05~1eV 3). 整个分子的转动 能量为ErE 级差为1×10-4~0.05eV 分子从低能E”跃迁到高能级E’时吸收电磁波产生谱线,其波数为~'"'"'"υλ==-+-+-1Ee Ee hc Ev Ev hc Er Er hc当分子的价电子能级发生跃迁是,常伴随着振动能级和转动能级的跃迁,故价电子在两个能级之间的跃迁所对应的能量差往往不是一个确定的值而是多个彼此相差很小的数值。
2. 当只有转动能级发生跃迁时所对应的分子光谱称为转动光谱。
波数介于0.8~0.81cm -1,波长为1.25~0.012cm,相当于微波和远红外波段。
3. 当振动能级发生跃迁时,总是伴随着转动能级的跃迁,所以对应的光谱称为震动-转动光谱。
波数为400~8000cm -1波长为2.5×10-3~1.25×10-4cm,相当于红外光谱区,故称分子的振动-转动光谱为红外光谱。
4. 分子的电子光谱结构比较复杂,波数为8000~160000cm -1波长为1250nm~62.5nm,相当于近红外到远紫外波段。
二. 分子的转动光谱:(双原子) 1. 双原子分子AB 的刚性转子模型(1).把两个原子看着体积可以忽略不计的质点,质量为m A m B (2)认为原子间的平衡核间距离Req 在转动过程中,保持不变。
2.求绕质心以角速度ω转动时的能量及能级:ε转=h I228πJ(J+1),J=0,1,2,............能级的间隔为: ∆E(J,J+1)=h I 228π[(J+1)(J+2)-J(J+1)]=h I228π2(J+1)或∆E(J,J+1)=2Beh(J+1)=2Bhc(J+1)其中 B=h IC228π (cm -1)B 为转动常数。


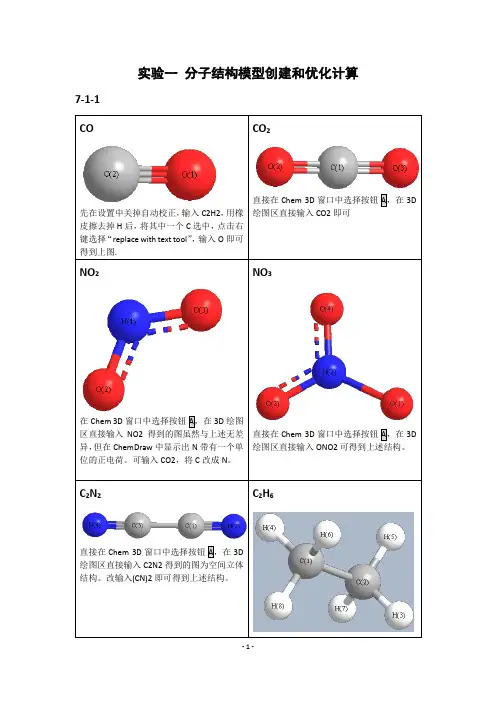
实验一分子结构模型创建和优化计算7-1-1绘图区直接输入C2H6即可。
HCOOH直接在Chem 3D窗口中选择按钮A,在3D绘图区直接输入HCOOH即可。
3DH3PO47-2-1-7-3-1 MM2O 和O 距离为2.765AE 1=-5.4331Kcal/Mol E 2= 0.0289 Kcal/Mol D=E 1-2E 2=-5.3753 Kcal/MolHF/6-31++GO 和O 距离为3.0 ÅE1= -95408.4 Kcal/mol (-152.04313 Hartrees) E2== -47701.8 Kcal/mol (-76.01774 Hartrees) D=E1-2E2=-4.8 Kcal/mol = (-0.00765 Hartrees) MP2/6-31++GO 和O 距离为2.9 ÅE1=-95650.8 Kcal/mol (-152.42932 Hartrees) E2=-47822.3 Kcal/mol (-76.20978 Hartrees) D=E1-2E2=-6.2 Kcal/mol (-0.00976 Hartrees) DFT= B3LYPO 和O 距离为2.8 ÅE1= -95870.8 Kcal/mol (-152.77997 Hartrees) E2= -47932.5 Kcal/mol (-76.38545 Hartrees) D=E1-2E2=-5.8 Kcal/mol (-0.00907 Hartrees)MOPAC-PM3O 和O 距离为3.0 ÅE1= -108.7 Kcal/molE2=-53.4 Kcal/molD=E1-2E2=-1.9 Kcal/mol7-4-2”化学意义”:RuClClPNN简介:第二代Grubbs催化剂是Grubbs在1999年对第一代催化剂的改进。
Grubbs 通过系统地对催化剂结构-性能关系进行研究,发现催化剂的活性与其中一个膦配体的解离有关,认为催化循环过程中经过一个高活性的单膦中间体,然后才与烯烃发生氧化加成。

