手把手教你做细胞计数实验
- 格式:doc
- 大小:537.00 KB
- 文档页数:2

细胞如何计数?(整理自网络)
方法一:血球计数盘
此物一般有二个chambers,分别刻有9 个1 mm²大正方形,4 个角落之正方形再细刻为16 个小格,深度均为0.1 mm。
当chamber 上方盖上盖玻片后,每个大正方形之体积为1 mm²×0.1 mm=0.1 mL。
计数每个大正方形内之细胞数目,乘以稀释倍数,再乘以10000,即为每mL 中之细胞数目。
操作步骤
1、取少许细胞悬液(约15 μL)自血球计数盘chamber 上方凹槽加入,盖上盖玻片,于100
倍倒立显微镜下观察;
2、计数四个大方格之细胞总数,再除4,乘以稀释倍数,最后乘以10000,即为每mL 中
细胞悬浮液之细胞数。
若细胞位于刻线上,只计上线与右线之细胞(下线与左线之细胞)。
计算公式为:4个大格细胞总数×稀释倍数×10000/4=细胞数/mL。
注:(1)计数板计数时,最适浓度为5~100000 细胞/mL,此范围外计数误差偏大。
高浓度细胞悬液,可取出部分作稀释或连续稀释后计数。
(2)吸管吸取细胞,让吸管在计数板一侧的凹槽处流出液体,至盖玻片被液体充满为止,不要溢出盖玻片,也不要过少或带气泡;(有人认为,10 uL 就可以被虹吸作用吸入且铺满计数板)。
(3)移液器(20 μL 的微量加样器)吸取20 μL 细胞悬液至计数板边缘,液体经虹吸作用进入凹槽。
(4)静置半分钟再于显微镜下观察。
方法二:粒子计数器自动计数。

细胞计数方法——---—细胞计数板法实验原理:当待测细胞悬液中细胞均匀分布时,通过测定一定体积悬液中得细胞得数目,即可换算出每毫升细胞悬液中细胞得细胞数目。
具体操作:1. 将计数板及盖片擦拭干净,并将盖片盖在计数板。
2、将细胞悬液吸出少许,滴加在盖片边缘,使悬液充满盖片与计数板之间,静置3min,注意盖片下不要有气泡,也不能让悬液流入旁边槽中。
3。
计算板四大格细胞总数,压线细胞只计左侧与上方得。
然后按公式计算:细胞数/mL=四大格细胞总数/4×10个/ml(注:当细胞很多时,可在四个格中选一定数目较平均得小格,由于每大格中有16个小格,然后计左侧与上方得细胞数,求出每小格得细胞数,取平均值m,m×16即每个格得平均值。
所以,细胞密度=m×16×10个/ml)说明:公式中除以4,因为计数了4个大格得细胞数。
公式中乘以10因为计数板中每一个大格得体积为:1。
0mm(长)×1.0mm(宽)×0。
1mm(高)=0.1mm 而1ml=1000ul=1000mm (注意:镜下偶见有两个以上细胞组成得细胞团,应按单个细胞计算,若细胞团10%以上,说明分散不好,需重新制备细胞悬液。
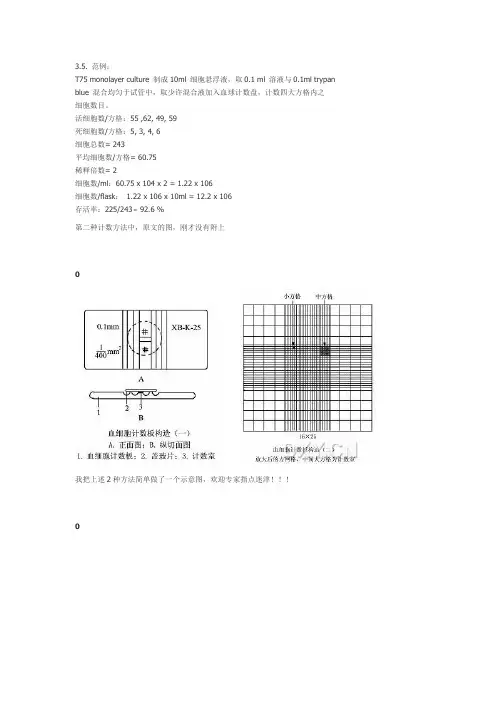
)================================================细胞计数板得使用一、血球计数板-基本构造血球计数板就是一块特制得厚型载玻片,载玻片上有四个槽构成三个平台。
中间得平台较宽,其中间又被一短横槽分隔成两半,每个半边上面各刻有一小方格网,每个方格网共分九个大格,中央得一大格作为计数用,称为计数区。
计数区得刻度有两种:一种就是计数区分为16个大方格(大方格用三线隔开),而每个大方格又分成25个小方格;另一种就是一个计数区分成25个大方格(大方格之间用双线分开),而每个大方格又分成16个小方格。
但就是不管计数区就是哪一种构造,它们都有一个共同特点,即计数区都由400个小方格组成、计数区边长为1mm,则计数区得面积为1mm2,每个小方格得面积为1/400mm2。
3.5. 范例:
T75 monolayer culture 制成10ml 细胞悬浮液,取0.1 ml 溶液与0.1ml trypan blue 混合均匀于试管中,取少许混合液加入血球计数盘,计数四大方格内之
细胞数目。
活细胞数/方格:55 ,62, 49, 59
死细胞数/方格:5, 3, 4, 6
细胞总数= 243
平均细胞数/方格= 60.75
稀释倍数= 2
细胞数/ml:60.75 x 104 x 2 = 1.22 x 106
细胞数/flask:1.22 x 106 x 10ml = 12.2 x 106
存活率:225/243﹦92.6 %
第二种计数方法中,原文的图,刚才没有附上
我把上述2种方法简单做了一个示意图,欢迎专家指点迷津!!!
1票
票数
玻片盖好加上液体后,液体高度是0.1mm(计数板上标的0.1mm就是指这个)
方法一,四个角的面积是1mm×1mm,体积就是0.1mm3,0.1mm3=0.1ul,若数出来数量是50,就是0.1ul 里面有50个细胞,乘上104就是1ml的细胞数,如果计数前稀释了10倍,就再乘以10.
所以计算公式就是:1ml细胞数=四个角的细胞总数/4×稀释倍数×104
方法二,同理了,一个大方格被分成25个中方格(中方格的面积就是1/25mm2),400个小方格(小方格的面积就是1/400mm2,计数板上标的1/400mm2就是指这个)。

细胞计数与存活的测试实验方法细胞冷冻与复苏是细胞培养的常规工作,可以解决细胞因为连续继代造成的退变或转化。
细胞的原代培养和传代培养以及细胞冻存和复苏后都需要细胞计数。
那么细胞计数与存活的测试实验方法有哪些呢?1、原理:(1)计算细胞数目可用血球计数盘或是Coultercounter粒子计数器自动计数。
(2)血球计数盘一般有二个chambers,每个chamber中细刻9个1mm2大正方形,其中4个角落之正方形再细刻16个小格,深度均为0.1mm。
当chamber上方盖上盖玻片后,每个大正方形之体积为1mm2×0.1mm=1.0x10-4ml。
使用时,计数每个大正方形内之细胞数目,乘以稀释倍数,再乘以104,即为每ml中之细胞数目。
(3)存活测试之步骤为dyeexclusion,利用染料会渗入死细胞中而呈色,而活细胞因细胞膜完整,染料无法渗入而不会呈色。
一般使用蓝色之trypan blue染料,如果细胞不易吸收trypan blue,则用红色之Erythrosin bluish。
计算细胞活率:活细胞数/(活细胞数+死细胞数)×100%。
计数应在台盼兰染色后数分钟内完成,随时间延长,部分活细胞也开始摄取染料;因为台盼兰对蛋白质有很强的亲和力,用不含血清的稀释液,可以使染色计数更为准确。
2、材料:0.4%w/v trypan blue(GibcoBRL15250-061);Erythosin bluish stain;取0.1gram Erythrosin bluish(SigmaE-9259)及0.05gram preservative methyl paraben(SigmaH-3647)溶于100mlCa++/Mg++freesaline;血球计数盘及盖玻片(Hemocytometerandcoverslip);计数器(counter);低倍倒立显微镜;粒子计数器(Coultercounter,CoulterElectronics)。

细胞计数法2009年02月06日星期五10:35细胞计数法是用来计数细胞悬液中细胞数量的一种方法。
一般利用计数板(血球计数板)进行。
即可用于分离(散)细胞培养接种前计数所制备的细胞悬液中的细胞数量,也可用于对培养物的细胞数量进行计数。
不论计数的对象如何,均须制备分散的细胞悬液。
1、制备细胞悬液对于悬液培养的细胞,可直接进行下面的步骤2(计数与计算过程)。
如果计数对象为贴壁生长的细胞,首先需将培养物制备成细胞悬液。
(1)终止培养,将培养液吸出,用PBS洗培养物一次。
(2)给培养瓶内加入1ml 0.25%胰蛋白酶溶液,于37℃消化3~5min 。
期间不断在镜下观察。
当细胞变圆接近脱壁时,弃消化液。
(3)加入一定量的培养液(如果这些培养细胞不再有用,可加PBS),用吸管吹打,使细胞脱壁而制成细胞悬液。
2、计数与计算过程(1)在细胞计数板中央放置计数专用的盖玻片。
(2)用玻璃虹吸管吸取细胞,让虹吸管在盖玻片上或下侧的计数板凹蹧处流出悬液,至盖玻片被液体充满为止。
(3)置显微镜下计数四角大方格内的细胞总数。
对于压线的细胞只计数在上线和左线者,对于细胞团按单个细胞计数。
(4)按下式计数细胞悬液的密度:细胞密度=(4个大格细胞总数/4)×104个/ml注意事项:(1)务必使分散成单个细胞,取样计数前,充分混匀细胞悬液。
(2)显微镜下计数时,遇到2个以上细胞组成的细胞团,应按单个细胞计算。
如果细胞团>10%,说明细胞分散不充分; 或细胞数<200个/10mm2或>500个/10 mm2 时,说明稀释不当,需重新制备细胞悬液。
实验原理:当待测细胞悬液中细胞均匀分布时,通过测定一定体积悬液中的细胞的数目,即可换算出每毫升细胞悬液中细胞的细胞数目。
具体操作:一、准备工作:取一瓶传代的细胞,待长成单层后以备使用。
二、细胞悬液制备:细胞悬液的制备方法是用0.25%的胰蛋白酶液消化、PBS液洗涤后,加入培养液(或Hanks液或PBS等平衡盐溶液),吹打制成待测细胞悬液。

实验原理:当待测细胞悬液中细胞均匀分布时,通过测定一定体积悬液中的细胞的数目,即可换算出每毫升细胞悬液中细胞的细胞数目。
具体操作:1. 将计数板及盖片擦拭干净,并将盖片盖在计数板。
2. 将细胞悬液吸出少许,滴加在盖片边缘,使悬液充满盖片和计数板之间,静置3min ,注意盖片下不要有气泡,也不能让悬液流入旁边槽中。
3. 计算板四大格细胞总数,压线细胞只计左侧和上方的。
然后按公式计算:细胞数∕mL=四大格细胞总数∕4× 104个/ml(注:当细胞很多时,可在四个格中选一定数目较平均的小格,由于每大格中有 16个小格,然后计左侧和上方的细胞数,求出每小格的细胞数,取平均值m,m× 16即每个格的平均值。
所以,细胞密度=m×16× 104个/ml)说明:公式中除以4,因为计数了 4个大格的细胞数。
公式中乘以104因为计数板中每一个大格的体积为:1.0mm (长)× 1.0mm (宽)× 0.1mm (高)=0.1mm 而 1ml=1OOOul=1OOOmm(注意:镜下偶见有两个以上细胞组成的细胞团,应按单个细胞计算,若细胞团1O%以上,说明分散不好,需重新制备细胞悬液。
)细胞计数板的使用一、血球计数板-基本构造血球计数板是一块特制的厚型载玻片,载玻片上有四个槽构成三个平台。
中间的平台较宽,其中间又被一短横槽分隔成两半,每个半边上面各刻有一小方格网,每个方格网共分九个大格,中央的一大格作为计数用,称为计数区。
计数区的刻度有两种:一种是计数区分为16个大方格(大方格用三线隔开),而每个大方格又分成25个小方格;另一种是一个计数区分成 25个大方格(大方格之间用双线分开),而每个大方格又分成16个小方格。
但是不管计数区是哪一种构造,它们都有一个共同特点,即计数区都由 4OO个小方格组成。
(d)tt X ⅛i*⅛lf fe ∙.■邛1 Ct*3⅞Hi⅞ft计数区边长为Imm ,则计数区的面积为Imm2,每个小方格的面积为1∕400mm 2。

细胞计数方法--—--—细胞计数板法实验原理:当待测细胞悬液中细胞均匀分布时,通过测定一定体积悬液中得细胞得数目,即可换算出每毫升细胞悬液中细胞得细胞数目。
具体操作:1、将计数板及盖片擦拭干净,并将盖片盖在计数板.2、将细胞悬液吸出少许,滴加在盖片边缘,使悬液充满盖片与计数板之间,静置3min,注意盖片下不要有气泡,也不能让悬液流入旁边槽中。
3、计算板四大格细胞总数,压线细胞只计左侧与上方得。
然后按公式计算:细胞数/mL=四大格细胞总数/4×10个/ml(注:当细胞很多时,可在四个格中选一定数目较平均得小格,由于每大格中有16个小格,然后计左侧与上方得细胞数,求出每小格得细胞数,取平均值m,m×16即每个格得平均值。
所以,细胞密度=m×16×10个/ml)说明:公式中除以4,因为计数了4个大格得细胞数。
公式中乘以10因为计数板中每一个大格得体积为:1、0mm(长)×1、0mm(宽)×0、1mm(高)=0、1mm 而1ml=1000ul=1000mm(注意:镜下偶见有两个以上细胞组成得细胞团,应按单个细胞计算,若细胞团10%以上,说明分散不好,需重新制备细胞悬液。
)================================================细胞计数板得使用一、血球计数板-基本构造血球计数板就是一块特制得厚型载玻片,载玻片上有四个槽构成三个平台。
中间得平台较宽,其中间又被一短横槽分隔成两半,每个半边上面各刻有一小方格网,每个方格网共分九个大格,中央得一大格作为计数用,称为计数区.计数区得刻度有两种:一种就是计数区分为16个大方格(大方格用三线隔开),而每个大方格又分成25个小方格;另一种就是一个计数区分成25个大方格(大方格之间用双线分开),而每个大方格又分成16个小方格。
但就是不管计数区就是哪一种构造,它们都有一个共同特点,即计数区都由400个小方格组成。

细胞计数方法------细胞计数板法实验原理:当待测细胞悬液中细胞均匀分布时,通过测定一定体积悬液中的细胞的数目,即可换算出每毫升细胞悬液中细胞的细胞数目。
具体操作:1. 将计数板及盖片擦拭干净,并将盖片盖在计数板。
2. 将细胞悬液吸出少许,滴加在盖片边缘,使悬液充满盖片和计数板之间,静置3min,注意盖片下不要有气泡,也不能让悬液流入旁边槽中。
3. 计算板四大格细胞总数,压线细胞只计左侧和上方的。
然后按公式计算:细胞数/mL=四大格细胞总数/4×104个/ml(注:当细胞很多时,可在四个格中选一定数目较平均的小格,由于每大格中有16个小格,然后计左侧和上方的细胞数,求出每小格的细胞数,取平均值m,m×16即每个格的平均值。
所以,细胞密度=m×16×104个/ml)说明:公式中除以4,因为计数了4个大格的细胞数。
公式中乘以104因为计数板中每一个大格的体积为:1.0mm(长)×1.0mm(宽)×0.1mm(高)=0.1mm3而1ml=1000ul=1000mm3(注意:镜下偶见有两个以上细胞组成的细胞团,应按单个细胞计算,若细胞团10%以上,说明分散不好,需重新制备细胞悬液。
)================================================细胞计数板的使用一、血球计数板-基本构造血球计数板是一块特制的厚型载玻片,载玻片上有四个槽构成三个平台。
中间的平台较宽,其中间又被一短横槽分隔成两半,每个半边上面各刻有一小方格网,每个方格网共分九个大格,中央的一大格作为计数用,称为计数区。
计数区的刻度有两种:一种是计数区分为16个大方格(大方格用三线隔开),而每个大方格又分成25个小方格;另一种是一个计数区分成25个大方格(大方格之间用双线分开),而每个大方格又分成16个小方格。
但是不管计数区是哪一种构造,它们都有一个共同特点,即计数区都由400个小方格组成。

细胞计数板计数方法
嘿,细胞计数板计数那可是超厉害的事儿呢!先说说步骤哈,把细胞悬液小心地滴到计数板上,就像给宝贝找个小窝。
然后在显微镜下观察,数清楚格子里的细胞个数。
这就跟在沙滩上找漂亮贝壳似的,得仔细看。
注意事项可不少呢!滴液的时候不能太多也不能太少,不然咋能数得准呢?那这过程安全不?放心啦!只要操作得当,就没啥危险,不像走钢丝那么让人提心吊胆。
稳定性也不错,只要按规矩来,结果一般都挺靠谱。
这计数方法能用在哪呢?在生物学研究里,那可是大功臣。
研究细胞生长、药物作用啥的,都离不开它。
就像厨师离不开锅铲,画家离不开画笔。
优势是啥呢?简单方便呀,不需要高大上的仪器,就能搞定细胞计数。
就像有个小魔法棒,轻轻一挥,细胞数量就知道啦。
给你讲个实际案例呗!有个实验室用细胞计数板计数,准确地知道了细胞的数量,为实验成功打下了坚实基础。
哇塞,这效果简直太棒啦!
细胞计数板计数方法超实用,能帮咱解决好多问题,大家一定要试试呀!。

细胞计数方法实验原理:当待测细胞悬液中细胞均匀分布时,通过测定一定体积悬液中的细胞的数目,即可换算出每毫升细胞悬液中细胞的细胞数目。
具体操作:1. 将计数板及盖片擦拭干净,并将盖片盖在计数板。
2. 将细胞悬液吸出少许,滴加在盖片边缘,使悬液充满盖片和计数板之间,静置3min,注意盖片下不要有气泡,也不能让悬液流入旁边槽中。
3. 计算板四大格细胞总数,压线细胞只计左侧和上方的。
然后按公式计算:细胞数/mL=四大格细胞总数/4×104说明:公式中除以4,因为计数了4个大格的细胞数。
公式中乘以104因为计数板中每一个大格的体积为:1.0mm(长)×1.0mm(宽)×0.1mm(高)=0.1mm3而1ml=1000mm3(注意:镜下偶见有两个以上细胞组成的细胞团,应按单个细胞计算,若细胞团10%以上,说明分散不好,需重新制备细胞悬液)正常细胞培养时,不论细胞的种类和供体的年龄如何,在细胞全生存过程中,大致都经历以下三个阶段:1、原代培养(Primary Culture)期也称初代培养,即从体内取出组织接种培养到第一次传代阶段,一般持续1一4周。
此期细胞呈活跃的移动,可见细胞分裂,但不旺盛。
初代培养细胞与体内原组织在形态结构和功能活动上相似性大。
细胞群是异质的(Heterogeneous),也即各细胞的遗传性状互不相同,细胞相互依存性强。
如把这种细胞群稀释分散成单细胞,在软琼脂培养基中进行培养时,细胞克隆形成率(Cloning Efficiency)很低,即细胞独立生存性差。
克隆形成率即细胞群被稀释分散成单个细胞进行培养时,形成细胞小群(克隆)的百分数。
初代培养细胞多呈二倍体核型;由于原代培养细胞和体内细胞性状相似性大,是检测药物很好的实验对象。
2、传代期初代培养细胞一经传代后便改称做细胞系(Cell Line)。
在全生命期中此期的持续时间最长。
在培养条件较好情况下,细胞增殖旺盛,并能维持二倍体核型,呈二倍体核型的细胞称二倍体细胞系(Diploid Cell Line)。

细胞计数方法--细胞计数板法实验原理:当待测细胞悬液中细胞均匀分布时,通过测定一定体积悬液中的细胞的数目,即可换算出每毫升细胞悬液中细胞的细胞数目。
具体操作:1. 将计数板及盖片擦拭干净,并将盖片盖在计数板。
2. 将细胞悬液吸出少许,滴加在盖片边缘,使悬液充满盖片和计数板之间,静置3min,注意盖片下不要有气泡,也不能让悬液流入旁边槽中。
3. 计算板四大格细胞总数,压线细胞只计左侧和上方的。
然后按公式计算:细胞数/mL=四大格细胞总数/4×104个/ml(注:当细胞很多时,可在四个格中选一定数目较平均的小格,由于每大格中有16个小格,然后计左侧和上方的细胞数,求出每小格的细胞数,取平均值m,m ×16即每个格的平均值。
所以,细胞密度=m×16×104个/ml)说明:公式中除以4,因为计数了4个大格的细胞数。
公式中乘以104因为计数板中每一个大格的体积为:1.0mm(长)×1.0mm(宽)×0.1mm(高)=0.1mm3而1ml=1000ul=1000mm3(注意:镜下偶见有两个以上细胞组成的细胞团,应按单个细胞计算,若细胞团10%以上,说明分散不好,需重新制备细胞悬液。
)================================================细胞计数板的使用一、血球计数板-基本构造血球计数板是一块特制的厚型载玻片,载玻片上有四个槽构成三个平台。
中间的平台较宽,其中间又被一短横槽分隔成两半,每个半边上面各刻有一小方格网,每个方格网共分九个大格,中央的一大格作为计数用,称为计数区。
计数区的刻度有两种:一种是计数区分为16个大方格(大方格用三线隔开),而每个大方格又分成25个小方格;另一种是一个计数区分成25个大方格(大方格之间用双线分开),而每个大方格又分成16个小方格。
但是不管计数区是哪一种构造,它们都有一个共同特点,即计数区都由400个小方格组成。
细胞计数一、手动计数1.1试剂耗材及仪器1.2、实验步骤(1)制备细胞悬液:将细胞用0.25%的胰酶消化后加入生理盐水或PBS制备成适当浓度的细胞悬液备用。
(2)计数板处理:用无水乙醇或95%乙醇溶液擦拭计数板后:,用绸布擦净:,另准备新盖玻片一张,把盖片覆在计数板上面。
(3)台盼蓝染色 0.4%的台盼蓝与细胞比例19混合均匀。
(4)加样 用滴管或移液器吸取染色后的细胞悬液10ul,从计数板边缘缓缓滴入:,使之充满计数板和盖片之间的空隙中:。
注意不要使液体流到旁边的凹槽中或带有气泡,否则要重做。
稍候片刻,将计数板放在低倍镜下(10×10 倍)观察计数。
(5)在显微镜下观察到死细胞被染色蓝色,而活细胞为无色透明状。
(6)计数方法 对计数板的四个角大方格(每个大方格又分16 个小方格)内的细胞数进行计数:。
注意计数时:,只计数完整的细胞:,若聚成一团的细胞则按一个细胞进行计数:。
在一个大方格中:,如果有细胞位于线上:,一般计下线细胞不计上线细胞,计左线细胞不计右线细胞。
二次重复计数误差不应超过±5%。
(7)浓度计算 细胞数/ml=(4个大方格细胞数/4)*稀释倍数*104。
1.3注意事项(1)细胞浓度过高时,需要进行适当的稀释,不然数数效果会有一定误差,同样也会影响计数。
(2)染色之后计数在3-5min之内完成,染色时间不宜过长,否则部分活细胞也会着色,从而干扰计数。
二、自动计数仪1.1赛默飞自动计数仪(1)制备细胞悬液:将细胞用0.25%的胰酶消化离心后加入生理盐水或PBS制备成适当浓度的细胞悬液备用。
(2)台盼蓝染色 0.4%的台盼蓝与细胞比例19混合均匀。
(3)加样 用滴管或移液器吸取染色后的细胞悬液10ul,从计数板月牙状边缘缓缓加入,使之充满计数板空隙之间,等待1min左右,将计数板加入计数仪中,调整参数计数。
(4)在计数仪计数界面下观察到死细胞被染色蓝色,而活细胞为无色透明状。
自然科学实验中的细胞计数技巧与方法细胞计数是生物学、医学等领域中常用的实验技术之一。
通过准确计数细胞数量,可以帮助科研人员了解细胞的生长、分裂、死亡等过程,从而推动科学研究的进展。
在细胞计数中,选择合适的技巧和方法对于结果的准确性至关重要。
本文将介绍一些常用的细胞计数技巧与方法。
1. 显微镜计数法显微镜计数法是最常用的细胞计数方法之一。
它通过使用显微镜观察细胞的形态和数量,从而进行计数。
在使用显微镜计数法时,需要将细胞样品制备成薄片,然后在显微镜下进行观察和计数。
这种方法需要经验丰富的实验人员进行操作,因为细胞的形态和密度可能会影响计数的准确性。
此外,显微镜计数法适用于较小的细胞数量,对于大量细胞的计数则不太适用。
2. 流式细胞仪计数法流式细胞仪是一种高级的细胞计数工具。
它利用细胞在流体中的特性,通过激光束的照射和细胞的荧光标记,实现对细胞数量的快速准确计数。
流式细胞仪计数法适用于大量细胞的计数,可以同时分析多个参数,如细胞大小、荧光强度等。
然而,流式细胞仪计数法的设备和操作较为复杂,需要专业的培训和经验,同时设备的价格较高,限制了其在一些实验室中的应用。
3. 细胞计数器计数法细胞计数器是一种常见且便捷的细胞计数工具。
它通过电子传感器对细胞进行计数,具有快速、准确的特点。
在使用细胞计数器进行计数时,需要将细胞样品与计数液混合,然后将混合液放入计数器中进行计数。
细胞计数器计数法适用于大量细胞的计数,可以提高实验效率。
然而,细胞计数器也存在一些局限性,如对细胞的大小和形态有一定的要求,同时在计数液的制备和操作过程中需要注意一些细节,以确保结果的准确性。
4. 自动图像分析计数法随着计算机图像处理技术的发展,自动图像分析计数法在细胞计数中得到了广泛应用。
它通过对细胞图像进行处理和分析,实现对细胞数量的计数。
自动图像分析计数法可以快速、准确地进行大量细胞的计数,同时可以提供更多的细胞参数信息。
然而,自动图像分析计数法的设备和软件较为复杂,需要专业的培训和操作,同时对于某些特殊形态的细胞可能会存在一定的误差。
环境工程微生物学实验实验一微生物细胞数的计数一、目的了解血球计数板的结构,掌握使用和计算方法。
二、仪器和材料1、器材:显微镜、擦镜纸、吸水纸、香柏油或液体石蜡、二甲苯。
2、测试样品:酵母菌液(细菌悬液也可)三、血球计数板的结构与计算方法血球计数板(图1)是一块比普通载玻片厚的特制玻片制成。
玻片中央刻有四条槽,中央两条槽之间的平面比其他平面略低,中央有一小槽,槽的两边的平面上各刻有9个大方格。
中间的一个大方格为计数室,它的长和宽各为1mm,深度为0.1mm,其体积为0.1mm3。
计数室有两种规格:一种是把大方格分成16中格,每一中格分成25小格,共400小格;另一种规格是把一大方格分成25中格,每一中格分成16小格,总共也是400小格。
计算方法如下:图1 血球计数板的结构图(A—正面图;B—侧面图)1、16×25的计数板计算公式细胞数/mL=(100小格内的细胞数/100)×400×10000×稀释倍数2、25×16的计数板计算公式细胞数/mL=(80小格内的细胞数/80)×400×10000×稀释倍数四、操作步骤1、稀释样品,为了便于计数,将样品适当稀释,使每格约含5个细胞。
2、取干净的血球计数板,用厚盖玻片盖住中央的计数室,用移液管吸取少许充分摇匀的待测菌液于盖玻片的边缘,菌液则自行渗入计数室,静置5~10min即可计数。
3、将血球计数板置于载物台上,用低倍镜找到小方格网后换高倍镜观察计数。
需不断地上、下旋动细调节器,以便看到计数室内不同浓度的菌体。
现以16×25规格的计数板为例,数四个角(左上、右上、左下、右下)的四中格(即100小格)的酵母菌数。
如果是25×16规格的计数板,除取四个角上四中格外,还取正中的一个中格(即80小格),对位于大格线上的酵母菌只计大格的上方及左方线上的酵母菌,或只计下方及右方线上的酵母菌。
血球计数板进行细胞计数细胞计数法是用来计数细胞悬液中细胞数量的一种方法。
一般利用计数板(血球计数板)进行。
即可用于分离(散)细胞培养接种前计数所制备的细胞悬液中的细胞数量,也可用于对培养物的细胞数量进行计数。
不论计数的对象如何,均须制备分散的细胞悬液。
1 制备细胞悬液(1)终止培养,将培养液吸出,用PBS洗培养物一次。
(2)给培养瓶内加入1ml 0.25%胰蛋白酶溶液,于37℃消化3~5min 。
期间不断在镜下观察,当细胞变圆接近脱壁时,弃消化液。
(3)加入一定量的培养液(如果这些培养细胞不再有用,可加PBS),用吸管吹打,使细胞脱壁而制成细胞悬液(一般满瓶细胞加4ml培养液)。
2 计数与计算过程(1)在细胞计数板中央放置计数专用的盖玻片。
(2)用加样枪吸取细胞,让加样枪在盖玻片上或下侧的计数板凹蹧处流出悬液,至盖玻片被液体充满为止(10-20μl)。
(3)置显微镜下计数四角大方格内的细胞总数(每个大格含有16个中格)。
对于压线的细胞只计数在上线和左线者,对于细胞团按单个细胞计数。
(4)按下式计数细胞悬液的密度:细胞密度=(4个大格细胞总数/4)×104个/ml。
说明:公式中除以4因为计数了4个大格的细胞数。
公式中乘以104因为计数板中每一个大格的体积为:1.0mm(长)×1.0mm(宽)×0.1mm(高)=0.1mm3而1ml=1000mm33 注意事项:(1)务必使分散成单个细胞,取样计数前,充分混匀细胞悬液。
(2)显微镜下计数时,遇到2个以上细胞组成的细胞团,应按单个细胞计算。
如果细胞团>10%,说明细胞分散不充分。
(3)进行细胞计数时,要求悬液中细胞数目不低于104个/ml,如果细胞数目很少要进行离心再悬浮于少量培养液中;(4)数细胞的原则是只数完整的细胞,若细胞聚集成团时,只按照一个细胞计算。
如果细胞压在格线上时,则只计上线,不计下线,只计右线,不计左线。
细胞计数方法------细胞计数板法实验原理:当待测细胞悬液中细胞均匀分布时,通过测定一定体积悬液中的细胞的数目,即可换算出每毫升细胞悬液中细胞的细胞数目。
具体操作:1. 将计数板及盖片擦拭干净,并将盖片盖在计数板。
2. 将细胞悬液吸出少许,滴加在盖片边缘,使悬液充满盖片和计数板之间,静置3min,注意盖片下不要有气泡,也不能让悬液流入旁边槽中。
3. 计算板四大格细胞总数,压线细胞只计左侧和上方的。
然后按公式计算:细胞数/mL=四大格细胞总数/4×104个/ml(注:当细胞很多时,可在四个格中选一定数目较平均的小格,由于每大格中有16个小格,然后计左侧和上方的细胞数,求出每小格的细胞数,取平均值m,m ×16即每个格的平均值。
所以,细胞密度=m×16×104个/ml)说明:公式中除以4,因为计数了4个大格的细胞数。
公式中乘以104因为计数板中每一个大格的体积为:1.0mm(长)×1.0mm(宽)×0.1mm(高)=0.1mm3而 1ml=1000ul=1000mm3(注意:镜下偶见有两个以上细胞组成的细胞团,应按单个细胞计算,若细胞团10%以上,说明分散不好,需重新制备细胞悬液。
)================================================细胞计数板的使用一、血球计数板-基本构造血球计数板是一块特制的厚型载玻片,载玻片上有四个槽构成三个平台。
中间的平台较宽,其中间又被一短横槽分隔成两半,每个半边上面各刻有一小方格网,每个方格网共分九个大格,中央的一大格作为计数用,称为计数区。
计数区的刻度有两种:一种是计数区分为16个大方格(大方格用三线隔开),而每个大方格又分成25个小方格;另一种是一个计数区分成25个大方格(大方格之间用双线分开),而每个大方格又分成16个小方格。
但是不管计数区是哪一种构造,它们都有一个共同特点,即计数区都由400个小方格组成。
手把手教你做细胞计数实验
实验用品
0.4% 台盼蓝溶液、无水乙醇或 95% 乙醇溶液、脱脂棉、普通显微镜、试管、吸管、毛细吸管、细胞计数板、绸布。
实验原理
在细胞培养工作中,常需要了解细胞生活状态和鉴别细胞死活,确定细胞接种浓度和数量以及了解细胞存活率和增殖度,如用酶消化制备的细胞悬液中细胞活力的鉴别,冻存细胞复苏后的活力检测等。
细胞悬液制备后,常用活体染料台盼蓝对细胞进行染色,进行细胞计数。
台盼蓝不能透过活细胞正常完整的细胞膜,故活细胞不着色。
而死亡细胞的细胞膜通透性增高,可使染料进入细胞内而使细胞着色(蓝色)。
细胞计数一般用血细胞计数板,按白细胞计数方法进行计数,便于确定细胞的生活状
况。
实验内容与方法
(一)制备动物细胞悬液
将动物细胞用生物盐水制备成适当浓度的细胞悬液备用。
(二)细胞计数
1.计数板处理
用无水乙醇或 95% 乙醇溶液擦拭计数板后,用绸布擦净,另擦净盖玻片一张,把盖片覆在计数板上面。
2.染色
用滴管吸取 0.4% 台盼蓝染液,按1∶1 比例加入细胞悬液中。
从计数板边缘缓缓滴入,使之充满计数板和盖片之间的空隙中。
注意不要使液体流到旁边的凹槽中或带有气泡,否则要重做。
稍候片刻,将计数板放在低倍镜下(10×10 倍)观察计数。
3.计数方法
按图计算计数板的四角大方格(每个大方格又分 16 个小方格)内的细胞数。
计数时,只计数完整的细胞,若聚成一团的细胞则按一个细胞进行计数。
在一个大方格中,如果有细胞位于线上,一般计下线细胞不计上线细胞,计左线细胞不计右线细胞。
二次重复计数误差不应超过±5%(图 7-1)。
镜下观察,凡折光性强而不着色者为活细胞,染上蓝色者为死细胞。