非金属及其化合物复习课
- 格式:ppt
- 大小:1.17 MB
- 文档页数:18





第四章《非金属及其化合物》复习教案【教学建议】对于非金属元素的考查,部分地区的高考中在保持原有考点不变的情况下,弱化了对磷的考查,但在以往高考中不被看好的元素硅及其化合物的性质在近年高考中的地位相当突出,要引起重视。
从考点的变化情况来看,常见非金属元素及其化合物的性质仍是高考命题的重点,其命题形式一般为实验探究、计算、推断等。
预计今后的高考中,将会进一步注重非金属元素及其化合物性质知识的整体性和探究性,强化与生活、社会实际问题的联系,试题可能以选择题的形式出现,也可能以实验题和无机推断题的形式出现,以环保为主题设计问题的可能性也比较大。
【复习策略】1.本单元中需要记忆的知识点较多,教师在教学时要注意引导学生以点带线,以线连面,即以具体物质推一般,以个别推整体。
2.要抓住“位——构——性”三者的关系,充分体现元素周期律、元素周期表的理论指导作用。
3.要充分体现氧化还原反应、离子反应等基本理论的指导作用。
4.本单元涉及的化学实验较多,要注意对实验的原理、设计、操作的要点及注意事项的理解,通过对实验现象的观察与思考,加深对物质性质的理解和掌握。
第10讲无机非金属材料的主角——硅【复习课题】无机非金属材料的主角——硅【考纲要求】1.碳、硅元素单质及其重要化合物的主要性质以及应用。
2.碳、硅元素单质及其重要化合物对环境质量的影响。
【课时安排】3课时1.第一课时:基础知识梳理2.第二课时:重、难点专题剖析3.第三课时:例题、变式训练讲评【第一课时:基础知识梳理】【教学过程】一、碳、硅网络导图二、硅及其重要化合物1、单质硅(Si):⑴存在:硅元素在地壳中的含量仅次于氧排第二,在自然界中没有游离态的硅,只有以化合态存在的硅,硅是一种亲氧元素(这与同主族的碳不同),一般以二氧化硅、硅酸盐的形式存在。
⑵物理性质:有金属光泽的灰黑色固体,熔点高,硬度大。
⑶原子结构:硅原子最外层有4个电子,既不易失电子又不易得电子,主要形成四价化合物。




高一化学必修1第四章 非金属及其化合物复习课一、硅及其化合物 1. 硅及其化合物的转化关系图 心。
、L 迎L %SiO,2. 硅及其化合物的特殊性(1) 非金属单质与强碱溶液反应一般不生成氢气,而硅与氢氧化钠等强碱溶液反应产生氢 气,且硅与氢气的物质的量之比为1 : 2…(2) 非金属单质一般不与非氧化性酸反应,而硅不但能与氢氟酸反应,而且有氢气生成。
无机酸一般易溶于水,而硅酸却是难溶于水的白色沉淀,这些往往也是框图推断题中的突破 口,因此要牢牢记住。
(3) 碳酸的酸性比硅酸强,二氧化碳、水与硅酸钠反应生成碳酸钠和硅酸沉淀。
在高温下 碳酸钠与二氧化硅反应生成硅酸钠和二氧化碳,其原因是在高温条件下,生成的二氧化碳离 开反应体系而能使反应进行到底。
二、氯及其化合物3. C1的检验物理性质:具有强烈 气味的. 制备原理: _________________________ 气体,密度比空气,能溶于水,有毒1.氯气 化学性熨2.氯水的成分及性质[与金国反应仁弩*一 I 与铜反应:_ 与非金属反应: _<与水反应: ____________制漂白液: 与破反.市!一"制漂白粉: ____卤素间的(通入KI 溶液:_置换反应"通..人NaBr 溶液: 成分:__________性质: ______、C 「的性质或CaO ⑨CO 2.H 2O 或强酸gc 。
,30,待测溶液先加 酸化,再加入 溶液,产生白色沉淀。
三、氮及其化合物物理性质:无色、有 气味、溶于水(水-+0H - 性 化学性质------- 1 原理:2NH,C1 + Ca (0H ): =^CaQ : +2H,0+ 2NH 3 T制法〈装置:H +固=-气收集: ___________ 法I 检验:湿润的 石蕊试纸或侬有浓盐酸的玻璃棒、用途〔硝酸的强裹化性 2. N 2> NO 和 NO21.氨、铉盐、硝酸;(物理性质:水 铉盐) |不稳定性! 一i 化学性质 I —与碱反应: ③④⑤四硫的氧化物及硫酸I ,物理性质: 色.有 气味的 毒气体.密度比空气大•容易液化.易溶于水,①与H ;0反应: _______________________________________酸性聂化物通性,②与碱反应: _________________________________________、③与碱性叙化物反应:漂白性:能使 槌色还原性:Cl : +S0, +2H,0 ^=2HC1 + H,SO 4 ①与H,0反应: _________________________________________________________________2.SO 3<j ②与破反应:S03 + Ba ( 0H )2 = ____________________________________________________.③与碱性氧化物反应:SO 3+CaO= ___________________________________________________稀H 2so 4:as 的通性ISO : I 化学性质、脱水性吸水性:干燥剂 强复化性课后作业•1.下列有关硅及其化合物的说法正确的是( )A. 晶体硅具有金属光泽,可以导电,属于金属材料B. 常温下,硅的化学性质稳定,所以自然界中的硅大部分以游离态存在 浓 H ;SO* 用途C.SiO2是一种酸性氧化物,能够与水反应生成相应的酸D.除去SiCh中混有的CaC03可加入适量的稀盐酸2.下列离子方程式不正确的是()A.石英与烧碱溶液反应:SiO2+ 2OH-=SiOi- + H20B.向小苏打溶液中加入过量的澄清石灰水:Ca2+ + OH「+ HCO]=CaCO3 I +H2OC.向氢氧化钠溶液中通入过量CO?: CO2 + 2OH ==COi +H2OD.晶体硅与NaOH 溶液反应:Si+2OH- + H2O==SiOi-+2H2 t3.下列有关氯气的说法正确的是()A.氯气是黄绿色的气体,有毒,有刺激性气味,不能溶于水B.将氯气持续通入紫色石蕊试液中,现象是先变红后褪色C.用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味D.氯水长时间放置不会变质,还可消毒杀菌4.甲、乙、丙3种溶液各含有■一种X—(X—为C「、或「),向甲中加入淀粉溶液和新制的氯水,溶液变为橙色,再加入丙溶液,颜色无明显变化,则甲、乙、丙依次为()A.Br > C「、IB. Br >「、CFC.「、Br「、ClD. C「、「、Br5.在下列反应中,硝酸既表现氧化性又表现酸性的是()A.FeO 和HNO3B. A1(OH)3与HNO3C. CuO 与HNO3D. CaCO3 与HNO36.某同学认为全运会金牌一“璇宝”为纯金制造,而非Cu合金,可用于检验的试剂是()A.盐酸B. CuSO4溶液C.硝酸D.硫酸7.将一盛满C12的试管倒立在水槽中,当日光照射相当一段时间后,试管中最后剩余的气体约占试管容积的()2 1 1 1A.^ B - C.^ D.-8.已知反应①2BrO; + Cl2==Br2+2ClO;②5C12+I2+6H2O=2HIO3+ 10HC1③CIO3+5C1 +6H*^=3C12+3H2。
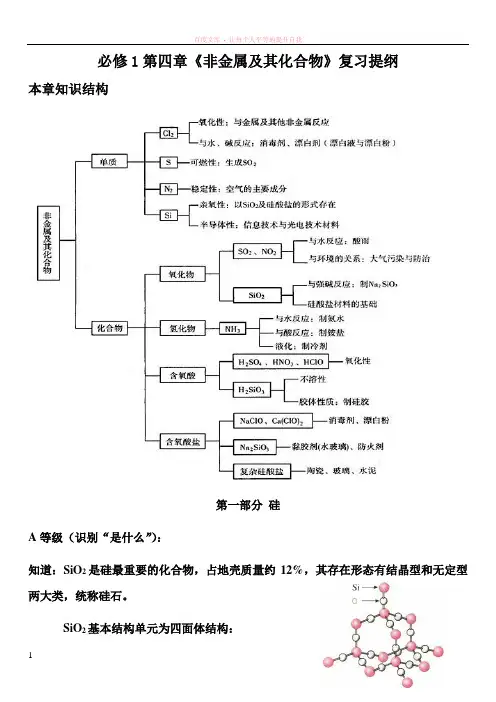
必修1第四章《非金属及其化合物》复习提纲本章知识结构第一部分硅A等级(识别“是什么”):知道:SiO2是硅最重要的化合物,占地壳质量约12%,其存在形态有结晶型和无定型两大类,统称硅石。
SiO2基本结构单元为四面体结构:高温 Si 与O 按1:2的比例组成立体网状结构。
B 等级(明确“是什么”): 二氧化硅和二氧化碳性质比较 物质二氧化硅 二氧化碳 熔沸点、硬度、状态很高、硬度大、固态 低、硬度小、气态化 学 性 质与水 不反应CO 2+H 2O=H 2CO 3 与氢氟酸 SiO 2+4HF=SiF 4↑+2H 2O 用HF 来腐蚀和雕刻玻璃。
不反应 与碱溶液 SiO 2+2NaOH=Na 2SiO 3+H 2O 盛装NaOH 溶液的试剂瓶用橡皮塞,而不用玻璃塞。
CO 2+2NaOH=Na 2CO 3+H 2O 与碱性氧化物SiO 2+CaO=CaSiO 3CO 2+CaO=CaCO 3异同点相同点都是酸性氧化物,都与碱或碱性氧化物反应。
不同点①CO 2与水反应生成H 2CO 3;SiO 2不与水反应; ②SiO 2溶于氢氟酸,CO 2不与氢氟酸反应;③SiO 2须在高温下与碱性氧化物反应,而CO 2可在常温常压下进行。
硅酸和碳酸的性质比较物质 硅酸 碳酸 化学式 H 2SiO 3 H 2CO 3 酸酐 SiO 2CO 2 制法硅酸胶体的制备:Na 2SiO 3+2HCl=2NaCl+H 2SiO 3↓CO 2+H 2O=H 2CO 3颜色与状态 白色、固体 无纯态,只存在于水溶液中水溶性 不溶于水只存在于水溶液中酸性比较H 2CO 3 >H 2SiO 3向硅酸钠饱和溶液中通入二氧化碳,同样可得到硅酸凝胶,说明硅酸是一种酸性比碳酸还弱的弱酸。
A等级(识别“是什么”):硅单质物性:①存在和形态:自然界中无游离态,主要以硅酸盐和二氧化硅形式存在。
②晶体硅是灰黑色、有金属光泽、硬而脆的固体。
③导电性:半导体材料,介于导体和半导体之间。
