第十六章元素有机化合物
- 格式:docx
- 大小:318.52 KB
- 文档页数:14


第十二章羧酸 (答案)1.解:(1)3-甲基丁酸(2)3-对氯苯基丁酸(3)间苯二甲酸(4)9,12-十八二烯酸3.解:4.解:6.解:7.按lewis酸碱理论:凡可接受电子对的分子、离子或基团称为酸,凡可给予电子对的分子、离子或基团成为碱。
8.解:9.解:9.解:C n H2n+1COOH=46。
所以n=0。
所以一元酸为甲酸(液体物质)。
若为二元酸,则M分子量=45*2=90, C n H2n(COOH)2=90。
所以n=0,故二元酸为乙二酸(固体物质)。
10.解:根据题意,B为二元酸,C可与苯肼作用,为羰基化合物,D为烃。
故A可能为环醇或环酮。
依分子式只能为环醇。
所以11.解:(1)由题意:该烃氧化成酸后,碳原子数不变,故为环烯烃,通式为C n H2n-2。
(2)该烃有旋光性,氧化后成二元酸,所以分子量=66*2=132。
故二元酸为。
12.由题意:m/e=179,所以马尿酸的分子量为179,它易水解得化合物D和E,D的IR谱图:3200-2300cm-1为羟基中O-H 键的伸缩振动。
1680为共扼羧酸的>C=O 的伸缩振动;1600-1500cm-1是由二聚体的O-H键的面内弯曲振动和C-O 键的伸缩振动之间偶合产生的两个吸收带;750cm –1和700cm-1是一取代苯的C-H键的面外弯曲振动。
再由化学性质知D为羟酸,其中和当量为121±1,故D的分子量为122,因此,。
又由题意:E为氨基酸,分子量为75,所以E的结构为H2NCH2COOH。
第十三章羧酸衍生物(答案)1. 说明下列名词:(答案)酯、油脂、皂化值、干性油、碘值、非离子型洗涤剂。
• 酯:由酸和醇脱水后形成的化合物;• 油脂:有有机酸酯和无机酸酯。
油脂是高级脂肪酸甘油酯的总称。
• 皂化值:工业上把1g 油脂完全皂化所需要的KOH 的毫克数叫做这种油脂的皂化值。
• 干性油:干结成膜快;• 碘值:100g 油脂所能吸收的碘的克数称为碘值(又称碘价)。


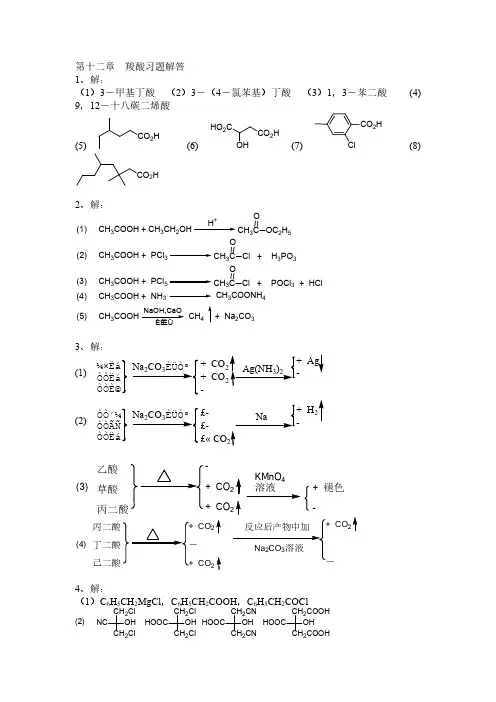
第十二章 羧酸习题解答1、解:(1)3-甲基丁酸 (2)3-(4-氯苯基)丁酸 (3)1,3-苯二酸 (4)9,12-十八碳二烯酸(5)CO 2H(6)HO 2CCO 2HOH(7)CO 2HCl(8)CO 2H2、解:(1) CH 3COOH + CH 3CH 2OHH +CH 3C OOC 2H 5(2) CH 3COOH + PCl 3CH3C O Cl + H 3PO 3(3) CH 3COOH + PCl 5CH 3C O Cl + POCl 3 + HCl(4) CH 3COOH + NH 3CH 3COONH 4(5) CH 3COOHCH 4NaOH,CaO+ Na 2CO 33、解:¼×ËáÒÒËáÒÒÈ©+ CO+ CO -(1)ÒÒ´¼ÒÒÃÑÒÒËá£-£- £« CO(2)乙酸草酸丙二酸-+CO 2+CO 2KMnO 4溶液+褪色-(3)丙二酸丁二酸己二酸CO 2CO 2CO (4)4、解:(1)C 6H 5CH 2MgCl ,C 6H 5CH 2COOH ,C 6H 5CH 2COClNC CH 2Cl CH 2ClOHHOOC CH 2Cl CH 2Cl OH HOOC CH 2CN CH 2CN OH HOOC CH 2COOHCH 2COOHOH(2)5、解:H 2C CH 23C CH 2NaCN3CH 2H 3O +3CH 2COOH(1)CH 3CH 2CH 2H +∆H 3CHC CH 2HBr¹ýÑõ»¯ÎïCH 3CHCH 3BrNaCNCH 3CHCH 3CNH 3O +CH 3CHCH 3COOH(2)CH 3CH 2COOH P + BrCH 3Br OH -CH 3CHCOOHOH (3)CH 3CH 2COOH +(4)CH 3CH 2COOH P 2O5∆(CH 3CH 2CO)2OBrEt 2OMgBr CO 2H 2OCOOH 2C 2H 5(5)6三个碳原子,只能是CH 3CH 2COOH 。



第十六章 元素有机化合物问题和习题解答(曾昭琼主编,有机化学,2004 第四版,下册P183-184)(井冈山学院化学系,方小牛提供).1. 解释下列名词,并举例说明之:(1)金属有机化合物 (2)p -络合物 (3)金属化反应 (4)氢金属化反应 (5)氧化-加成反应 (6)羰基化反应 解:(1) 金属有机化合物:是指有机基团以碳原子直接与金属相连接的化合物。
如Grignard 试剂RMgX ,烷基锂RLi ,二茂铁(C 5H 5)2Fe 等。
(2) p -络合物:是指亲电试剂(特别是过渡金属元素)与p 体系的有机物(如不饱各烃、芳烃)中的p 电子云形成的配合物。
如Ni(CO)4, 二茂铁(p -C 5H 5)2Fe, Zeise 盐等。
(3) 金属化反应:有些具有活泼氢的烃类,如乙炔、环戊二烯、三苯甲烷以及一些杂环化合物如呋喃、噻吩等可以直接与金属或金属有机化合物反应,活性氢被金属取代而生成相应的金属烃基化合物,这类反应称为金属化反应。
(4) 氢金属化反应:III~VIA 族元素的氢化物很活泼,M -H 键易与碳碳双键或叁键进行加成反应而生成相应的烃化物,此类反应称为氢金属化反应。
如:(5) 氧化加成反应:卤代烃配位体加成到配位尚未饱和的过渡金属配合物上的反应称为氧化-加成反应。
如:(6) 羰基化反应:在羰基铁、镍或钴催化下,由氢,一氧化碳对烯烃加成,生成醛的反应称为羰基化反应。
如:2.命名下列化物:(1) (CH3)3Si-O-Si(CH3)3 (2) CH2=CH-Si(CH3)3(2) (C6H5)3SiOH (4) (CH3)2BCH(CH3)2(5) CH3OBCl2 (6) (C6H6)2Cr解:(1) 六甲基二硅氧烷(2) 三甲基乙烯基硅烷(3) 三苯基硅醇(4) 二甲基异丙基硼烷(5) 甲氧基二氯化硼(6) 二苯铬3.写出下列物质的结构式:(1) 齐格勒-纳塔催化剂(2) 9-BBN (3) 三甲硅基烯醇醚(4) 三苯膦羰基镍(5) 蔡塞盐(6) 威尔金逊催化剂解:(1) (C2H5)3Al-TiCl3 (or TiCl4 )(3) (CH3)3SiOCH=CHR(4) Ph3PNi(CO)3(5) K[PtCl3·C2H4](6) (Ph3P)3RhCl4. 写出下列各反应的主要产物:5.完成下列转化:6.对下列化合物,你能提出哪几种合理的合成步骤。


有机化合物知识点归纳总结一、有机化合物的概念。
1. 定义。
- 有机化合物通常是指含碳元素的化合物,但一些简单的含碳化合物,如一氧化碳(CO)、二氧化碳(CO₂)、碳酸盐(如CaCO₃)、碳化物(如CaC₂)等,由于它们的性质与无机物相似,通常被归为无机物。
2. 组成元素。
- 除碳元素外,有机化合物还常含有氢、氧、氮、硫、磷、卤素等元素。
二、甲烷(CH₄)——最简单的有机化合物。
1. 分子结构。
- 甲烷分子是正四面体结构,碳原子位于正四面体的中心,四个氢原子位于正四面体的四个顶点。
- 甲烷分子中的C - H键为极性共价键,但由于甲烷分子结构对称,所以甲烷是非极性分子。
2. 物理性质。
- 无色、无味、密度比空气小(标准状况下,密度为0.717g/L)的气体。
- 极难溶于水。
3. 化学性质。
- 稳定性:通常情况下,甲烷比较稳定,与强酸、强碱、强氧化剂等一般不发生反应。
- 氧化反应。
- 可燃性:CH₄+2O₂{点燃}{→}CO₂ + 2H₂O(火焰呈淡蓝色)。
- 取代反应。
- 甲烷与氯气在光照条件下发生取代反应,反应的化学方程式为:- CH₄+Cl₂{光照}{→}CH₃Cl+HCl(一氯甲烷,气体);- CH₃Cl+Cl₂{光照}{→}CH₂Cl₂+HCl(二氯甲烷,液体);- CH₂Cl₂+Cl₂{光照}{→}CHCl₃+HCl(三氯甲烷,又称氯仿,液体);- CHCl₃+Cl₂{光照}{→}CCl₄+HCl(四氯化碳,液体)。
三、烷烃。
1. 概念。
- 烷烃是只由碳和氢两种元素组成,分子中的碳原子之间都以单键相结合,碳原子的剩余价键均与氢原子结合,使碳原子的化合价都达到“饱和”的一类有机化合物,又叫饱和烃。
2. 通式。
- CₙH₂ₙ₊₂(n≥1)。
3. 物理性质。
- 随着碳原子数的增多,烷烃的状态由气态(n = 1 - 4)逐渐变为液态(n = 5 - 16)、固态(n≥17)。
- 烷烃的密度逐渐增大,但都小于水的密度。
♦元素有机化合物的涵义和分类;♦元素有机化合物的合成方法;♦有机锂、硼、硅化合物结构和性质;♦了解过渡金属π络合物。
♦元素有机化合物的涵义和分类;♦有机锂、硼、硅化合物的重要反应。
1元素有机化合物的涵义(CH 3)3B含有氢、氧、氮、硫、氯、溴、碘以外的其他元素-碳键的有机化合物。
C 2H 5MgBr(C 6H 5)3SiCl三甲基硼烷溴化乙基镁三苯基氯硅烷C 2H 5PO OCH 3OCH 3乙基膦酸二甲酯Ti(OC 2H 5)4钛酸乙酯不是元素有机化合物。
2元素有机化合物的价键类型H He Li* Be* B* C N O F Ne Na Mg* Al* Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn Fr Ra Ac Rf Ha U nh Uns Uno Une主要形成离子型化合物,主要形成π络合物,主要形成σ键化合物,* 可形成桥键化合物。
(1)非金属元素硼、硅、磷、砷、硒、碲、氟,与碳原子以σ型共价键相连。
键的极性,可以根据元素电负性作粗略估计。
C—F键,极性极性很强;其余几种非金属元素-碳键的极性不强。
(2)金属元素非过渡金属元素:第一、二主族的钠、钾、铷、铯和钙、锶、钡常生成离子键型金属有机化合物。
其余非过渡金属元素一般生成共价键型金属有机化合物。
(C2H5)2Mg (C5H5)-Mg+二乙基镁,共价键型二环戊二烯基镁,离子键型过渡金属元素:与有机基团(烃基、酰基)形成σ型金属-碳共价键;与不饱和的有机基团或分子形成非经典的多原子π型键。
FeCOCOOCCH 2 CH 2Cl Pt ClClK+-三氯乙烯合铂(II )酸钾环戊二烯基三羰基铁3元素有机化合物的分类(1)离子型化合物第一、二主族的烃基化合物,通式为RM、R2M。
第十六章元素有机化合物一、教学目的和要求1、掌握元素有机化合物的分类及重要性2、掌握C—M健的一般合成方法3、掌握过渡金属n -络合物的结构及合成上的应用4、了解有机元素化合物的性质及在合成上的应用二、教学重点与难点1、C— M健的一般合成方法2、过渡金属n —络合物的结构及合成上的应用三、教学方法和教学学时1、教学方法:以课堂讲授为主,结合必要的课堂讨论。
教学手段以板书和多媒体相结合。
2、教学学时:4学时四、教学内容第一节元素有机化合物的分类及重要性第二节C—M健的一般合成方法一、金属与卤代烃反应二、金属盐与有机金属化合物的反应三、烃类金属化反应四、金属或非金属氢化物与不饱和烃的加成第三节有机锂化合物有机锂化合物的结构、性质及在合成上的应用第四节第四节烷基硼化合物一、烷基硼及在合成上的应用二、烷基硼反应的立体化学第五节有机硅化合物有机硅化合物的制备及在合成上的应用第六节过渡金属n —络合物一、过渡金属元素的成健特征二、不饱和烃n —络合物、夹心结构n —络合物、金属n —络合物的结构五、课后作业、思考题习题:3, 4, 5。
我们学习过的有机化合物,归纳起来主要是含有H , O, N , X及S, P等元素的碳化合物。
这些元素以各种各样的方式与碳相结合,形成了数以百万计的有机化合物。
然而,能够与碳相结合的元素并非仅限于上述少数几个几素,除了零族元素以外,绝大多数元素都能与碳相结合,形成了一大类新颖的有机化合物,它们被统称为元素有机化合物、严格地讲,元素有机化合物是指有机基团以碳原于直接与金属或非金属元素相连结的化合物。
如果有机基团是通过氧原于与金属或非金属元素相连接的,这一类化合物就不属于元素有机化合物。
本章将重点讨论锌、硼、硅及过渡元素的右机化合物、皱合前面已学过的有关镁、磷、硫等元素有机化合物的知识,使我们对元素有机化学有一个初步的认识。
§ 16-1元素有机化合物的分类和重要性一、元素有机化台物的分类根据元素在周期表的地位从各元素与碳成链的类型,大体上可把元素有机化合物分为离子型化合物,d键化合物以及非经典键化合物等三大类型。
1.离子型化合物碱金属和碱土金属电负性很小。
它们所形成的烃基化合物,大多为离子型化合物,其通式为RM , R2M ,它们具有离子化合物的典型特征,可以把它们看作为烃R —H的盐类。
由K, Na, Ca, Sr, Ba等元素所形成的烃基化物,一般不溶于烃类溶剂,具有异乎寻常的反应活性,其溶液可以导电,对空气敏感,遇水发生剧烈水解。
2.d键化合物IB、川B及m —W B等元素电负性较大,它们主要生成d键化合物,即有机基团以d键与金属或非金属元素相键合的化合物,在这类化合物中,虽然有些化合物的离子特性仍相当大,但大多数化合物是共价键占优势,典型的d键化合物的反应活性比典型的离子键化合物小,具有挥发性,对空气稳定,一般溶于非极性溶剂。
3.非经典键化合物在元素有机化合物中,除了上述的离子型和d键型化合物外,还存在许多化合物,它们分子中的M—C键不能用普通的离子键或d键来描述,其中有一类是属于多中心键型化合物。
另一大类非经典键化合物是由过渡金属与不饱和烃、芳烃(包括非苯芳烃)形成的化合物,通称为过渡金属n —络合物。
二、元素有机化台物的重要性元素有机化合物在理论研究上丰富和发展了化学结构理论,它在实际应用上为工农业生产以及国防、尖端科学提供了性能优异的合成材料和各种具有特殊性能的化学物质。
元素有机化合物作为有机合成试剂利有机反应的高教、高选择性催化剂,近二十多年来进行了广泛而深入的研究,发展迅速。
§ 16-1 C —M键的一般合成方法合成金属或非金属的 C 一 M 键的方法很多,这里将结合以下各节的有关内容较 典型的制法介绍如下:一、金属与卤代烃反应利用金属句卤代烃直接反应制备金属有机化合物的方法历史悠久。
典型的例子 是格氏试剂合成法,有机锂化合物也主要用该法制备。
” -G&CI + 2口 汎-(:"加口+Li 口二、金属盐与有机金属化台物反应利用碱金属或碱土金属的有机化合物与其他金属盐类 (如卤化物)反应,来合成其他金属的有机化合物,此反应可看作是复分解反应。
2C 2H s Li+Zn(:!: —-(C-HjJjZn + 2I J Q iQHaMgCl F CdCk —•(QHJiCd + ZMgCh 3C fl H 5 M e Br + BF*MgRrF2(.^H t MgRr 卜 迥—YG 區bSig 辽MgRiCl 3&出屈尺由+A]Cb —(C ,H 3)J A] + 3M K BrCI三、烃类的金后化反应■ XJ Lj .GH& + Na- <\H ;Na + L yH ? 环戊二册四、金属或非金属氢化物与不饱和烃加成THI< ”、RCn —cib + HIL - FRCHQHJP- or: -RCH —Clb I H- Si<h 一 A _ RO4&H£i (?bB —L.§ 16-2有机锂化台物、结构和性质1- 2L ,i25V-LiBr+ x-GKAi —锂的烃化物具有碱金属有机化合物的一些通性;例如,化学性质很活泼•暴露在空气中立即自然与水及水蒸气迅速反应等。
但是行机理化合物在化学键特性上和一些主要的物理性质上同其他碱金属有机化合物之间存在着明显的差别。
有机理化合物通常为液体或低熔点固体。
烷基锂的反应活性与分子缔合度很有关系、缔合作用降低了烷基锂的反应活性,聚集态的活性远低于单体烷基锂的活性。
、有机锂化台物在有机合成中的应用在碱金属有机化合物中以有机锂化合物的活性最小,但要比格氏试剂更活泼些,反应方式与格氏试剂相同。
1.与CO2及活性氢的化合物反应烷基锂与C02反应生成羧酸盐,酸化转变为羧酸,这是实验室里合成羧酸的一种方法。
CO?RLi 一- RCOOIJ 一:一RCnOH2.与碳基化合物的加成反应烷基锂与醛、酮反应分别得到第二醇和第三醇。
反R rI _ HjC)H iHL I +X?=Q R—O 亠0 Li1- - —R— C - OHR" - 丨I3.与羧酸反应4与a 、B —不饱和碳基化合物的共扼加成格氏试剂和有机锂试剂与 1, 4—不饱和酮的加成反应 1, 2—加成和1 , 4—加成 方式都可能发生,而有机铜锂试剂对 1, 4—不饱和酮的加成选择性极好,基本上生成1, 4 —加成产物。
例如:99%CH,C)!IIC C —ICH 3 72%§ 16-3有机硼化合物硼和铝同为川A 元素,可是硼的化学行为不太象侣而象硅。
硼可以形成许多硼 氢化合物,简称为硼烷。
一、二硼烷最简单的硼烷是 BH 3,它不能游离存在,倾向于二聚为比较稳定的二硼烷 B 2H 6。
二硼烷为气体(沸点一92C ),在空气中自燃,遇水立即水解为出和B(0H)3。
2NaBH 4 + 2CH 3COOH -B 2H 6 +2^ +2CH 3COONaI』+ (CH ?)s CuLi-1)乙, lOrrnn <■-CH 2—CH3NaBH 4 + 4BF 3 * 0 (C/J 2 m+3NaBF 4 +4 (C 2H S ) 20二、烷基硼硼烷中的氢被烃基取代后的化合物称为烃基硼烷。
RBHRBH 一烃基硼烷二烃基硼烷最简单的三烃基硼烷是三甲基硼烷, 分子中的硼呈 平面三角形构型。
三烃基硼烷形成配位化合物后, 硼呈 变成四面体构型。
B十:NH, --------- — _I/八CH S C 比 CH.平面构型 阿闻侔构塑 W 杂此)3’杂比)/RCH=CH,.、KC 由CH 尹吃兔比― RCH^CHjBH ,. ---------------- (KCHjCH^EH一烷基硼烷二烷基硼烷RCH=CH ?------- 1(RCH 2CH 2) 3B三烷基珈烷三、烷基硼在有机合成中的应用 1.硼氢化-还原烯烃的硼氢化-还原相当于烯烃的双键发生顺式加氢,最后得到烯烃的还原产物烷烃。
RB 三烃基硼烷sp 2杂化,分子的立体形象是 sp 3杂化,分子的立体形象转*NH SRC = CH+l/ZB^Hg — R^C = CH+R 2BH —2.硼氢化-卤化烯烃在适当条件下发生的硼氢化-卤化反应相当于烯烃的双键与卤化氢发生反马氏规则的加成,产物是卤代烃。
例如,三烃基硼烷在氧化剂氯胺T的存在下,可以和碘化钠发生反应,得到的产物相当于原料烯烃与碘化氢发生了反马氏规则的加成。
3.硼氢化-氧化烯烃的硼氢化-氧化相当于烯烃的双键和水发生反马氏规则的加成,可以用来制备醇。
而炔烃的硼氢化-氧化则可以用来制备醛和酮。
CH.CH/C=CHC2H5 CHCH^C 尹5B£V THF硼氯化「C = C\H> n-C4H9CHjCHO4.硼氢化-加成许多烃基硼烷可与类化合物。
a , 3 -不饱和醛、酮发生1 , 4-加成,继而水解得到醛、酮烯悭R S B^H2=CH-C-CH^RCH2CH=C-CHRCH2CH2CCHCH3COOH L H.H2o5J oir氧化'u ru异松垛磐B位上有烷基取代的a,3 -不饱和醛、酮要在自由基引发剂的存在下才能顺利进行此类反应。
少数烷基硼烷可与醛发生1 , 2-加成,然后在碱性条件下氧化得到醇。
H2O2J OH"5.硼氢化-烃基化在碱性条件下,烷基硼烷可使a -卤代羰基化合物发生烃基化反应,这是在羰基a -碳上接长碳链的良好方法。
a +峡罰(»B啓严卞D YH J-OR6. 选择性还原许多烃基硼烷是具有高度选择性的还原剂,它们能使醛羰基、酮羰基顺利还原,而分子中的硝基、酯羰基、羧酸羰基等不受干扰。
还原的立体选择性也很高。
CH5CCOOC2H5〔—孩基円-[3. 3.1]壬顷旦<CH3CHCOOC^H582畑7. 烯烃的立体选择性合成乙烯基硼烷的衍生物在制备Z型烯烃、E型烯烃、共轭E, E-二烯烃、共轭Z,E-二烯烃和共轭Z, Z-二烯烃方面具有很高的选择性。
例如,将碘加到烯基、二烷基或环烷基硼烷的碱溶液中,硼原子上的一个烷基基团转移到邻近的碳原子上,生成Z型烯烃。
而烯基、二烷基硼烷同溴化腈反应则生成E型烯烃。
又如,二烯基氯代硼烷在甲基铜诱导下发生偶联反应可得到立体化学纯度很高、产率很好的(E, E)-1 , 4-二烯化合物。
> CHXH,C= C< 2 SCH3CH/K CH2CH3烃基硼烷涉及到的反应丰富多样,而且大都具有反应条件温和、操作简便、立体选择性好、产率高等优点,它们在精细有机合成方面、特别是在天然产物的立体合成方面显现了很好的应用价值。
§ 16-2 有机硅化合物一、有机硅化合物的结构硅是第W A元素,位于碳之下,外层电子构型为3s23p2,硅在大多数化合物中处于sp3杂化状态,是四价元素,当它以单键与四个不同的基团相连时,分子的立体形象呈四面体结构,有一对光活性异构体。