热学第四章习题参考答案
- 格式:doc
- 大小:334.50 KB
- 文档页数:7


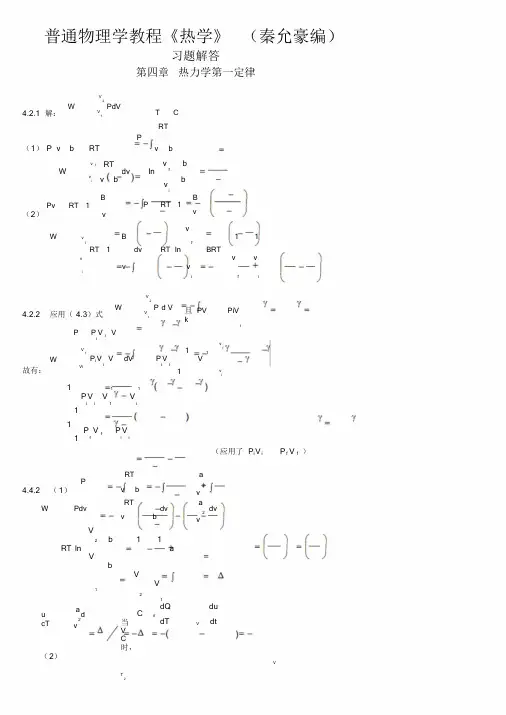
普通物理学教程《热学》(秦允豪编)习题解答第四章 热力学第一定律4.2.1 解:⎰-=21V V PdVW C T =(1)()RT b v P =-b v RTP -=⎪⎪⎭⎫ ⎝⎛---=--=⎰b v b v dv bv RTW i f v v fi ln(2)⎪⎭⎫ ⎝⎛-=v B RT Pv 1 ⎪⎭⎫ ⎝⎛-=v B RT P 1 ⎪⎪⎭⎫ ⎝⎛-+-=⎪⎭⎫ ⎝⎛--=⎰i f i f v v v v BRT v v RT dv v B RT W f i11ln 14.2.2 应用(4.3)式⎰-=21V V PdVW 且k PiV PV i ==γγ γγ-=V V P P i i故有:fifv v i i V Vii i V V P dV V V P W γγγγγ----=-=⎰111()()i i f f i f i i V P V P V V V P --=--=--111111γγγγγ (应用了γγf f i i V P V P =)4.4.2 (1)2v ab v RT P --=⎰⎰⎰+--=-=dvv adv b v RT Pdv W 2aV V b V b V RT ⎪⎪⎭⎫⎝⎛--⎪⎪⎭⎫ ⎝⎛---=121211ln (2)d v a cT u +-=2当C V =时,V V V dt du dT dQ C ⎪⎭⎫ ⎝⎛=⎪⎭⎫ ⎝⎛= ∴C C V =TC CdT Q T T ∆==⎰214.4.3 水蒸气的凝结热即为定压状况下单位质量物质相变时吸收(或释放)的热量,在等压下此值即为比焓变化,即:()kJh mHl V 4.244459.1000.2545-=--=∆-=∆= (系统放热)4.4.4 铜升温过程,是等压过程()212121221T T T T T T P P bT aT dT bT a dT C Q H ⎪⎭⎫⎝⎛+=+===∆⎰⎰()()2122122T T b T T a -+-=()()122447107.2300120092.5213001200103.2-⋅=-⨯⨯+-⨯⨯=mol J4.4.515.46190846823866921291542321223-⋅-=⎪⎭⎫⎝⎛⨯+⨯--=+-=mol J h h h Q H N NH P4.4.6 在定压情况下,21molH 和221molO 化合生成mol 1水时吸收的热量为 1510858.2-⋅⨯-=∆=mol J H Q (系统放热Q Q -=')每产生一个水分子有两个电子自阴极到阳极,生成mol 1水有A N 2电子到阳极。
普通物理学教程《热学》 (秦允豪编)习题解答第四章 热力学第一定律V24.2.1 解:WV1PdVT CRT P(1) P v bRT vbWvvi fRT v bdv lnv fvibbB Pv RT 1 (2)vPRT 1B vWvvB11 ffRT 1dv RT lnBRTvvvvviifiV24.2.2 应用( 4.3)式WV1P d V且PVPiVkiPP V i i V故有:VfWVi1 P i V VdV P VViii11vfvi11 1P V VViifi11 1 P fVfP Vii(应用了 P i V iP f V f )4.4.2 (1)PRT vba 2vWPdvRT vbdv a 2 vdv V2b 1 1RT lnaVbVV121u cTa 2 vd当VC时,C VdQdT Vdu dt(2)VT2∴C CV QT1C d T C T4.4.3 水蒸气的凝结热即为定压状况下单位质量物质相变时吸收(或释放)的热量,在等压下此值即为比焓变化,即:l HV h 2545 .0 100 .59 2444 .4 m kJ(系统放热)4.4.4 铜升温过程,是等压过程T2H QT T12 2P C dT a bT dT aT bTPT T21 12T1a T2 T1b2T 222T114 2 22.310 1200 300 5. 92 1200 300212. 47107 J mol4.4.5Q hP NH1 3 1 33 h h 29154 8669 8468 46190 .5 J mol2 2N H2 2 2 214.4.6 在定压情况下,1molH 2 和12molO2化合生成1mol 水时吸收的热量为5 1Q (系统放热Q ' Q )H 2 .858 10 J mol每产生一个水分子有两个电子自阴极到阳极,生成 1 m ol 水有2 N A 电子到阳极。
总电量为q 19 232 (q 2N e )1 .60 10 6 .02 10 CA两极间电压为, A q19 23A 1 .229 2 1 .60 10 6 .02 1082.84%5Q' 2. 858 104.4.7 设 1 m ol 固体状态方程为:v v aT bP0 ,内能表示为:u CT aPT ,a 均为常数。


秦允豪热学第四章习题答案秦允豪热学第四章习题答案热学作为一门物理学科,研究的是物体的热现象和热力学规律。
而在学习热学的过程中,习题是不可或缺的一部分。
本文将为大家提供秦允豪热学第四章习题的答案,希望能够帮助大家更好地理解和掌握热学知识。
第一题:一个理想气体在等温过程中,其体积由V1变为V2,求该过程中气体对外界做功的大小。
答案:根据理想气体的状态方程PV=constant,可知P1V1 = P2V2。
由于等温过程中温度保持不变,所以P1 = P2。
因此,对外界做功的大小为W = P1(V2 - V1) = P2(V2 - V1)。
第二题:一个物体的质量为m,温度由T1降低到T2,求该过程中物体释放的热量。
答案:根据热容的定义,热量Q = mcΔT,其中c为物体的比热容,ΔT为温度变化。
由于温度由T1降低到T2,所以ΔT = T2 - T1。
因此,物体释放的热量为Q = mc(T2 - T1)。
第三题:一个理想气体在等压过程中,其体积由V1变为V2,求该过程中气体吸收的热量。
答案:根据理想气体的状态方程PV=constant,可知P1V1 = P2V2。
由于等压过程中压强保持不变,所以P1 = P2。
根据热容的定义,热量Q = ncΔT,其中n为气体的物质量,c为气体的摩尔热容,ΔT为温度变化。
由于等压过程中压强保持不变,所以ΔT = T2 - T1。
因此,气体吸收的热量为Q = nc(T2 - T1)。
第四题:一个物体的质量为m,温度由T1升高到T2,求该过程中物体吸收的热量。
答案:根据热容的定义,热量Q = mcΔT,其中c为物体的比热容,ΔT为温度变化。
由于温度由T1升高到T2,所以ΔT = T2 - T1。
因此,物体吸收的热量为Q = mc(T2 - T1)。
通过以上习题的解答,我们可以看出热学中的一些基本概念和公式的应用。
热学作为一门重要的物理学科,不仅在理论上具有广泛的应用,而且在实际生活中也有着重要的意义。

第四章热力学第一定律(题号有所不同)5-1.0.020Kg的氦气温度由升为,若在升温过程中:(1)体积保持不变;(2)压强保持不变;(3)不与外界交换热量,试分别求出气体内能的改变,吸收的热量,外界对气体所作的功,设氦气可看作理想气体,且,解:理想气体内能是温度的单值函数,一过程中气体温度的改变相同,所以内能的改变也相同,为:热量和功因过程而异,分别求之如下:(1)等容过程:V=常量A=0由热力学第一定律,(2)等压过程:由热力学第一定律,负号表示气体对外作功,(3)绝热过程Q=0由热力学第一定律5-2.分别通过下列过程把标准状态下的0.014Kg氮气压缩为原体积的一半;(1)等温过程;(2)绝热过程;(3)等压过程,试分别求出在这些过程中气体内能的改变,传递的热量和外界对气体所作的功,设氮气可看作理想气体,且,解:把上述三过程分别表示在P-V图上,(1)等温过程理想气体内能是温度的单值函数,过程中温度不变,故由热一、负号表示系统向外界放热(2)绝热过程由或得由热力学第一定律另外,也可以由及先求得A(3)等压过程,有或而所以===由热力学第一定律,也可以由求之另外,由计算结果可见,等压压缩过程,外界作功,系统放热,内能减少,数量关系为,系统放的热等于其内能的减少和外界作的功。
5-3 在标准状态下的0.016Kg的氧气,分别经过下列过程从外界吸收了80cal的热量。
(1)若为等温过程,求终态体积。
(2)若为等容过程,求终态压强。
(3)若为等压过程,求气体内能的变化。
设氧气可看作理想气体,且解:(1)等温过程则故(2)等容过程(3)等压过程5-4 为确定多方过程方程中的指数n,通常取为纵坐标,为横坐标作图。
试讨论在这种图中多方过程曲线的形状,并说明如何确定n。
解:将两边取对数或比较知在本题图中多方过程曲线的形状为一直线,如图所示。
直线的斜率为可由直线的斜率求n。
或即n可由两截距之比求出。
5-5 室温下一定量理想气体氧的体积为,压强为。

第四章思考题4-1 容器被闸板分割为A 、B 两部分。
A 中气体参数为P A 、T A ,B 为真空。
现将隔板抽去,气体作绝热自由膨胀,终压将为P 2,试问终了温度T 2是否可用下式计算?为什么?122()k k A Ap T T p -=答:气体作绝热自由膨胀是不可逆绝热过程,因此终了温度T 2不可用上式计算。
4-2 今有任意两过程a-b ,b-c ,b 、c 两点在同一定熵线上,如图所示。
试问:Δuab 、Δuac 哪个大?再设b 、c 两点在同一条定温线上,结果又如何?答:由题可知,因b 、c 两点在同一定熵线上T b >T c , ub >uc . Δuab >Δuac 。
若b 、c 两点在同一条定温线上,T b =T c , ub =uc . Δuab =Δuac 。
4-3将满足下列要求的多变过程表示在p-v 图和T-s 图上(工质为空气)。
(1)工质又升压、又升温、又放热; (2)工质又膨胀、又降温、又放热;(3)n=1.6的膨胀过程,判断q ,w ,Δu 的正负;答:n=1.6的压缩过程在p-v 图和T-s 图上表示为1→2过程。
在此过程中q>0, w<0,Δu>0(4)n=1.3的压缩过程,判断q ,w ,Δu 的正负。
答:n=1.3的压缩过程在p-v 图和T-s 图上表示为1→2过程。
在此过程中q<0,w<0,Δu>04-4将p-v 图表示的循环,如图所示,表示在T -s 图上。
图中:2-3,5-1,为定容过程;1-2,4-5为定熵过程;3-4为定压过程。
答:T-s 图如图所示4-5 以空气为工质进行的某过程中,加热量的一半转变为功,试问过程的多变指数n 为多少?试在p-v 图和T-s 图上画出该过程的大概位置(比热容比可视为定值)。
答:多变过程中,遵循热力学第一定律q u w =∆+,由题可知12q u =∆,由于v 21()1n -k q c T T n =--,所以()v 21v 21()()21n -k c T T c T T n -=--即:()121n -k n =-,0.6n =4-6如果采用了有效的冷却方法后,使气体在压气机汽缸中实现了定温压缩,这时是否还需要采用多级压缩?为什么?(6分) 答:还需要采用多级压缩,由余隙效率可知,12111n v p c p λ⎡⎤⎛⎫⎢⎥=-- ⎪⎢⎥⎝⎭⎢⎥⎣⎦,余隙使一部分气缸容积不能被有效利用,压力比越大越不利。
![热学第四章习题参考答案[1]](https://uimg.taocdn.com/f0f629094afe04a1b171dea5.webp)
热学习题答案第四章:热力学第一定律(内容对应参考书的第五章)1. (P 192。
1)0.020Kg 的氦气温度由17C ︒升为27C ︒。
若在升温过程中:(1)体积保持不变;(2)压强保持不变;(3)不与外界交换热量,试分别求出气体内能的改变,吸收的热量,外界对气体所做的功。
设氦气可看作理想气体,且R C m v 23,=。
解:已知=︒=C T 171290K ,K C T 300272=︒=,()mol molKg KgM5/104020.03=⨯==-μν(1)体积保持不变:外界对气体做功0=A ,内能的变化()()()cal R R T T C U m v 1507529030023512,≈=-⨯=-=∆ν,根据热力学第一定律,由0=A 有系统吸收热量()cal R U Q 15075≈=∆= (或者=623.55J );(2)压强保持不变:由P =常数,及理想气体状态方程RT PV ν=有 外界对气体做功()()()cal R T T R V V P PdV A V V 10050212121-≈-=-=-=-=⎰ν,内能的变化()()cal R T T C U m v 1507512,≈=-=∆ν, 由热力学第一定律,得系统吸收热量:()cal R A U Q 250125≈=-∆=;此问也可以先求A 和()12T T C Q P -=,而后再由第一定律得Q A U +=∆。
(3)不与外界交换热量:由于理想气体内能的变化只由温度决定,则 内能的变化仍然是()()cal R T T C U m v 1507512,≈=-=∆ν,但由0=Q ,根据热力学第一定律知此时外界对系统所做的功完全转化为系统内能的增加量,即外界对气体做功()()cal R T T C U A m v 1507512,≈=-=∆=ν。
注意:此题很简单,目的在于理解理想气体内能无论在什么样的准静态过程下都只由温度决定。

热学思考题和参考解答第一章 热学基础知识和温度1.1 若热力学系统处于非平衡态,温度概念能否适用?【答】 对于处于非平衡态的系统,只要局域平衡条件能满足,则对于处于局域平衡的每个子系统来说,温度概念仍能适用。
1.2 系统A 和B 原来各自处在平衡态,现使它们互相接触,试问在下列情况下,两系统接触部分是绝热的还是透热的,或两者都可能?(1)当A V 保持不变,A p 增大时,B V 和B p 都不发生变化;(2)当A V 保持不变,A p 增大时,B p 不变而B V 增大;(3)当A V 减少,A p 增大时,B V 和B p 均不变.【答】设容器都是密闭的.(1)是绝热的.因为A p A V 增大,所以A 的温度 增加.但它并不使B 状态发生变化,说明既没有热量传递也没有做功.(2)是透热的.因为A p A V 增大,所以A 的温度增加.从B 来说,B V 增加了,说明B 膨胀对外做了功,其能量只能来源于从A 吸热.(3)因为B V 和B p 均不变,说明B 的温度不变.但是A V 减少,同时A p 增大,这两者的乘积可变可不变,所以A 的温度也可变可不变.若A 的温度改变则是绝热的;若A 的温度不变,则A ,B 相互 接触的部分仍然绝热,因为B 的状态始终不变.1.3 在建立温标时是否必须规定热的物体具有较高的温度,冷的物体具有较低的温度?是否可作相反的规定?在建立温标时,是否须规定测温属性一定随温度作线性变化?【答】 在建立温标时必须规定热的物体具有较高的温度,冷的物体具有较低的温度,因为热量是从高温物体传递到低温物体的.很有意思的是,对于处于负温度的子系则是例外.因为负温度比正温度还要高,热量是从负温度物体流向正温度物体的.建立温标时并不一定规定测温属性随温度作线性变化,这完全由分度公式来规定.1.4 冰的正常溶点是多少?纯水的三相点温度是多少?【答】 冰的正常溶点是273.15K,纯水的三相点温度是273.16K 。
李椿热学答案及部分习题讲解部分习题的参考答案“热学”课程第一章作业习题说明:“热学”课程作业习题全部采用教科书(李椿,章立源,钱尚武编《热学》)里各章内的习题。
第一章习题:1,2,3[1],4,5,6,8,10,11,20,24[2],25[2],26[2],27,28,29,30,31,32,33. 注:[1] 与在水的三相点时[2] 设为等温过程第一章部分习题的参考答案1.(1) –40;(2) 574.5875;(3) 不可能.2.(1) 54.9 mmHg;(2) 371 K.3. 0.99996.4. 400.574.5. 272.9.6. a = [100/(X s–X i)]?(?C/[X]), b = –[100 X i/(X s–X i)]?C, 其中的[X]代表测温性质X的单位.8. (1) –205?C;(2) 1.049 atm.10. 0.8731 cm, 3.7165 cm.11. (1) [略];(2) 273.16?, 273.47?;(3) 不存在0度.20. 13.0 kg?m-3.24. 由教科书137页公式可得p = 3.87?10-3 mmHg.25. 846 kg?m-3.26. 40.3 s (若抽气机每旋转1次可抽气1次) 或40.0 s (若抽气机每旋转1次可抽气2次, 可参阅教科书132页).27. 28.9, 1.29 kg?m-3.28. 氮气的分压强为2.5 atm, 氧气的分压强为1.0 atm, 混合气体的压强为3.5 atm.29. 146.6 cm-3.30. 7.159?10-3 atm, 71.59 atm, 7159 atm; 4.871?10-4 atm, 4.871 atm, 487.1 atm.31. 341.9 K.32. 397.8 K.33. 用范德瓦耳斯方程计算得25.39 atm, 用理想气体物态方程计算得29.35 atm.“热学”课程第二章作业习题第二章习题:1,3,4,5,6,7,8,9[3],10,11,12,13[4],16,17,18,19,20.注:[3] 设为绝热容器[4] 地球和月球表面的逃逸速度分别等于11.2 km?s-1和2.38 km?s-1第二章部分习题的参考答案1. 3.22?103 cm-3.3. 1.89?1018.4. 2.33?10-2 Pa.5. (1) 2.45?1025 m-3;(2) 1.30 kg?m-3;(3) 5.32?10-26 kg;(4) 3.44?10-9 m;(5) 6.21?10-21 J.6. 3.88?10-2 eV,7.73?106 K.7. 301 K.8. 5.44?10-21 J.9. 6.42 K, 6.87?104Pa (若用范德瓦耳斯方程计算) 或6.67?104 Pa (若用理想气体物态方程计算).10. (1) 10.0 m?s-1;(2) 7.91 m?s-1;(3) 7.07 m?s-111. (1) 1.92?103 m?s-1;(2) 483 m?s-1;(3) 193 m?s-1.12. (1) 485 m?s-1;(2) 28.9, 可能是含有水蒸气的潮湿空气.13. 1.02?104 K, 1.61?105 K; 459 K, 7.27?103 K.16. (1) 1.97?1025 m-3 或2.00?1025 m-3;(2) 由教科书81页公式可得3.26?1027m-2或3.31?1027 m-2;(3) 3.26?1027 m-2或3.31?1027 m-2;(4) 7.72?10-21 J, 6.73?10-20 J.17. 由教科书81页公式可得9.26?10-6 g?cm-2?s-1.18. 2.933?10-10 m.19. 3.913?10-2 L, 4.020?10-10 m, 907.8 atm.20. (1) (V1/3 -d)3;(2) (V1/3 -d)3 - (4π/3)d3;(3) (V1/3 -d)3 - (N A - 1) ?(4π/3)d3;(4)因V1/3>>d,且N A>>1, 故b = V - (N A/2)?{(V1/3 -d)3 +[(V1/3 -d)3 - (N A - 1)?(4π/3)d3]}?(1/N A) ≈ 4N A(4π/3)(d/2)3.“热学”课程第三章作业习题第三章习题:1,2,4,5[5],6,7,9,10,11,12,13,15,16,17,18,19,20[6],22[7],23,24,25[8],26,27,28,29,30.注:[5] 设p0 = 1.00 atm[6] 分子射线中分子的平均速率等于[9πRT/(8μ)]1/2[7] 设相对分子质量等于29.0[8] f(ε)dε = 2π-1/2(kT)-3/2ε1/2e-ε/kT dε第三章部分习题的参考答案1. (1) 3.18 m?s-1;(2) 3.37 m?s-1;(3) 4.00 m?s-1.2. 395 m?s-1, 445 m?s-1, 483 m?s-1.4. 3π/8.5. 4.97?1016个.6. 0.9534.7. (1) 0.830 %;(2) 0.208 %;(3) 8.94?10-7 %.9. [2m/(πkT)]1/2.10. (1) 198 m?s-1;(2) 1.36?10-2 g?h-1.11. [略].12. (1) [略];(2) 1/v0;(3) v0/2.13. (1) 2N/(3v0);(2) N/3;(3) 11v0/9.15. [略].16. [略].17. 0.24 %.18. (1) 0.5724N;(2) 0.0460N.19. n[kT/(2πm)]1/2?[1 + (mv2/2kT)]?exp[ –(mv2/2kT)]或[nv p /(2π1/2)] ?[1 + (v2/v p2)]?exp[ –(v2/v p2)].20. 0.922 cm, 1.30 cm.22. 2.30 km.23. 1955 m.24. kT/2.25. f(ε)dε = 2(π)-1/2(kT)-3/2ε1/2exp[ -ε/(kT)]dε, kT/2.26. 3.74?103 J?mol-1, 2.49?103 J?mol-1.27. 6.23?103 J?mol-1, 6.23?103 J?mol-1; 3.09?103 J?g-1, 223 J?g-1.28. 5.83 J?g-1?K-1.29. 6.61?10-26 kg和39.8.30. (1) 3, 3, 6;(2) 74.8 J?mol-1?K-1.“热学”课程第四章作业习题第四章习题:1,2,4,6[7],7,8,10,11,13[2],14,15,17,18[9],19,21.注:[2] 设为等温过程[7] 设相对分子质量等于29.0[9] CO2分子的有效直径等于4.63×10-10 m第四章部分习题的参考答案1. 2.74?10-10 m.2. 5.80?10-8 m, 1.28?10-10 s.4. (1)5.21?104 Pa; (2) 3.80?106 m-1.6. (1) 3.22?1017 m-3;(2) 7.77 m (此数据无实际意义);(3) 60.2 s-1 (此数据无实际意义).7. (1) 1.40;(2) 若分子有效直径与温度无关, 则得3.45?10-7 m;(3) 1.08?10-7 m.8. (1) πd2/4;(2) [略].10. (1) 3679段;(2) 67段;(3) 2387段;(4) 37段;(5) 不能这样问.11. 3.11?10-5 s.13. (1) 10.1 cm;(2) 60.8 μA.14. 3.09?10-10 m.15. 2.23?10-10 m.17. (1) 2.83;(2) 0.112;(3) 0.112.18. (1) –1.03 kg?m-4;(2) 1.19?1023 s-1;(3) 1.19?1023 s-1;(4) 4.74?10-10 kg?s-1.19. [略].21. 提示:稳定态下通过两筒间任一同轴柱面的热流量相同.“热学”课程第五章作业习题第五章习题:1,2,3,5,7,8,10,12,13,15,16,17,18,19,21,22[10],23,24[11],25,26,27,28,29,31,33[12],34,35.注:[10] 使压强略高于大气压(设当容器中气体的温度与室温相同时其压强为p1)[11] γp0A2L2/(2V)[12] 设为实现了理想回热的循环第五章部分习题的参考答案1.(1) 623 J, 623 J, 0;(2) 623 J, 1.04?103 J, –416 J;(3) 623 J, 0, 623 J.2.(1) 0, –786 J, 786 J;(2) 906 J, 0, 906 J;(3) –1.42?103 J, –1.99?103 J, 567 J.3.(1) 1.50?10-2 m3;(2) 1.13?105 Pa;(3) 239 J.4.(1) 1.20;(2) –63.3 J;(3) 63.3 J;(4) 127 J.7. (1) 265 K;(2) 0.905 atm;(3) 12.0 L.8. (1) –938 J;(2) –1.44?103 J.10. (1) 702 J;(2) 507 J.12. [略].13. [略].15. 2.47?107 J?mol-1.16. (1) h = CT + v0p + bp2;(2) C p = C, C V= C + (a2T/b)–ap.17. –46190 J?mol-1.18. 82.97 %.19. [略].21. 6.70 K, 33.3 cal, 6.70 K, 46.7 cal; 11.5 K, 80.0 cal, 0, 0.22. γ = ln(p1/p0)/ln(p1/p2).23. (1) [略];(2) [略];24. (1) [略];(2) [略].25. (1) p0V0;(2) 1.50 T0;(3) 5.25 T0;(4) 9.5 p0V0.26. (1) [略];(2) [略];(3) [略].27. 13.4 %.28. (1) A→B为吸热过程, B→C为放热过程;(2) T C = T(V1/V2)γ– 1, V C = V2;(3) 不是;(4) 1 – {[1 – (V1/V2)γ– 1]/[(γ– 1)ln(V2/V1)]}.29. [略].31. 15.4 %.33. [略].34. [略].35. [略].“热学”课程第六章作业习题第六章习题:2,3,5,9,10,11,12[13],13,15,16,19. 注:[13] 设为一摩尔第六章部分习题的参考答案2. 1.49?104 kcal.3. (1) 473 K;(2) 42.3 %.5. 93.3 K.9. (1) [略];(2) [略];10. [略].11. [略].12. [略].13. [略].15. ?T = a (v2-1–v1-1)/C V = –3.24 K.16. [略].19. –a(n A–n B)2/[2C V V(n A+ n B)].“热学”课程第七章作业习题第七章习题:8.第七章部分习题的参考答案8. 提示:在小位移的情况下, exp[ -(cx2-gx3-fx4)/(kT)]≈ exp[ -cx2/(kT)]?{1 + [gx3/(kT)]}?{1 + [fx4/(kT)]}≈ exp[ -cx2/(kT)]?{1 + [gx3/(kT)] + [fx4/(kT)]}.“热学”课程第八章作业习题第八章习题:1,2,3,4,6,7[14],8,10.注:[14] 设θ= 0第八章部分习题的参考答案1. 2.19?108 J.2. 7.24?10-2 N?m-1.3. 1.29?105 Pa.4. 1.27?104 Pa.6. f = S[α(R1-1 + R2-1) –(ρgh/2)]= {Sα?[2cos(π–θ)]/[2(S/π)1/2 ?cos(π–θ) + h–h sin(π–θ)]} + {Sα?[2cos(π–θ)]/h} –(Sρgh/2)≈Sα?[2cos(π–θ)/h]= 25.5 N.7. 0.223 m.8. 2.98?10-2 m.10. (1) 0.712 m; (2) 9.60?104 Pa; (3) 2.04?10-2 m.“热学”课程第九章作业习题第九章习题:1,2,4[15],6[5],7,8,9[16],11,12,13[17].注:[5] 设p0 = 1.00 atm[15] 水蒸气比体积为1.671 m3/kg[16] 100℃时水的饱和蒸气压为1.013×105Pa,而汽化热为2.38×106 J?kg -1,由题8中的[17] 23.03 - 3754/T第九章部分习题的参考答案1. 3.21?103 J.2. (1) 6.75?10-3 m3;(2) 1.50?10-5 m3;(3) 液体体积为1.28?10-5 m3, 气体体积为9.87?10-4 m3.4. 373.52 K.6. 1.36?107 Pa.7. [略].8. [略].9. 1.71?103 Pa.11. 4.40?104 J?mol-1.12. (1) 52.0 atm;(2) 157 K.13. (1) 44.6 mmHg, 195 K;(2) 3.121?104 J?mol-1, 2.547?104 J?mol-1, 5.75?103 J?mol-1.。
《热学教程》习题参考答案第四章 习 题4-1. 电子管的真空度为1.333×103-Pa,设空气分子有效直径为3.0×1010-m,求27℃时空气分子的数密度n ,平均自由程λ和碰撞频率Z .(答: 3.2×1017m 3-,7.8 m ,60s 1-) 解:由nkT P =,可得)m (1021.3317-⨯==kTP n 分子平均自由程为)m (78.7212==n d πλ碰撞频率为 )s (2.6081-===λπμλRTvZ4-2. 求氦原子在其密度2.1×102-kg/m 3,原子的有效直径=d 1.9×1010-m 的条件下的平均自由程λ.(答:1.97×106-m)解:由n N mn A μρ==,可得 )m (1016.3324-⨯==μρA N n 分子平均自由程为)m (10972.12162-⨯==nd πλ 4-3. 试估算宇宙射线中的质子在海平面附近的平均自由程.(答:约m 102.16-⨯)4-4. 测得温度15℃和压强76cmHg 时氩原子和氖原子的平均自由程分别为Ar λ=6.7×108-m 和Ne λ=13.2×108-m ,试问:(1)氩原子和氖原子的有效直径各为多少?(2) 20℃和15cmHg 时Ar λ和-40℃和75cmHg 时Ne λ多大?(答(1)101063.3-⨯m,101059.2-⨯m;(2) 71045.3-⨯m,71080.1-⨯m)解:(1)由Pd kT n d 22221ππλ==,可得 )m (1063.321021Ar Ar -⨯=⎪⎪⎭⎫ ⎝⎛=λπP kT d)m (1059.221021Ne Ne -⨯=⎪⎪⎭⎫ ⎝⎛=λπP kT d(2)由分子平均自由程与温度及压强的关系)m (1045.3107.6288157629378Ar11212Ar2--⨯=⨯⨯⨯⨯==λλT P P T )m (1008.1102.13288757623378Ne11212Ne2--⨯=⨯⨯⨯⨯==λλT P P T 4-5. 高空的一片降雨云层,单位时间通过单位面积的降雨量为Q =10cm/hour 。
《热学教程》习题解答第一章习题(P43)1.1解:根据trR R R T 16.273)(= 则: )K (1.29135.9028.9616.273=⨯=T1.2解:(1)摄氏温度与华氏温度的关系为C)(5932F)( t t +=解出: 40-=t(2)华氏温标与开氏温标的关系为)15.273(5932-+=T t解出: 575=t(3)摄氏温度与开始温度的关系为15.273-=T t可知:该方程无解,即摄氏温标和开氏温标不可能给出相同的读数。
1.3解:根据定压理想气体温标的定义式K 15.373732038.0K 16.273limK 16.273)(0===→trP V V V T tr1.4解:(1)第三种正确。
因为由实验发现,所测温度的数值与温度计的测温质有关,对同种测温质,还与其压强的大小有关。
(2)根据理想气体温标定义trP P PT tr 0limK 16.273→=当这个温度计中的压强在水的三相点时都趋于零时,即0→tr P 时,则所测温度值都相等。
1.5解:(1)根据2t t βαε+=,由t 值可求出ε的值(见后表)(2)根据b a t +=*ε,利用0=*t ,100=*t 及相应的ε值,可得b a +⨯=00与 b a +⨯=15100解出: 0,320==b a这样,由ε320=*t 求出相应的*t 值(见后表)。
(3)将与t 对应的ε及*t 值列表如下:由表中数据即可作出t -ε,*-t ε和*-t t 图(图略)。
(4)很明显,除冰点,t 与*t 相同外,其它温度二者温度值都不相同。
*-t ε是正比关系,但是用温度t 是比较熟悉的,与日常生活一致。
1.6解:当温度不变时,C PV =,设气压计的截面积为S ,由题意可知:S P S )73474880()734(80)748768(-+⨯-=⨯-可解出:)Pa (1099.9)Pa (76010013.1)734948020(45⨯=⨯⨯+⨯=P1.7解:设气体压强分别为P 1、P 2,玻璃管横截面积为S ,由题意可知: (1)cmHg P P 2001+= hcmHg P P -=02S h P S P )70()2070(21-⨯=-⨯解出:)cm (55.3=h (注意大气压强单位变换) (2)S P S P 70)2070(21⨯≥-⨯)Pa (1065.65040⨯=≤cmHg P1.8答:活塞会移动。
第四章 气体和蒸汽的热力过程4-1 有 2.3kg 的CO ,初态11477K 0.32MPa T p ==,,经可逆定容加热,终温2600K T =,设CO 为理想气体,求U Δ、H Δ、S Δ,求过程功及过程热量。
(1)比热容为定值;(2)比热容为变值,按气体性质表计算。
解 (1)定值比热容2211600K 0.32MPa 0.4025MPa477KT p p T ==×=由附表328.0110kg/mol M −=×,g 38.3145J/(mol K)296.8J(kg K)28.0110kg/molR R M−⋅===⋅×。
g 55296.8J/(kg K)742.1J/(kg K)22V c R ==×⋅=⋅g 77296.8J/(kg K)1038.94J/(kg K)22p c R ==×⋅=⋅21() 2.3kg 742.1J/(kg K)(600477)K 209.94kJ V U mc T T Δ=−=×⋅−=21Δ() 2.3kg 1038.94J/(kg K)(600477)K 293.92kJp H mc T T =−=×⋅−=21600K ln2.3kg 742.1ln0.3916kJ/K477KV T S mc T Δ==×=0W =,209.94JQ U =Δ=(2)变比热容由附表查得 1477K T =时m,113921.704J/mol H =,0m,1211.312J/(mol K)S =⋅2600K T =时m,217612.7J/mol H =,0m,2218.217J/(mol K)S =⋅ m,1m,1113921.704J/mol 8.3145J/(mol K)477K 9955.69J/molU H RT =−=−⋅×=m,2m,2217612.7J/mol 8.3145J/(mol K)600K 12624.0J/mol U H RT =−=−⋅×=3m 32.3kg (12624.09955.69)J/mol219.1010J 28.0110kg/molm U U M−×−Δ=Δ==××3m 32.3kg (17612.713921.704)J/mol303.0810J28.0110kg/mol m H H M−×−Δ=Δ==××000022m,2m,1m,2m,11133lnln600K 2.3kg [218.317211.312]J/(mol K)8.3145J/(mol K)ln 477K 28.0110kg/mol0.418610J/K p T m S n S S R S S R p M T −Δ=−−=−−×−⋅−⋅×=×=×⎛⎞⎛⎞⎜⎟⎜⎟⎝⎠⎝⎠⎛⎞⎜⎟⎝⎠0W =,219.10kJQ U =Δ=4-2 甲烷4CH 的初始状态10.47MPa p =、1393K T =,经可逆定压冷却对外放出热量4110.76J/mol ,试确定其终温及41molCH 的热力学能变化量m U Δ、焓变化量m H Δ。
第四章习题答案4.1解:.,00000AkTNmgn mgkT An en dz dy dx dN N dxdydzen dN kTmgzkTmgz=∴⋅===∴=-∞-⎰⎰⎰⎰⎰⎰气柱截面4.2,4.3解:00ln,p p g RT z ep p RTgzμμ==- 4.4 解:RTgzen z n z n V x n V μ-⋅=⋅⋅=⋅⨯00)()(174.5解:RTgze r z r e r RT e V z p V p z r z V V p z V z p ep z p RTgz gz T RTgz3)(34)()(34)()()()(03000030000μππμμμ=∴======--=∆-4.6解:取Y 轴竖直向上,y 处单位体积内有各种速度的分子总数为n ,y=0处n=n 0由流体静力学原理,)2()()()1(00nk dydny T k dy dp y T nk nkT p gdydp αααρ--=-==-=由(1),(2)得.1ln )(1ln 1ln ')()(,)()()(00000000⎥⎦⎤⎢⎣⎡--⎪⎭⎫ ⎝⎛-=∴--=--=--=-⎰⎰kT y T k k m g n n dy y T k m g k n dn dy y T k m g k n dn nk dydny T k nmg ynn αααααααα而.ln ln ln3)3(,)(ln ln00000000yT T R gyT T k m g p p y T nk kT n p p ααμααα-=-=-=)式代入,整理得:将(4.7解:mkTv 32=4.9 ,4.10 解:水平管旋转起来后,管中分子受到惯性离心力,可认为分子处于一定势场中,由玻尔兹曼分布律:z y x kT kT vv v z dv dv dxdydzdv e e kT m n dN p k zyxεεπ--⎪⎭⎫ ⎝⎛=230,,,2 可得分子沿管数密度分布;结果是:⎪⎪⎪⎪⎪⎭⎫⎝⎛+=∆p l l p 6122222ρωωρ4.13解:由玻尔兹曼分布律:z y x kT kT vv v z dv dv dxdydzdv e e kT m n dN p k zyxεεπ--⎪⎭⎫ ⎝⎛=230,,,2 =∆∆∴⎪⎭⎫ ⎝⎛=∆⎪⎭⎫ ⎝⎛=∆-∆+∆+-⎰⎰2123022301222211N N dxdydzdv ekT m n N dxdydzdv ekT m n N kTvv v vv v kt k k εεππ 这里用积分太复杂,因为△v很小,所以可以用)()()(4122112121v f v v f v dN dN N N dvdtdA v nvf dN v ==∆∆∴=4.14解:由麦克斯韦分布律:.)()(,4)(.4)(.2,24)(212111232223222p p p p p p p v v pp kT mv v v v f v f e v v f v v v ev v f mkTv v ekT m v f p=∴===∴=⎪⎭⎫ ⎝⎛=-----ππππ时,当又4.15解:由麦克斯韦分布律:83,83.3,821212ππμμμπμ=∴===T T RT RT RTv RTv 由题:4.16解:.3;8;22μπμμRTv RTv RTv p ===4.17解:.8.424)(11022302mkTv vvdv ekT m dv v f v v kTmv ππππ==⎪⎭⎫ ⎝⎛==⎪⎭⎫ ⎝⎛⎰⎰+∞-+∞其中,4.18解:由4.14已知 ,4)(11--=e v vf p p π所以,速率v p —v p +△v 在区间内的分子数:.)(.244)(1111----∝∆∴∆⋅⋅=∆=∆=∆T N v e kT mNv e v Nv v Nf N p p ππ4.19解:dtdA v n N 41=∆4.20解:(1) 设中子气的中子数密度为n,有 ,844110416πμRTn v n ==⨯ 所以 );(1035.630031.88100.11016313316--⨯=⨯⨯⨯⨯⨯⨯=m n π(2) 中子气的分压).(1063.23001038.11035.672313Pa nkT p --⨯=⨯⨯⨯⨯== 4.21解:假设凡射入小孔中的分子均可通过。
热学习题答案第四章:热力学第一定律(容对应参考书的第五章)1. (P 192。
1)0.020Kg 的氦气温度由17C ︒升为27C ︒。
若在升温过程中:(1)体积保持不变;(2)压强保持不变;(3)不与外界交换热量,试分别求出气体能的改变,吸收的热量,外界对气体所做的功。
设氦气可看作理想气体,且R C m v 23,=。
解:已知=︒=C T 171290K ,K C T 300272=︒=,()mol molKg KgM5/104020.03=⨯==-μν(1)体积保持不变:外界对气体做功0=A ,能的变化()()()cal R R T T C U m v 1507529030023512,≈=-⨯=-=∆ν,根据热力学第一定律,由0=A 有系统吸收热量()cal R U Q 15075≈=∆= (或者=623.55J );(2)压强保持不变:由P =常数,及理想气体状态方程RT PV ν=有 外界对气体做功()()()cal R T T R V V P PdV A V V 10050212121-≈-=-=-=-=⎰ν,能的变化()()cal R T T C U m v 1507512,≈=-=∆ν, 由热力学第一定律,得系统吸收热量:()cal R A U Q 250125≈=-∆=;此问也可以先求A 和()12T T C Q P -=,而后再由第一定律得Q A U +=∆。
(3)不与外界交换热量:由于理想气体能的变化只由温度决定,则 能的变化仍然是()()cal R T T C U m v 1507512,≈=-=∆ν,但由0=Q ,根据热力学第一定律知此时外界对系统所做的功完全转化为系统能的增加量,即外界对气体做功()()cal R T T C U A m v 1507512,≈=-=∆=ν。
注意:此题很简单,目的在于理解理想气体能无论在什么样的准静态过程下都只由温度决定。
2. (P 192。
2)分别通过下列过程把标准状态下的0.014Kg 氮气压缩为原体积的一半:(1)等温过程;(2)绝热过程;(3)等压过程。
试分别求出在这些过程中气体能的改变,传递的热量和外界对气体所做的功。
设氮气可看作理想气体,且R C m v 25,=。
解:由已知有 ()mol molKg KgM5.0/1028014.03=⨯==-μν,K T 2731=,a p p 5110013.1⨯=, 11212p RT V V ν==,57,,,,=+==mV m V mV m P C R C C C γ (1)等温过程:由已知,氮气看做理想气体,故能变化量0=∆U ,由热力学第一定律,有A Q -=,而外界对气体所做的功为()J V V RT V dVRT PdV A V V V V 7862ln 15.273314.85.0ln 212121≈⨯⨯⨯==-=-=⎰⎰νν; (2)绝热过程:传递的热量0=Q ,绝热过程外界对气体所做的功为()112211V p V p A --=γ,由绝热过程方程有 γγ1122V p V p =,即 γ⎪⎪⎭⎫ ⎝⎛=2112VV p p ()()()J RT A 9071214.115.273314.85.0122114.11≈--⨯⨯=⎪⎪⎭⎫ ⎝⎛--=∴-γγν (3)等压过程:维持1p 不变,则 211212T V V T T ==能的变化量为 ()()J R T T C U m v 1419215.273255.012,-≈⨯⨯-=-=∆ν,而又由 R C m p 27,= 可得气体吸收的热量为()()J R T T C Q m P 1987215.273275.012,-≈⨯⨯-=-=ν根据热力学第一定律,有外界对气体所做的功为()J Q U A 56819871419=+-=-∆=。
3. (P 193。
8)0.0080Kg 氧气,原来温度为27C ︒,体积为0.41L 。
若:(1)经过绝热膨胀体积增加为4.1L ;(2)先经过等温过程再经过等容过程达到与(1)同样的终态。
试分别计算在以上两种过程中外界对气体所做的功。
设氧气可以看作理想气体,且R C m v 25,=。
解:已知,()mol mol Kg Kg M41/10320080.03=⨯==-μν,K C T 300271=︒=, L V 41.01=,L V 1.42=,57,,,,=+==mV m V mV m P C R C C C γ (1)绝热膨胀过程:满足绝热过程方程 c TV =-1γ,由题意可知122111--=γγV T V T , 即()K V V T T 49.1191.441.015.30015712112≈⎪⎭⎫⎝⎛=⎪⎪⎭⎫⎝⎛=--γ,则外界对系统做功()()()()J T T R V P V P A 75.93815.30049.1194314.825111121122-=-⋅=--=--=γνγ; (2)等温过程:外界对系统做功()J V V RT V dV RT PdV A V V V V 49.143641.01.4ln 15.3004314.8ln 12112121-≈⨯⨯=-=-=-=⎰⎰νν, 由题意,再经过等容过程使温度由1T 降至2T ,因为在等容过程中外界对系统不做功,故整个过程中外界对系统做功为()J A 49.1436-≈。
4. (P 194。
16)设一摩尔固体的状态方程可写作bp aT v v ++=0;能可表示为apT cT u -=,其中a 、b 、c 和0v 均是常数。
试求:(1)摩尔焓的表达式; (2)摩尔热容量m P C ,和m v C ,。
解:(1)由题意,摩尔焓可表示为()200bp pv cT bp aT v p apT cT pv u h ++=+++-=+=;(2)由(1),有c T h C P m P =⎪⎭⎫⎝⎛∂∂=,,ap c T u C vm v -=⎪⎭⎫⎝⎛∂∂=,,且由已知有()aT v v bp --=01,则()T b a v v b a c C m v 20,2+--=(最终用题目给的常数来表述)。
5. (P 196。
23)瓶盛有气体,一横截面为A 的玻璃管通过瓶塞插入瓶。
玻璃管放有一质量为m 的光滑金属小球(像个活塞)。
设小球在平衡位置时,气体的体积为V ,压强为AmgP P m +=0(0P 为大气压强)。
现将小球稍向下移,然后放手,则小球将以周期T 在平衡位置附近作简谐振动。
假定在小球上下振动的过程中,瓶气体进行的过程可看作准静态绝热过程,试证明: (1)使小球进行简谐振动的准弹性力为y VA P F m 2γ-=,这里VPC C =γ,y 为小球偏离平衡位置的位移。
(2)小球进行简谐振动周期为22A P mVT m γπ=。
(3)由此说明如何利用这现象测定γ。
解:(1)设任意位移y 处对应的瓶气体的压强为P ,小球受外力为F ,对小球进行受力分析可知mg A P PA F --=0,由准静态绝热过程,满足过程方程c PV =γ,对于平衡位置和偏离平衡位置的两种状态,由题意有()γγγγ⎪⎭⎫ ⎝⎛+=+=y V A PV Ay V P V P m 1故若将y 视为无穷小量时,可得⎪⎭⎫ ⎝⎛-≈⎪⎭⎫ ⎝⎛+=-y V A P y V A P P m m γγ11则有小球做简谐振动的准弹性力y V A P mg A P y V A A P F m m 201γγ-=--⎪⎭⎫ ⎝⎛-=,得证;(2)由(1)知小球做简谐振动的势能为222y VA P y d F V m yγ=⋅-=⎰可以求出k V A P dy Vd m ==⎪⎪⎭⎫ ⎝⎛222γ,则可得小球简谐振动的周期 222AP mVk m T m γππ==,得证。
(3)可以根据本题设计一个实验,实验中m 、V 、m P 、A 都为已知的不变的量,因而可以通过测量小球振动的周期来测量γ值:2224TPA mVπγ=。
6. (P 198。
28)如图所示为一理想气体(γ已知)所经历的循环过程,其中CA 为绝热过程,A 点的状态参量()11,V T 和B 点的状态参量()21,V T 均为已知。
(1)气体在B A →,C B →两过程中分别与外界交换热量吗?是放热还是吸热?(2)求C 点的状态参量; (3)这个循环是不是卡诺循环; (4)求这个循环的效率。
解:(1)由题意分别讨论各过程:B A →:等温膨胀过程,气体从外界吸热AB Q ;C B →:等容降压过程,气体向外界放热'BCQ ; A C →:绝热压缩过程,能增加,外界对气体做功。
(2)令C 点的状态参量为()22,V T ,由绝热方程122111--=γγV T V T ,有12112-⎪⎪⎭⎫ ⎝⎛=γVV T T ;(3)该循环不是卡诺循环;(4)该循环在高温热源1T 和低温热源2T 间工作,则 在1T 处吸热 121ln V V RT Q AB ν= 在2T 处放热()⎪⎪⎭⎫⎝⎛⎪⎪⎭⎫ ⎝⎛--=⎪⎪⎭⎫ ⎝⎛⎪⎪⎭⎫ ⎝⎛-=-=-=--12111211,21,'111γγγνννV V RT V V T C T T C Q Q m V m V BCBC 可得循环的效率为:()12121'ln 1/1V V V V Q Q Q AB BC AB -⎪⎪⎭⎫ ⎝⎛⎪⎪⎭⎫⎝⎛-=-=-γηγ。
7. (P 199。
31)如图中ABCD 为一摩尔理想气体氦的循环过程,整个循环由两条等压线和两条等容线组成。
设已知A 点的压强为atm P A 0.2=,体积L V A 0.1=,B 点体积为L V B 0.2=,C 点压强为atm P C 0.1=,求循环效率。
设R C m v 23,=。
解:由题意,分别讨论各个过程:B A →:等压膨胀过程,气体吸热()A B P AB T TC Q -=;C B →:等容降压过程,气体放热()C B V BC BCT T C Q Q -=-='; D C →:等压压缩过程,气体放热()D C P CD CDT T C Q Q -=-='; A D →:等容加压过程,气体吸热()D A P DA T T C Q -=。
由一摩尔理想气体状态方程RT PV =和已知条件有2==A B A B V V T T ,2==D C D C V V T T ,2==C B C B P P T T ,2==DA D A P PT T 其中R R V P T A A A 2==,得R T B 4=,R T C 2=,RT D 1=,则循环效率%4.15132123225125223111''1'2≈=⋅+⋅⋅+⋅-=++-=-=RR R R R R R R Q Q Q Q Q QDAAB CDBC η。