一种简单鉴别铁离子与亚铁离子方法
- 格式:doc
- 大小:701.50 KB
- 文档页数:12

学科分类号(二级)150.2510本科学生毕业论文(设计)题目一种简单区别Fe3+与Fe2+的方法姓名付兆锋学号*********院、系化学化工学院专业化学类指导教师陈芮职称(学历)讲师(博士)一种简单区别Fe3+与Fe2+的方法摘要:单宁酸属水解类单宁,是具有重要开发利用价值的天然产物。
本文首先以单宁酸的化学性质为重点,论述了单宁酸的研究意义,进展及前景。
由于Fe3+和Fe2+遇单宁酸呈现不同的颜色,本研究采用单宁酸试纸来区别这两种离子。
浓度为0.01 mol/L的单宁酸制备的试纸鉴别效果最佳,检测下限可达5.0×10-6 mol/L。
该法具有鉴别速度快、效果明显、检测下限低等特点。
采用摩尔比法测得单宁酸与Fe3+和Fe2+形成的络合物的络合比分别为15:1和7:1。
关键词:单宁酸;络合比;光度分析;检测限1 引言单宁酸(Tannic acid)又称鞣酸,是具有重要开发利用价值的天然产物[1],也是研究最早的单宁类化合物之一,富含于中国五棓子、土耳其棓子、塔拉果荚、石榴、漆树叶、黄栌、金缕梅树等植物中。
单宁酸自然资源丰富,在世界上主要分布于南美洲西北部的秘鲁、厄多瓜尔、哥伦比亚等国;在我国主要分布于气候、土壤等条件独特的秦岭、巴山、武当山等地区[2]。
单宁酸属于典型的葡萄糖棓酰基化合物,常温下为黄色或棕黄色无定形松散粉末,有特殊气味及强吸湿性;毒性低;在空气中易被氧化使颜色变深;易溶于水、乙醇、丙酮,不溶于氯仿或乙醚[3]。
单宁酸由多种化合物组成,化学成分比较复杂。
根据化学结构的差异,通常将单宁酸分为如下2类:(1)缩合类单宁酸。
这类单宁酸是黄烷醇衍生物,分子中黄烷醇的2位通过碳-碳与儿茶酚或苯三酚相连。
(2)可水解类单宁酸。
其分子中含有酯键,是葡萄糖的没食子酸酯[4]。
此类单宁酸的化学结构如图1所示。
图1 单宁酸的化学结构式Fig. 1 Chemical Structure of Tannic Acid单宁酸具有多个酚羟基结构,这种结构赋予了它独特的化学性质及生理活性。
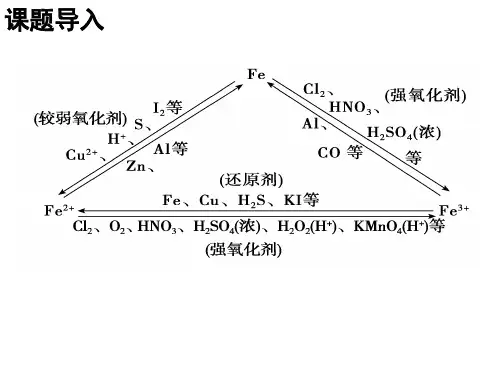




铁离子检定的定性方法(Fe3+)的检验方法:(1)加苯酚显紫红色。
(2)加SCN-(离子) 显血红色 (络合物)。
(3)加氢氧化钠有红褐色沉淀,从开始沉淀到沉淀完全时溶液的pH(常温下):2.7~3.7。
(4)NH4SCN试法。
Fe3+与SCN-生成血红色具有不同组成的络离子。
碱能分解络合物,生成Fe(OH)3沉淀,故反应需要在酸性溶液中进行。
HNO3有氧化性,可使SCN-受到破坏,故应用稀HCL溶液酸化试液。
其他离子在一般含量时无严重干扰。
(5)K4Fe(CN)6试法Fe3+在酸性溶液中与K4Fe(CN)6生成蓝色沉淀(以前为普鲁土蓝),但实际上它与前述滕氏蓝系同一物质。
其他阳离子在一般含量时不干扰鉴定。
Co2+、Ni2+等与试剂生成淡蓝色至绿色沉淀,不要误认为是Fe3+。
三价铁离子的检验方程式加入KSCN溶液,如果出现血红色,说明原溶液中有三价铁。
离子方程式 Fe3+ +3SCN- =Fe(SCN)3根据碱的不同有区别,强碱:Fe3+ +3OH== Fe(OH)3沉淀符号弱碱:例如氨水:Fe3+ +3NH3.H2O == 3NH4+ + Fe(OH)3沉淀符号Fe3+ + 3OH→ Fe(OH)3加入硫化钾溶液,若溶液变为血红色,则有三价铁离子Fe3+ + 3SCN==Fe(SCN)3加入KSCN 溶液,如果出现血红色,说明原溶液中有三价铁。
①浓度高的时候直接观察颜色,黄色的是三价铁,二价铁是浅绿色的.②加氢氧化钠,产生红棕色沉淀的是三价铁.产生白色沉淀并中途变为墨绿色,最后变为红棕色的是亚铁离子.③加KSCN【硫氰化钾】溶液,不变色的是亚铁离子,血红色的是铁离子.④加苯酚溶液,变成浅紫色的是铁离子.⑤加酸性高锰酸钾溶液,褪色的是亚铁离子.⑥加碘化钾淀粉,使之变蓝色是三价铁离子.⑦PH试纸,即使两者浓度不相同,低浓度的铁离子水解程度也是非常大的,一般加入酸抑制水解,酸性很强,酸性强者是铁离子,中学一般不建议使用此法.检验Fe2+、Fe3+的常用方法1.溶液颜色含有Fe2+的溶液显浅绿色含有Fe3+的溶液显黄色2.用KSCN溶液和氯水(1)流程:(2)有关反应:Fe3++3SCN-??Fe(SCN)3(血红色)2Fe2++Cl2===2Fe3++2Cl-3.用NaOH溶液(1)流程:铁离子的检验(2)有关反应:Fe3++3OH-===Fe(OH)3↓(红褐色沉淀)Fe2++2OH-===Fe(OH)2↓(白色沉淀)4Fe(OH)2+O2+2H2O===4Fe(OH)3铁离子测定的几种方法(邻菲啰啉法)本方法采用邻菲啰啉分子吸收光谱法测定铁含量,本方法适用于含Fe0.02~20mg/L 范围工业循环冷却水中铁含量的测定。



检验铁离子的方法铁离子是一种常见的金属离子,它在生活和工业中都有着广泛的应用。
检验铁离子的方法有很多种,可以通过化学反应、仪器分析等手段进行检测。
下面将介绍几种常见的检验铁离子的方法。
一、化学法。
1. 硫氰化钾法。
将待检样品溶液加入硫氰化钾溶液中,若生成深红色沉淀,则表示样品中含有铁离子。
这是因为硫氰化钾与铁离子生成深红色的硫氰化铁沉淀。
2. 硫酸亚铁法。
将待检样品溶液加入硫酸亚铁溶液中,若生成蓝色沉淀,则表示样品中含有铁离子。
这是因为硫酸亚铁与铁离子生成蓝色的硫酸铁沉淀。
3. 酚酞指示法。
将待检样品溶液加入酚酞溶液中,若生成酚酞红色溶液,则表示样品中含有铁离子。
这是因为酚酞与铁离子生成酚酞铁络合物,呈现出红色。
二、仪器分析法。
1. 原子吸收光谱法。
原子吸收光谱法是一种常用的仪器分析方法,可以准确测定样品中的铁离子含量。
通过测量样品溶液对特定波长的光的吸收情况,可以确定样品中铁离子的浓度。
2. X射线荧光光谱法。
X射线荧光光谱法是一种非破坏性的分析方法,可以对样品进行快速分析,得到样品中铁离子的含量和分布情况。
以上介绍的方法只是检验铁离子的其中几种常见方法,实际上还有很多其他方法,如电化学法、光谱法、色谱法等。
选择合适的检验方法需要根据具体的实验要求和条件来确定。
在进行铁离子检验时,需要注意样品的处理和实验操作的规范,确保实验结果的准确性和可靠性。
另外,不同的检验方法可能对样品的要求不同,需要根据实际情况进行选择。
总之,检验铁离子的方法有很多种,每种方法都有其适用的场合和特点。
通过合理选择和运用这些方法,可以准确、快速地检验样品中铁离子的含量,为相关领域的研究和应用提供有力的支持。

鉴别铁离子和亚铁离子的方法
鉴别铁离子和亚铁离子的方法主要有以下几种:
一、氢氨法
1. 将所要鉴别的离子溶液加入到酸性氰化钾溶液中。
2. 加入氨水蒸馏至完全分离。
3. 看到溶液中沉淀出红棕色的铁氰化物时,则说明有铁离子存在,若
无则说明只有亚铁离子存在。
二、亚硫酸盐法
1. 将所要鉴别的离子溶液加入到亚硫酸钠溶液中。
2. 加热至沸腾,观察溶液颜色变化。
3. 铁离子存在时,溶液从浅绿色变为黄褐色;亚铁离子存在时,溶液
从浅绿色变为深绿色。
三、硝酸盐法
1. 将所要鉴别的离子溶液加入到硝酸银溶液中。
2. 铁离子存在时,会产生灰白色沉淀,且滤渣用盐酸加热后可以溶解;亚铁离子存在时,不会产生沉淀。
四、高锰酸钾法
1. 将所要鉴别的离子溶液加入到高锰酸钾溶液中。
2. 铁离子存在时,高锰酸钾的紫色会逐渐消失并产生棕色沉淀;亚铁离子存在时,高锰酸钾的紫色会逐渐消失但不产生沉淀。
以上是鉴别铁离子和亚铁离子的四种常见方法,通过运用不同的化学试剂和观察溶液在化学反应中产生的颜色变化及物质变化来实现区分铁离子和亚铁离子。

二价铁离子和三价铁离子的鉴别方法知识点1:亚铁离子、铁离子的检验一、观察法(颜色不同)1.可溶性硫氰化物法(这就是高中化学最常用的方法)用2支试管分取两种溶液各少量,分别滴入可溶性硫氰化物(如kscn、nascn、nh4scn)等溶液,变血红色的是fe3+的溶液:fe3++scn-=fe(scn)2+维持不变血红色的就是fe2+的溶液,因为fe2+与scn-分解成的络合物fe(scn)2为无色fe2++2scn-=fe(scn)2取二溶液分别加入碱液(如氨水、氢氧化钠、氢氧化钾溶液),生成红褐色沉淀的是fe3+的溶液。
(提氨水)fe3++3nh3·h2o=fe(oh)3↓+3nh4+,现象红褐(加强碱)fe3++3oh-=fe(oh)3↓,现象红褐分解成白色结晶并立即转型为绿色,最后变成红褐色的就是fe2+的溶液,(提氨水)fe2++2nh3·h2o=fe(oh)2↓+2nh4+,现象白至绿(加强碱)fe2++2oh-=fe(oh)2↓,现象白至绿4fe(oh)2+2h2o+o2=4fe(oh)3↓,现象红褐在盛苯酚溶液的2支试管中分别滴入几滴二溶液,变紫色的是fe3+的溶液(苯酚与fe3+生成紫色的络离子),不变紫色的是fe2+的溶液。
fe3++6c6h5oh=[fe(c6h5o)6]3-+6h+取二溶液分别滴入赤血盐溶液,出现滕氏蓝沉淀的是fe2+的溶液,无滕氏蓝沉淀生成的是fe3+的溶液,3fe2++2[fe(cn)6]3-=fe3[fe(cn)6]2↓,滕氏蓝取二溶液分别滴入黄血盐溶液,出现普鲁士蓝沉淀的是fe3+的溶液,无普鲁士蓝沉淀生成的是fe2+的溶液。
4fe3++3fe(cn)64-=fe4[fe(cn)6]3↓,普鲁士蓝(二)氧化还原法将铁粉重新加入两种溶液中,铁粉熔化的就是fe3+的溶液,并无显著现象的就是fe2+的溶液。
2fe3++fe=3fe2+在铜片的两个位置上分别滴上二溶液,过一段时间后铜片腐蚀的是fe3+的溶液,无明显现象的是fe2+的溶液。
检验亚铁离子的方法
亚铁离子是指铁离子的氧化态为+2的离子,常见的化学式为
Fe2+。
以下是检验亚铁离子的几种常用方法:
1. 硬质胶体法:将含有亚铁离子的溶液与硫氰酸钾溶液混合,之后滴加硬脂酸胶体溶液。
如果出现红棕色沉淀,则可判断有亚铁离子存在。
2. 硫代硫酸盐法:将含有亚铁离子的溶液与硫代硫酸钠溶液混合,加热至沸腾。
此时如有亚铁离子存在,则会生成黑色沉淀。
3. 氰化物法:将含有亚铁离子的溶液与氰化钾溶液混合,加入盐酸进行酸化。
若出现深蓝色沉淀,则可证明有亚铁离子存在。
以上是几种常见的检验亚铁离子的方法,它们都基于亚铁离子与特定试剂之间的化学反应产生可见的观察结果来判断其存在与否。
铁离⼦的检验⽅法我们最常接触的铁离⼦有⼆价铁离⼦和三价铁离⼦,那么如何区分这两种不同的铁离⼦呢?有什么判断⽅法呢?下⾯就和⼩编来学习⼀下帖离⼦的检验⽅法吧。
1、⼆价铁离⼦的检验⽅法1.硫氰化钾+氧化剂法,观察反应:取两种溶液各少量,分别滴⼊硫氰化钾溶液(或硫氰化钠、硫氰化铵等溶液),向不变⾊的溶液中加⼊少量氯⽔,变⾎红⾊的原溶液中含有亚铁离⼦。
如果亚铁离⼦中含有铁离⼦,加⼊硫氰根离⼦后溶液⽴即显红⾊,导致后续变⾊不明显,因此这种⽅法只能⽤来在不含铁离⼦的溶液中鉴定亚铁离⼦。
2.加⼊氢氧化钠,观察反应:加⼊氢氧化钠溶液,⽣成⽩⾊沉淀,⽩⾊沉淀迅速变成灰绿⾊,最后,变成红褐⾊。
这证明有铁离⼦。
3.加⼊酸性⾼锰酸钾,观察反应:取两种溶液各少量,加⼊酸性⾼锰酸钾,向溶液中加⼊酸性⾼锰酸钾,若褪⾊,则有⼆价铁,不褪⾊,则证明没有⼆价铁离⼦。
2、三价铁离⼦的检验⽅法1.三价铁离⼦溶液呈棕黄⾊2.加苯酚显紫红⾊(络合物)Fe3+ + 6C6H5OH =[Fe(C6H5O)6]3- + 6H+。
3.加SCN-(离⼦) 显⾎红⾊ (络合物)Fe3+ + 3SCN- ==Fe(SCN)3(络合反应,是可逆的,两种离⼦结合的⽐例不唯⼀,是检验三价铁的特征反应,⼆价铁⽆此特性)4.加氢氧化钠有红褐⾊沉淀从开始沉淀到沉淀完全时溶液的pH(常温下):2.3.75.NH4SCN试法:Fe3+与SCN-⽣成⾎红⾊具有不同组成的络离⼦.碱能分解络合物,⽣成Fe(OH)3沉淀,故反应需要在酸性溶液中进⾏.HNO3有氧化性,可使SCN-受到破坏,故应⽤稀HCL溶液酸化试液.其他离⼦在⼀般含量时⽆严重⼲扰。
6.K4Fe(CN)6试法:Fe3+在酸性溶液中与K4Fe(CN)6⽣成蓝⾊沉淀(以前为普鲁⼟蓝),但实际上它与前述滕⽒蓝系同⼀物质.其他阳离⼦在⼀般含量时不⼲扰鉴定。
Co2+、Ni2+等与试剂⽣成淡蓝⾊⾄绿⾊沉淀,不要误认为是Fe3+。
铁离子的检验方法
铁离子的检验方法:
1、加入氢氧化钠溶液,生成白色沉淀,白色沉淀迅速变成灰绿色,最后,变成红褐色,这证明有铁离子。
2、向溶液中加入酸性高锰酸钾,若褪色,亚铁离子,不褪色,则为铁离子。
3、向溶液中加入醋酸钠,由于亚铁离子遇醋酸钠无现象,而铁离子则发生双水解,产生沉淀,再结合。
铁离子化学性质:
铁离子的氧化性是大于铜离子的,而铁单质可以还原铜离子,自然更能还原铁离子了。
还原性从大到小:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、H、Cu、Hg、Ag、Pt、Au。
氧化性从小到大:K+、Ca2+、Na+、Mg2+、Al3+、Zn2+、Fe2+、Sn4+、Pb2+、H+、Cu2+、Fe3+、Hg+、Ag+,其实这是按照金属活动性顺序排列的。
(注:Pt、Au很稳定,一般很难形成对应的离子)。
铁离子和亚铁离子检验方法1、瑰红酸钾检验法:取少量溶液置入烧杯中,分别滴入瑰红酸钾溶液,只要溶液变为血红色,就可以证明溶液存在铁离子。
这个反应的原理是:铁离子遇到硫氰根离子显红色是检验铁离子的特征反应。
2、苯酚检验法:取少量溶液置入烧杯中,分别滴入几滴苯酚溶液,变紫色的溶液中含有铁离子。
需要注意的是亚铁离子的存在不会干扰铁离子的鉴定。
3、溴水检验法:取少量溶液置入烧杯中,分别滴入使用硫酸酸化的溴水中,振荡烧杯,可以使溴水褪色的溶液中含有亚铁离子。
很多强还原性离子,可以和溴水可以反应,因此用溴水检验法可以判断亚铁离子是否存在。
4、加碱液检验法:取少量溶液置入烧杯中,分别加入碱液(如氨水、氢氧化钠、氢氧化钾溶液),生成红褐色沉淀的溶液中含有铁离子。
生成白色沉淀并立即转变为绿色,最后变为红褐色的溶液中含有亚铁离子。
需要注意的是,这种方法需要铁离子和亚铁离子的浓度较高,而且易受其它金属离子(如镁离子,铜离子)干扰,现象并不明显,所以这种方法不适合从未知成分的溶液中鉴别这两种离子。
5、高锰酸钾检验法:取少量溶液置入烧杯中,分别加入酸性高锰酸钾溶液,振荡烧杯,紫色褪去的溶液中含有亚铁离子。
这种方法的原理是强还原性离子可以和高锰酸根反应。
6、纯碱检验法:取少量溶液置入烧杯中,分别滴入少量纯碱溶液,产生灰色沉淀的溶液含有亚铁离子,生成红褐色沉淀的溶液含有铁离子。
纯碱和亚铁盐生成碳酸亚铁,和铁盐发生双水解反应。
需要注意的是此种方法易受其它金属离子(如镁离子,铝离子)干扰,不适合从未知成分的溶液中鉴定这两种离子。
7、铜片检验法:取少量溶液置入烧杯中,分别滴在铜片上,过一段时间后铜片发生腐蚀的溶液中含有铁离子。
8、赤血盐检验法:取少量溶液置入烧杯中,分别滴入赤血盐溶液,出现蓝色沉淀的溶液含亚铁离子,无蓝色沉淀生成原溶液含铁离子。
学科分类号(二级)150.2510本科学生毕业论文(设计)题目一种简单区别Fe3+与Fe2+的方法姓名付兆锋学号*********院、系化学化工学院专业化学类指导教师陈芮职称(学历)讲师(博士)一种简单区别Fe3+与Fe2+的方法摘要:单宁酸属水解类单宁,是具有重要开发利用价值的天然产物。
本文首先以单宁酸的化学性质为重点,论述了单宁酸的研究意义,进展及前景。
由于Fe3+和Fe2+遇单宁酸呈现不同的颜色,本研究采用单宁酸试纸来区别这两种离子。
浓度为0.01 mol/L的单宁酸制备的试纸鉴别效果最佳,检测下限可达5.0×10-6 mol/L。
该法具有鉴别速度快、效果明显、检测下限低等特点。
采用摩尔比法测得单宁酸与Fe3+和Fe2+形成的络合物的络合比分别为15:1和7:1。
关键词:单宁酸;络合比;光度分析;检测限1 引言单宁酸(Tannic acid)又称鞣酸,是具有重要开发利用价值的天然产物[1],也是研究最早的单宁类化合物之一,富含于中国五棓子、土耳其棓子、塔拉果荚、石榴、漆树叶、黄栌、金缕梅树等植物中。
单宁酸自然资源丰富,在世界上主要分布于南美洲西北部的秘鲁、厄多瓜尔、哥伦比亚等国;在我国主要分布于气候、土壤等条件独特的秦岭、巴山、武当山等地区[2]。
单宁酸属于典型的葡萄糖棓酰基化合物,常温下为黄色或棕黄色无定形松散粉末,有特殊气味及强吸湿性;毒性低;在空气中易被氧化使颜色变深;易溶于水、乙醇、丙酮,不溶于氯仿或乙醚[3]。
单宁酸由多种化合物组成,化学成分比较复杂。
根据化学结构的差异,通常将单宁酸分为如下2类:(1)缩合类单宁酸。
这类单宁酸是黄烷醇衍生物,分子中黄烷醇的2位通过碳-碳与儿茶酚或苯三酚相连。
(2)可水解类单宁酸。
其分子中含有酯键,是葡萄糖的没食子酸酯[4]。
此类单宁酸的化学结构如图1所示。
图1 单宁酸的化学结构式Fig. 1 Chemical Structure of Tannic Acid单宁酸具有多个酚羟基结构,这种结构赋予了它独特的化学性质及生理活性。
早在上世纪80年代,Haslam等提出了多酚与蛋白质的反应机理为“手套-手”反应模式,从而揭示了单宁酸与蛋白质、生物碱、多糖反应的本质[5-7]。
单宁酸的多酚羟基结构具有很强的供氢能力,能很好地清除氧自由基,表现出比其他抗氧化剂更强的活性[8]。
单宁酸相邻的酚羟基能以氧负离子的形式与金属离子形成稳定的五元环螯合物;邻苯三酚结构中的第三个酚羟基虽然没有参与络合反应,但可以使另外两个酚羟基发生离解,从而促进络合物的形成及稳定[9]。
单宁酸能发生亚硫酸化、磺化、醚化、酯化、偶氮化等衍生化反应。
通过衍生化反应改变其疏水、亲水比值、增加脂溶性,能进一步改善和拓展单宁酸的性质,满足更广泛领域的需求[10]。
单宁酸与金属离子形成的络合物通常都有颜色,且在不同pH下能生成沉淀,如单宁酸与Fe3+反应生成黑色沉淀[2];与Fe2+反应却没有颜色上的变化,这一反应特征可用来鉴别Fe3+与Fe2+。
单宁酸活泼的化学性质决定了其在生产和生活中广泛的用途。
在日化工业中由于单宁酸对链球菌有很强的抑制作用,同时,还可以抑制牙龈透明质酸酶和胶原酶的活性。
因此,在牙膏中加入单宁酸可有效防止牙龈病和牙周炎,具有抗龋齿的功能[11]。
单宁酸对易引起皮肤衰老的美拉德反应有很强的抑制作用。
因此,单宁酸被用作为化妆品中防晒和抗衰老的有效成分[12]。
传统药方中,含单宁酸为主的五棓子、儿茶鞣质为主的儿茶素,常因其具有收敛性被用作创伤、烧伤表面的止血剂,同时由于它们具有一定的抑菌作用,可以保护伤部,防止伤口感染发炎[13]。
近年来,单宁酸因具有抗诱变、抗肿瘤和抗癌等性质,已引起了药学家们浓厚的兴趣。
研究表明:单宁酸和茶单宁对于化学诱变的皮肤、肺及前胃肿瘤有很好的抑制作用[14-15]。
此外,单宁酸在食品工业中也得到了广泛应用,如:用作保健品、食品、酒类等的添加剂[16-17]。
在化学领域,鉴别Fe3+和Fe2+鉴别方法很多。
硫氰化物法是利用Fe3+和Fe2+与可溶性硫氰化物(如KSCN、NaSCN、NH4SCN)等溶液反应后,得到不同颜色的产物来进行区别。
变为血红色的是含有Fe3+的溶液:Fe3++SCN-=Fe(SCN)2+;不变血红色的是Fe2+。
磺基水杨酸法[18]即在pH=1.8~2.5的酸性水溶液中,Fe3+和磺基水杨酸可以形成稳定的紫红色络合物;且在此条件下只有Fe3+和磺基水杨酸根离子(SSal2-)络合显色,Fe2+则不显色。
与多酚络合,由于多酚与金属离子络合所形成的螯合物通常有颜色,并在不同pH下生成沉淀,如单宁酸与Fe3+反应和单宁酸与Fe2+反应的现象明显不同,因此单宁酸可用来区别Fe3+和Fe2+[19]。
研究表明:单宁酸与金属离子并不是以1:1的比例进行络合的,同时发现单宁酸的最大吸收特征峰均在近紫外区215及276 nm处[20]。
常用测定络合比的方法包括:饱和法、等摩尔连续变量法、斜率比法、平衡移动法。
由于单宁酸与Fe3+和Fe2+形成的络合物比较稳定,因此,本实验采用摩尔比法(或称饱和法)测定单宁酸与Fe3+和Fe2+的络合比[21-22],具体做法如下。
设金属离子M和络合剂L形成络合物的化学反应为:M + nL=ML n式中,n为络合物的配位数,采用摩尔比法进行测定,即配制一系列溶液,各溶液的金属离子浓度、酸度、温度等条件恒定,只改变配位体的浓度,在络合物的最大吸收波长处测定各溶液的吸光度A,以A对摩尔比c L/c M作图,如图2所示。
图2 摩尔比法测定络合物组成Fig. 2 Determination of Complex by Mole Ratio Method将曲线的线性部分延长相交于一点,该点对应的c L/c M值即为配位数n。
近年来,单宁酸以其独特的物理化学性质在化学、医药、生物科学等领域获得了广泛的应用。
本论文以单宁酸与Fe3+和Fe2+所形成的络合物呈现不同颜色为基础,尝试制备单宁酸试纸[23-24],并将其用于区分Fe3+和Fe2+。
通过调整实验条件、优化单宁酸试纸的制备过程,采用目测法确定单宁酸试纸的检测限[25]。
同时,通过对单宁酸、Fe3+和Fe2+性质的研究,采用分光光度法探究测定络合系数的实验条件,以达到对单宁酸性质的深入研究。
通过改变Fe3+和Fe2+的浓度采用目测法确定单宁酸试纸的检测限,希望这种研究思路能够为快速、灵敏地区别其它金属离子提供研究方法与参考。
通过研究单宁酸与Fe3+和Fe2+的络合行为进一步认识单宁酸的组成、结构及性质,以期这种研究能为区别Fe3+和Fe2+提供一种快速、灵敏、全新的方法。
2 实验部分2.1主要仪器和试剂TU-1901型紫外-可见分光光度计(北京普析通用仪器有限责任公司)实验所用试剂氯化铁晶体(深圳市迈顿科技有限公司)、氯化亚铁晶体(深圳市迈顿科技有限公司)、单宁酸(宁波韩发化工有限公司)等试剂均为分析纯2.2实验方法2.2.1单宁酸试纸的制备及检测限测定分别配制浓度为0.1 mol/L,0.01 mol/L,0.001 mol/L的单宁酸溶液50 mL。
然后滤纸条分别在单宁酸溶液中浸泡2 h,取出干燥即为单宁酸试纸。
将浓度为0.1 mol/L的FeCl3溶液分别滴到单宁酸试纸上,从三组试纸中选出显色速率较快、显色效果最好的一组作为标准试纸进行检测限的测定。
在标准试纸上滴加浓度依次稀释10倍的FeCl3溶液,观察至试纸颜色不再发生变化,以确定其检测限。
2.2.2 络合比的测定遵循摩尔比法测定络合比的原理。
在10 mL的容量瓶中分别加入固定体积的Fe3+标准溶液,然后分别加入体积逐渐增大且浓度一定的单宁酸溶液,定容。
用相同方法处理Fe2+标准溶液,从而制得一系列络合物溶液。
用1 cm的比色皿,以空白溶液为参比溶液,在波长200~600 nm处测定各溶液的吸光度。
以最大吸收峰对应的吸光度A为纵坐标,c L/c M为横坐标作图,确定络合物的络合比n。
3 实验结果与讨论3.1试纸制备及检测限确定实验选用了三组不同浓度的单宁酸溶液进行试纸制备。
用0.1 mol/L单宁酸溶液制备出的试纸为深棕色,质地干硬,滴上0.1 mol/LFeCl3溶液5 s后可观察到试纸变成黑蓝色,由于试纸本身颜色的干扰,显色效果并不明显。
用0.01 mol/L 单宁酸溶液制备出的试纸为棕黄色,质地比较柔软,滴上0.1 mol/LFeCl3溶液试纸后迅速变为黑蓝色,颜色和试纸本身差别很大,滴加FeCl3溶液前后,变色效果明显。
用0.001 mol/L单宁酸溶液制备出的试纸为浅黄色,用同样方法处理,发现试纸颜色立即发生变化,可相对于用0.01 mol/L单宁酸溶液制得的试纸,滴加FeCl3溶液前后试纸颜色变化不明显。
因此,实验中选取0.01 mol/L单宁酸溶液制备的试纸作为标准试纸。
在标准试纸上分别滴加逐级稀释10倍的FeCl3溶液,发现随FeCl3溶液浓度的减小,试纸逐渐由蓝黑色变为蓝色最后变为浅蓝色。
当浓度达5.0×10-6 mol/L 时试纸颜色不再变化。
研究表明:用0.01 mol/L单宁酸溶液制得的试纸显色效果最好,能检测出浓度大于5.0×10-6 mol/L的Fe3+溶液。
3.2络合比的测定用1 cm的比色皿,以蒸馏水为参比溶液,在波长200~600 nm处测定各溶液的吸光度。
结果如下,图3和图4分别为单宁酸与Fe3+和Fe2+形成的络合物的紫外吸收谱图。
结果表明:单宁酸与Fe3+形成的络合物在273 nm处和213 nm处有吸收峰,最大吸收波长为213 nm。
单宁酸与Fe2+形成的络合物同样有两个吸收峰,分别位于波长271 nm处和212 nm,最大吸收峰出现在212 nm处。
图3单宁酸与Fe3+形成络合物的紫外-可见光吸收谱图Fig.3Ultraviolet-Visible Absorption Spectra of Tannins and Fe3+ Complex图4单宁酸与Fe2+形成络合物的紫外-可见光吸收谱图Fig.4Ultraviolet-Visible Absorption Spectra of Tannins and Fe2+ Complex 将图3和图4所测得的络合物最大吸收峰对应的吸光度A及c L/c M的计算结果列于表1及表2中。
表中所用单宁酸、Fe3+及Fe2+溶液的浓度均为2.5×10-6 mol·L-1。
表1单宁酸与Fe 3+形成的络合物的实验数据Tab.1 Experimental Data of Tannins and Fe 3+ Complex 表2单宁酸与Fe 2+所形成络合物的实验数据Tab.2 Experimental Data of Tannins and Fe 2+ Complex编号加入Fe 3+溶液的体积(mL ) 加入单宁酸溶液的体积(mL ) A c L /c M 1 0.5 1.0 0.0196 2 20.5 2.0 0.1073 4 30.5 3.0 0.1825 6 40.5 4.0 0.2446 8 50.5 5.0 0.3325 10 60.5 6.0 0.3883 12 70.5 7.0 0.4321 14 80.5 8.0 0.4965 16 9 0.5 9.0 0.3283 18编号加入Fe 2+溶液的体积(mL ) 加入单宁酸的体积(mL ) A c L /c M 11.0 1.0 0.1108 1 21.0 1.5 0.1628 2 31.02.0 0.2225 3 41.02.5 0.2525 4 51.0 3.0 0.2924 5 61.0 3.5 0.3548 6 71.0 4.0 0.4078 7 81.0 4.5 0.4078 8 91.0 5.0 0.3967 9以吸光度A为纵坐标,c L/c M为横坐标作图,其中图5为单宁酸与Fe3+形成的络合物的吸光度A与c L/c M的关系曲线;图6为单宁酸与Fe2+形成的络合物的吸光度A与c L/c M的关系曲线。