(完整word版)初三化学物质的检验、鉴别、共存与除杂
- 格式:doc
- 大小:63.51 KB
- 文档页数:2

共存、除杂、鉴别
一、溶液相关的不共存:
1、生成水:H+与OH—(包括不溶性碱)
2、生成气体:H+与CO32—(包括不溶性碳酸盐),H+与HCO3—,H+与活泼金属,OH—与NH4+
3、生成沉淀:背熟溶解性表
4、置换:较活泼金属单质与不活泼金属离子或H+(如:Fe与Cu2+,Fe与H+)
注意:1、H+或OH—有时用pH表示
2、有相同离子的物质,相互间一般不发生复分解反应
二、除杂的原则
1、显然要能除去杂质(一般用溶液反应,否则不能保证杂质充分反应而除尽)
2、不能生成或引入新杂质
3、允许生成需保留的物质,尽量不消耗需保留的物质
三、物质鉴别的思考顺序
1、本身有颜色
2、可相互反应且有明显现象(颜色、气泡、沉淀)
3、发生第一次反应后的生成物还可发生别的反应
4、有时明显放热或吸热、气味等也可作为鉴别的依据
四、鉴别SO42—
1、加入BaCl2,生成白色沉淀
2、加入稀硝酸,沉淀不消失,即可确认是SO42—
3、若沉淀消失且有气泡产生,则为CO32—
五、鉴别Cl—
1、加入AgNO3,生成白色沉淀
2、加入稀硝酸,沉淀不消失,即可确认是Cl—。


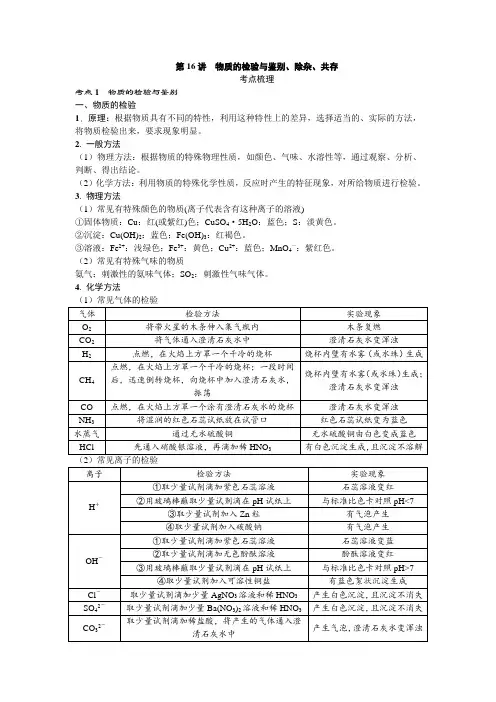
第16讲物质的检验与鉴别、除杂、共存考点梳理考点1 物质的检验与鉴别一、物质的检验1. 原理:根据物质具有不同的特性,利用这种特性上的差异,选择适当的、实际的方法,将物质检验出来,要求现象明显。
2. 一般方法(1)物理方法:根据物质的特殊物理性质,如颜色、气味、水溶性等,通过观察、分析、判断、得出结论。
(2)化学方法:利用物质的特殊化学性质,反应时产生的特征现象,对所给物质进行检验。
3. 物理方法(1)常见有特殊颜色的物质(离子代表含有这种离子的溶液)①固体物质:Cu:红(或紫红)色;CuSO4·5H2O:蓝色;S:淡黄色。
②沉淀:Cu(OH)2:蓝色;Fe(OH)3:红褐色。
③溶液:Fe2+:浅绿色;Fe3+:黄色;Cu2+:蓝色;MnO4—:紫红色。
(2)常见有特殊气味的物质氨气:刺激性的氨味气体;SO2:刺激性气味气体。
4. 化学方法(1)常见气体的检验1. 物质的鉴别原则:操作简单、试剂种类少、现象明显。
2. 物质鉴别的方法:应先简后繁,先用物理方法后用化学方法。
(1)物理方法:依据物质的特殊的物理性质(如颜色、状态、气味、溶解性、溶解时的吸放热现象)进行观察、分析、判断,得出结论。
(2)化学方法:依据物质间反应时所产生的特殊反应现象(如变色、放出气体、生成沉淀、放热等)进行鉴别。
3. 物质鉴别的形式(1)一种试剂鉴别:选择一种试剂,分别加入待测物质中,观察实验现象。
(2)多种试剂鉴别:选择多种试剂,依次加入待测物质中,会出现明显不同现象。
(3)无试剂鉴别:先利用物质物理性质不同或物质间的相互反应(包括与生成物反应)而产生不同现象把物质鉴别出来。
考点2 物质的除杂1. 除杂原则:不增、不减、易分(1)主不减:所选试剂不能与被提纯物质(主要成分)反应。
(2)杂不增:在除去杂质的同时,不能产生新的杂质。
(3)易分离:除杂后生成的产物的状态与被提纯物质的状态要不同,方便除去。
2. 除杂方法(1)气体的除杂方法一:将杂质气体通过物质吸收、反应除去,如氧气中的水蒸气可通过浓硫酸吸收除去、一氧化碳中的二氧化碳可通过氢氧化钠溶液吸收除去。


专题一物质的共存、检验、鉴别和除杂Ⅰ. 物质的共存(8年3考)针对训练1. (2013长沙)下列各组物质分别加入到足量的水中,能得到无色透明溶液的是( )A. 3、、B. 3、24、C. 4、H24、D. 2、、2. (2016赤峰)某溶液中大量存在的离子仅有、2+和X离子,则X是( )A. -B. -C. K+D.3. (2016重庆A)某植物培养液中含有4和4,下列物质在该培养液中能大量存在的是( )A. B. 2 C. 3 D. 34. (2017衡阳)下列离子在=1的溶液中能大量共存,且为无色溶液的是( )A. 2+-B. K++-C. 3+2+-D. +2+-5. (2017荆州)某溶液能使紫色石蕊溶液变蓝,下列各组离子在该溶液中能大量共存的是( )A. 、、2+、-B. 2+、+、、K+C. K+、、、-D. H+、2+、K+、6. (2017南京)下列各组离子在水中能大量共存的是( )A. 2+、+、-、-B. H+、K+、、C. +、、、-D. +、2+、、-7. (2017滨州)小滨对某无色溶液所含溶质的记录,合理的是( )A. 、、24B. 3、2、3C. 3、H24、D. 、23、8. (2016巴中)下列各组离子在指定的溶液中能大量共存的一组是( )A.在硝酸铵溶液中:+、2+、-B.在稀盐酸中:2+、、2+C.在氯化钠溶液中:K+、2+、D.在氢氧化钠溶液中:H+、2+、-Ⅱ.物质的检验、鉴别(8年4考)针对训练【长沙真题精选】1. (2011长沙)“家庭小实验”是利用家庭生活中常用的物用“家庭小实验”质,进行化学实验探究的活动。
下列实验不能..完成的是( )A. 检验自来水是否含有氯离子B. 用闻气味的方法鉴别酒精和水C. 检验自来水是否为硬水D. 探究铁在潮湿的空气中是否生锈2. (2014长沙)鉴别下列物质使用的方法或试剂,正确的是( )A. 氧气与氢气——闻气味B. 硫酸铜粉末与氯化钠固体——加水C. 稀硫酸与稀盐酸——滴加紫色石蕊溶液D. 二氧化碳气体与氯气——用燃着的木条3. (2017长沙)下列各组物质的溶液,不另加试剂就不能鉴..别出来的一组是( )A. 43B. 333C. 232D. 2K23【好题精练】4. (2017北京)下列方法能区分氧气和二氧化碳两瓶气体的是( )A. 闻气味B. 观察颜色C. 倒入适量氢氧化钠溶液D. 将燃着的木条伸入集气瓶中5. (2017成都)能用于鉴别氢氧化钠溶液和氢氧化钙溶液的物质是( )A. B. 3 C. K23 D. 36. (2017株洲)只用一种试剂可以区分(4)24、4、K24三种无色溶液,这种试剂是( )A. 3溶液B. ()2溶液C. 溶液D. 盐酸7. (2017南雅下学期一模改编)下列鉴别物质的方法中,切实可行的是( )A. 用酚酞溶液鉴别溶液和盐酸B. 用水鉴别23和3固体C. 用碳酸钠鉴别稀盐酸和稀硫酸D. 用酚酞溶液鉴别烧碱与纯碱8. (2017麓山一模)用括号内试剂不能一次性将组内物质鉴别出来的是( )A. 固体:、43、(水)B. 液体:稀盐酸、H2O、()2溶液(石蕊溶液)C. 固体:、3、(水)D. 液体:(3)2溶液、2溶液、K23溶液(稀硫酸)9. (2017烟台改编)下列各组物质的溶液,不用其他试剂,只用观察和组内物质的溶液相互混合的方法,就能将它们一一鉴别出来的是( )A. 、2、4、3B. (3)2、、24、C. 、2、、D. 、23、、210. (2017哈尔滨)区分下列各组物质的两种方法都正确的是( )11. (2017益阳)鉴别下列各组中的三种物质,所选试剂或用品能达到目的的是( )12. (2017德州)下列四个实验方案设计不合理的是( )13. (2016麓山实验模拟)下列各组溶液不用其他试剂,而用物质间两两混合的方法能够鉴别的是( )A. 24、2、3、B. 、24、3、2C. 24、23、2、D. 、3、3、Ⅲ. 物质的除杂(近8年仅2011年未考)针对训练【长沙真题精选】1. (2017长沙)除去下列物质中含有的少量杂质,所用试剂或方法正确的是( )2. (2014长沙)除去下列物质中混有的少量杂质(括号内为杂质),所用方法正确的是( )A. (2)——通过灼热的氧化铜B. (24)——加入硝酸银溶液C. 3固体(固体)——高温煅烧D. 4溶液(H24)——加入铁粉【好题精练】3. (2017株洲)除去氯化钾溶液中混有的少量碳酸钾,最合理的方法是( )A. 加入足量的氯化钡溶液,过滤B. 加入足量的稀盐酸,加热C. 加入足量的硝酸钡溶液,过滤D. 加入足量的稀硫酸,加热4. 下列各组括号内除杂质的试剂或方法错误的一组是( )A. O2中混有少量的水蒸气(浓硫酸)B. 中混有3(高温煅烧)C. 铜粉中混有少量铁粉(稀硫酸,过滤)D. 溶液中混有少量2(适量溶液,过滤)5. (2017湘潭)要除去下列物质中的少量杂质(括号内物质为杂质),所选试剂不正确的是( )A. (23):盐酸B. 2(O2):灼热的铜粉C. (2):氢氧化钠溶液D. O2(H2O):浓硫酸6. (2017广州改编)下列除杂所选用试剂与操作方法均正确的是( )7. (2017雅礼教育集团模拟改编)除去下列物质中含有的少量杂质(括号内为杂质),所用试剂与主要操作均合理的是( )8. (2017明德天心模拟)将下列物质中混有的杂质除去,所选用的试剂与操作方法均正确的是( )9. (2017麓山一模)下列关于物质的除杂所选用的试剂或方法错误的是( )10. (2017衡阳改编)为除去物质中的杂质(括号内为杂质),所选试剂与操作方法错误的是( )11. (2017南京改编)除去下列物质中混有的少量杂质(括号内为杂质),拟定的实验方案不可行的是( )A. 2溶液(2)——加入过量的铁粉,过滤B. 固体(3)——加入少量的二氧化锰,并加热C. 4溶液(H24)——加入足量的氧化铜粉末,过滤D. 溶液(2)——加入过量的氢氧化钠溶液,过滤,滤液中加稀盐酸至中性12. (2017遵义改编)除去下列物质中少量杂质(括号内为杂质)的方法,叙述正确的是( )A. 一氧化碳(二氧化碳)——通过灼热的氧化铜B. 水(植物油)——加洗洁精,搅拌振荡C. 23(3)固体——充分加热至固体质量不变D. 溶液(2)——滴加适量K23溶液、过滤参考答案与解析Ⅰ.物质的共存针对训练1. A 【解析】A中的三种物质溶于水都能形成无色透明的溶液,相互之间不发生化学反应;B中3的水溶液呈黄色;C中的水溶液呈蓝色;D中2的水溶液呈浅绿色,且2与不能共存。
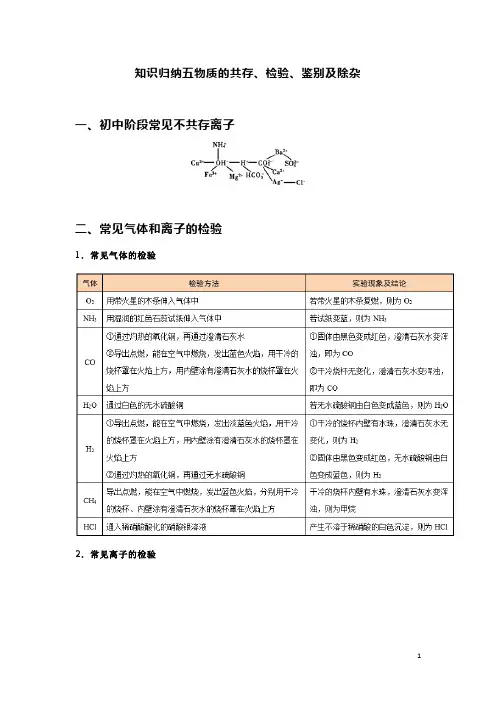
知识归纳五物质的共存、检验、鉴别及除杂一、初中阶段常见不共存离子
二、常见气体和离子的检验
1.常见气体的检验
2.常见离子的检验
三、常见物质的鉴别
四、常见物质的除杂
1.除杂原则——“不增、不减、易分离”
(1)除杂过程中不能引入新杂质,即“不增”。
(2)加入的试剂不能与所需要的物质反应,所需物质可增多但不可减少,即“不减”。
(3)杂质应转化为原物质或沉淀、气体、水等易分离的物质,即“易分离”。
2.酸、碱、盐溶液除杂技巧
(1)被提纯物与杂质阳离子相同(如NaCl中含杂质NaOH),选取与杂质中的阴离子(OH-)不共存的阳离子(H+),再与被提纯物中的阴离子(Cl-)组合成除杂试剂(HCl)。
发生反应:NaOH+HCl=NaCl+H2O。
(2)被提纯物与杂质阴离子相同(如NaCl中含杂质BaCl2),选取与杂质中的阳离子(Ba2+)不共存的阴离子(SO42-),再与被提纯物中的阳离子(Na+)组合成除杂试剂(Na2SO4)。
发生反应:BaCl2+Na2SO4=BaSO4↓+2NaCl。
(3)被提纯物与杂质阴、阳离子都不相同(如NaNO3中含杂质CuSO4),选取与杂质中的阴离子(SO42-)、阳离子(Cu2+)都不共存的阳离子(Ba2+)、阴离子(OH-)组合成的除杂试剂[Ba(OH)2]。
发生反应:CuSO4+Ba(OH)2=BaSO4↓+Cu(OH)2↓。
3.气体除杂
4.固体除杂
5.液体除杂。

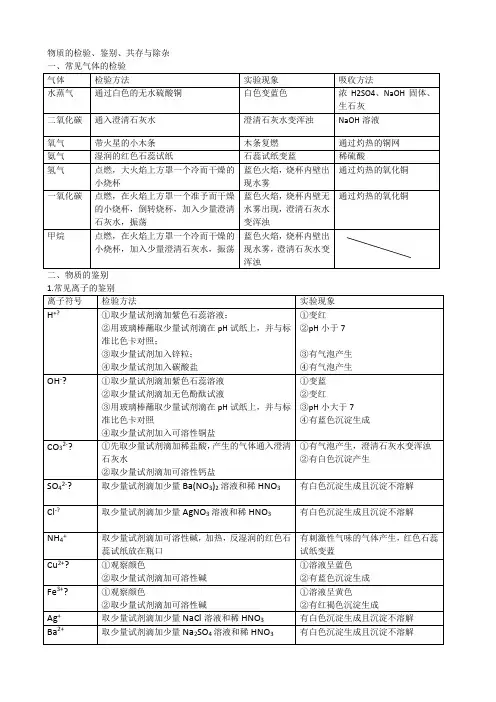
讲义内容⑻硬水与软水:加肥皂水,软水泡沬丰富(1)沉淀的颜色(2)固体的颜色(3)溶液的颜色3、物质鉴别的思路和方法①气体鉴别:一看颜色,二用试纸,三用火点,四加试剂。
②固体、液体鉴别:一看颜色,二看气体,三辨沉淀。
③一种试剂的鉴别:练习.•1.(2013北京市)下列方法能鉴别氧气和空气的是A.闻气味B.将集气瓶倒扣在水中C.观察颜色D.将带火星的木条伸入集气瓶屮2.(2013泉州市)下列实验方法无法达到实验口的的是蠢蠢A.用肥皂水鉴别硬水和软水B.用燃着的木条鉴别氯气与二氧化碳C.用熟石灰中和废液中的盐酸D.用紫色石蕊试液鉴别稀硫酸和蒸馏水例:分离食盐和芝麻的混合物的步骤:(1)先将混合物加足量水溶解(2)过滤(3)蒸发滤液,得到固体食盐(4)如果要获得固体芝麻,可洗涤烘干(二)化学方法1、沉淀法:使混合物中的杂质与适当试剂反应,生成沉淀通过过滤而除去2、气体法:采用加热或加入某种试剂,将混合物屮的杂质转化成气体而除去3、置换法:将混合物中的杂质与适量试剂通过发生置换反应而除去例:FeSOf固体(CuSOJ:加适量水溶解,加入适量铁粉,过滤蒸发滤液4、加热法:通过加热(或高温)将杂质转化为被提纯的物质eg:除去下列物质屮的杂质(括号内的物质是杂质),用化学方程式表示①CaO (CaCO3) ____________②CuO (Cu) ______________5、吸收法:两种以上混合气体中的杂质被某种溶剂或溶液吸收,而要提纯的气体不能被吸收时,可用此方法。
例:一氧化碳中含省二氧化碳时,可将混合气体通过足量氢氧化钠的溶液附:常见气体吸收剂如下:用化学方法除去溶液中的杂质时,要使被分离的物质或离子尽可能除净,需要加入过量的分离试剂, 在多步分离过程中,后加的试剂应能够把前面所加入的过量试剂除去。
练习:1、写出除去下列括号中的杂质所用方法及相关的化学方程式(没有说明皆为固体或气体):NaCl (泥沙) __________________________________N2 (02) ______________________________________co2(水蒸气)________________________________02(水蒸气) ________________________________CaO (CaCO3)KC K KCIO O ______________________________________co (co2) __________________________ 、co2 (co) __________________________CuO (Cu) _____________________________________Cu (CuO) _____________________________________Cu 粉(Fe 粉)___________________________ 、2、将N2、CO、HC1三种混合气体依次通过NaOH溶液、浓硫酸、灼热的CuO,假设每次处理均能完全反应(或吸收)。

题型二物质的共存检验鉴别和除杂物质的共存是溶液中的物质相互间不发作化学反响。
物质的检验,即对物质停止反省验证,证明物质的存在。
物质的鉴别指的是对一定范围内的几种物质停止区分。
物质的除杂是指除去某种物质所含的杂质,使其变得纯真。
河南中考中有关〝物质的共存、检验、鉴别、除杂〞的内容,主要触及酸、碱、盐之间的复分解反响,掌握酸、碱、盐中的有关〝离子对〞是解答此局部标题的关键。
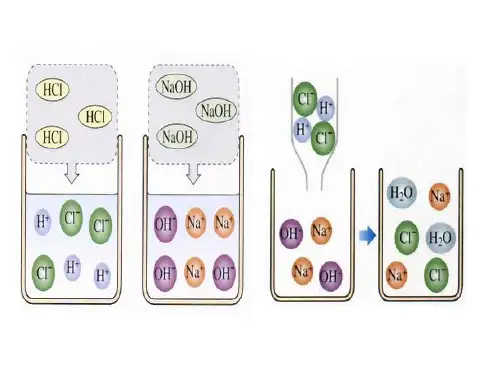
类型1 物质的共存1.物质共存的条件(1)组内物质均可溶。
(2)在同一溶液中,物质(或物质所含离子)之间不发作化学反响,即不会生成水、气体或沉淀。
2.罕见的相互不能共存的离子对罕见的不能共存的离子对,记忆口诀:〝3气1水8沉淀〞。
(1)3气(生成气体)①H++CO 32-}H2O+CO2↑②H++HCO3-③N H4++OH-NH3↑+H2O(2)1水(生成水)H++OH-H2O(3)8沉淀(生成沉淀)①生成盐:Ca2++C O32-CaCO3↓(白色)Ba2++C O32-BaCO3↓(白色)Ba2++S O42-BaSO4↓(白色)Ag++Cl-AgCl↓(白色)②生成碱:Cu2++OH-Cu(OH)2↓(蓝色)Fe3++OH-Fe(OH)3↓(红褐色)Mg2++OH-Mg(OH)2↓(白色)Al3++OH-Al(OH)3↓(白色)3.物质共存的隐含条件(1)罕见的有颜色的溶液蓝色溶液:含Cu2+的溶液,如CuCl2、CuSO4溶液等。
浅绿色溶液:含Fe2+的溶液,如FeCl2、FeSO4溶液等。
黄色溶液:含Fe3+的溶液,如FeCl3、Fe2(SO4)3溶液等。
紫白色溶液:KMnO4溶液。
在无色溶液中,上述溶液中的溶质不能存在。
(2)溶液的酸碱性①酸性:溶液的pH<7,溶液中一定存在H+,那么该溶液中一定不含能与H+反响的物质或离子,如OH-、C O32-、HC O3-等。
②碱性:溶液的pH>7,溶液中一定存在OH-,那么该溶液中一定不含能与OH-反响的物质或离子,如H+、Cu2+、Mg2+、N H4+等。
初中化学常见物质的除杂总结概念理解首先明白物质除杂是干什么,物质除杂又叫物质提纯,即把混合物中少量的杂质出去,得到较纯净物质的过程。
初中化学除杂、提纯方法及例题将混合物中的几种物质分开而分别得到较纯净的物质,这种方法叫做混合物的分离。
将物质中混有的杂质除去而获得纯净物质,叫提纯或除杂。
1 物理方法1.l 过滤法.原理:把不溶于液体的固体与液体通过过滤而分开的方法称为过滤法。
如:氯化钙(CaCl2)中含有少量碳酸钙(CaCO3)杂质,先将混合物加水(H2O)溶解,由于氯化钙(CaCl2)溶于水,而碳酸钙(CaCO3)难溶于水,过滤除去杂质碳酸钙(CaCO3),然后蒸发滤液,得到固体氯化钙(CaCl2)。
如果要获得杂质碳酸钙(CaCO3),可洗涤烘干。
练习1 下列混合物可以用溶解、过滤、蒸发操作来分离的是:()A.CaCO3 CaO B.NaCl KNO3C.NaNO3 BaSO4D.KCl KClO31.2 结晶法.原理:几种可溶性固态物质的混合物,根据它们在同一溶剂中的溶解度或溶解度随温度的变化趋势不同,可用结晶的方法分离。
eg:除去固体硝酸钾(KNO3)中混有的氯化钠(NaCl)杂质,先在较高温度下制成硝酸钾的饱和溶液,然后逐步冷却,由于硝酸钾(KNO3)的溶解度随温度的升高而显著增大,温度降低,大部分硝酸钾成为晶体析出,而氯化钠的溶解度随温度的升高而增大得不显著,所以大部分氯化钠仍留在母液中,通过过滤把硝酸钾和氨化钠溶液分开。
为进一步提纯硝酸钾,可再重复操作一次,叫重结晶或再结晶。
练习2 下列混合物适宜用结晶法分离的是:()A.NaNO3 Na2CO3B.NaNO3 NaCl C.NaOH Mg(OH)2D.NaCl BaSO42 化学方法:原理(一)、加入的试剂只与杂质反应,不与原物反应。
(二)、反应后不能带入新的杂质。
(三)、反应后恢复原物状态。
(四)、操作方法简便易行。
初中常用化学除杂方法有以下几种:2.1 沉淀法:使混合物中的杂质与适当试剂反应,生成沉淀通过过滤而除去。