高中有机化学方程式总结(及高锰酸钾褪色超全)
- 格式:doc
- 大小:202.50 KB
- 文档页数:10

高中有机化学方程式总结高中有机化学方程式综述一、碳氢化合物甲烷烷烃通式:CnH2n-2 (1)氧化反应燃烧甲烷燃烧:CH4+2O2 CO2+2H2O甲烷不能使酸性高锰酸钾溶液和溴水变色。
(2)取代反应光线氯甲烷:CH4+Cl2 CH3Cl+HCl2.乙烯乙烯的制备:烯烃通式:(1)乙烯的氧化反应燃烧:乙烯会使酸性高锰酸钾溶液褪色并引起氧化反应。
(2)加成反应丙烯和溴水加成:丙烯和氢加成:丙烯和氯化氢加成:丙烯和水加成:(3)聚合反应丙烯加成聚合,3.1,3丁二烯向溴中加入1,3丁二烯:1:1加入1,3丁二烯:4。
乙炔乙炔的制备:(1)乙炔在氧化反应中的燃烧;乙炔会使酸性高锰酸钾溶液变色并引起氧化反应。
(2)加成反应和溴水添加:加入氢气;加入氯化氢;图2乙炔(3)聚合反应的制备丙烯加聚:5。
苯苯的同系物具有以下通式:(1)氧化反应苯的燃烧:(苯不能淡化溴水和酸性高锰酸钾溶液。
(2)取代反应①苯和溴反应(2)硝化反应高中化学方程式概述(第二部分),第2-1页,共6页(3)加成反应甲苯(1)氧化甲苯的燃烧:甲苯不能使溴水褪色,但能使酸性高锰酸钾溶液褪色。
(2)取代反应:与溴的反应甲苯硝化反应产生2,4,6-三硝基甲苯,简称三硝基甲苯,也称为三硝基甲苯,是一种淡黄色晶体,不溶于水。
它是一种烈性炸药,广泛用于国防、采矿等。
二。
碳氢化合物衍生物烃类衍生物的重要类别及主要化学性质:卤代烃类醇酚醛羧酸酯代表物质通式为R-X R-羟基溴乙烷C2H5Br乙醇C2H5OH苯酚-羟基乙醛O | | CH3-C-H分子结构特征C-X键具有极性,易断裂的C-O键和O-H 键具有极性;-羟基直接与链烃基相连-羟基直接与苯环相连。
碳氧双键具有极性,并具有不饱和的主要化学性质。
1.取代反应:用氢氧化钠溶液进行取代反应生成乙醇;2.消除反应:与强碱醇溶液共同加热生成烯烃。
1.与钠反应生成醇钠并释放氢气;2.氧化反应:O2:产生CO2和H2O;;氧化剂:产生乙醛;3.脱水反应:140℃;乙醚;170℃:乙烯;4.酯化反应。

高锰酸钾褪色化学方程式
高锰酸钾(Potassium permanganate)褪色的化学方程式如下:
1. KMnO4 + 4HCl = KCl + MnCl2 + 2H2O + Cl2
2. KMnO4 + H2SO4 = K2SO4 + MnSO4 + Cl2 + H2O
3. KMnO4 + H3PO4 = K3PO4 + Mn3(PO4)2 + Cl2 + H2O
4. KMnO4 + HNO3 = KNO3 + Mn(NO3)2 + Cl2 + H2O
用高锰酸钾进行褪色实验是一种经常使用的技术。
高锰酸钾具有以下特点:
一、高效率:
高锰酸钾是一种物理氧化褪色剂,它对多种染料的褪色效果很理想。
如果高锰酸钾的浓度是一定的、水温控制在一定的范围内,则褪色的效率会比较高。
二、安全性:
高锰酸钾不使用任何危险的化学物质,它的氧化能力比氯酸小,可以
保证安全性。
三、稳定性:
高锰酸钾的稳定性非常好,它在空气中是稳定的,不易分解,而且易
于储存、操作、移动,可以长期保存,使用方便。
四、兼容性:
与混色型染料相比,高锰酸钾可以有效褪色配合染料中的蓝色成分。
此外,它还可以褪色经典、无机染料,并且与多种助剂和污染物兼容,不能褪色染料的残留物。
高锰酸钾的副作用也比较大。
它含有MnO4-离子,如果使用过量,会
对蛋白质、青贮蔬菜等食物形成氧化反应,产生不利影响,同时可能
会导致皮肤的刺激性和过敏性。
因此,在褪色实验中一定要注意使用量,以及希望获得最佳褪色效果的正确操作。
只有这样,才能有效地
保护环境和我们自身的健康。
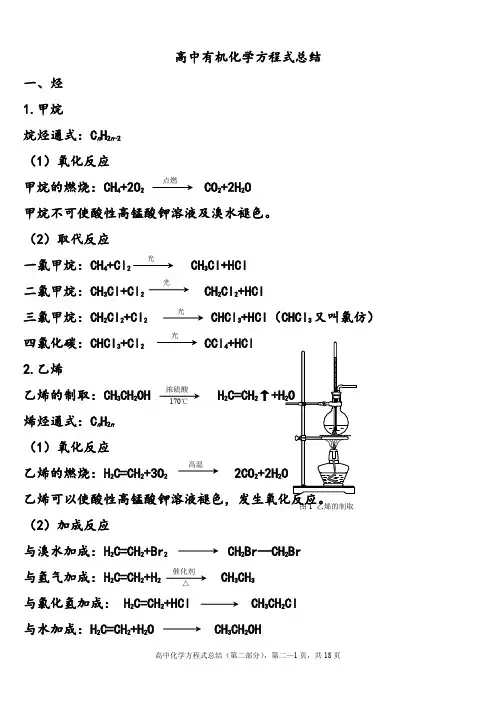
高中有机化学方程式总结一、烃 1.甲烷烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O 甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl 二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl 三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿) 四氯化碳:CHCl 3+Cl 2 CCl 4+HCl 2.乙烯乙烯的制取:CH 3CH 2OH H 2C=CH 2↑烯烃通式:C n H 2n (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br 与氢气加成:H 2C=CH 2+H 2 CH 3CH 3 与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl 与水加成:H 2C=CH 2+H 2O CH 3CH 2OH 点燃光光 光光 浓硫酸 170℃ 高温催化剂△图1 乙烯的制取乙烯加聚,生成聚乙烯:n H 2 2 n3.乙炔乙炔的制取:CaC 2+2H 2O HC ≡CH ↑+Ca(OH)2 (1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br 2HC=CH B rCHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl (3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2=CHCl nCHn4.苯苯的同系物通式:C n H 2n-6 (1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。

高中有机化学方程式总结一、烷烃比较稳定,常温下不能被酸性高锰酸钾溶液氧化,也不与强酸、强碱及溴的四氯化碳溶液反应。
(1)氧化反应——可燃性C n H 2n +2+3n +12 O 2――→点燃 n CO 2+(n +1)H 2O 。
(2)取代反应——特征反应CH 3CH 3+Cl 2――→光 CH 3CH 2Cl +HCl 。
二、烯烃 (1)氧化反应①烯烃能使酸性高锰酸钾溶液褪色,常用于的检验;②可燃性:单烯烃燃烧的通式为C n H 2n +3n 2 O 2――→点燃 n CO 2+n H 2O 。
(2)加成反应烯烃可与X 2、HX(X 表示卤素原子)、H 2、H 2O 等在一定条件下发生加成反应。
例如:(3)加聚反应丙烯生成聚丙烯:n CH 3CH===CH 2――→催化剂 。
三、.二烯烃的加成反应:如1,3-丁二烯。
1,3-丁二烯与溴发生加成反应时,有以下两种方式:(1)1,2-加成:CH 2==CH—CH==CH 2+Br 2→CH 2==CH—CHBr—CH 2Br 。
(2)1,4-加成:CH 2==CH—CH==CH 2+Br 2→CH 2Br—CH==CH—CH 2Br 。
四、苯的化学性质五、苯的同系物苯的同系物与苯的化学性质相似,但由于苯环与烷基的相互作用,使苯的同系物的化学性质与苯又有所不同。
(1)氧化反应①苯的同系物均能燃烧,:C n H 2n -6+3n -32 O 2――→点燃 n CO 2+(n -3)H 2O 。
②苯的某些同系物中,如果侧链烃基与苯环直接相连的碳原子上有氢原子,侧链烃基能被酸性KMnO 4溶液氧化(苯环使烃基活化):应用:常用于区别苯和苯的同系物。
(2)取代反应(以甲苯为例)甲基使苯环上与甲基处于邻、对位的氢原子活化而易被取代。
①卤代+Br 2――→FeBr 3;+Cl 2――→光。
②硝化。
生成的三硝基甲苯的系统命名为2,4,6-三硝基甲苯,又叫梯恩梯(TNT),是一种淡黄色晶体, (3)加成反应六、卤代烃 (1)取代反应C 2H 5Br +NaOH ――→水△ C 2H 5OH +NaBr (2)消去反应(消除反应)CH 3CH 2Br +NaOH ――→乙醇△ CH 2===CH 2↑+NaBr +H 2O__ 七、乙醇的化学性质八、苯酚的酸性①实验探究苯酚的酸性②苯酚的酸性与碳酸、碳酸氢根离子的比较所以酸性:H 2CO 3(2)苯环上的取代反应(3)显色反应苯酚与FeCl 3溶液作用显紫色,利用这一反应可以检验苯酚的存在。
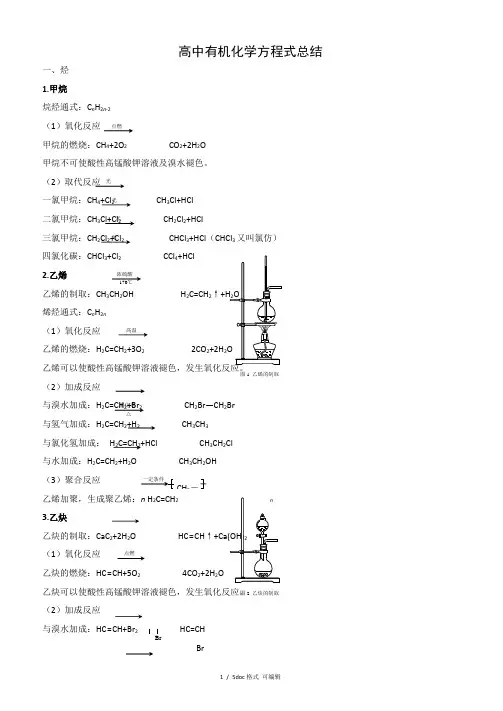
高中有机化学方程式总结一、烃1.甲烷烷烃通式:C n H 2n -2(1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl 二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿) 四氯化碳:CHCl 3+Cl 2 CCl 4+HCl2.乙烯 乙烯的制取:CH 3CH 2OH H 2C=CH 2↑烯烃通式:C n H 2n(1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2(2)加成反应 与溴水加成:H 2C=CH 2+Br2 CH 2Br —CH 2Br 与氢气加成:H 2C=CH 2+H 2 CH 3CH3 与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应 乙烯加聚,生成聚乙烯:n H 2C=CH 23.乙炔 乙炔的制取:CaC 2+2H 2O HC ≡CH ↑(1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应 与溴水加成:HC ≡CH+Br 2 HC=CHBr点燃光光光光浓硫酸170℃高温催化剂 △CH 2-图1 乙烯的制取点燃图2 乙炔的制取BrCHBr=CHBr+Br 2 CHBr2—CHBr 2 与氢气加成:HC ≡CH+H 2H 2C=CH 2 与氯化氢加成:HC ≡CH+HCl CH 2=CHCl (3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2=CHCl nn4.苯苯的同系物通式:C n H 2n-6(1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
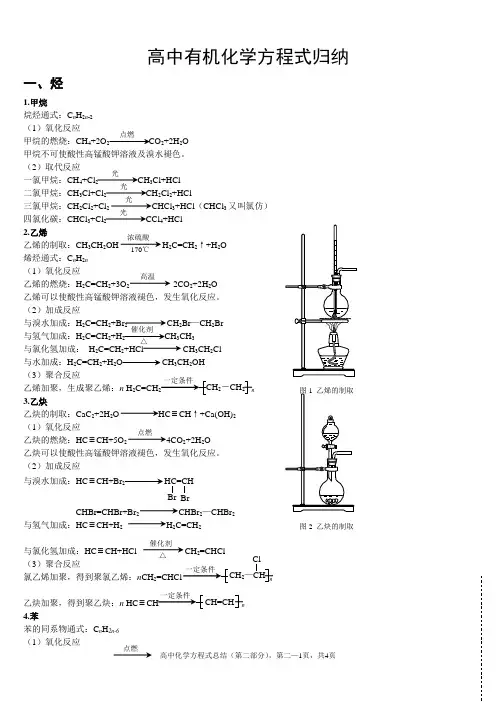
高中有机化学方程式归纳一、烃1.甲烷烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl 4+HCl2.乙烯乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O 烯烃通式:C n H 2n (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl 与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2C=CH n 3.乙炔乙炔的制取:CaC 2+2H 2O ≡CH ↑+Ca(OH)2 (1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br2HC=CHCHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2 n乙炔加聚,得到聚乙炔:n HC ≡ n4.苯苯的同系物通式:C n H 2n-6 (1)氧化反应点燃光光光光浓硫酸170℃ 高温催化剂 △2-CH 2点燃图2 乙炔的制取催化剂△Br 2—CHClCH=CH苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。

溴水和高锰酸钾溶液在有机化学中常用来作为检验一些有机物的试剂,反应以溶液中颜色变化来鉴定或鉴别某些有机物。
(1)能使溴水褪色或变色的物质及有关化学反应原理分别为:①烯烃、炔烃、二烯烃等不饱和烃类及其不饱和烃的衍生物反应,使溴水褪色CH2=CH2+Br2——→CH2Br-CH2BrCH≡CH+Br2——→CHBr=CHBr(或CH≡CH+2Br2——→CHBr2-CHBr2CH2=CH-CH=CH2+Br2——→CH2Br-CH=CH-CH2Br(或CH2=CH-CH=CH2+Br2——→CH2Br-CHBr-CH=CH2)②与苯酚反应生成白色沉淀图1③与醛类等有醛基的物质反应,使溴水褪色CH3CHO+Br2+H2O=CH3COOH+2HBr④因萃取作用使溴水褪色,有机溶剂溶解溴呈橙色(或棕红色)。
(1)密度大于1的溶剂(四氯化碳、氯仿、溴苯、二硫化碳等);(2)密度小于1的溶剂(液态的饱和烃、直馏汽油、苯及其同系物、液态环烷烃、液态饱和酯)。
⑤与碱性溶液(如NaOH溶液、Na2CO3溶液等)反应,使溴水褪色。
Br2+2NaOH=NaBr+NaBrO+H2O(或3Br2+6NaOH=5NaBr+NaBrO3+3H2O)Br2+Na2CO3=NaBr+NaBrO+CO2⑥与较强的无机还原剂(如H2S、SO2、KI和FeSO4等)发生反应,使溴水褪色。
Br2+H2S=2HBr+S↓(浅黄色沉淀)Br2+SO2+2H2O=2HBr+H2SO43Br2+6FeSO4=2Fe2(SO4)3+2FeBr3Br2+2KI=2KBr+I2(溶液变为棕色)⑦其它:石油产品(裂化气、裂解气、裂化石油等);天然橡胶等。
(2)能使高锰酸钾溶液褪色的物质及有关化学反应原理分别为:①与烯烃、炔烃、二烯烃等不饱和烃类及不饱和烃的衍生物反应,使高锰酸钾溶液褪色;与苯的同系物(甲苯、乙苯、二甲苯等)反应,使酸性高锰酸钾溶液褪色。
②与部分醇羟基、酚羟基(如苯酚)发生氧化还原反应,使高锰酸钾溶液褪色③与醛类等有醛基的有机物(如醛、甲酸、甲酸酯、甲酸盐、葡萄糖、麦芽糖等)发生氧化还原反应,使高锰酸钾溶液褪色④与具有还原性的无机还原剂(如H2S、SO2、FeSO4、KI、HCl等)反应,使高锰酸钾溶液褪色。

班别 小组 姓名高中有机化学方程式汇总甲烷及烷烃的反应(烷烃性质较稳定,主要是燃烧和取代反应)1. 甲烷的取代反应(一氯取代)4 + 23 + (取代反应)2. 甲烷的高温分解3. 甲烷的实验室制取4. 石油气的裂化5. 有机物的燃烧通式+ (42)O 2 2 + 2H 2O乙烯的化学性质(乙烯产量标志着一个国家石油工业的发展水平)6. 乙烯与溴水的反应 (加成反应)7. 乙烯与水的反应 (加成反应)8. 乙烯与溴化氢反应(加成反应) 9. 乙烯与氢气反应 (加成反应) 10. 乙烯的催化氧化(氧化反应)11. 烯烃的燃烧通式12. 乙烯的加聚反应(加聚反应)苯密度比水小,沸点为80.1℃,不能使酸性高锰酸钾褪色,能萃取溴使溴水褪色。
13. 苯与液溴的反应 (催化剂为铁粉)(取代反应)14. 苯与浓硝酸的反应 (硝化反应)(取代反应) 15. 苯与浓硫酸反应(磺化反应)(取代反应)16. 苯与氢气反应(加成反应)17. 苯的生成反应18. 甲苯与浓硝酸反应(取代反应)浓硫酸Δ光照19. 甲苯被酸性高锰酸钾氧化(高锰酸钾褪色)(氧化反应)卤代烃的化学性质(卤代烃连接着烃及烃的衍生物,是有机反应的纽带)20. 卤代烃生成醇(水解反应)21. 卤代烃生成烯烃(消去反应)醇类的化学性质(甲乙丙等低级醇均可与水混溶,不能充当溶液的萃取剂)22. 工业上制乙醇 (加成反应)乙醇和氢卤酸反应→23. 乙醇和钠反应 (取代反应) 24. 乙醇的催化氧化(氧化反应) 25. 乙醇的脱水反应(分子内) (消去反应)乙醇的脱水反应(分子间)(取代反应)26. 乙醇与酸的酯化反应(取代反应)醛的化学性质(甲醛是市内装修的主要污染物,其水溶液叫福尔马林)27. 乙醛与氢气的加成 (加成反应) 28. 乙醛的催化氧化 (氧化反应)29. 银镜反应(氧化) 30. 醛与新制氢氧化铜的反应(氧化)羧酸的化学性质(甲酸的分子结构决定了它既有酸的性质,又有醛的性质)31. 冰醋酸与金属钠反应 (置换/取代)32. 醋酸与纯碱反应 (复分解) 33. 醋酸与小苏打反应 (复分解)34. 醋酸与烧碱反应(中和)35. 醋酸与弱碱反应(中和)C 2H 5—Δ322O (取代反应)36. 醋酸与醇的酯化反应 (酯化/取代)37. 甲酸的银镜反应(氧化)酯的化学性质(有催化剂及加热情况下才会水解;碱存在时完全水解,反应不可逆;酸存在时,部分水解,反应可逆)38. 酯的碱性水解(取代反应)39. 酯的酸性水解(取代反应) 40. 酯键的缩聚 (缩聚反应) 41. 丁二烯烃的加聚反应(加聚反应)炔烃的化学性质(可加成、加聚,可使酸性高锰酸钾褪色)42. 实验室制乙炔43. 乙炔与溴水1:1加成(加成反应)乙炔与氢气足量加成((加成反应) 乙炔与水1:1加成(加成反应)44. 1,2-二溴乙烯与液溴的加成(加成反应)45. 氯乙烯的加聚反应(加聚反应)苯酚(易被氧气氧化成粉红色,有毒,沾到皮肤时,应立即用酒精清洗;常温下微溶于水,65℃以上时与水混溶;能使高锰酸钾褪色)46. 苯酚与强碱的反应(复分解反应)(可用于除去苯中混有的少量苯酚)47. 苯酚的电离(弱酸性)48. 苯酚钠与二氧化碳反应(复分解反应)(比较碳酸与石炭酸的酸性强弱)49. 苯酚与浓溴水的取代反应(取代反应)50. 苯酚与浓硝酸的硝化反应(取代反应)⇋2H 23351.酚类的显色反应(紫色,可用于检验酚类物质)52.苯酚与氢气的加成反应(加成反应)53.苯酚的缩聚反应基本营养物质的组成及性质54.葡萄糖的彻底氧化55.二糖蔗糖的水解(取代反应)(水解反应)二糖麦芽糖的水解56.多糖淀粉的水解(取代反应)(水解反应)多糖纤维素的水解57.植物油的硬化反应58.油脂的水解反应(皂化反应)59.乙二醇与乙二酸的聚合反应。

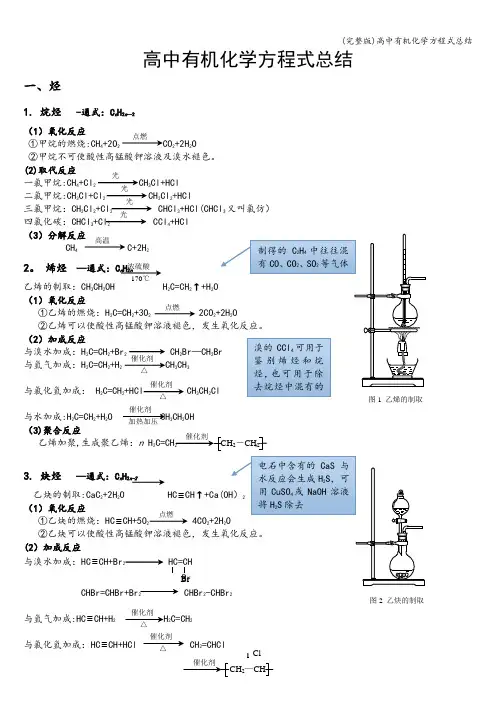
高中有机化学方程式总结一、烃1. 烷烃 -通式:C n H 2n —2(1)氧化反应①甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O ②甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl 二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl 三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl(CHCl 3又叫氯仿) 四氯化碳:CHCl 3+Cl 2 CCl 4+HCl (3)分解反应 CH 4 C+2H 2 2。
烯烃 —通式:C n H 2n乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O(1)氧化反应①乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2与水加成:H 2C=CH 2+H 2O CH 3CH 2OH (3)聚合反应乙烯加聚,生成聚乙烯:n H 2n3. 炔烃 —通式:C n H 2n-2乙炔的制取:CaC 2+2H 2O HC ≡(1)氧化反应 ①乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2(2)加成反应与溴水加成:HC ≡CH+Br 2 HC=CHBrCHBr=CHBr+Br 2 CHBr 2-CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl 点燃光光光光浓硫酸 170℃点燃催化剂 △催化剂加热加压 2-CH 2点燃图2 乙炔的制取催化剂 △催化剂Br 催化剂 △高温(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2=CHCl n乙炔加聚,得到聚乙炔:n HC CH n4. 苯 C 6H 6(1)氧化反应①苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O ②苯不能使溴水和酸性高锰酸钾溶液褪色。
高中有机化学方程式总结高中有机化学方程式总结烃是有机化合物中最简单的一类,包括烷烃、烯烃和炔烃。
烷烃的通式为XXX,其中n为烷基的碳数。
烷烃的氧化反应包括甲烷的燃烧和酸性高锰酸钾溶液及溴水褪色。
烷烃的取代反应包括一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳的生成。
烷烃的分解反应可以制得乙烯。
烯烃的通式为XXX,其中n为烯基的碳数。
乙烯可以通过浓硫酸催化乙醇脱水制得。
乙烯的氧化反应包括燃烧和酸性高锰酸钾溶液褪色。
乙烯的加成反应包括与溴水、氢气和水的加成。
乙烯可以聚合生成聚乙烯。
炔烃的通式为CnH2n-2,其中n为炔基的碳数。
乙炔可以通过电石与水反应制得。
乙炔的氧化反应包括燃烧和酸性高锰酸钾溶液褪色。
乙炔的加成反应包括与溴水、氢气和氯化氢的加成。
乙炔可以用CuSO4或NaOH溶液除去生成的H2S。
需要注意的是,烯烃和烷烃可以通过加成反应鉴别。
同时,乙烯和乙炔的制取方法也有所不同。
聚合反应是一种重要的化学反应,其中氯乙烯和乙炔分别加聚,分别得到聚氯乙烯和聚乙炔。
这些反应都需要催化剂来促进反应的进行。
另外,苯是一种重要的芳香烃,它可以发生氧化、取代和加成等反应。
其中,苯不能使溴水和酸性高锰酸钾溶液褪色。
甲苯是苯的同系物,也可以发生氧化、取代和加成等反应。
其中,甲苯不能使溴水褪色,但可以使酸性高锰酸钾溶液褪色。
烃的衍生物包括卤代烃、醇、酚等。
这些衍生物具有不同的分子结构特点和化学性质。
例如,卤代烃的C-X键有极性,易断裂,可以与NaOH溶液发生取代反应,生成醇。
醇具有C-O键和O-H键,有极性,可以与强碱的醇溶液共热,生成烯烃。
酚具有弱酸性,可以与NaOH溶液中和,还可以与浓溴水反应,生成三溴苯酚白色沉淀。
C=O双键具有极性和不饱和性。
由于C=O的影响,O—H键能够电离产生H+。
醛能够发生酯化反应与醇反应生成酯。
羧酸可以被弱氧化剂氧化成羧酸(如银镜反应和还原氢氧化铜)。
乙醇可以通过加成反应与氢加成生成,催化剂为Ni。
高中有机化学方程式总结及高锰酸钾褪色超全IMB standardization office【IMB 5AB- IMBK 08- IMB 2C】溴水和高锰酸钾溶液在有机化学中常用来作为检验一些有机物的试剂,反应以溶液中颜色变化来鉴定或鉴别某些有机物。
(1)能使溴水褪色或变色的物质及有关化学反应原理分别为:①烯烃、炔烃、二烯烃等不饱和烃类及其不饱和烃的衍生物反应,使溴水褪色CH2=CH2+Br2——→CH2Br-CH2BrCH≡CH+Br2——→CHBr=CHBr(或CH≡CH+2Br2——→CHBr2-CHBr2CH2=CH-CH=CH2+Br2——→CH2Br-CH=CH-CH2Br(或CH2=CH-CH=CH2+Br2——→CH2Br-CHBr-CH=CH2)②与苯酚反应生成白色沉淀图1③与醛类等有醛基的物质反应,使溴水褪色CH3CHO+Br2+H2O=CH3COOH+2HBr④因萃取作用使溴水褪色,有机溶剂溶解溴呈橙色(或棕红色)。
(1)密度大于1的溶剂(四氯化碳、氯仿、溴苯、二硫化碳等);(2)密度小于1的溶剂(液态的饱和烃、直馏汽油、苯及其同系物、液态环烷烃、液态饱和酯)。
⑤与碱性溶液(如NaOH溶液、Na2CO3溶液等)反应,使溴水褪色。
Br2+2NaOH=NaBr+NaBrO+H2O(或3Br2+6NaOH=5NaBr+NaBrO3+3H2O)Br2+Na2CO3=NaBr+NaBrO+CO2⑥与较强的无机还原剂(如H2S、SO2、KI和FeSO4等)发生反应,使溴水褪色。
Br2+H2S=2HBr+S↓(浅黄色沉淀)Br2+SO2+2H2O=2HBr+H2SO43Br2+6FeSO4=2Fe2(SO4)3+2FeBr3Br2+2KI=2KBr+I2(溶液变为棕色)⑦其它:石油产品(裂化气、裂解气、裂化石油等);天然橡胶等。
(2)能使高锰酸钾溶液褪色的物质及有关化学反应原理分别为:①与烯烃、炔烃、二烯烃等不饱和烃类及不饱和烃的衍生物反应,使高锰酸钾溶液褪色;与苯的同系物(甲苯、乙苯、二甲苯等)反应,使酸性高锰酸钾溶液褪色。
完美版)高中有机化学方程式总结高中有机化学方程式总结一、烃1.甲烷烷烃通式:CnH2n-21)氧化反应甲烷的燃烧:CH4 + 2O2 → CO2 + 2H2O甲烷不能使酸性高锰酸钾溶液及溴水褪色。
2)取代反应一氯甲烷:CH4 + Cl2 光→ CH3Cl + HCl二氯甲烷:CH3Cl + Cl2 光→ CH2Cl2 + HCl三氯甲烷:CH2Cl2 + Cl2 光→ CHCl3 + HCl(CHCl3又叫氯仿)四氯化碳:CHCl3 + Cl2 光→ CCl4 + HCl2.乙烯乙烯的制取:CH3CH2OH + 浓硫酸 170℃ → H2C=CH2 ↑+H2O烯烃通式:XXX1)氧化反应乙烯的燃烧:H2C=CH2 + 3O2 → 2CO2 + 2H2O乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
2)加成反应与溴水加成:H2C=CH2 + Br2 → CH2Br—CH2Br与氢气加成:H2C=CH2 + H2 催化剂→ CH3CH3与氯化氢加成:XXX + HCl △ → CH3CH2Cl与水加成:XXX + H2O → CH3CH2OH3)聚合反应乙烯加聚,生成聚乙烯:nHC=CH2 一定条件→ -(-CH2-CH2-)n-3.乙炔乙炔的制取:CaCO2 + 2H2O → HC CH↑+Ca(OH)21)氧化反应乙炔的燃烧:HC CH + 5O2 点燃→ 4CO2 + 2H2O乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
2)加成反应与溴水加成:HC CH + Br2 → HC=CHBrBr →CHBr=CHBr + Br2与氢气加成:H2C=CH2 + H2 催化剂→ CH3CH3与氯化氢加成:HC CH + HCl 催化剂→ CH2=CHCl3)聚合反应氯乙烯加聚,得到聚氯乙烯:nCH2=CHClCH2—CHn乙炔加聚,得到聚乙炔:nHC CH 一定条件→ -(-C≡C-)n-4.苯苯的同系物通式:CnH2n-61)氧化反应苯的燃烧:2C6H6 + 15O2 点燃→ 12CO2 + 6H2O甲苯不能使溴水褪色,但可以使酸性高锰酸钾溶液褪色。
浓硫酸△ 有机物化学反应方程式汇总有机物类别官能团 主要化学性质 烷烃——取代反应:CH 4+Cl 2CH 3Cl +HCl烯烃碳碳双键加成反应: CH 2=CH 2+HBr催化剂 △CH 3-CH 2Br ,(还可与Br 2、H 2O 、H 2在一定条件下发生加成反应)加聚反应:nCH 2=CH 2催化剂-[CH 2-CH 2氧化反应:使酸性KMnO 4溶液褪色(同时生成CO 2)炔烃碳碳三键同烯烃 芳香烃苯——取代反应: FeBr 3加成反应:苯的 同系物——取代反应:氧化反应:使酸性KMnO 4溶液褪色(与苯环相连的C 上有H 时统一被氧化为苯甲酸)卤代烃 —X取代反应:CH 3CH 2Br+NaOHH 2OCH 3CH 2OH+NaBr消去反应:CH 3CH 2Br+NaOH CH 2=CH 2↑+NaBr+H 2O 醇—OH与活泼金属反应:2CH 3CH 2OH+2Na 2CH 3CH 2ONa+H 2↑取代反应:CH 3CH 2OH+HBr△CH 3CH 2Br+H 2O 消去反应:CH 3CH 2OH浓硫酸 170℃CH 2=CH 2↑+H 2O氧化反应:2CH 3CH 2OH+O 2催化剂 △2CH 3CHO+2H 2O醛—CHO还原反应(加成反应):CH 3CHO+H 2催化剂 △CH 3CH 2OH氧化反应:2CH 3CHO+O 2催化剂 △2CH 3COOHCH 3CHO+2Ag(NH 3)2OH△CH 3COONH 4+2A g ↓+3NH 3+H 2OCH 3CHO+2C u (O H )2 +NaOH△CH 3COONa+Cu 2O ↓+3H 2O羧酸 —COOH 酸的通性:如CH 3COOH+NaHCO 3CH 3COONa+H 2O+CO 2↑酯化反应:CH 3COOH+ CH 3CH 2OH 浓H 2SO 4CH 3COOCH 2CH 3+H 2O 酯—COO —水解反应:CH 3COOCH 2CH 3+H 2OCH 3COOH+ CH 3CH 2OH酚弱酸性:取代反应: 光照+HNO 3—NO 2 +H 2O浓硫酸 △OHOH + NaOH ONa + H 2O OH+3Br 2OHBrBrBr+3HBr↓ 乙醇+HBr+Br 2 Br —CH 3 +3HNO 3 CH 3NO 2O 2N NO 2+3H 2O +3H 2Ni反应试剂有机物类别或官能团反应类型反应方程式举例X2氯气、液溴CH4+Cl2CH3Cl+HCl浓溴水苯酚取代反应溴水或溴的四氯化碳溶液“C=C”或“C≡C”加成反应H2C=CH2 + Br2 BrH2C-CH2BrHX “C=C”或“C≡C”加成反应H2C=CH2+HBr催化剂△H3C-CH2Br醇取代反应CH3CH2OH+HBr△CH3CH2Br+H2OH2O “C=C”或“C≡C”加成反应H2C=CH2+H2O催化剂△H3C-CH2OH酯水解反应CH3COOCH3+H2O催化剂△CH3COOH+CH3OHNa 醇、苯酚、—COOH置换反应2CH3CH2OH+ 2Na 2CH3CH2ONa+H2↑NaOH 苯酚、—COOH中和反应HCOOH+NaOH HCOONa+H2O酯水解反应CH3COOCH3+ NaOH CH3COONa+CH3OH卤代烃取代反应CH3CH2Br+NaOH△CH3CH2OH+NaBr消去反应CH3CH2Br+NaOH CH2= CH2↑+NaBr+H2ONa2CO3苯酚、—COOH复分解反应NaHCO3—COOH 复分解反应HCOOH+NaHCO3==HCOONa+CO2↑+H2OH2“C=C”或“C≡C”加成反应H2C=CH2+H2催化剂△H3C-CH3苯环加成反应羰基、醛基加成反应(还原反应)CH3CHO +H2催化剂△CH3CH2OH银氨溶液、新制Cu(OH)2醛、葡萄糖氧化反应略O2醛、醇氧化反应2CH3CHO+O2催化剂△2CH3COOH 大多数有机物氧化反应大多数有机物可燃烧生成CO2和H2O酸性KMnO4溶液醛、醇、酚、“C=C”、“C≡C”苯的同系物氧化反应略乙醇OH+3Br2OHBrBrBr+3HBr↓光照取代反应烷烃、苯环+3H2Ni。
高中化学方程式总结(第二部分),第二—1页,共2页
高中有机化学方程式总结
一、烃
1.甲烷
烷烃通式:
(1)氧化反应
甲烷 可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应 一氯甲烷:CH 4+Cl 2 二氯甲烷:CH 3Cl+Cl 2三氯甲烷:CH 2Cl 2+Cl
2 (CHCl 3又叫 ) 2.(1(2(3乙烯加聚,生成聚乙烯: 4.苯
苯的同系物通式:
(1)氧化反应
苯的燃烧: 苯 能使溴水和酸性高锰酸钾溶液褪色。
(2)取代反应
①苯与溴反应
②硝化反应
+HO —NO 2 +H 2O
(3)加成反应
二、烃的衍生物
烃的衍生物的重要类别和主要化学性质:
光 图1 乙烯的制取
图2 乙炔的制取 光
7.乙醇 (1)与钠反应
乙醇与钠反应: (乙醇钠)
(2)氧化反应
乙醇的催化氧化:2CH 3CH 2OH+O 2 (乙醛) (3)消去反应
乙醇在浓硫酸做催化剂的条件下,加热到 ℃生成 。
注意:该反应加热到 ℃时,乙醇进行另一种脱水方式,生成 。
2C 2H 5OH (乙醚)
6.乙酸
(1)乙酸的酸性
乙酸的电离:
(2)酯化反应
注意:酸和醇起作用,生成酯和水的反应叫做 反应。
7.乙酸乙酯
乙酸乙酯是一种带有香味的 。
(1)水解反应 CH 3COOC 2H 5+H 2O (2)中和反应 CH 3COOC 2H 5+NaOH 附加:烃的衍生物的转化
催化剂 △ 浓硫酸 140℃ 无机酸。
高中《有机化学基础》化学方程式一、烃1、烷烃(甲烷)烷烃通式:C n H2n+2(1)氧化反应①甲烷酸性高锰酸钾溶液及溴水褪色。
②甲烷的燃烧:光照(2)取代反应CH4+Cl22、烯烃(乙烯)烯烃通式:C n H2n(1)乙烯的制取:(2)氧化反应①乙烯酸性高锰酸钾溶液褪色,发生氧化反应。
②乙烯的燃烧(3)加成反应①乙烯与溴水加成:②乙烯与氢气加成:③乙烯与水加成:(4)加聚反应:①乙烯加聚反应:②1,3—丁二烯的加成:③1,3—丁二烯的加聚:3、炔烃(乙炔)炔烃的通式:C n H2n-2(1)乙炔的制取:(2)氧化反应①乙炔酸性高锰酸钾溶液褪色,发生氧化反应。
②乙炔的燃烧:(3)加成反应①与溴水加成:②与氢气加成:③与氯化氢加成:(4)聚合反应①氯乙烯加聚,得到聚氯乙烯:②乙炔加聚,得到聚乙炔:4、苯:苯的同系物通式:C n H2n-6(1)氧化反应①苯溴水和酸性高锰酸钾溶液褪色②苯的燃烧(2)取代反应①苯与溴反应②硝化反应(3)苯与氢气加成反应:5、甲苯甲苯溴水褪色。
(1)氧化反应:酸性高锰酸钾溶液褪色。
(2)取代反应:注意:甲苯在光照...条件下发生苯环上的取代......。
.....,而在催化剂..条件下发生侧链的取代(3)与氢气加成反应:二、烃的衍生物1、溴乙烷:纯净的溴乙烷是无色液体,沸点38.4℃,密度比水大。
(1)取代反应:溴乙烷的水解反应(2)消去反应:溴乙烷的消去反应2、乙醇(1)与钠反应:(2)催化氧化:(3)消去反应:(4)取代反应:①与浓HBr反应:②酯化反应:③分子间脱水生成乙醚:总结乙醇的氧化反应有哪些?3、苯酚:苯酚是无色晶体,露置在空气中会因氧化显粉红色。
苯酚具有特殊的气味,熔点43℃,水中溶解度不大,易溶于有机溶剂。
苯酚有毒,是一种重要的化工原料。
(1)苯酚的酸性:①苯酚(俗称石炭酸)的电离:②苯酚与NaOH的反应:③苯酚钠与CO2反应:④苯酚钠与盐酸反应:(2)取代反应:(与浓溴水反应)(3)显色反应:苯酚能和FeCl3溶液反应,使溶液。
溴水和高锰酸钾溶液在有机化学中常用来作为检验一些有机物的试剂,反应以溶液中颜色变化来鉴定或鉴别某些有机物。
(1)能使溴水褪色或变色的物质及有关化学反应原理分别为:①烯烃、炔烃、二烯烃等不饱和烃类及其不饱和烃的衍生物反应,使溴水褪色CH2=CH2+Br2——→CH2Br-CH2BrCH≡CH+Br2——→CHBr=CHBr(或CH≡CH+2Br2——→CHBr2-CHBr2CH2=CH-CH=CH2+Br2——→CH2Br-CH=CH-CH2Br(或CH2=CH-CH=CH2+Br2——→CH2Br-CHBr-CH=CH2)②与苯酚反应生成白色沉淀图1③与醛类等有醛基的物质反应,使溴水褪色CH3CHO+Br2+H2O=CH3COOH+2HBr④因萃取作用使溴水褪色,有机溶剂溶解溴呈橙色(或棕红色)。
(1)密度大于1的溶剂(四氯化碳、氯仿、溴苯、二硫化碳等);(2)密度小于1的溶剂(液态的饱和烃、直馏汽油、苯及其同系物、液态环烷烃、液态饱和酯)。
⑤与碱性溶液(如NaOH溶液、Na2CO3溶液等)反应,使溴水褪色。
Br2+2NaOH=NaBr+NaBrO+H2O(或3Br2+6NaOH=5NaBr+NaBrO3+3H2O)Br2+Na2CO3=NaBr+NaBrO+CO2⑥与较强的无机还原剂(如H2S、SO2、KI和FeSO4等)发生反应,使溴水褪色。
Br2+H2S=2HBr+S↓(浅黄色沉淀)Br2+SO2+2H2O=2HBr+H2SO43Br2+6FeSO4=2Fe2(SO4)3+2FeBr3Br2+2KI=2KBr+I2(溶液变为棕色)⑦其它:石油产品(裂化气、裂解气、裂化石油等);天然橡胶等。
(2)能使高锰酸钾溶液褪色的物质及有关化学反应原理分别为:①与烯烃、炔烃、二烯烃等不饱和烃类及不饱和烃的衍生物反应,使高锰酸钾溶液褪色;与苯的同系物(甲苯、乙苯、二甲苯等)反应,使酸性高锰酸钾溶液褪色。
②与部分醇羟基、酚羟基(如苯酚)发生氧化还原反应,使高锰酸钾溶液褪色③与醛类等有醛基的有机物(如醛、甲酸、甲酸酯、甲酸盐、葡萄糖、麦芽糖等)发生氧化还原反应,使高锰酸钾溶液褪色光照光照 光照 光照 高温 CaO △ 催化剂加热、加压催化剂 △ 催化剂 ④与具有还原性的无机还原剂(如H2S 、SO2、FeSO4、KI 、HCl 等)反应,使高锰酸钾溶液褪色。
⑤石油产品(裂化气、裂解气、裂化石油等);天然橡胶等。
(3)归纳“既使高锰酸钾溶液褪色,又使溴水褪色的物质”包括: 既能使酸性高锰酸钾溶液褪色,又能使溴水褪色的物质包括分子结构中有C=C 双键、C≡叁键、醛基(—CHO)的有机物;苯酚和无机还原剂。
苯的同系物只能使其中的酸性高锰酸钾溶液褪色;有机萃取剂只能使其中的溴水褪色。
有此可见:烃类有机物的鉴别最常用的试剂是酸性高锰酸钾溶液和溴水,烃的衍生物的鉴别往往避免使用酸性高锰酸钾溶液和溴水,一般是利用各官能团的特征反应。
1. CH 4 + Cl 2 CH 3Cl + HCl2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl3. CH 2Cl + Cl 2 CHCl 3 + HCl4. CHCl 3 + Cl 2 CCl 4+ HCl5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 38. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br 9. CH 2 = CH 22OH10. CH 2 = CH 23—CH 2Br 11. CH 2 = CH 2CH 312. nCH 2 = CH 2 ] n13. nCH 22-CH=CH-CH 2] n 14. 2CH 23CHO 15. CH ≡CH + Br 2 CHBr = CHBr 16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 2 17. CH ≡CH + HCl H 2C = CHCl 18. nCH 2 = CH [ CH 2-CH ] n Cl Cl 19. CH ≡CH + H 2O CH 3CHO催化剂△浓硫酸170℃浓硫酸140℃催化剂△20. CaC2 + 2H2O CH≡CH↑+ Ca(OH)2+ Br222. + HO2 +H2O23. + HO3H+H2O24.+ 3H2-NO22O26. 3CH≡C H27. CH3CH2Br + H228. CH3CH229. CH3CH22O30. 2CH3CH2OH+2Na 2CH3CH2ONa + H2↑31. 2CH3CH2OH+O2 2CH3CHO + 2H2O32. CH3CH2OH CH2 = CH2↑+ H2O33.C2H5OH+C2H5OH C2H5OC2H5+H2O34. 2O35. 2O -+H3O+233738. CH339. 2CH340. CH34+2Ag↓+3NH3+H2O催化剂 催化剂催化剂催化剂 催化剂 △催化剂加热、加压41CH 3CHO+2Cu(OH)2 CH 3COOH+Cu 2O ↓+2H 2O 42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑ 43.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑44. CH 3COOH+NaHCO 3 CH 3COONa+H 2O+CO 2↑45. CH 3COOH + NaOH CH 3COONa + H 2O46. 2CH 3COOH + Cu(OH)2 (CH 3COO)2Cu + 2H 2O 47.CH 3COOH+CH 3CH 23COOCH 2CH 3 +H 2O48. CH 3COOCH 2CH 33COONa+CH 3CH 2OH 49. nOHCH 2CH 2COO H → [ OCH 2CH 2C ] n +H 2O 50. C 6H 12O 6 (s) + 6O 2 (g) 6CO 2 (g) + 6H 2O (l) 51. C 6H 12O 6 2CH 3CH 2OH + 2CO 2 52. C 12H 22O 11+H 2O C 6H 12O 6+ C 6H 12O 6 蔗糖 葡萄糖 果糖53. C 12H 22O 11 + H 2O 2C 6H 12O 6麦芽唐 葡萄糖54. (C 6H 10O 5)n + nH 2O n C 6H 12O 6 淀粉 葡萄糖 55. (C 6H 10O 5)n + nH 2O n C 6H 12O 6纤维素 葡萄糖56.C 17H 33COO-CH 2 C 17H 35COO-CH 2C 17H 33COO-CH +3H 2 C 17H 35COO-CHC 17H 33COO-CH 2 C 17H 35COO-CH 2 57. C 17H 35COO-CH 2 CH 2-OH COO-CH +3NaOH COONa+ CH-OH(4)、乙酸乙酯的水解(70-80℃)(5)、中和热的测定(6)制硝基苯(50-60℃)〔说明〕:(1)凡需要准确控制温度者均需用温度计。
(2)注意温度计水银球的位置。
3.能与Na反应的有机物有:醇、酚、羧酸等——凡含羟基的化合物。
4.能发生银镜反应的物质有:醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖——凡含醛基的物质。
5.能使高锰酸钾酸性溶液褪色的物质有:(1)含有碳碳双键、碳碳叁键的烃和烃的衍生物、苯的同系物(2)含有羟基的化合物如醇和酚类物质(3)含有醛基的化合物(4)具有还原性的无机物(如SO2、FeSO4、KI、HCl、H2O2等)6.能使溴水褪色的物质有:(1)含有碳碳双键和碳碳叁键的烃和烃的衍生物(加成)(2)苯酚等酚类物质(取代)(3)含醛基物质(氧化)(4)碱性物质(如NaOH、Na2CO3)(氧化还原――歧化反应)(5)较强的无机还原剂(如SO2、KI、FeSO4等)(氧化)(6)有机溶剂(如苯和苯的同系物、四氯甲烷、汽油、已烷等,属于萃取,使水层褪色而有机层呈橙红色。
)7.密度比水大的液体有机物有:溴乙烷、溴苯、硝基苯、四氯化碳等。
8、密度比水小的液体有机物有:烃、大多数酯、一氯烷烃。
9.能发生水解反应的物质有卤代烃、酯(油脂)、二糖、多糖、蛋白质(肽)、盐。
10.不溶于水的有机物有:烃、卤代烃、酯、淀粉、纤维素11.常温下为气体的有机物有:分子中含有碳原子数小于或等于4的烃(新戊烷例外)、一氯甲烷、甲醛。
12.浓硫酸、加热条件下发生的反应有:苯及苯的同系物的硝化、磺化、醇的脱水反应、酯化反应、纤维素的水解13.能被氧化的物质有:含有碳碳双键或碳碳叁键的不饱和化合物(KMnO4)、苯的同系物、醇、醛、酚。
大多数有机物都可以燃烧,燃烧都是被氧气氧化。
14.显酸性的有机物有:含有酚羟基和羧基的化合物。
15.能使蛋白质变性的物质有:强酸、强碱、重金属盐、甲醛、苯酚、强氧化剂、浓的酒精、双氧水、碘酒、三氯乙酸等。
16.既能与酸又能与碱反应的有机物:具有酸、碱双官能团的有机物(氨基酸、蛋白质等)17.能与NaOH溶液发生反应的有机物:(1)酚:(2)羧酸:(3)卤代烃(水溶液:水解;醇溶液:消去)(4)酯:(水解,不加热反应慢,加热反应快)(5)蛋白质(水解)18、有明显颜色变化的有机反应:1.苯酚与三氯化铁溶液反应呈紫色;2.KMnO4酸性溶液的褪色;3.溴水的褪色;4.淀粉遇碘单质变蓝色。
5.蛋白质遇浓硝酸呈黄色颜色反应《有机化学基础》方程式归纳请大家注意方程式的反应条件、一些结构简式的书写形式、和气体、沉淀等符号!取代反应1.CH4 + Cl2CH3Cl + HCl2.3.4.5.6.7.8.9.10.11.12.13.14.15.16.17.18.19.20.加成反应21.+Br222.+ H223.24.25.26.27.28.29.30.31.32.消去反应33.34.35.36.氧化反应37.38.39.40.41.42.43.还原反应44.45.46.47.加聚反应48.49.50.51.52.53.缩聚反应54.55.56.57.。