九年级化学上册探秘水世界元素时元素周期表简介新版鲁教版
- 格式:pptx
- 大小:8.27 MB
- 文档页数:21

第二单元探秘水世界单元备课(上)第一节运动的水分子第二节水分子的变化第三节原子的构成第四节元素到实验室去:化学实验基本技能训练(二)单元备课(下)第二单元探秘水世界单元备课(上)3.重视新旧知识的联系。
⑴从宏观上认识水的组成及特征;⑵从微观上认识水电解的实质。
第一节运动的水分子难点分子基本性质的应用(第一课时)水是由水分子构成的,一滴水大约有十六万亿亿个水分子。
固液气1.一定量的水,当它由固态变为液态,再由液态变为气态时,水分子的数目和大小不会变化,只是分子之间的距离和分子的排列方式发生变化。
2.水分子的运动导致了水的状态的变化,水分子获得能量时,运动加快,分子的间隔增大,由液态变成气态;失去能量时,运动减慢,分子间隔减小,水由气态变为液态。
P30活动天地冰融化成水时,分子间隔较小。
⑴分子很小,⑵相互间存在间隔,⑶总在不停地运动。
另外:⑷同种分子性质相同;不同种分子性质不同。
过滤后的液体虽然澄清,但有第二节水分子的变化难点化的本质。
(保持物质化学性质的最小微粒)变化的叙述止的属性。
变化由性质决定,性质在变化中第三节原子的构成教学媒体多媒体素材、挂图、元素周期表电子质量的1836倍。
带负电荷的离子叫阴离子,如:F,难点相对原子质量的意义★教学目标1、了解元素的概念,初步学会用元素描述物质的宏观组成,用微粒描述物质的微观构成。
2、通过对纯净物和元素的分类,进一步体会分类的思想,学习分类的方法。
3、学会正确书写元素符号,记住一些常见的元素符号。
★教学内容分析本节教材从学生在前几章教材中所见到的分子模型入手,把原子归类,建立元素的概念,并在次基础上学习单质和化合物的概念,顺势给出了表示元素的一些符号,这样把宏观物质、微观构成和抽象符号很自然地结合在一起,易于学习和掌握。
★教学对象分析人类使用符号的历史源远流长,图形、标记、语言文字、数字、公式等这些符号的使用是学生在潜移默化中学会的,学生以前可能不曾体会绘画、做标记、书写各种文字都是在使用符号实现对事物的记载和与他人的交流,没有体会使用符号给人类带来的便捷。

鲁教版九上化学第二单元探秘水世界第一节运动的水分子一、微粒观点1、物质都是由肉眼看不见的、极其微小的微粒构成的2、构成物质的微粒在不断的运动3、微粒之间有空隙【知识解读】1、构成物质的基本微粒是指分子、原子、离子,它们的体积质量都很小,肉眼看不见。
灰尘满天,就不能说微粒在不断运动,原因是灰尘肉眼看得见,是固体小颗粒,不是微粒。
2、分子间的间隔与温度与压强有关:温度越高分子间的间隔越大:如热胀冷缩;压强越大分子间的间隔越小,如:空气加压压缩,体积减小。
3、水的三态变化就是由于水分子的运动导致了水的状态变化。
水分子获得能量是,运动加快,分子间的间隔增大,水由液态变成了气态(或由固态变为了液态);失去能量时,运动减慢,分子间的间隔减小,水由气态又变回了液态(或由液态变为固态)二、纯净物和混合物纯净物:由单一物质组成的物质混合物:由由两种或两种以上的物质组成的物质【知识解读】1、从微观角度把握概念:纯净物里只有一种分子,混合物是由两种或两种以上的分子构成的2、混合物与纯净物的判断:①自然界中的物质、食品饮料、溶液、合金都是混合物;纯净物一般都是按化学名称命名,即根据名称可知道其组成。
②纯净的空气是混合物,冰水混合物是纯净物。
③自然界中的水是混合物,只有说“水”“纯净水”“蒸馏水”时才是纯净物。
三、水的净化方法(重点、难点)水的净化方法有:沉降(除去水中颗粒较大的不溶性杂质)、吸附(除去悬浮在水中颗粒较小的杂质)、过滤(除去水中不溶性固体杂质)、蒸馏(除去水中可溶性杂质,净化程度最高---得到的是蒸馏水)、消毒杀菌。
【知识解读】1、沉降包括静置沉降和吸附沉降。
净水过程中先静置自然沉降后,再加明矾进行化学沉降。
2、明矾:吸附水中的悬浮的杂质而沉降;活性炭:吸附水中细小的杂质。
氯气、漂白粉:消毒杀菌3、吸附、沉降、过滤只能除去不溶性固体杂质,使浑浊的水变清澈,但是不能除去溶于水的杂质;要除去水中可溶性杂质,要用蒸馏法。


第一节运动的水分子一、水的三态变化问题与猜想:湿衣服能晾干是因为其中的液态水变成水蒸气到了空气中,请你猜想并想象,湿衣服上的水分子是怎样到了空气中?封闭在针筒内的少量水煮沸变成水蒸气,体积变大,猜想在这一过程中是什么原因导致水蒸气的体积变大?1、水的三态变化把在封闭的针管中少量的水煮沸,液态的水煮沸会变成水蒸气,体积明显变大,这是为什么呢?固态水分子:紧密有序排列、不能自由移动(不是不运动)液态水分子:间隔小、一定程度上自由运动气态水分子:间隔较大、完全自由运动2、三态变化伴随能量变化水分子的大小、数目不变;水分子的排列方式、间隔改变。
2、分子:构成物质的一种基本粒子,都是由原子构成的。
3、分子的性质①分子很小②分子在不停地运动③分子间有一定的间隔④同种物质的分子性质相同,不同种物质的分子性质不同二、水的天然循环1、我们的水资源2、三、天然水的人工净化水的净化方法有:沉降(除去水中颗粒较大的不溶性杂质)、吸附(除去悬浮在水中颗粒较小的杂质)、过滤(除去水中不溶性固体杂质)、蒸馏(除去水中可溶性杂质,净化程度最高---得到的是蒸馏水)、消毒杀菌。
1、沉降:大颗粒的难溶性杂质在重力的作用下下沉,沉到底部。
2、过滤:(1)过滤器的制作(2)过滤装置及注意事项(3)实验分析:过滤后的滤液仍然浑浊,可能的原因有哪些?液面高于滤纸边缘;滤纸破了;盛接滤液的烧杯不干净等。
3、吸附:活性炭吸附剂,可以吸附一些有颜色、有气味的杂质。
4、蒸馏:5、自来水厂净水6、硬水:含有较多可溶性钙,镁矿物质的天然水软水:不含或含较少钙,镁矿物质的水区分:在等量的硬水和软水中,分别滴加等量的相同肥皂出现较多泡沫的是软水,出现泡沫较少或没有泡沫转化:设法消除或减少硬水中的钙,镁矿物质,在生活中在实验室常用蒸馏法,工业上用离子交换法或药剂软化法。
危害:用硬水洗涤衣服,既浪费肥皂又洗不净衣服;锅炉长期用硬水,易形成水垢,不仅浪费燃料,严重的还可以引起锅炉爆炸(水垢可有稀盐酸除去:CaCO3+2HCl=CaCl2+H2O+CO2↑)。
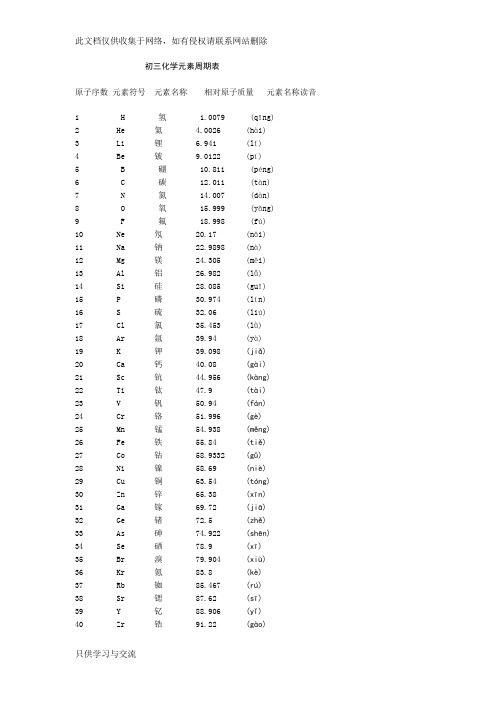
初三化学元素周期表原子序数元素符号元素名称相对原子质量元素名称读音1 H 氢 1.0079 (qīng)2 He 氦 4.0026 (hài)3 Li 锂 6.941 (lǐ)4 Be 铍 9.0122 (pí)5 B 硼 10.811 (péng)6 C 碳 12.011 (tàn)7 N 氮 14.007 (dàn)8 O 氧 15.999 (yǎng)9 F 氟 18.998 (fú)10 Ne 氖 20.17 (nǎi)11 Na 钠 22.9898 (nà)12 Mg 镁 24.305 (měi)13 Al 铝 26.982 (lǚ)14 Si 硅 28.085 (guī)15 P 磷 30.974 (lín)16 S 硫 32.06 (liú)17 Cl 氯 35.453 (lǜ)18 Ar 氩 39.94 (yà)19 K 钾 39.098 (jiǎ)20 Ca 钙 40.08 (gài)21 Sc 钪 44.956 (kàng)22 Ti 钛 47.9 (tài)23 V 钒 50.94 (fán)24 Cr 铬 51.996 (gè)25 Mn 锰 54.938 (měng)26 Fe 铁 55.84 (tiě)27 Co 钴 58.9332 (gǔ)28 Ni 镍 58.69 (niè)29 Cu 铜 63.54 (tóng)30 Zn 锌 65.38 (xīn)31 Ga 镓 69.72 (jiā)32 Ge 锗 72.5 (zhě)33 As 砷 74.922 (shēn)34 Se 硒 78.9 (xī)35 Br 溴 79.904 (xiù)36 Kr 氪 83.8 (kè)37 Rb 铷 85.467 (rú)38 Sr 锶 87.62 (sī)39 Y 钇 88.906 (yǐ)40 Zr 锆 91.22 (gào)42 Mo 钼 95.94 (mù)43 Tc 锝 (99) (dé)44 Ru 钌 161.0 (liǎo)45 Rh 铑 102.906 (lǎo)46 Pd 钯 106.42 (bǎ)47 Ag 银 107.868 (yín)48 Cd 镉 112.41 (gé)49 In 铟 114.82 (yīn)50 Sn 锡 118.6 (xī)51 Sb 锑 121.7 (tī)52 Te 碲 127.6 (dì)53 I 碘 126.905 (diǎn)54 Xe 氙 131.3 (xiān)55 Cs 铯 132.905 (sè)56 Ba 钡 137.33 (bèi) 57-71 La-Lu 镧系57 La 镧 138.9 (lán)58 Ce 铈 140.1 (shì)59 Pr 镨 140.9 (pǔ)60 Nd 钕 144.2 (nǚ)61 Pm 钷 (147) (pǒ)62 Sm 钐 150.3 (shān)63 Eu 铕 151.96 (yǒu)64 Gd 钆 157.25 (gá)65 Tb 铽 158.9 (tè)66 Dy 镝 162.5 (dī)67 Ho 钬 164.9 (huǒ)68 Er 铒 167.2 (ěr)69 Tm 铥 168.9 (diū)70 Yb 镱 173.04 (yì)71 Lu 镥 174.967 (lǔ)72 Hf 铪 178.4 (hā)73 Ta 钽 180.947 (tǎn)74 W 钨 183.8 (wū)75 Re 铼 186.207 (lái)76 Os 锇 190.2 (é)77 Ir 铱 192.2 (yī)78 Pt 铂 195.08 (bó)79 Au 金 196.967 (jīn)80 Hg 汞 200.5 (gǒng)81 Tl 铊 204.3 (tā)82 Pb 铅 207.2 (qiān)83 Bi 铋 208.98 (bì)85 At 砹 (201) (ài)86 Rn 氡 (222) (dōng)87 Fr 钫 (223) (fāng)88 Ra 镭 226.03 (léi)89-103 Ac-Lr 锕系89 Ac 锕 (227) (ā)90 Th 钍 232.0 (tǔ)91 Pa 镤 231.0 (pú)92 U 铀 238.0 (yóu)93 Np 镎 (237) (ná)94 Pu 钚 (244) (bù)95 Am 镅 (243) (méi)96 Cm 锔 (247) (jú)97 Bk 锫 (247) (péi)98 Cf 锎 (251) (kāi)99 Es 锿 (252) (āi)100 Fm 镄 (257) (fèi)101 Md 钔 (258) (mén)102 No 锘 (259) (nuò)103 Lr 铹 (262) (láo)104 Rf 钅卢 (257) (lú)105 Db 钅杜 (261) (dù)106 Sg 钅喜 (262) (xǐ)107 Bh 钅波 (263) (bō)108 Hs 钅黑 (262) (hēi)109 Mt 钅麦 (265) (mài)110 Uun (281)111 Uuu (272)112 Uub (285)114 Uuq (289)(加括号的数据为该放射性元素半衰期最长同位素的质量数。

初三化学元素周期表(完整版)初三化学元素周期表顺口溜:氢(qīng) 氦(hài)锂(lǐ) 铍(pí) 硼(péng) 碳(tàn) 氮(dàn) 氧(yǎng) 氟(fú) 氖(nǎi)n) 硫(liú)氯(lǜ) 氩(yà)钠(nà) 镁(měi) 铝(lǚ) 硅(guī) 磷(lí钾(jiǎ) 钙(gài) 钪(kàng) 钛(tài) 钒(fán) 铬(gè) 锰(měng) 铁(tiě) 钴(gǔ) 镍(niè) 铜(tóng) 锌(xīn) 镓(jiā) 锗(zhě) 砷(shēn) 硒(xī) 溴(xiù)氪(kè)铷(rú) 锶(sī) 钇(yǐ) 锆(gào) 铌(ní) 钼(mù) 锝(dé) 钌(liǎo) 铑(lǎo) 钯(pá) 银(yín) 镉(gé) 铟(yīn) 锡(xī) 锑(tī) 碲(dì) 碘(diǎn) 氙(xiān)铯(sè) 钡(bèi) 镧(lán) 铪(hā) 钽(tǎn) 钨(wū) 铼(lái) 锇(é) 铱(yī) 铂(bó) 金(jīn) 汞(gǒng) 铊(tā) 铅(qiān) 铋(bì) 钋(pō) 砹(ài) 氡(dōng)钫(fāng) 镭(léi) 锕(ā) 钅卢(lú) 钅杜(dù) 钅喜(xǐ) 钅波(bō) 钅黑(hēi) 钅麦(mài) 钅达(dá) 钅仑(lún)镧(lán) 铈(shì) 镨(pǔ) 钕(nǚ) 钷(pǒ) 钐(shān) 铕(yǒu) 钆(gá) 铽(tè) 镝(dí) 钬(huǒ) 铒(ěr) 铥(diū) 镱(yì)镥(lǔ)锕(ā) 钍(tǔ) 镤(pú) 铀(yóu) 镎(ná) 钚(bù) 镅(méi) 锔(jū) 锫(péi) 锎(kāi) 锿(āi) 镄(fèi) 钔(mén) 锘(nuò) 铹(láo)附化学元素周期表口诀青害李皮朋,探丹阳付奶。
课型:新授课题:第二单元探秘水世界第四节元素第一课时课标要求:1、让学生认识元素的存在,形成元素的概念,会正确区分元素和原子,知道元素的简单分类。
2、学生学会元素符号的正确写法,了解元素符号所表示的意义,逐步记住一些常见元素的名称和符号内容和学情分析:学生以前可能不曾体会绘画、做标记、书写各种文字都是在使用符号实现对事物的记载和与他人的交流,没有体会使用符号给人类带来的便捷。
当他们知道构成大千世界形形色色的物质的元素不外乎一百多种,每一种元素都有一种特定的便于书写和交流的符号,学会了这些符号和运用这些符号表示多样化的物质的规则,就可以与全世界的人方便地进行学术交流!他们可能会对学习充满兴趣。
学习建议:学习过程中多结合实例、多做练习,在反复练习中加深理解和巩固,使所学的概念得到比较清晰的对比、区分和归类及规范地书写元素符号。
为了提高学习兴趣,减轻对枯燥无味的元素符号的记忆负担,学习过程中组织一些有趣味的活动,如元素符号游戏记忆等。
学习目标:1.知识与技能(1)能对常见的物质进行简单分类,并能从组成上区分单质和化合物。
(2)记住一些常见元素的名称和符号。
(3)能读懂某些商品标签上标示的物质成分为元素。
2.过程与方法通过交流和讨论,使学生能清楚的表达自己的观点,形成良好的学习习惯和学习方法。
3.情感态度与价值观通过对纯净物和元素的分类,进一步体会分类的思想,学习分类的方法。
知识点(重点、难点):(重点) 1.元素的概念。
2.元素符号的书写和意义。
(难点) 1.元素概念的形成。
2.单质及化合物的理解教学准备:分子模型、卡片、元素周期表知识结构:教师活动学生活动活动意图课前教师布置研究性课题:1、利用橡皮泥、泡沫塑料、塑料小球、牙签、铁丝、双面胶等材料在学习小组内动手制作水、氧气、一氧化碳、二氧化碳、二氧化氮等物质的分子模型。
2、搜集各种食品的包装盒(袋)。
学生亲自动手制作模型、搜集材料。
在学生已有的知识的基础上,利用学生感兴趣的问题将学生的思维引向深入,在制作模型的过程中充分感受到原子是有类别之分的,不同的原子大小是不同的,分子具有独特的立体结构等许多微观知识。