A.高沸点 B. 酸性 C.吸水性 D.脱水性 E.强氧化性
① 浓硫酸常温使纸片变黑: ② 浓硫酸与铜共热产生气体:
D
;
BE ; ③ 浓硫酸使蔗糖变成“黑面包”: CDE ; E ④ 浓硫酸常温下使铁铝钝化: ;
⑤ 浓硫酸使胆矾变成白色粉末:
C
;
⑥ 浓硫酸与NaCl固体制HCl气体: AB 。
思考3. 向50mL 18mol∙L-1的H2SO4溶液中加入足量的铜 片并加热, 充分反应后, 被还原的H2SO4的物质的量。
与碱反应 与盐反应
BaCl2+H2SO4 = BaSO4↓ +2HCl
稀释浓硫酸时应该如何操作? 正确操作: 将浓硫酸沿烧杯内壁慢慢注 入水中, 并用玻璃棒及时搅拌。
“酸入水, 沿杯壁, 慢慢注, 及时搅”
(二) 化学性质
实验1.① 2支试管各加入2 mL浓硫酸, 其一敞开久 置, 另一密封保存, 观察; ② 向试管中加入少量的胆矾, 再加入2 mL浓 硫酸, 观察.
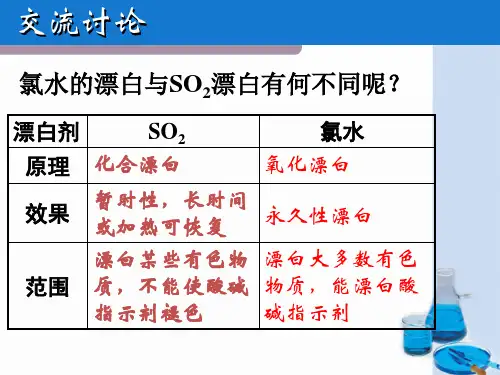
SO2可以用来杀菌、抗氧化、防腐 资料卡:
基本观念——辩证的哲学观
早在1487年,普鲁士皇室颁布法令同意在葡萄酒酿制中使用二氧化硫 (SO2)。今天,在葡萄酒的酿制中加入SO2,是再平常不过的事情。 简单地 来说,如果没有SO2,所有的葡萄酒都将会在短短的几个月之内坏掉。 SO2在葡萄酒中的主要作用有: 杀菌 用作抑菌剂,防止和缓慢无益微生物的繁殖; 澄清 净化发酵基质,提高葡萄酒酒度; 抗氧化 抑制氧化酶的作用,防止褐变现象,香气损失,苦味和青草味的 产生; 溶解 可溶解葡萄细胞加速酚类物质和颜色的提取,增加色度; 增酸 提高有机酸含量;降低挥发酸含量; 改善口味 改善葡萄酒的味感质量——缓和霉味、泥土味、醋味和氧 化味等,保持果香味。