金属钠的性质及应用
- 格式:ppt
- 大小:1.45 MB
- 文档页数:18

金属钠引言:金属钠是一种在常温常压下具有金属特性的化学元素,化学符号为Na,是元素周期表中的一个碱金属元素。
金属钠具有许多独特的性质和广泛的应用领域。
本文将介绍金属钠的物理性质、化学性质、制备方法以及其在工业和生活中的应用。
一、物理性质金属钠是一种银白色的金属,在常温下具有柔软的质地。
它具有较低的密度(0.97 g/cm³)和较低的熔点(97.72°C),因此在室温下是液体。
金属钠的熔融点低于许多其他金属,这使得它成为一种重要的熔剂和合金添加剂。
此外,金属钠具有良好的导电性和导热性,使得它在电子工业和热传导方面有广泛的应用。
二、化学性质金属钠是一种高活性的金属,与水和空气中的氧气反应剧烈。
当金属钠与水反应时,会产生氢气并放出大量的热能。
这种反应在实验室中经常用来展示金属活性和化学反应的特性。
此外,金属钠也会与酸类发生反应,产生相应的盐和氢气。
金属钠的高活性使其在化学实验和工业中具有广泛的应用。
三、制备方法金属钠主要通过电解氯化钠溶液来制备。
首先,将氯化钠溶解在水中形成钠离子和氯离子。
然后,在电解池中加入两个电极,通常使用铁或钢作为阴极,而使用碳作为阳极。
当通电时,钠离子会在阴极上还原成金属钠,而氯离子则会在阳极上氧化成氯气。
这种方法是目前最主要也最常用的金属钠制备方法。
四、应用领域金属钠在工业和生活中有广泛的应用。
首先,在冶金工业中,金属钠被用作还原剂,能够与许多金属氧化物发生反应,使金属从氧化物中获得自由态。
其次,在有机合成中,金属钠常用于制备有机化合物,例如脂肪酸盐、酯类等。
此外,金属钠还在高能物理实验中被应用于制备高能量和高密度的物质。
在生活中,金属钠的化合物广泛用于食盐和食品添加剂,以及各类碱性物质和清洁剂中。
结论:金属钠是一种具有独特物理性质和化学性质的金属元素。
它在工业和生活中有广泛的应用,如在冶金工业中作为还原剂,在有机合成中用于合成化合物,在食品和清洁剂中用作添加剂等。



金属钠的化学性质
金属钠是一种无色、比重为0.971的闪烁金属,常温下为固体,以温度较高的圆柱形的形态存在。
它的化学计量式为Na,原子量为22.990,属碱金属,熔点和沸点为97.8℃和883℃, 广泛存在于地壳和海水中。
金属钠有着特殊的性质:它易溶于水,且在水溶液中分解出氢气,产生热,尤其在外加一点醋酸的条件下,能产生更多的氢气,从而加速它的溶解速度。
另外,金属钠还有一种极其强烈的化学性,它能够溶解其他许多碱金属,比如另一种无色的碱金属钾,当这两种金属在水溶液中混合后反应产生的热量可达到408.3卡/克热量。
此外,金属钠也可以与一些氧化物发生化学反应,比如氯氧化钠和氯氧化钾,其反应产生电解质,如氢氧化钠和氢氧化钾,这种反应十分复杂,其反应热量可达到-4375.77卡/克。
金属钠的用途也很广泛,比如它可以用来制造火药、颜料、杀虫剂以及食物添加剂。
此外,也可以用在水处理、电器制造、有机合成工业等领域。
最重要的是,它也是制作洗衣粉、油炸食品、洗涤用品等必不可少的原料,这些产品的千家万户都离不开金属钠。
综上所述,金属钠是一种十分重要又实用的元素,它具有特殊的性质,广泛应用于各行各业,可以说,没有金属钠,现代社会技术的发展将大打折扣。

第1讲金属钠的性质及应用知识点总结1、钠的物理性质。
问题:从那些方面来描述物质的物理性质?2、钠的化学性质钠原子最外层只有一个电子,在化学反应中钠原子容易失去最外层的一个电子,具有很强的还原性,是一种活泼的金属元素。
问题:金属活动顺序表的知识有哪些?(1)物理性质银白色固体、质软、密度比水小、熔点较低化学性质与O2反应常温:4Na+O2=2Na2O(白色)加热:2Na+O2Na2O2(淡黄色)与Cl2反应2Na+Cl22NaCl(白烟)与H2O(滴有酚酞)反应2Na+2H2O =2NaOH +H2↑(浮起、熔、游、响、红)与稀H2SO4反应2Na+H2SO4=Na2SO4+H2↑与CuSO4溶液反应总反应:2Na+2H2O+CuSO4=Na2SO4 +Cu(OH)2↓+H2↑(1)2Na+2H2O=NaOH+H2↑(2)CuSO4+2NaOH=Na2SO4+Cu(OH)2用途冶炼钛:4Na+TiCl4(熔融)=Ti+4NaCl制Na2O2、制钾钠合金(常温为液态)、高压钠灯存在只以化合态(如NaCl、NaSO4、NaNO3等)存在保存保存在煤油中或密封在石蜡中(大量时)问题:Na在水中反应和Na在盐酸中反应,哪个反应更加剧烈?他们反应的实质分别是什么?问题:Na与NH4Cl溶液的化学反应方程式,描述反应现象?【例1】钾(K)与Na在性质上具有很大的相似性...,但K比Na的活泼性强.,下面是根据Na的性质对K的性质的预测,其中正确的是()A.K可以保存在水中B.K可以与水剧烈反应,生成氧气C.K在空气可以被空气中的氧气所氧化 D.K 与水能够反应,但不如Na与水的反应剧烈,但产物都有氢气【例2】某实验小组对中学课本中可生成氢气的反应进行了研究,总结出四个可以生成H2的反应:①Zn+盐酸②Na+水③Al+NaOH溶液④Na+无水乙醇为点燃上述四个反应生成的H2,他们设计了如下装置图,请回答下列问题:(1)写出Na与H2O反应的化学方程式;(2)在点燃H2之前必须先进行,方法是;(3)实验小组在点燃用上述装置制得的H2时,①③④实验获得成功,②却失败了。

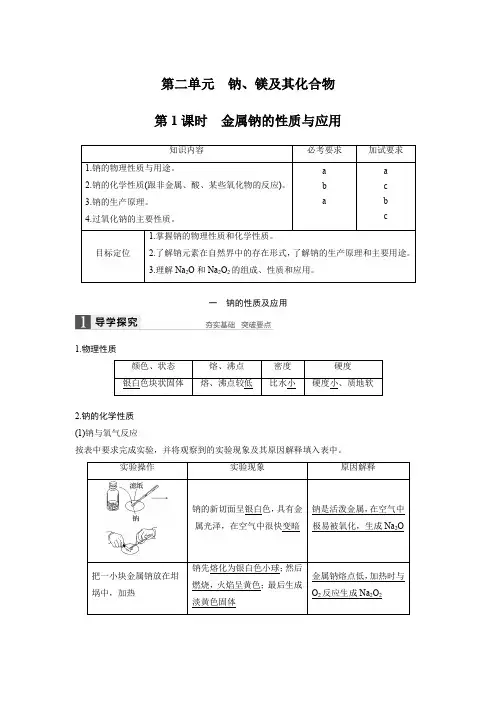
第二单元 钠、镁及其化合物 第1课时 金属钠的性质与应用一 钠的性质及应用1.物理性质2.钠的化学性质 (1)钠与氧气反应按表中要求完成实验,并将观察到的实验现象及其原因解释填入表中。
①钠在常温下与氧气反应的化学方程式是4Na +O 2==2Na 2O ,在加热点燃时反应的化学方程式是2Na +O 2=====点燃Na 2O 2。
由此你能得出的结论是 。
②通过以上实验过程,可以说明钠具有的性质有哪些?并分析说明在实验室中应怎样保存金属钠?(2)钠与水反应在小烧杯中加入约1/2的水,滴入1~2滴酚酞溶液,将切好的钠投入到水中,盖上表面皿,观察实验现象。
填写下表:钠与水反应的化学方程式是2Na +2H 2O==2NaOH +H 2↑,氧化剂是H 2O ,还原剂是Na 。
3.钠的制备和用途 (1)制备工业上电解熔融NaCl 可以得到金属钠:2NaCl=====通电2Na +Cl 2↑(填电解方程式)。
(2)用途①钠和钾的合金常温下呈液态,可用于快中子反应堆作热交换剂。
②高压钠灯发出的黄光射程远,透雾能力强,常用作路灯。
③金属钠还可以用于钛、锆、铌、钽等金属的冶炼。
如Na 与TiCl 4反应:TiCl 4+4Na =====700~800 ℃Ti +4NaCl 。
归纳总结 有关钠的反应(1)钠在常温下与O 2反应生成Na 2O ,加热条件下生成Na 2O 2,钠与O 2的反应产物是由温度决定的,而不是由O 2的量决定的。
(2)钠与水(滴有酚酞)反应的实验现象可概括为5个字——“浮”、“熔”、“游”、“响”、“红”。
(3)钠与酸反应是先酸后水;钠与盐溶液反应是先水后盐,并不能置换出不活泼金属。
(4)钠与熔融的盐反应时可以置换出比其不活泼的金属。
1.等质量的两块钠,第一块在足量氧气中加热,第二块在足量氧气(常温)中充分反应,则下列说法正确的是()A.第一块钠失去电子多B.两块钠失去电子一样多C.第二块钠的反应产物质量大D.两块钠的反应产物质量一样大2.将少量金属钠分别投入下列物质的水溶液中,有气体放出,且溶液质量减轻的是()A.HClB.NaOHC.K2SO4D.CuSO4二氧化钠和过氧化钠(过氧化钠为加试要求)1.氧化钠是一种碱性氧化物,能与水、酸、酸性氧化物等发生反应。


高中化学钠的性质及应用钠是一种常见的碱金属元素,其化学性质十分活泼。
下面将从物理性质、化学性质和应用三个方面来详细介绍钠的性质及其应用。
一、物理性质:1. 外观:钠是一种银白色的金属,具有很强的金属光泽。
2. 密度:钠的密度相对较低,约为0.97 g/cm³,属于轻金属。
3. 熔点和沸点:钠的熔点较低,为97.8,而沸点则较高,为883。
4. 导电性:钠是良好的导电体,具有很高的导电性能,可用于制造导线和电池等。
二、化学性质:1. 活泼性:钠是一种极活泼的金属,能够与氧、水和氯等物质迅速反应,释放大量的热量。
2. 与氧的反应:钠可以与氧气反应生成氧化钠(Na2O)和过氧化钠(Na2O2)。
其中,钠与氧气反应形成氧化钠的反应是钠的常见氧化反应之一,而钠与过氧化氢反应形成过氧化钠的反应是一种还原反应。
3. 与水的反应:钠与水反应会放出氢气,并生成氢氧化钠(NaOH)。
该反应是剧烈的放热反应,钠在水中剧烈燃烧,并在水中迅速溶解产生碱性溶液。
4. 与氯的反应:钠与氯反应会形成氯化钠(NaCl)。
该反应是一种离子键形成的反应,而氯化钠是世界上最常见的盐之一。
三、应用:1. 钠在冶金工业中广泛用于制备其他金属,如铝和镁等。
钠可以与一些金属氧化物反应,从而与金属氧化物中的金属离子置换,制备金属。
2. 钠在化学工业中用作还原剂,能够将许多金属离子还原为金属。
此外,钠还可以用于生产合成橡胶、有机化学品等。
3. 钠可以用于制备钠合金,如钠铅合金和钠汞合金等。
这些合金具有较低的熔点和较高的导电性能,被广泛应用于电池和其他电器设备中。
4. 氢氧化钠是一种强碱,广泛用于工业和日常生活中。
氢氧化钠可以用于制备肥皂、合成染料和纺织品等。
5. 氯化钠是一种重要的食盐,被广泛应用于食品加工、调味品制备等领域。
总结:综上所述,钠是一种活泼的金属,具有很多特殊的物理和化学性质。
它在冶金、化学、电池和食盐等业界应用广泛,对于工业生产和日常生活都具有重要意义。


高一化学金属钠的知识点金属钠是我们生活中常见的一种金属元素,它具有一些独特的性质和用途。
在高一化学中,学习金属钠的知识点对了解金属元素和化学反应有着重要的作用。
本文将介绍金属钠的原子结构、性质、制取方法以及其在工业和日常生活中的应用。
1. 原子结构金属钠的原子序数是11,属于周期表中的第3周期。
它的原子结构由11个质子、11个电子和12个中子组成。
在电子排布方面,金属钠的电子排布可简化为2-8-1。
2. 物理性质金属钠是一种银白色金属,具有良好的延展性和导电性。
它在常温下为固态,室温下具有较低的熔点和沸点。
金属钠可以在空气中迅速与氧气反应生成氧化钠。
此外,金属钠是一种柔软的金属,可以用刀片切割成薄片。
3. 化学性质金属钠具有很强的活泼性,容易与其他物质发生化学反应。
它与水反应时会放出大量的氢气,同时生成氢氧化钠。
此反应非常剧烈,会伴随着氢气燃烧的现象。
金属钠还与非金属元素如氧、硫等发生反应,形成相应的氧化物和硫化物。
4. 制取方法金属钠的制取主要有三种方法:电解法、热法和化学法。
其中,电解法是最常用的制取方法。
通过在熔融的氯化钠溶液中施加电流,可以使氯离子还原成氯气,同时金属钠离子被电子还原成固态的金属钠。
5. 应用领域金属钠在工业和日常生活中有着广泛的应用。
在冶金行业中,金属钠可以作为还原剂用于提取金属。
此外,金属钠的高导电性使其在电池制造、电磁铁和导线等领域中有很大的用途。
在化学实验中,金属钠可以用于制取高纯度的有机化合物。
此外,金属钠还可以用作食品添加剂和防腐剂。
综上所述,金属钠是一种重要的金属元素,具有独特的原子结构和化学性质。
了解金属钠的知识点对理解化学反应和金属元素有着重要的意义。
在工业和日常生活中,金属钠的应用领域广泛,对于提高生产效率和改善生活品质起着重要作用。
加深对金属钠的理解,有助于我们更好地应用它的性质和特点,为社会的发展做出贡献。
钠金属知识点总结钠是一种常见的化学元素,它是第11号元素,化学符号为Na,原子序数为11。
钠是一种易熔、易氧化的金属,在自然界中以碳酸盐和氯化钠的形式广泛存在。
钠金属在工业生产和实验室应用中具有广泛的用途,本文将对钠金属的性质、用途以及相关的知识点进行总结。
一、钠金属的性质1. 外观和物理性质钠金属是一种银白色的块状金属,在常温下具有良好的延展性和可塑性。
钠的熔点为97.80°C,沸点为893.0°C,密度为0.971 g/cm³。
钠金属具有较低的硬度和熔点,因此易于加工和熔炼。
2. 化学性质钠金属具有较强的还原性,在空气中会迅速氧化生成氧化钠。
由于钠的还原性较强,因此在水中会剧烈反应并放出氢气,产生氢氧化钠。
此外,钠金属还与酸类物质发生反应,生成相应的盐类化合物。
3. 放射性由于钠金属中存在稳定的钠-23同位素,并且钠的原子核中的中子数比质子数稍多,因此钠金属是一种轻微的放射性物质。
然而,钠的放射性活性很低,对人体健康的影响极小。
二、钠金属的用途1. 工业生产钠金属在工业生产中有着重要的应用价值,主要用于制备金属钠化合物,如氢氧化钠、碳酸钠等。
这些化合物广泛应用于玻璃工业、皂液生产、纺织工业和冶金工业等领域。
2. 实验室应用钠金属在实验室中也有着重要的应用价值,例如用于合成有机化合物、催化剂制备、金属表面处理等方面。
此外,钠金属还可用于研究放射性同位素的性质和研究核反应等领域。
3. 其他用途钠金属还可用于制备钠灯、蓄电池、合金制备等领域。
由于钠金属具有较强的还原性和导热性,因此在一些特殊的工业领域具有重要的应用价值。
三、钠金属的安全问题1. 存储和运输由于钠金属具有强烈的还原性和与水反应产生氢气的特性,因此在存储和运输过程中应注意避免与水和潮湿空气接触。
此外,钠金属还应存放在干燥的环境中,并采取防火防爆措施。
2. 使用注意事项在使用钠金属时,应戴上防护眼镜和手套等个人防护装备,以避免钠金属造成的化学灼伤。
金属钠的用途概述金属钠是一种常见的碱金属元素,具有较低的密度和良好的导电性能。
由于其独特的化学性质和物理性质,金属钠在许多领域都有广泛的应用。
本文将从以下几个方面详细介绍金属钠的用途。
1. 钠离子电池钠离子电池是一种新型的高能量密度电池,可以作为锂离子电池的替代品。
相比于锂离子电池,钠离子电池具有较低的成本和更广泛的资源储备。
金属钠作为钠离子电池的主要阳极材料,在充放电过程中可以反复嵌入和脱嵌钠离子,实现能量存储与释放。
2. 化学合成金属钠在化学合成过程中起着重要作用。
例如,在有机合成中,氢化钠可以作为还原剂用于还原醛、酮等官能团;氰化钠可用于合成有机氰化物;碳酸氢钠常被用作中和剂和酸中和剂。
3. 铸造金属钠具有较低的熔点和高的流动性,因此在铸造领域有广泛应用。
例如,在航空航天工业中,钠铝合金可以用于制造轻质结构件;在汽车制造中,钠铝合金可以用于制造发动机部件和车身结构;在电子行业中,钠合金可用于制造高温超导体。
4. 金属处理金属钠可以与一些金属形成合金或化合物,从而改善其性能。
例如,将小量的钠添加到铝中可以改善其塑性和可锻性;将钠添加到镍基合金中可以提高其耐腐蚀性能;将钠与锑形成化合物可以提高锑的热导率。
5. 溶剂由于其较低的粘度和良好的溶解性,液态金属钠被广泛应用于许多化学反应的溶剂中。
例如,在有机合成中,液态金属钠可用作还原剂、脱水剂和催化剂。
6. 真空技术由于其低蒸汽压和良好的热传导性能,金属钠在真空技术中有重要应用。
例如,在高温熔融盐堆核电站中,钠被用作冷却剂和传热介质;在气相沉积中,钠可以用于生长薄膜和纳米材料。
7. 其他应用除了以上提到的应用领域外,金属钠还有一些其他的特殊用途。
例如,在火焰检测器中,金属钠可以通过与空气中的水分反应产生可见光,并触发火焰报警系统;在核工业中,金属钠可以作为一种冷却剂和传热介质。
结论综上所述,金属钠具有广泛的应用领域,包括能源存储、化学合成、铸造、金属处理、溶剂、真空技术以及其他特殊用途等。