配置氯化钠溶液步骤
- 格式:docx
- 大小:12.20 KB
- 文档页数:1



大学化学氯化钠的配置原理
大学化学实验室中,常见的氯化钠配置主要是用于制备标准溶液或配制实验溶液时使用。
配置氯化钠溶液的原理如下:
1. 获取纯净的氯化钠固体:一般使用实验室中的试剂瓶或从化学试剂供应商购买新鲜的氯化钠试剂,确保试剂质量纯净。
2. 称取适量的氯化钠固体:根据需要调配的氯化钠溶液浓度和体积,使用天平称取准确质量的氯化钠固体。
3. 加入适量的溶剂:在一个干燥且洁净的容器中,通常是一个烧杯或烧瓶中,加入足够的溶剂(通常是去离子水或蒸馏水)。
4. 搅拌溶解:使用玻璃搅拌棒或磁力搅拌器将氯化钠溶剂混合均匀,直到完全溶解为止。
5. 调整浓度:根据实验要求,可能需要通过加入溶剂或纯化钠固体来调整溶液的浓度。
6. 筛选和储存:使用滤纸或其他筛选方法将溶液中的杂质滤去,然后将配置好的氯化钠溶液转移到干净的试剂瓶或烧瓶中进行储存。
确保密封储存并标记浓度和配置日期等信息。
重要注意事项:
- 配制溶液前,确保实验室设备和容器的清洁和干燥。
- 配制溶液时,注意安全操作,避免溶液溅泼或吸入气体。
- 确保配制和储存过程中的溶液密封,以防止杂质的进入或溶液浓度的变化。
- 注意使用纯化水或蒸馏水,避免使用自来水或其他含有杂质的溶剂。
- 在实验室中操作时,要遵守实验室安全规范和操作流程。

氯化钠溶液的配置实验报告
实验目的:掌握氯化钠溶液的配置方法,了解溶液的稀释计算和实验操作。
实验原理:氯化钠(NaCl)是由钠离子和氯离子组成的离子化合物。
在溶液中,氯化钠会解离为钠离子(Na+)和氯离子(Cl-)。
溶液的浓度通常用质量浓度(g/L)或摩尔浓度(mol/L)表示。
实验材料:
1.氯化钠固体(NaCl)
2.纯水
3.量筒
4.称量器具
5.烧杯
6.搅拌棒
7.实验器皿
实验步骤:
1.准备一定质量的氯化钠固体,并称重记录其质量。
2.将烧杯放在天平上,称取一定质量的氯化钠固体(例如10克),记录其质量。
3.预先量取一定体积的纯水(例如100毫升)倒入烧杯中。
4.使用搅拌棒充分搅拌,使氯化钠充分溶解在水中。
5.过滤溶液,将溶液倒入一个干净的玻璃器皿中。
实验结果与计算:
1.记录添加的氯化钠固体的质量。
2.记录纯水的体积。
3.根据质量和体积的记录,计算溶液的浓度。
实验讨论:
1.在实验中,溶液的浓度可以通过质量浓度或摩尔浓度来表示。
质量浓度可以通过质量和体积的比值来计算,摩尔浓度可以通过摩尔数和体积的比值来计算。
2.需要注意的是,在计算溶液浓度时,要将溶质的摩尔质量和分子量考虑在内。
实验总结:
通过本次实验,我们成功掌握了氯化钠溶液的配置方法,并通过计算得出了溶液的浓度。
在实验过程中,我们了解了溶液的稀释计算和实验操作技巧。
这对我们日后在化学实验中的实验操作和溶液配置都具有重要的指导意义。

氯化钠溶液的配制步骤
氯化钠溶液的配制步骤如下:
1. 准备所需的材料
从化学试剂或市售药店购买氯化钠(NaCl)和蒸馏水(H2O)。
2. 称量氯化钠
使用称量器具称量所需的氯化钠。
通常情况下,氯化钠的浓度是以摩尔浓度(mol/L)或百分比浓度(%w/v)来表示的。
例如,如果要配制0.9%浓度的氯化钠溶液,需要称量9克氯化钠加入1000毫升蒸馏水中。
3. 加入蒸馏水
将称量好的氯化钠加入一定量的蒸馏水中,并进行搅拌以使氯化钠充分溶解。
根据需要,可以逐渐加水到容量瓶中,直到溶液体积达到预定值。
4. 调整溶液的pH值
氯化钠溶液的pH值通常是中性的,即7左右。
如果需要调整溶液的pH值,则
可以使用弱酸或弱碱来调节。
例如,如果需要调节为碱性,可以加入一定量的氢氧化钠(NaOH)。
5. 筛选和贮存
完成溶液配制后,使用滤纸将悬浮物和杂质筛除。
将溶液存储在干燥、阴凉的地方,以免溶液被污染或蒸发。
总结
综上所述,氯化钠溶液的配制步骤包括准备材料、称量氯化钠、加入蒸馏水、调整溶液的pH值、筛选和贮存等。
在配制过程中,需要严格按照比例称量和混合,以便获得所需的浓度。
为了保证最终溶液的质量,需要注意溶液的pH值和悬浮物的筛选。

化学实验中,如何制备氯化钠溶液?
氯化钠溶液是一种常见的化学实验试剂,可以在许多实验中使用。
以下是制备氯化钠溶液的步骤:
1. 准备材料和设备:
- 氯化钠固体(NaCl)
- 纯净水
- 量筒或容量瓶
- 搅拌棒
- 秤量器
2. 称量氯化钠固体:
- 使用秤量器准确称取所需的氯化钠固体量。
根据实验需要,通常使用0.1 M或0.5 M浓度的氯化钠溶液。
3. 配制氯化钠溶液:
- 将秤量好的固体氯化钠溶解在适量的纯净水中。
使用量筒或容量瓶来容纳所需的溶液量。
注意,固体溶解时会产生热量,所以可以等待其冷却到室温再使用。
4. 搅拌和混合:
- 使用搅拌棒将溶液充分搅拌,以确保氯化钠均匀溶解在水中。
继续搅拌,直到溶液成为透明的。
5. 浓度检查:
- 可以使用电导率计或其他适当的工具检测氯化钠溶液的浓度。
确保溶液达到所需的浓度。
6. 清洗和储存:
- 每次使用完后,使用纯净水彻底清洗和搅拌棒。
将制备好的
氯化钠溶液储存在干燥、避光的地方,以防止其受到污染。
请注意,以上步骤仅供参考,具体的实验条件和要求可能因实
验设计而有所不同。
在进行化学实验时,安全是最重要的,所以请
务必遵守实验室安全操作规程,并穿戴适当的个人防护装备。
参考文献:
1. 张三, 李四. 化学实验指导书. 化学出版社, 20xx.
2. 陈五, 王六. 化学实验技术手册. 高等教育出版社, 20xx.。

化学实验报告【实验目的】1、练习配制一定溶质质量分数或量浓度一定的溶液。
2、加深对溶质的质量分数以及量浓度概念的理解。
【实验器材】托盘天平、烧杯、玻璃棒、药匙、量筒、胶头滴管。
氯化钠、浓盐酸溶液、蒸馏水、容量瓶、漏斗。
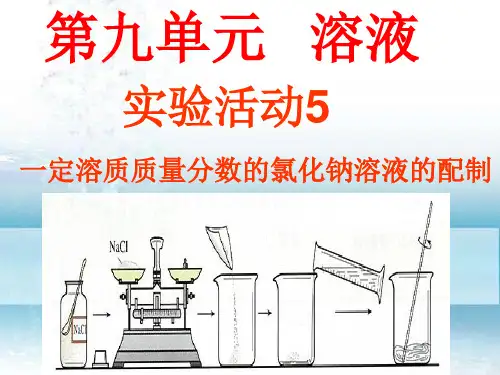
【实验步骤】1、配置质量分数为6%的氯化钠溶液(1)计算:配制50g质量分数为6%的氯化钠溶液所需氯化钠和水的质量分别为:NaCl:50g*6%=3g ;水:47g。
(2)称量:用托盘天平称取所需的氯化钠,放入烧杯中。
(3)量取:用量筒量取所需的水(水的密度可近似看作1g/cm3),倒入盛有氯化钠的烧杯中。
(4)溶解:用玻璃棒搅拌,使氯化钠溶解。
2、用已配制好的质量分数为6%的氯化钠溶液(密度约为1.04g/cm3),配制50g质量分数为3%的氯化钠溶液。
(1)计算:所得溶液中,氯化钠的质量为50g*3%=1.5g,所以需要质量分数为6%的氯化钠溶液25g(体积为26ml),蒸馏水25g(体积约为25ml)(2)量取:用量筒量取所需的氯化钠溶液和水,倒入烧杯中。
(3)混匀:用玻璃棒搅拌,使溶液混合均匀。
将上述配制好的溶液分别转入试剂瓶内,并贴上标签,区分开来。
3、配制250ml,2mol/L的稀盐酸(1)计算所需浓盐酸的体积设所需浓盐酸的体积为V1,则C1*V1=0.25L*2mol/L12mol/L*V1=0.25L*2mol/L解得该体积为41.7ml(2)用量筒量取41.7ml的浓盐酸(3)在烧杯中加入少量(大大少于250ml)的水和量取好的浓盐酸,用玻璃棒搅拌稀释。
(4)使用漏斗将烧杯内的溶液转移到容量瓶中。
(5)用水洗涤盛过盐酸的量筒和烧杯,并把洗涤液转移至容量瓶。
(6)定容:用胶头滴管继续加水,直至溶液凹液面达到250ml刻度。
(7)压紧容量瓶瓶盖将溶液摇匀。
仅供个人用于学习、研究;不得用于商业用途。
For personal use only in study and research; not for commercial use.Nur für den persönlichen für Studien, Forschung, zu kommerziellen Zwecken verwendet werden.Pour l 'étude et la recherche uniquementà des fins personnelles; pas à des fins commerciales.толькодля людей, которые используются для обучения, исследований и не должны использоваться в коммерческих целях.以下无正文仅供个人用于学习、研究;不得用于商业用途。

溶液的配制实验步骤详细配制溶液分三种情况:第一情况是用固体配制溶液;第二情况是用液体配制溶液;第三情况是用气体配制溶液。
初中只需掌握前两种溶液的配制。
例1、配制100克质量分数为10%的氯化钠溶液的实验步骤:1、计算配制100克质量分数为10%的氯化钠溶液所需氯化钠的质量=100g*10%=10克,所需水的质量=100g-10g=90g,所需水的体积=90g/(1g/ml)=90ml2、称量用托盘天平称量10克的氯化钠,e79fa5e98193e4b893e5b19e31333330353631倒入烧杯中。
3、溶解用量筒量取90毫升的水,倒入盛有氯化钠的烧杯里,用玻璃棒搅拌,使氯化钠溶解。
4、贴标签贮存把配好的溶液装入试剂瓶并贴上标签(标签中应包括药品名称和溶液中溶质的质量分数),放到试剂柜中例2:用质量分数98%的浓硫酸(p=1.84g/ml)配制500克质量分数为20%的稀硫酸的实验步骤:1、计算配制500克质量分数为20%的稀硫酸需要浓硫酸的质量=(500g*20%)/98%=102g需要浓硫酸的体积=102g/1.84g/ml=55.4ml所需水的质量=500g-102g=398g所需水的体积=398g/(1g/ml)=398ml2、量取(此步与固体配制溶液不同)用量筒量取398ml水,倒入烧杯中。
3、稀释(此步与固体配制溶液也不同)用量筒量取55.4毫升的浓硫酸,沿烧杯壁慢慢注入水中,并不断用玻璃棒搅拌,使产生的热量迅速扩散。
4、贴标签贮存把配好的溶液冷却后装入试剂瓶并贴上标签(标签中应包括药品名称和溶液中溶质的质量分数),放到试剂柜中。


一、实验目的1. 掌握溶液配置的基本原理和方法。
2. 熟悉常用溶液的配制过程。
3. 提高实验操作技能和实验数据分析能力。
二、实验原理溶液是由溶质和溶剂组成的均匀混合物。
溶液的浓度是指溶质在溶液中的含量,通常用质量浓度(g/L)或摩尔浓度(mol/L)表示。
溶液配置是将已知浓度的溶液按照一定比例稀释或浓缩,以得到所需浓度的溶液。
三、实验仪器与试剂1. 仪器:电子天平、容量瓶、移液管、烧杯、玻璃棒、滴定管、洗瓶、滤纸等。
2. 试剂:氯化钠(NaCl)、蒸馏水、浓盐酸、氢氧化钠(NaOH)等。
四、实验步骤1. 配制0.1mol/L氯化钠溶液(1)称取1.7g氯化钠,置于烧杯中。
(2)加入适量蒸馏水,用玻璃棒搅拌溶解。
(3)将溶液转移到100mL容量瓶中,用蒸馏水冲洗烧杯和玻璃棒,并将冲洗液转移到容量瓶中。
(4)向容量瓶中加入蒸馏水至刻度线,用滴定管滴加浓盐酸,调节pH值为7,摇匀。
(5)贴上标签,备用。
2. 配制0.1mol/L氢氧化钠溶液(1)称取4.0g氢氧化钠,置于烧杯中。
(2)加入适量蒸馏水,用玻璃棒搅拌溶解。
(3)将溶液转移到100mL容量瓶中,用蒸馏水冲洗烧杯和玻璃棒,并将冲洗液转移到容量瓶中。
(4)向容量瓶中加入蒸馏水至刻度线,用滴定管滴加浓盐酸,调节pH值为7,摇匀。
(5)贴上标签,备用。
3. 配制1mol/L盐酸溶液(1)称取36.5g浓盐酸,置于烧杯中。
(2)加入适量蒸馏水,用玻璃棒搅拌溶解。
(3)将溶液转移到1000mL容量瓶中,用蒸馏水冲洗烧杯和玻璃棒,并将冲洗液转移到容量瓶中。
(4)向容量瓶中加入蒸馏水至刻度线,摇匀。
(5)贴上标签,备用。
五、实验数据记录与分析1. 配制0.1mol/L氯化钠溶液称量:1.7g溶质:NaCl溶剂:蒸馏水浓度:0.1mol/L2. 配制0.1mol/L氢氧化钠溶液称量:4.0g溶质:NaOH溶剂:蒸馏水浓度:0.1mol/L3. 配制1mol/L盐酸溶液称量:36.5g溶质:HCl溶剂:蒸馏水浓度:1mol/L六、实验结果与讨论1. 实验结果通过以上实验,成功配制了0.1mol/L氯化钠溶液、0.1mol/L氢氧化钠溶液和1mol/L盐酸溶液,各溶液浓度符合预期。
实验4: 配制100mL1.00 mol/L的NaCl溶液
班级: 姓名:
【实验目的】
1.练习配制一定物质的量浓度的溶液;
2.加深对物质的量浓度概念的理解;
3.练习容量瓶的使用方法
【实验仪器药品】
药匙、小烧杯、、、、玻璃棒、量筒【实验药品】
NaCl固体、
1
、改用胶头滴管滴加, 是为了防止加入液体过多;
2、注意定容时眼睛应平视, 不能俯视或仰视。
3、注意定容时眼睛应平视,不能俯视或仰视。
【交流与思考】
容量瓶使用时应注意的事项:
为什么要用蒸馏水来配置溶液而不能用自来水配置呢?
为什么要洗涤玻璃棒和烧杯?如何洗涤?
能否将溶解的NaCl溶液立即注入容量瓶中?为什么?
为什么要将配好的溶液, 从容量瓶里倒入试剂瓶?
定容时不慎滴加液体超过刻度线, 则该怎么做?
1、谈谈你对本次实验的感受;
下列实验操作会使所配制的溶液浓度偏高,偏低,还是不变?为什么?
①把溶液向容量瓶中转移, 有少量溶液溅出;( ) 原因:;
②未洗涤烧杯和玻璃棒;( ) 原因: ;
③定容时加水超过了刻线;( )原因: ;
④定容时仰视观察液面;( )原因: ;
⑤定容时俯视观察液面;( )原因: ;
⑥将溶液转移到容量瓶之前, 容量瓶中有少量蒸馏水;()原因: ;
⑦将配得的溶液从容量瓶转移到干燥、洁净的试剂瓶中时, 有少量溅出;( )原因:;
⑧定容时, 俯视观察容量瓶刻度线;()原因:;。
配置氯化钠溶液的操作过程一、准备工作1.1 材料准备为了配置氯化钠溶液,我们需要准备以下材料: - 氯化钠固体 - 蒸馏水1.2 实验器材准备除了材料外,还需要以下实验器材: - 称量瓶 - 取样瓶 - 搅拌棒 - 称量器 - 称量纸 - 烧杯 - 注射器二、配置氯化钠溶液的步骤2.1 称量氯化钠固体1.使用称量器将所需氯化钠固体的质量称量到称量纸上。
根据实验要求,确定所需氯化钠溶液的浓度和体积,以及氯化钠的摩尔质量。
2.将称量纸上的氯化钠固体倒入称量瓶中,并记录下氯化钠的质量。
2.2 配制溶液1.取一个干净的烧杯,用蒸馏水冲洗一遍,确保烧杯内没有杂质。
2.用注射器将一定体积的蒸馏水吸取到烧杯中,记录下蒸馏水的体积。
3.将称量好的氯化钠固体加入到烧杯中的蒸馏水中。
4.使用搅拌棒充分搅拌溶液,直到氯化钠完全溶解。
2.3 调整溶液浓度如果需要调整溶液的浓度,可以根据以下步骤进行: 1. 根据实验要求,计算出所需溶液的浓度和体积。
2. 根据计算结果,向已配制好的溶液中加入适量的蒸馏水或氯化钠固体,以达到所需的浓度。
2.4 检验溶液浓度为了确保所配制的氯化钠溶液浓度准确无误,可以进行以下检验: 1. 使用取样瓶取一定体积的溶液。
2. 将取样瓶中的溶液放入溶液计中,测量其浓度。
3. 将测得的溶液浓度与实验要求进行比较,确保其在允许误差范围内。
三、注意事项在配置氯化钠溶液的过程中,需要注意以下事项: 1. 操作过程中要注意个人安全,避免溶液溅入眼睛或皮肤。
2. 及时清理实验器材,避免交叉污染。
3. 搅拌溶液时要充分搅拌,确保氯化钠完全溶解。
4. 操作过程中要准确称量和记录实验数据,确保溶液的准确性和可重复性。
5. 根据实验要求,及时调整溶液的浓度,以满足实验的需要。
四、总结通过以上步骤,我们可以成功配置氯化钠溶液。
在操作过程中,我们需要准备好所需材料和实验器材,按照一定的步骤进行操作,并注意安全和准确性。
氯化钠溶液配置实验步骤
嘿,朋友们!今天咱来唠唠氯化钠溶液配置这事儿。
氯化钠,就是咱平常说的盐啦!你可别小瞧这盐,它在好多地方都大有用处呢。
那怎么配置氯化钠溶液呢?听我慢慢和你说哈。
咱先得把家伙事儿准备齐全了。
那得有天平,用来称盐的重量;有量筒,来量水的多少;还有玻璃棒,这可是搅拌的好帮手;当然少不了烧杯啦,溶液就在里面诞生。
然后呢,根据你想要的浓度,算出需要多少盐。
这就好比你做饭要放多少盐调味一样,得心里有数。
算好了,就把盐放在天平上称一称。
哎呀,这天平就像个小法官,精确地衡量着盐的分量呢!称好了盐,就把它轻轻地倒进烧杯里。
接下来就是倒水啦!看着那水缓缓地流进烧杯,就像小溪在流淌一样。
这时候可不能马虎,得慢慢倒,边倒边看着刻度,可别倒多了或者倒少了。
水倒好了,就得请出玻璃棒啦!用它在烧杯里搅啊搅,就像在给溶液做按摩一样。
把盐和水充分地混合均匀,让它们亲密无间地融合在一起。
你说这像不像在交朋友?一开始盐和水各是各的,通过我们的努力,让它们成为了好伙伴,一起组成了氯化钠溶液。
在配置的过程中,可得细心再细心。
要是不小心称错了盐的重量,或者倒错了水的量,那可就前功尽弃啦!就像你走路走偏了方向,得赶紧调整回来。
配置好的氯化钠溶液用处可多啦!可以用来做实验,可以在医疗上发挥作用,还能在一些工业生产中大展身手呢!
所以啊,朋友们,别小看这小小的氯化钠溶液配置,这里面的学问可大着呢!只要我们认真对待,就能配置出完美的氯化钠溶液。
大家都来试试吧,感受一下这其中的乐趣和奥秘!这就是我要和你们分享的氯化钠溶液配置,希望你们也能顺利完成哦!。
生理盐水配置方法
生理盐水是医学中一种用于补充体液和维持平衡的溶液,其主要成分是纯净水和氯化钠。
下面是生理盐水的配置方法:
材料:
1升纯净水
9克氯化钠
步骤:
1. 取一升纯净水放入干净的烧杯中;
2. 称量9克氯化钠,加入到烧杯中;
3. 用玻璃搅棒搅拌至氯化钠完全溶解;
4. 最后用容量瓶将溶液加至1000毫升,摇匀后即可使用。
注意事项:
1. 氯化钠应使用无菌试剂,并且要滤纸过滤过;
2. 所有操作器材应保持无菌状态;
3. 使用前要进行无菌检测。
4. 配制的生理盐水应密封保存,避免灰尘或细菌污染。