2019全国高考化学评分细则ppt课件
- 格式:ppt
- 大小:2.82 MB
- 文档页数:36

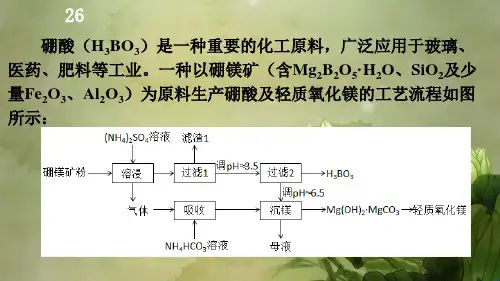
2019年高考理科综合(全国I卷)化学试题标准答案与阅卷评分细则硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工业。
一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如图所示:(1)在“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为。
标准答案:NH4HCO3+NH3===(NH4)2CO3 或(2分)NH 4HCO 3+2NH 3+H 2O===(NH 4)2CO 3+NH 3·H 2O评分细则: b.(1)平均分0.77a. 写成两步反应也可以, 但只写其中一步不给分;(2)“滤渣1”的主要成分有。
为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学试剂是。
标准答案:SiO2,Fe2O3,Al2O3 (3分)KSCN (1分)评分细则:a.写SiO2或SiO2、Fe2O3或SiO2、Al2O3均给2分;(2)平均分1.99Fe2O3,Al2O3给1分;只写这俩其中一个不给分; 只要有错的就不给分。
b.KSCN 或硫氰酸钾、硫氰化钾、亚铁氰酸钾、K4[Fe(CN)6]、K4Fe(CN)6、苯酚、NaOH、KOH均可凡错别字不给分(3)根据的解离反应:,可判断H3BO3是酸;在“过滤2”前,将溶液调节至3.5,目的是。
标准答案:一元弱(2分)转化为H3BO3,促进析出(2分)评分细则:a.只答“一元”或“弱”或“非氧化性弱”得1分。
b.答:促进H3BO3生成或者促进转化为H3BO3,或者抑制H3BO3解离,也得2分。
以下不给分:富集H3BO3;使H3BO3沉淀完全;有利于H3BO3的分离;得到纯净的H3BO3;(3)平均分1.56(4)在"沉镁"中生成沉淀的离子方程式为,母液经加热后可返回工序循环使用。
由碱式碳酸镁制备轻质氧化镁的方法是。
标准答案:2Mg2+ + 3CO32- + 2H2O === Mg(OH)2·MgCO3↓+2HCO3(2分)2Mg2+ + 2CO32- + H2O === Mg(OH)2·MgCO3 + CO2↑ 评分细则:a.写成2Mg2+ + 2CO32- + 2H2O===Mg(OH)2·MgCO3↓+H2CO3也给分;但这样不给分:2Mg2+ + 2CO32- + 2H2O===Mg(OH)2·MgCO3↓+H2O+CO2b.“==”“可逆号”“→”不扣分;“↓”“↑”不扣分;反应物产物错误,不配平0分。

2013-2019年高考化学非选择题评分细则制定与评分标准标准目录(内部交流资料)高考理科综合化学阅卷评分细则的制订与执行 (2)2013年高考化学非选择题评分细则 (3)2014年高考化学非选择题评分细则 (9)2015年高考化学非选择题评分细则 (13)2016年高考化学非选择题评分细则 (15)2017年高考化学非选择题评分细则与答卷中的共性问题 (17)湖北省高考理科综合化学阅卷评分细则的制订与执行(内部资料仅供参考)评分细则的制定1.指导思想以教育部考试中心下发的―理科综合能力测试参考答案和评分参考‖(简称―国标‖)为准绳,结合本省各种层次的考生(好、中、差)答题的实际情况,制订兼具科学性、合理性及可操作性的评分执行细则。
2.制订细则执行的具体原则①化学专用名词中出现错别字都要参照标准扣分。
②化学方程式,离子方程式未配平的,都不给分(包括分子式前的倍数或分数都视为不规范!)③在做计算题时,没有考虑有效数字的,可不扣分(有特殊注明的情况除外)④考生如按其他方法或步骤解题,正确的同样给分;有错误的,根据错误的性质,参照评分参考中相应的规定评分。
⑤制订评分执行细则时,第一依据是―国标‖,其次是中学正规教材,教参及权威的资料。
⑥坚持实事求是,即―白纸黑字‖原则,不作任何主观臆测。
⑦一个问题出现多种答案的,则酌情给分,甚至―0‖分。
⑧凡是字迹模糊,辨认不清者皆按―0‖分处理。
⑨未按指定位置答题又没有加以标注者按―0‖分处理。
3.制订评分执行细则的程序①认真研究―国标‖→调阅样卷,梳理出有代表性的典型的答案→业务组讨论并制定评分细则初稿→业务组向评卷员宣讲评分执行细则并讨论→定稿→无条件执行②根据各小题的题分设置若干个小分值。
评卷工作中的有关规范问题1.有关无机化学方面的试题①严格按要求给分:填空要求填什么就写什么,答非所问者按―0‖分处理。
②元素符号的书写:一定要符合规范要求,其中包括原子序数、原子量、电荷数、化合价以及同位素的表示等。




2019 年普通高等学校招生全国统一考试理科综合能力测试化学2019-6-9H 1 Li 7 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Ar 40 Fe 56 I 127一、选择题:在每小题给出的四个选项中,只有一项是符合题目要求的。
7.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。
下列说法错误的是A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点8.关于化合物2- 苯基丙烯(),下列说法正确的是A.不能使稀高锰酸钾溶液褪色B.可以发生加成聚合反应C.分子中所有原子共平面D.易溶于水及甲苯9.实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是A.向圆底烧瓶中滴加苯和溴的混合液前需先打开KB.实验中装置 b 中的液体逐渐变为浅红色C.装置c中的碳酸钠溶液的作用是吸收溴化氢D.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯10.固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。
下图为少量HCl 气体分子在253 K 冰表面吸附和溶解过程的示意图。
下列叙述错误的是1A.冰表面第一层中,HCl 以分子形式存在+浓度为5×10- 3 mol·L- 1(设冰的密度为0.9 g c·m- 3)B.冰表面第二层中,HC.冰表面第三层中,冰的氢键网格结构保持不变D.冰表面各层之间,均存在可逆反应HCl H ++Cl-- 3 ,11.NaOH 溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾H2A 的K a1=1.1 ×10- 6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中 b K a2=3.9 ×10点为反应终点。
下列叙述错误的是A.混合溶液的导电能力与离子浓度和种类有关+与A2- 的导电能力之和大于HA - 的B.NaC.b 点的混合溶液pH=72+/MV +在电极+)>c(K+)>c(OH - )D.c点的混合溶液中,c(Na12.利用生物燃料电池原理研究室温下氨的合成,电池工作时MV 与酶之间传递电子,示意图如下所示。




2019年普通高等学校招生全国统一考试(江苏卷)化学注意事项考生在答题前请认真阅读本注意事项及各题答题要求1.本卷满分为120分,考试时间为100分钟。
考试结束后,请将本试卷和答题卡一并交回。
2.答题前,请务必将自己的姓名、准考证号用0.5毫米黑色墨水的签字笔填写在试卷及答题卡的规定位置。
3.请认真核对监考员在答题卡上所粘贴的条形码上的姓名、准考证号与本人是否相符。
4.作答选择题,必须用2B 铅笔将答题卡上对应选项的方框涂满、涂黑;如需改动,请用橡皮擦干净后,再选涂其他答案。
作答非选择题,必须用0.5毫米黑色墨水的签字笔在答题卡上的指定位置作答,在其他位置作答一律无效。
5.如需作图,须用2B 铅笔绘、写清楚,线条、符号等须加黑、加粗。
可能用到的相对原子质量:H -1 C -12 N -14 O -16 Na -23 Mg -24 Al -27 S -32 Cl -35.5 K -39 Ca -40 Cr -52 Fe -56 Cu -64 Ag -108 I -127选择题单项选择题:本题包括10小题,每小题2分,共计20分。
每小题只有一个选项符合题意。
1、糖类是人体所需的重要营养物质。
淀粉分子中不含的元素是( )A. 氢B. 碳C. 氮D. 氧 2、反应NH 4Cl+NaNO 2NaCl+N 2↑+2H 2O 放热且产生气体,可用于冬天石油开采。
下列表示反应中相关微粒的化学用语正确的是( )A. 中子数为18的氯原子:1817ClB. N 2的结构式:N=NC. Na +的结构示意图:D. H 2O 的电子式:3、下列有关物质的性质与用途具有对应关系的是( )A. NH 4HCO 3受热易分解,可用作化肥B. 稀硫酸具有酸性,可用于除去铁锈C. SO 2具有氧化性,可用于纸浆漂白D. Al 2O 3具有两性,可用于电解冶炼铝4、室温下,下列各组离子在指定溶液中能大量共存的是( )A. 0.1mol·L −1NaOH 溶液:Na +、K +、23CO -、2AlO -B. 0.1mol·L −1FeCl 2溶液:K +、Mg 2+、24SO -、4MnO -C. 0.1mol·L −1K 2CO 3溶液:Na +、Ba 2+、Cl −、OH −D. 0.1mol·L −1H 2SO 4溶液:K +、4NH +、3NO -、3HSO -5、下列实验操作能达到实验目的的是( )A. 用经水湿润的pH 试纸测量溶液的pHB. 将4.0gNaOH 固体置于100mL 容量瓶中,加水至刻度,配制1.000mol·L −1NaOH 溶液C. 用装置甲蒸干AlCl 3溶液制无水AlCl 3固体D. 用装置乙除去实验室所制乙烯中的少量SO 26、下列有关化学反应的叙述正确的是( )A. Fe 在稀硝酸中发生钝化B. MnO 2和稀盐酸反应制取Cl 2C. SO 2与过量氨水反应生成(NH 4)2SO 3D. 室温下Na 与空气中O 2反应制取Na 2O 27、下列指定反应的离子方程式正确的是( )A. 室温下用稀NaOH 溶液吸收Cl 2:Cl 2+2OH −ClO −+Cl −+H 2OB. 用铝粉和NaOH 溶液反应制取少量H 2:Al+2OH −2AlO -+H 2↑C. 室温下用稀HNO 3溶解铜:Cu+23NO -+2H +Cu 2++2NO 2↑+H 2OD. 向Na 2SiO 3溶液中滴加稀盐酸:Na 2SiO 3+2H +H 2SiO 3↓+2Na +8、短周期主族元素X 、Y 、Z 、W 的原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层有2个电子,Z 的单质晶体是应用最广泛的半导体材料,W 与X 位于同一主族。