实验室制取氧气的装置图(学习类别)
- 格式:doc
- 大小:1.38 MB
- 文档页数:4


第2课时实验室制取氧气的装置及操作1.实验室制取氧气的装置。
(1)发生装置。
①高锰酸钾、氯酸钾、二氧化锰都是______体,且反应都需要加热,故加热高锰酸钾或混有二氧化锰的氯酸钾制氧气都采用________装置。
②过氧化氢溶液是______体,二氧化锰是固体,且反应不需要加热,故分解过氧化氢制氧气采用________装置,如下图。
(2)收集装置。
如下图,______为排水集气装置,______为向上排空气装置。
A B2.加热高锰酸钾制氧气的实验步骤:(1)查:检查装置的__________。
如上图。
将导管一端放入水槽中,双手紧握试管外壁,观察水槽中是否有气泡冒出。
如果________________,则装置气密性良好。
(2)装:将高锰酸钾药品装入试管内。
(3)定:将试管固定在铁架台上,使试管口________________。
(4)点:点燃酒精灯加热(一定要先______)。
(5)收:收集氧气(用排水法或______________法)。
(6)移:收集氧气完毕,先要将导管从水槽中移出。
(7)熄:最后熄灭酒精灯。
3.操作注意事项:(1)凡是制取气体的实验,首先要做的一定是检查装置的________。
(2)试管口要__________,目的是防止冷凝水倒流到试管底部使试管炸裂。
(3)试管口__________,目的是防止高锰酸钾粉末堵塞导管。
(4)伸入试管内的导管不能________,目的是便于试管内的气体排出。
(5)用排水法收集氧气时,当产生的气泡________冒出时才开始收集,理由是待试管和导管内的空气排尽后收集到的氧气才会纯净。
(6)收集完毕,先______________,后______________,这样做的目的是防止水槽中的水倒流入试管中炸裂试管。
4.氧气的验满:把____________放在集气瓶口,如果________,则氧气已收集满。
实验室制取氧气的装置[例1] 实验室用加热高锰酸钾的方法制取氧气,下列仪器中不需要...的是( )。
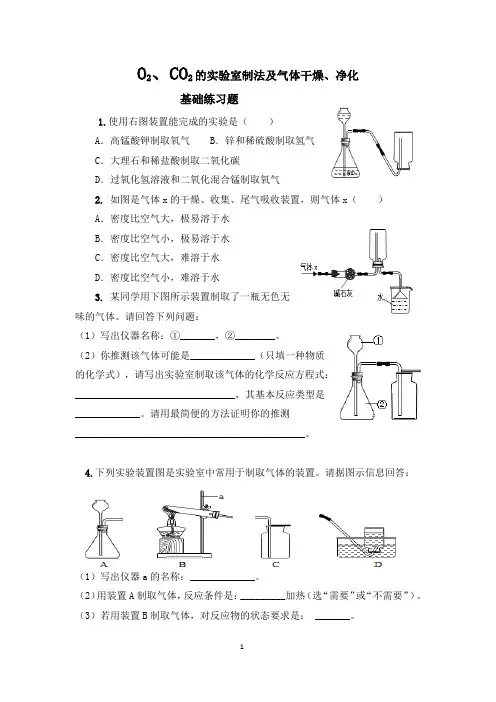
O2、CO2的实验室制法及气体干燥、净化基础练习题1.使用右图装置能完成的实验是()A.高锰酸钾制取氧气B.锌和稀硫酸制取氢气C.大理石和稀盐酸制取二氧化碳D.过氧化氢溶液和二氧化混合锰制取氧气2.如图是气体x的干燥、收集、尾气吸收装置,则气体x()A.密度比空气大,极易溶于水B.密度比空气小,极易溶于水C.密度比空气大,难溶于水D.密度比空气小,难溶于水3.某同学用下图所示装置制取了一瓶无色无味的气体。
请回答下列问题:(1)写出仪器名称:①_______,②________。
(2)你推测该气体可能是_____________(只填一种物质的化学式),请写出实验室制取该气体的化学反应方程式:________________________________,其基本反应类型是_____________。
请用最简便的方法证明你的推测______________________________________________。
4.下列实验装置图是实验室中常用于制取气体的装置。
请据图示信息回答:(1)写出仪器a的名称:_____________。
(2)用装置A制取气体,反应条件是:_________加热(选“需要”或“不需要”)。
(3)若用装置B制取气体,对反应物的状态要求是: _______。
(4)若制取的气体难溶于水、不与水反应,且密度比空气的小,则应选用的收集装置是_____________。
5.实验室制取气体所需的装置如图所示。
(1)写出装置中标号仪器的名称:a______,b_____。
(2)用大理石和稀盐酸制取一瓶干燥的二氧化碳气体时,应选用装置_____________(填字母代号)组合。
F 装置中浓硫酸的作用是_____________。
提高练习题1.用下列装置制取CO 2气体,由于装置错误导致可能收集不到CO 2的是( )A. B. C. D.2. 下列实验设计及气体流向(“→”表示气体流向)正确的是( )A 干燥氨气B 收集氢气C 收集氨气D 收集氧气3.以下是研究实验室制取氧气的装置图,请按要求回答下列问题。

【同步实验课】过氧化氢制取氧气实验【实验目的】1.学习实验室用过氧化氢制取氧气的方法。
2.了解化学反应需要一定的条件,知道催化剂对化学反应的重要作用。
【实验仪器】锥形瓶、分液漏斗、双孔橡胶塞、胶皮管、玻璃导管、集气瓶、水槽、玻璃片、弹簧夹、火柴【实验试剂】过氧化氢溶液、二氧化锰【实验步骤】(1)连接装置并。
(2)向锥形瓶中加入。
(3)塞好带有分液漏斗和导管的双孔塞。
(4)向分液漏斗中加入。
(5)滴加液体:打开分液漏斗活塞,慢慢滴加过氧化氢溶液。
(6)用排水集气法收集。
1. 反应原理(1)文字表达式:(2)符号表达式:2. 催化剂(1)定义:在化学反应中能其他物质的化学反应速率,而本身的和在反应前后都没有发生变化的物质。
(2)特点:“一变两不变”①一变:;(可以加快也可以减慢)①两不变:。
(物理性质可以改变)01实验梳理02实验点拨03典例分析04对点训练05真题感悟【注意】①催化剂(填“能”或“不能”)改变生成物的质量;①催化剂(填“能”或“不能”)控制反应的发生与停止;①同一化学反应(填“一定”或“不一定”)只有一种催化剂;同一物质可以在的化学反应中起催化作用。
(3)验证某物质是催化剂的方法①改变反应速率:设计实验,观察加入该物质前后化学反应速率是否改变。
①反应前后质量不变:称量该物质在的质量是否发生变化。
①化学性质不变:一般进行实验,观察重新加入反应物的现象和原来的现象是否相同。
3. 分液漏斗检查装置气密性的方法方法①:连接装置后,先关闭分液漏斗活塞,再将导管的末端放入水中,双手紧握锥形瓶,若,松开手后导管中形成一段水柱,说明装置气密性良好。
方法①:连接装置后,夹紧止水夹,关闭分液漏斗活塞,向分液漏斗中加水,打开活塞,一段时间后,,说明装置气密性良好。
4.发生装置的评价D.可用向下排空气法收集氧气【典例03】过氧化氢在催化剂作用下可迅速分解成水和氧气,量筒中涌出柱状的泡沫,可形象地称为“大象牙膏”,下列说法正确的是()A.反应产生的氧气支持燃烧,可以作燃料B.加发泡剂和催化剂后反应减缓了C.反应前后催化剂的质量不变D.没有催化剂过氧化氢不会分解【典例04】某小组用过氧化氢制取氧气,下图是实验室中常用仪器,回答下列问题。

课题3 制取氧气(1)【学习目标】1. 初步学习氧气的实验室制取方法,通过探究氧气的制法,让学生初步学习实验探究方法和运用比较学习法。
2. 了解氧气的工业制法。
【课前预习】写出下列物质化学式。
知识点1 实验室制取氧气1. 阅读课本P37~P39,了解实验室制取氧气的三种方法。
思路点拨:实验室制取氧气的方法有三种,分别是加热分解高锰酸钾、加热分解氯酸钾和分解过氧化氢溶液来制取。
其中高锰酸钾是暗紫色固体,氯酸钾是白色晶体,过氧化氢溶液是无色液体,二氧化锰是黑色粉末。
2. 阅读课P37“实验2-5”及相关内容,了解加热高锰酸钾制取氧气的相关知识。
知识点2 氧气的工业制法阅读课本P40“资料卡片”,了解工业上大量制取氧气的方法并回答下列问题:工业上大量制取氧气的方法(_____________________):在低温条件下加压,使空气转变为液态,然后蒸发。
由于液态氮的沸点是-196 ℃,比液态氧的沸点(-183 ℃)低,因此______________首先从液态空气中蒸发出来,剩下的主要就是_______________。
该变化属于____________变化。
【课堂练习】1. 实验室制取氧气可选用的药品有()①过氧化氢溶液②水③氯酸钾④锰酸钾⑤高锰酸钾A. ①②B. ②③C. ④⑤D. ①③⑤2. 实验室用高锰酸钾制取氧气,下列相关装置及操作正确的是( )3. 如图2-3-1为实验室用高锰酸钾制取氧气的实验装置,请指出图中存在的错误并改正。
(1)___________________________。
(2)___________________________。
(3)____________________________。
(4)____________________________。
4. 工业制氧气的原料是()A.空气B.高锰酸钾C.过氧化氢D.水5. 工业上用分离液态空气法制取氧气的依据是()A.氧气和氮气的沸点不同B.氧气和氮气在水中的溶解性不同C.氧气和氮气的密度不同D.氧气和氮气的化学性质不同【课堂检测】1. 实验室用加热高锰酸钾的方法制取氧气时,用到的一组仪器是()A. 量筒、试管B. 铁架台、酒精灯C. 烧杯、单孔塞D. 燃烧匙、集气瓶2. 在实验室用加热高锰酸钾的方法制取氧气,并用排水法收集时,主要操作有①装药品、②用排水法收集氧气、③检查装置气密性、④将装有药品的试管固定在铁架台上、⑤加热、⑥停止加热、⑦将导管移出水面。

一、发生装置的选择: 实验室制取气体的装置由两部分组成:发生装置和收集装置 发生装置由反应物的状态和反应条件决定(是否需要加热)1、固体加热制备气体反应物和反应条件的特征:反应物都是固体,反应需要加热。
装置气密性的检查方法:把导气管浸在水中,用手紧握试管,如果有气泡 冒出则气密性好好。
(原理:气体的热胀冷缩)实验中的应用高锰酸钾取氧气:2KMnO 4 △K 2MnO 4 + MnO 2 + O 2↑氯酸钾制取氧气 : 2KClO 3 MnO2 2KCl + 3O 2 ↑(还有一用途:木炭还原氧化铜:C+想 2CuO 高温 2Cu + CO 2↑)加热时的注意事项:1、铁夹应夹在试管的中上部,大约是距试管口 三分之一 处。
2、药品要斜铺在在试管底部,便于均匀受热。
3、试管口要 略向下倾斜,防止冷凝水回流 到热的试管底部炸裂试管。
4、试管内导管应稍露出胶塞即可。
如果太长,不利于气体排出。
5、停止反应时,为了安全应先将导管移出水槽 ,再熄灭酒精灯,防止水 槽中的水被倒吸入热的试管中,使试管炸裂。
2、固液不加热型反应物和反应条件的特征:反应物中有固体和液体,反应不需要加热。
装置气密性的检查方法:在导管出口处套上橡皮塞,用弹簧夹夹紧橡 皮塞,从漏斗中加水。
如果液面不下降 ,则表明装置气密性良好。
实验中的应用双氧水制取氧气:2H 2O 2 MnO2 2H 2O+ O 2↑制取二氧化碳:CaCO 3+2HCl==CaCl 2+H 2O+CO 2↑检验:二氧化碳通入澄清石灰水:CO 2 +C a (O H )2 ==CaCO 3↓+ H 20现象:澄清石灰水变浑浊。
1、长颈漏斗作用:便于随时添加药品。
2、如果使用长颈漏斗,注意长颈漏斗的下端管口应插入液面以下,形成 液封,防止生成的气体从长颈漏斗逸出。
使用分液漏斗时无需考虑这个问题。
3、固体药品通过锥形瓶口加入,液体药品通过分液漏斗加入。
4、优点:不需要加热气体收集装置收集装置由气体的性质决定适用情况:收集的气体不溶或难溶于水,且不与水反应。

实验活动氧气的实验室制取与性质【实验目的】1、学习实验室制取氧气的方法。
2、加深对氧气性质的认识。
【实验用品】高锰酸钾、木炭、澄清石灰水。
大试管、试管夹、单孔橡皮塞、胶皮管、玻璃导管、集气瓶、水槽、铁架台(带铁夹)、酒精灯、玻璃片、坩埚钳、细铁丝、木条,棉花。
火柴。
【实验步骤】1、制取氧气(1)仔细观察右图装置,使用的仪器有等。
侧为气体发生装置,侧是气体收集装置。
因为氧气,可采用排水法收集。
(2)用带有导管的橡胶塞塞紧试管,检查装置的气密性。
确认装置不漏气后,拔开橡胶塞,在试管中装入少量高锰酸钾,并在试管口放一团棉花,防止。
用带有导管的橡胶塞塞紧管口,把试管口略向下倾斜固定在铁架台上,以防止加热时。
(3)将两个集气瓶分别装满水,用玻璃片盖住瓶口,然后把盛满水的集气瓶连同玻璃片一起倒立在盛水的水槽内。
(4)先使酒精灯火焰在试管下方来回移动,让试管,然后对高锰酸钾的部位加热。
导管口开始有气泡放出时,不宜立即收集,当气泡连续均匀放出时,再把导管口伸入盛满水的集气瓶。
待集气瓶里的水排完以后,盖住瓶口。
小心地把集气瓶移出水槽,放在桌子上。
用同样的方法再收集一瓶氧气(瓶中留有少量水)。
(5)停止加热时,先把导管移出水面,然后再熄灭酒精灯,防止,使热试管骤然冷却而炸裂。
2、氧气的性质(1)如图所示,用坩埚钳夹取一小块木炭,在酒精灯上加热到发红,由瓶口向下缓慢插入到氧气瓶中,可观察到。
燃烧停止后,取出坩埚钳,向集气瓶中加入少量澄清石灰水,振荡,观察到。
点燃系在螺旋状细铁丝底端的火柴,待火柴快燃尽时,插入盛有氧气的集气瓶中。
可观察到。
集气瓶底部预先方少量水或一层细沙,可以防止。
【问题与交流】1、检查装置的气密性时,除了用手紧握的方法外,还可以用什么方法?2、如果某同学制得的氧气不纯,你认为可能的原因有哪些?3、把红热的木炭插入盛有氧气的集气瓶时,为什么要由瓶口向下缓慢插入?4、做铁丝在氧气中燃烧实验时,小华同学把铁丝绕成螺旋状缠在火柴梗上点燃后,伸入她收集的氧气瓶中,却没有观察到铁丝燃烧现象。

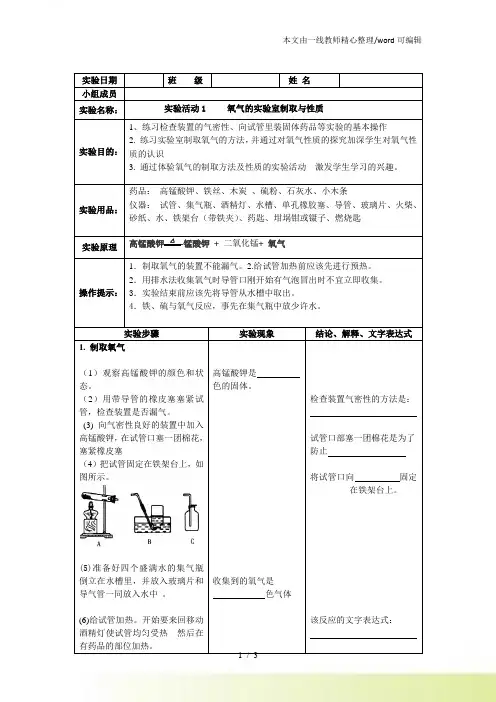
实验日期班级姓名小组成员实验名称:实验活动1 氧气的实验室制取与性质实验目的:1、练习检查装置的气密性、向试管里装固体药品等实验的基本操作2. 练习实验室制取氧气的方法,并通过对氧气性质的探究加深学生对氧气性质的认识3. 通过体验氧气的制取方法及性质的实验活动激发学生学习的兴趣。
实验用品:药品:高锰酸钾、铁丝、木炭、硫粉、石灰水、小木条仪器:试管、集气瓶、酒精灯、水槽、单孔橡胶塞、导管、玻璃片、火柴、砂纸、水、铁架台(带铁夹)、药匙、坩埚钳或镊子、燃烧匙实验原理高锰酸钾△-锰酸钾+ 二氧化锰+ 氧气操作提示:1.制取氧气的装置不能漏气。
2.给试管加热前应该先进行预热。
2.用排水法收集氧气时导管口刚开始有气泡冒出时不宜立即收集。
3.实验结束前应该先将导管从水槽中取出。
4.铁、硫与氧气反应,事先在集气瓶中放少许水。
实验步骤实验现象结论、解释、文字表达式1. 制取氧气(1)观察高锰酸钾的颜色和状态。
(2)用带导管的橡皮塞塞紧试管,检查装置是否漏气。
(3) 向气密性良好的装置中加入高锰酸钾,在试管口塞一团棉花,塞紧橡皮塞(4)把试管固定在铁架台上,如图所示。
(5)准备好四个盛满水的集气瓶倒立在水槽里,并放入玻璃片和导气管一同放入水中。
(6)给试管加热。
开始要来回移动酒精灯使试管均匀受热然后在有药品的部位加热。
高锰酸钾是色的固体。
收集到的氧气是色气体检查装置气密性的方法是:试管口部塞一团棉花是为了防止将试管口向固定在铁架台上。
该反应的文字表达式:附件一:实验报告单(7)当导管口有气泡连续而均匀的放出后用排水法收集两瓶氧气。
盖好玻璃片正放在桌面上。
(8)实验结束前,将导气管撤离出水槽再熄灭酒精灯。
气泡连续放出后再收集是因为试管和导管里原来有。
正放是因为氧气的密度比空气密度。
2、试验氧气的化学性质: (1)木炭在氧气里的燃烧及产物的检验(2)铁丝在氧气里燃烧(3)硫在氧气里燃烧(见上图)木炭在氧气里燃烧比在空气里燃烧更剧烈,发出光。


【同步教育信息】一. 本周教学内容:1. 掌握实验室制取氧气的反应原理、仪器装置、操作方法,初步了解通过化学实验制取新物质的方法。
2. 理解分解反应的概念。
3. 认识催化剂及其在化学反应中所起的作用。
4. 学会连接仪器装置,检查装置的气密性,用排水法收集气体等实验基本操作。
二. 重点、难点:1. 重点:实验室制取氧气的方法及实验操作。
2. 难点:催化剂的概念。
【例题评析】[例1] 实验室用高锰酸钾加热制取并用排水法收集氧气完毕后,应()A. 先把试管从铁夹上取下B. 继续加热至不再产生气体时为止C. 先移开酒精灯停止加热D. 先将导气管从水槽中取出评析:化学实验中正确的操作步骤是十分重要的。
一旦发生错误操作,就可能导致实验失败甚至发生伤害事故。
整个实验没结束,不能把试管从铁夹上取下,A是错误的;制取氧气收集完毕,继续加热至不再产生气体时没有任何意义,B选项不正确;所以收集气体完毕,必须先把导气管从水槽中取出,再移开酒精灯,这样可以防止水的倒吸。
如按C中操作,由于温度突然降低而造成试管内压强降低,水槽内的水就会被倒吸入试管导致试管炸裂,是严重错误。
答案:D[例2] 下列有几种能够产生氧气的变化,其中符合实验室制取氧气的要求的是()A. 空气经过净化、液化、蒸发得到氧气B. 水通过电解得到氧气C. 过氧化氢溶液和二氧化锰混合得到氧气D. 加热氯酸钾与二氧化锰的混合物制取氧气评析:实验室制取氧气的要求是反应速度便于控制,操作比较方便,安全可靠,所以通常用分解过氧化氢溶液或加热高锰酸钾的方法制取氧气。
A是工业上生产大量氧气的方法,B虽然能制取出比较纯净的氧气,但反应速率慢且不安全;D因为氯酸钾具有强氧化性,如混有少量木炭粉或木屑等易燃物质,加热时容易发生爆炸,存在安全隐患。
答案:C。
【模拟试题】自主评测一. 选择题(每道小题只有一个符合题意的答案)1. 实验室用高锰酸钾制氧气时,错误的操作是( )A. 检查装置的气密性时,先对试管加热,过一会儿把导管放入水里,没有看到气泡逸出,说明装置漏气。
实验室制取氧气及其性质实验报告实验名称:加热高锰酸钾(KMnO4)制取氧气及探究氧气性质实验日期:_________ 姓名_________ 同组人____________________ 【实验目的】1. 通过实验操作,练习仪器组装、加热、检查装置气密性、收集气体和检验等基本操作。
2. 通过小组合作,学习用加热高锰酸钾制取氧气的实验步骤和方法,并能验证氧气的性质。
【实验准备】物品准备:试管、单孔橡胶塞、胶皮管、玻璃导管、集气瓶、水槽、铁架台(带铁夹)、酒精灯、玻璃片、镊子、钥匙、木条、棉花、高锰酸钾、火柴、废液缸、污物杯、抹布等。
实验药品:高锰酸钾、木炭、澄清石灰水、铁丝等【实验原理及装置图】1. 实验原理:(请写出文字表达式)2.实验装置图:【实验过程与方法】一、制取氧气1. 检查装置的气密性。
连接装置,将导气管末端伸入水中,用手紧握试管外壁,观察水中的导管口,说明装置不漏气。
2. 装药品。
先使试管倾斜,把盛有药品的药匙送至试管底部,然后使试管直立起来。
在试管口。
(目的:防止加热时高锰酸钾粉末进入导管),用带有导管的塞子塞紧瓶口,伸进试管内的导管不宜太长,稍伸出胶塞即可(目的:有利于气体的导出)。
3. 固定仪器。
把试管口略向倾斜。
(目的:防止冷凝水回流到热的试管底部,炸裂试管)固定在铁架台上,铁夹应夹在距试管口约处。
4. 点燃酒精灯,加热。
先使酒精灯火焰在试管下方来回移动,让试管均匀受热,然后对高锰酸钾所在的部位加热。
5. 收集。
(收集2瓶氧气,加热前先将集气瓶充满水,盖好玻璃片,倒放在水槽中,做好准备。
)当导管口气泡排出时,再把导管口伸入盛满水的集气瓶里,待集气瓶口有大气泡冒出时,移出导管,在水下盖好玻璃片,取出。
把集气瓶正放在桌子上(原因:相同条件下氧气的密度略大于空气的密度)。
6. 撤离导管:先把导气管从水中移出,再熄灭酒精灯。
7. 熄灭酒精灯。
用灯帽盖灭。
二、验证氧气的性质1. 取一小块木炭,在酒精灯上烧至发红,然后将木炭缓慢插入集气瓶内。
实验室制取气体的常见装置图
一、实验室制取气体的两套发生装置:
该装置适用于固+固在加热条件下制取气体
以上三种装置适用于:反应物为固态和液态,反应不需加热.
检查装置第二和第三气密性的方法是:
用弹簧夹夹紧橡皮管,向长颈漏斗中注入水至长颈漏斗下端管口浸没液面以下,继续加水,然后观察长颈漏斗管中的液面高度是否变化,如果液面不下降则说明气密性好;
二、实验室收集气体的三种收集装置:
排水法:
一.适用范围:不易溶于水,不与水发生反应的
气体
二.优点:1.易于收集到较纯的气体
2.便于观察气体是否已经收集满
向上排空气法:一.适用范围:密度比空气大,
不与空气中任何成分反应的气体
二.优点:操作较为方便,需验满
向下排空气法:(1)适用范围:密度比空气小的
气体,不与空气中任何成分反应的气体
(2)优点:操作较为方便,需要验满。