高考化学全国卷Ⅰ专题———结构化学知识点考点总结(含答案)
- 格式:docx
- 大小:1.13 MB
- 文档页数:22
【2020全国I】1.国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,乙醚、75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿等均可有效灭活病毒。
对于上述化学药品,下列说法错误的是A. CH3CH2OH能与水互溶B. NaClO通过氧化灭活病毒C. 过氧乙酸相对分子质量为76D. 氯仿的化学名称是四氯化碳【答案】D【详解】A.乙醇分子中有羟基,其与水分子间可以形成氢键,因此乙醇能与水互溶,A说法正确;B.次氯酸钠具有强氧化性,其能使蛋白质变性,故其能通过氧化灭活病毒,B说法正确;C.过氧乙酸的分子式为C2H4O3,故其相对分子质量为76,C说法正确;D.氯仿的化学名称为三氯甲烷,D说法不正确。
综上所述,故选D。
【2020全国I】2.紫花前胡醇可从中药材当归和白芷中提取得到,能提高人体免疫力。
有关该化合物,下列叙述错误的是A. 分子式为C14H14O4B. 不能使酸性重铬酸钾溶液变色C. 能够发生水解反应D. 能够发生消去反应生成双键【答案】B【解析】A.根据该有机物的分子结构可以确定其分子式为C14H14O4,A叙述正确;B.该有机物的分子在有羟基,且与羟基相连的碳原子上有氢原子,故其可以被酸性重铬酸钾溶液氧化,能使酸性重铬酸钾溶液变色,B叙述不正确;C.该有机物的分子中有酯基,故其能够发生水解反应,C叙述正确;D.该有机物分子中与羟基相连的碳原子的邻位碳原子上有氢原子,故其可以在一定的条件下发生消去反应生成碳碳双键,D叙述正确。
综上所述,故选B。
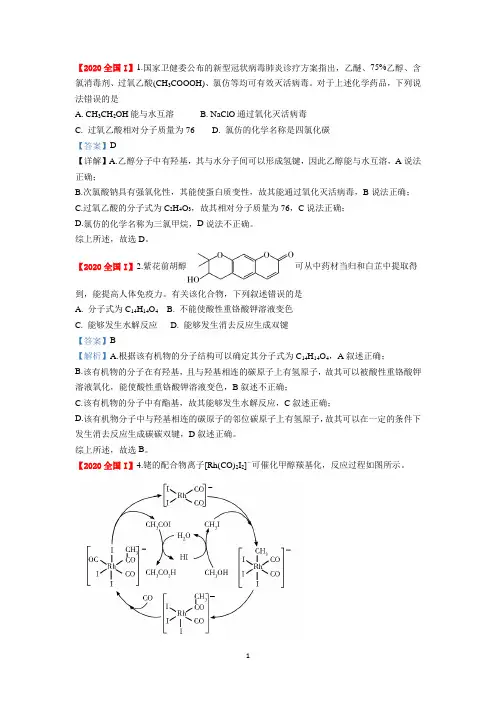
【2020全国I】4.铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。
下列叙述错误的是A. CH 3COI 是反应中间体B. 甲醇羰基化反应为CH 3OH+CO=CH 3CO 2HC. 反应过程中Rh 的成键数目保持不变D. 存在反应CH 3OH+HI=CH 3I+H 2O【答案】C 【解析】题干中明确指出,铑配合物()22Rh CO I -⎡⎤⎣⎦充当催化剂的作用,用于催化甲醇羰基化。

高考结构化学知识点总结高考化学是理科生的必修科目之一,也是考生们备战高考的重中之重。
结构化学是化学的基础,它涉及到物质的组成、性质、结构以及变化规律等方面的内容。
下面将对高考结构化学知识点进行总结,以帮助考生加深对这一部分知识的理解和掌握。
一、元素的周期性元素周期表是化学知识体系中的重要工具,它按照元素的原子序数从小到大排列,展示了元素的周期性规律。
元素周期表的一些主要概念包括周期、族和周期趋势等。
1. 周期:周期是指元素周期表上的横行,每一个周期都有相同的电子层结构。
2. 族:族是指元素周期表上的纵列,具有相同的化学性质和相似的电子外层结构。
3. 周期趋势:周期趋势是元素周期表上的一些物理和化学性质随周期变化的规律,如原子半径、电离能、电负性等。
二、化学键和分子的构造化学键是原子之间形成的力,它决定了化合物的组成和性质。
常见的化学键有离子键、共价键和金属键。
1. 离子键:离子键是由正离子和负离子之间的吸引力形成的,常见于金属和非金属元素的结合。
2. 共价键:共价键是由共享电子对形成的,常见于非金属元素之间的结合。
3. 金属键:金属键是由金属原子之间的电子云形成的,常见于金属元素之间的结合。
分子是由化学键连接在一起的原子团。
一个分子中的原子数量称为分子量。
三、化学反应中的平衡和速率化学反应是物质发生转化的过程,包括反应物和生成物。
在化学反应中,平衡定律和速率定律是两个核心概念。
1. 平衡定律:平衡定律描述了反应达到平衡时,反应物和生成物浓度的关系。
平衡常数是一个表征反应进行程度的参数。
2. 速率定律:速率定律描述了反应速率与反应物浓度之间的关系。
速率常数是一个表征反应速率的参数。
四、溶液和酸碱中的离子反应溶液是指溶质溶解在溶剂中形成的均匀混合物。
酸碱中的离子反应是指酸和碱之间发生的中和反应。
1. 溶液的浓度:溶液的浓度可以用质量浓度、体积浓度和摩尔浓度等方式表示。
2. 酸碱中的离子反应:酸和碱之间的中和反应是指酸的氢离子和碱的氢氧根离子结合形成水分子的反应。

高考专题之结构化学1. 铜及其化合物在人们的日常生活中有着广泛的用途。
回答下列问题:(1)铜或铜盐的焰色反应为绿色,下列有关原理分析的叙述正确的是_____(填字母)。
a.电子从基态跃迁到较高的激发态b.电子从较高的激发态跃迁到基态c.焰色反应的光谱属于吸收光谱d.焰色反应的光谱属于发射光谱(2)基态Cu原子中,核外电子占据的最高能层符号是_____,其核外电子排布式中未成对电子数为______个,Cu与Ag均属于IB族,熔点:Cu____Ag(填“>”或“<”)。
(3)[Cu(NH3)4]SO4中阴离子的立体构型是_________;中心原子的轨道杂化类型为__________,[Cu(NH3)4]SO4中Cu2+与NH3之间形成的化学键称为________________。
(4)用Cu作催化剂可以氧化乙醇生成乙醛,乙醛中σ键和π键的比值为___________。
(5)碘、铜两种元素的电负性如表:元素I Cu电负性 2.5 1.9CuI属于_______(填“共价”或“离子”)化合物。
(6)Cu 与Cl 形成某种化合物的晶胞如图所示,该晶体的密度为ρg·cm-3,晶胞边长为a cm,则阿伏加德罗常数为__________(用含ρ、a的2.ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。
请回答下列问题:(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是____;(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为___;(3)Se原子序数为____,其核外M层电子的排布式为____;(4)H2Se的酸性比H2S___(填“强”或“弱”)。
气态SeO3分子的立体构型为____,SO32-离子的立体构型为______;(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释;○1H2SeO4和H2SeO3第一步电离程度大于第二部电离的原因:______;○2H 2SeO 4和H 2SeO 3酸性强的原因:____________; 3.乙炔是有机合成工业的一种原料。

结构化学选修3知识点总结(人教版)全国卷适用一、考纲考点展示《选修3:物质的结构与性质》高考试题中9种常考点1普通高等学校招生全国统一考试理科综合(化学部分)考试大纲的说明(节选)必修2:物质结构和元素周期律①了解元素、核素和同位素的含义。
②了解原子构成。
了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
③了解原子核外电子排布。
④掌握元素周期律的实质。
了解元素周期表(长式)的结构(周期、族)及其应用。
⑤以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。
⑥以IA和VIIA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
⑦了解金属、非金属在元素周期表中的位置及其性质递变的规律。
⑧了解化学键的定义。
了解离子键、共价键的形成。
选修3:物质结构与性质1.原子结构与元素的性质⑴了解原子核外电子的排布原理及能级分布,能用电子排布式表示常见元素(1~36号)原子核外电子、价电子的排布。
了解原子核外电子的运动状态。
⑵了解元素电离能的含义,并能用以说明元素的某些性质。
⑶了解原子核外电子在一定条件下会发生跃迁,了解其简单应用。
⑷了解电负性的概念,知道元素的性质与电负性的关系。
2.化学键与物质的性质⑴理解离子键的形成,能根据离子化合物的结构特征解释其物理性质。
⑵了解共价键的形成,能用键能、键长、键角等说明简单分子的某些性质。
⑶了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。
⑷理解金属键的含义,能用金属键理论解释金属的一些物理性质。
了解金属晶体常见的堆积方式。
⑸了解杂化轨道理论及常见的杂化轨道类型(sp、sp2、sp3)⑹能用价层电子对互斥理论或者杂化轨道理论推测常见的简单分子或者离子的空间结构。
3.分子间作用力与物质的性质⑴了解化学键和分子间作用力的区别。
⑵了解氢键的存在对物质性质的影响,能列举含有氢键的物质。
⑶了解分子晶体与原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的区别。

高考结构化学知识点在高中化学教学中,结构化学是一个非常重要的内容。
它既是学生学习化学的基础,也是后续学习有机化学、无机化学和生物化学等领域的前提知识。
本文将重点介绍高考结构化学的知识点,帮助学生更好地复习和备考。
一、化学键化学键是物质中形成化合物的力量,可以分为离子键、共价键和金属键等。
离子键是由阳离子和阴离子之间的强烈电荷吸引形成的。
离子键的特点是固定方向性、高熔点和良好的导电性。
共价键是由共享电子对形成的,可以分为单共价键、双共价键和三共价键。
共价键的特点是共享电子对、共价长度和共价极性。
金属键是金属元素中原子与周围原子之间的电子云形成的强大吸引力。
金属键的特点是良好的导电性和变形性。
二、分子和离子分子是由两个或多个原子通过化学键结合而成的粒子。
在化学反应中,分子往往作为物质的最小单位参与。
比如水分子H2O是由氢原子和氧原子组成。
离子是具有电荷的原子或原子团,可以是带正电荷的阳离子或带负电荷的阴离子。
离子之间通常通过离子键结合形成离子晶体。
比如Na+和Cl-形成的离子晶体就是盐。
三、分子式和分子式分子式是用元素符号和下标表示化合物所含元素的种类和数量。
比如H2O表示水分子中有两个氢原子和一个氧原子。
分子式可以通过比例关系进行简化,例如NaCl表示氯化钠。
分子式有助于我们快速了解化合物的组成,也方便我们进行化学计算和反应方程式的编写。
四、同分异构体同分异构体是指分子式相同、结构式不同的化合物。
由于它们的分子组成完全相同,但结构不同,所以它们的化学特性也会有所不同。
同分异构体是现代有机化学的一个重要概念,对于理解有机物的性质和反应机理非常重要。
五、官能团官能团是有机化合物分子中具有一定特定性质和反应性的部分。
常见的官能团包括羟基、羰基、羧基、胺基、卤原子等。
官能团可以决定有机化合物的性质和反应性,为我们研究和分类有机物提供了重要的依据。
六、立体化学立体化学研究的是有机化合物中原子或基团的立体排布和空间结构。

全国高考结构化学知识点归纳高考化学是高中生命科学的一门重要学科,学生在备考高考时,结构化知识点的掌握是至关重要的。
本文将对全国高考结构化化学知识点进行归纳,共分为46个细分知识点。
1.元素和元素符号:理解元素的概念,掌握元素符号的命名规则。
2.原子结构:了解原子的结构,包括质子、中子、电子的分布。
3.元素周期表:熟悉元素周期表的排列规律和元素的分类。
4.分子和离子:区分分子和离子的概念,了解它们的化学性质。
5.化学键:掌握化学键的种类,了解共价键和离子键的形成。
6.化学方程式:掌握化学方程式的书写和平衡方法。
7.氧化还原反应:理解氧化还原反应的定义和特点,学会平衡氧化还原反应。
8.电负性:了解元素的电负性,掌握电负性对化学键性质的影响。
9.氣體的性质:了解气体的物理性质和化学性质,包括气体的压强、体积和温度的关系。
10.气体的混合物:理解气体混合物的概念,了解气体的分压定律。
11.气体的摩尔体积:掌握气体摩尔体积的计算方法和应用。
12.气体的状态方程:了解气体的状态方程,包括理想气体状态方程和实际气体状态方程。
13.气体的分子速度:了解气体分子速度与温度的关系,掌握气体分子速度的计算方法。
14.气体的扩散和扩散速率:熟悉气体的扩散过程和扩散速率的计算方法。
15.胞是板是区分烃类、卤代烃、醇、醚的基本区别,了解它们的性质和反应。
16.烃类的还原反应:了解烃类的还原反应,包括烃类的氧化和还原。
17.烃类的裂解反应:掌握烃类的裂解反应,了解裂解反应的产物。
18.烃类的取代反应:了解烃类的取代反应,包括烃类的卤代取代反应。
19.脂肪族与芳香族化合物:理解脂肪族和芳香族化合物的区别,了解芳香族化合物的特性。
20.烃类的物理性质:了解烃类的物理性质,包括沸点、熔点和密度。
21.卤代烃的制备和性质:掌握卤代烃的制备方法和性质,包括卤代烃的稳定性和反应性。
22.醇和醚的制备和性质:了解醇和醚的制备方法和性质,包括它们的溶解性和还原性。

⾼考化学全国卷Ⅰ专题———结构化学(含答案)⾼考专题之结构化学1. 铜及其化合物在⼈们的⽇常⽣活中有着⼴泛的⽤途。
回答下列问题:(1)铜或铜盐的焰⾊反应为绿⾊,下列有关原理分析的叙述正确的是_____(填字母)。
a.电⼦从基态跃迁到较⾼的激发态b.电⼦从较⾼的激发态跃迁到基态c.焰⾊反应的光谱属于吸收光谱d.焰⾊反应的光谱属于发射光谱(2)基态Cu原⼦中,核外电⼦占据的最⾼能层符号是_____,其核外电⼦排布式中未成对电⼦数为______个,Cu与Ag均属于IB族,熔点:Cu____Ag(填“>”或“<”)。
(3)[Cu(NH3)4]SO4中阴离⼦的⽴体构型是_________;中⼼原⼦的轨道杂化类型为__________,[Cu(NH3)4]SO4中Cu2+与NH3之间形成的化学键称为________________。
(4)⽤Cu作催化剂可以氧化⼄醇⽣成⼄醛,⼄醛中σ键和π键的⽐值为___________。
(5)碘、铜两种元素的电负性如表:CuI属于_______(填“共价”或“离⼦”)化合物。
(6)Cu 与Cl 形成某种化合物的晶胞如图所⽰,该晶体的密度为ρg·cm-3,晶胞边长为a cm,则阿伏加德罗常数为__________(⽤含ρ、a的2.ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和⽣产中有许多重要⽤途。
请回答下列问题:(1)S单质的常见形式为S8,其环状结构如下图所⽰,S原⼦采⽤的轨道杂化⽅式是____;(2)原⼦的第⼀电离能是指⽓态电中性基态原⼦失去⼀个电⼦转化为⽓态基态正离⼦所需要的最低能量,O、S、Se原⼦的第⼀电离能由⼤到⼩的顺序为___;(3)Se原⼦序数为____,其核外M层电⼦的排布式为____;(4)H2Se的酸性⽐H2S___(填“强”或“弱”)。
⽓态SeO3分⼦的⽴体构型为____,SO32-离⼦的⽴体构型为______;(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第⼀步⼏乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释;○1H2SeO4和H2SeO3第⼀步电离程度⼤于第⼆部电离的原因:______;○2H 2SeO 4和H 2SeO 3酸性强的原因:____________; 3.⼄炔是有机合成⼯业的⼀种原料。

高考化学结构知识点归纳总结化学结构是化学学科中的重要部分,涉及到物质的构成、组成以及性质等方面。
在高考化学考试中,结构知识点的掌握对于考生来说至关重要。
本文将对高考化学结构知识点进行归纳总结,帮助考生更好地准备考试。
一、元素与化合物的结构1. 元素的结构元素的结构由原子组成,原子由质子、中子和电子构成。
质子和中子位于原子核中,而电子则绕着核运动。
元素的结构决定了它的化学性质。
2. 化合物的结构化合物是由不同元素通过化学键结合而成的物质。
化合物的结构包括分子结构和晶体结构两种。
分子结构指的是化合物中原子通过共价键连接形成的分子,而晶体结构则指的是化合物的离子排列方式。
二、键的类型与性质1. 化学键的类型化学键根据电子云的共享情况可分为离子键、共价键和金属键三种。
离子键是由正离子和负离子之间的相互作用力形成的,共价键是由原子间电子云的重叠形成的,而金属键则是金属中自由电子的共享形成的。
2. 化学键的性质化学键的性质主要包括键长、键能和键级等。
键长是指两个原子之间的距离,键能是断裂化学键需要吸收的能量,而键级则指化合物中特定键的数量。
三、分子式与结构式1. 分子式分子式是用来表示化合物中原子种类和数量的简略符号。
分子式由元素符号和原子个数构成,根据不同元素之间的比例关系可以确定化合物的分子式。
2. 结构式结构式是用来表示分子中原子的排列方式和连接关系的符号。
结构式通过线段、化学键和它们之间的角度来表示原子的空间位置关系。
四、同分异构体同分异构体是指化学式相同、结构不同的化合物。
同分异构体的存在丰富了化学物质的多样性,并对化学性质和应用产生了重要影响。
1. 空间异构体空间异构体是指分子结构中原子或基团的空间位置不同,但它们的化学键相同。
空间异构体可以通过立体化学、手性等方面进行分类。
2. 功能异构体功能异构体是指分子结构中原子或基团的变化导致了不同的化学性质。
功能异构体主要包括官能团变化引起的异构体和骨架变化引起的异构体。

结构化学高考知识点一、化学键和分子式在结构化学中,我们首先需要了解化学键的概念和分子式的表达方式。
化学键是指原子之间的连接,可以通过共价键、离子键或金属键来实现。
分子式是用化学符号表示化合物中各种元素的种类和数量的表达方式。
1. 共价键:共享电子对的键,常见于非金属元素之间的化合物。
如氧气分子(O2)中的两个氧原子通过双键共享四个电子。
2. 离子键:电子从一个原子转移到另一个原子形成的键,常见于金属与非金属之间的化合物。
如氯化钠(NaCl)中的钠离子和氯离子通过离子键连接。
3. 金属键:形成于金属原子之间的键,金属中的电子可以自由移动。
金属键的存在使金属具有良好的导电性和导热性。
二、分子结构和分子模型分子结构是描述分子中原子排列方式的概念。
分子模型则是采用不同的模型来表示和研究分子结构。
下面介绍几种常见的分子模型:1. 杆状模型:将原子表示为小球,通过直线段连接表示化学键。
杆状模型可以清晰地展示分子中原子的连接方式。
2. 空间填充模型:在杆状模型的基础上,给原子和键填充上适当大小的球体,使整个模型更加立体化。
空间填充模型可以帮助我们更好地理解分子的三维结构。
3. 球棍模型:用小球表示原子,用棍子表示化学键,通过连接不同的小球和棍子来表示分子结构。
球棍模型是一种比较简单直观的模型。
三、化学键的性质了解化学键的性质对于理解化学反应和分子性质具有重要意义。
以下是几个常见的化学键性质:1. 极性键:由于原子对电子的亲密程度不同,共价键中电子的分布可能存在不均匀性,形成极性键。
极性键决定了分子的极性和化学性质。
2. 长键和短键:根据共价键中原子核之间的距离不同,可以形成长键和短键。
长键可见于不同原子间的键,而短键则常见于同一元素的键。
3. 强键和弱键:根据键的结合能力不同,可以将化学键分为强键和弱键。
强键包括共价键、离子键和金属键,而弱键包括氢键和范德华力等。
四、分子间相互作用力分子间相互作用力是指分子之间由于电荷分布不均匀而产生的相互作用力。

2014-2016年全国I 卷及全国Ⅱ卷结构化学及答案解析1、(2016新课标I 卷)[化学——选修3:物质结构与性质](15分) 锗(Ge )是典型的半导体元素,在电子、材料等领域应用广泛。
回答下列问题:(1)基态Ge 原子的核外电子排布式为[]Ar __________,有__________个未成对电子。
(2)Ge 与C 是同族元素,C 原子之间可以形成双键、叁键,但Ge 原子之间难以形成双键或叁键,从原子结构角度分析,原因是 。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因。
(4)2424Zn 、Ge 、O 电负性由大至小的顺序是____________________。
(5)Ge 单晶具有金刚石型结构,其中Ge 原子的杂化方式为__________,微粒之间存在的作用力是__________。
(6)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge 单晶的晶胞,其中原子坐标参数A 为()000,,;B 为11022⎛⎫ ⎪⎝⎭,,;C 为11022⎛⎫ ⎪⎝⎭,,。
则D 原子的坐标参数为 。
②晶胞参数,描述晶胞的大小和形状。
已知Ge 单晶的晶胞参数565.76pm a =,其密度为__________3g cm -⋅(列出计算式即可)。
【答案】(1)10223d 4s 4p ;2。
(2)Ge 原子半径较大,难以形成稳定的π键,不易形成双键或叁键。
(3)4GeCl 、4GeBr 、4GeI 的熔沸点依次上升。
因为其组成和结构相似的物质,随分子量增大,范德华力增大,熔沸点上升。
(4)O Ge Zn >>。
(5)3sp ,共价键。
(6)①111(,,)444;②231038736.0210(565.7610)-⨯⨯⨯⨯。
【解析】(1)锗位于硅的正下方,是(141832)+=号元素,核外电子排布为1022[Ar]3d 4s 4p 。
(2)双键、叁键与单键中均有σ键,但只有双键和叁键中存在π键。

高考化学知识点总结基本概念与基础理论:一、阿伏加德罗定律1.内容:在同温同压下,同体积的气体含有相同的分子数。
即“三同”定“一同”。
2.推论(1)同温同压下,V1/V2=n1/n2 同温同压下,M1/M2=ρ1/ρ2注意:①阿伏加德罗定律也适用于不反应的混合气体。
②使用气态方程PV=nRT有助于理解上述推论。
3、阿伏加德罗常这类题的解法:①状况条件:考查气体时经常给非标准状况如常温常压下,1.01×105Pa、25℃时等。
②物质状态:考查气体摩尔体积时,常用在标准状况下非气态的物质来迷惑考生,如H2O、SO3、已烷、辛烷、CHCl3等。
③物质结构和晶体结构:考查一定物质的量的物质中含有多少微粒(分子、原子、电子、质子、中子等)时常涉及希有气体He、Ne等为单原子组成和胶体粒子,Cl2、N2、O2、H2为双原子分子等。
晶体结构:P4、金刚石、石墨、二氧化硅等结构。
二、离子共存1.由于发生复分解反应,离子不能大量共存。
(1)有气体产生。
如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
(2)有沉淀生成。
如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
(3)有弱电解质生成。
如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN-、C17H35COO-、等与H+不能大量共存;一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;NH4+与OH-不能大量共存。
(4)一些容易发生水解的离子,在溶液中的存在是有条件的。
如AlO2-、S2-、CO32-、C6H5O-等必须在碱性条件下才能在溶液中存在;如Fe3+、Al3+等必须在酸性条件下才能在溶液中存在。
高考化学结构知识点总结在高考化学考试中,结构知识是非常重要的一部分。
掌握了结构知识,可以帮助我们更好地理解和应用化学原理,提高解题能力。
本文将对高考化学结构知识点进行总结,帮助同学们系统地复习和掌握这些重要内容。
一、原子结构1. 原子的组成:原子由质子、中子和电子组成,质子和中子位于原子核中,电子绕核运动。
2. 质子数和原子序数:质子数等于原子核中的质子数,也等于电子的数目,而原子序数等于元素的质子数。
3. 原子的电子层结构:原子的第一层最多容纳2个电子,第二层最多容纳8个电子,第三层最多容纳18个电子。
4. 原子核的作用:原子核带正电荷,决定了原子的化学性质。
二、化学键1. 离子键:由正负离子之间的电荷吸引力形成,通常在金属和非金属之间形成。
2. 共价键:由共用电子对形成,通常在非金属之间形成。
3. 价键键能:化学键的强度取决于键能,键能越大,化学键越稳定。
4. 杂化轨道:在共价键的形成过程中,原子的s和p轨道杂化形成新的杂化轨道,以适应键形成的需要。
三、分子结构1. 分子的几何构型:分子的几何构型决定了分子的性质,包括线性、三角形、四面体、平面等。
2. 极性分子和非极性分子:分子中的原子围绕中心原子排列对称,则分子是非极性的;如果原子围绕中心原子排列不对称,则分子是极性的。
极性分子具有极性键,有较高的沸点和溶解度。
四、有机化学结构1. 烷烃:由碳和氢原子组成的分子,分子中只有单键。
根据碳原子数目,可以分为甲烷、乙烷、丙烷等。
2. 单元式:有机化合物的最简单形式,例如甲醇、乙醇、乙酸等。
3. 功能团:有机化合物中使其具有某种特定性质或反应活性的官能团,例如羟基、羧基、酮基等。
4. 同分异构体:分子式相同但结构不同的有机化合物称为同分异构体。
五、高分子化合物1. 高分子化合物:由大量重复单元组成的大分子化合物,如聚合物、纤维素等。
2. 聚合反应:将较小的单体分子通过化学反应连接成高分子化合物的过程。
高考化学必考结构知识点化学作为一门实验性科学,涉及到物质的组成、变化以及性质等多个方面。
在高考中,学生需要掌握并理解一些基础的结构知识点,以便在考试中能够正确解答与结构相关的问题。
下面将逐一介绍几个高考化学必考的结构知识点。
一、原子结构原子是构成物质的基本单位,了解原子结构对于理解物质的性质具有重要意义。
原子由质子、中子和电子组成。
质子和中子位于原子核中,电子则在原子核外围的轨道上运动。
质子的电荷为正电荷,质量约为1 Dalton(质子与中子的质量约为相同),而电子的电荷为负电荷,质量较轻,约为1/1836 Dalton。
并且,质子和中子的质量之和约等于原子的相对原子质量。
二、分子结构分子是由两个或更多原子以化学键结合而成的。
分子的结构对于物质的性质具有重要影响。
化学键可以分为共价键和离子键。
共价键是由共享电子对形成的,常见的有单共价键、双共价键和三共价键。
离子键则是由正负离子间的电荷吸引力形成的,通常由金属与非金属元素的结合产生。
三、物质晶体结构晶体是由大量离子、原子或分子按照一定规律有序排列形成的固体。
晶体结构的三个基本要素是晶胞、晶格和晶系。
晶胞是最小的对称单位,晶格是晶体内有序排列的晶胞构成的结构,而晶系是根据晶胞的对称性质将晶体分为七种不同的组别。
四、有机化合物的结构有机化合物是碳与氢以及其他元素形成的化合物,是生命体系中最基本的结构。
有机化合物的结构可以通过分子式、结构式以及键盘式来表示。
结构式能够展示出分子中的键和原子之间的关系,而键盘式可以帮助我们更好地理解分子中的原子和键的空间位置。
总结起来,高考化学中涉及的结构知识点主要包括原子结构、分子结构、物质晶体结构以及有机化合物的结构。
理解这些知识点有助于学生对物质的组成、变化以及性质有更深入的认识。
在备考过程中,学生可以通过反复训练掌握这些知识点的应用,提高答题的准确性和速度。
同时,化学是一门实践性强的科学,学生也应该注重实验训练,通过实践加深对结构知识点的理解和应用能力。
高考化学全国卷Ⅰ专题———化学分子(含答案)高考化学全国卷Ⅰ专题———化学分子(含答案)概述本专题将重点讲解高考化学全国卷第一卷中与化学分子相关的知识点。
化学分子是化学中最基本的单位,了解化学分子的结构和性质对于理解化学反应和物质变化至关重要。
1. 化学分子的定义和组成* 化学分子是由两个或更多原子通过共价键连接而成的粒子。
* 化学分子的组成原子可以是同种元素或不同种元素。
* 化学分子的组成确定了其化学性质和反应能力。
2. 化学式和分子式* 化学式是用化学符号表示化学物质的种类和元素的相对数量。
* 分子式是化学式中表示化学分子组成的子式。
3. 分子的结构与性质* 化学分子的结构由其中原子的种类和相互连接方式决定。
* 分子的大小、形状和极性等性质直接影响其物理和化学性质。
4. 化学分子的命名* 有机化合物的命名遵循一定的命名规则,如碳氢化合物的命名需要指明其基本结构和取代基的位置。
* 无机化合物的命名通常根据其组成元素和化学性质进行命名。
5. 基本的化学反应* 化学反应是指化学分子之间的物质转化过程。
* 化学反应的类型包括氧化还原反应、酸碱中和反应、置换反应等。
6. 化学分子的应用* 化学分子的应用广泛,涵盖了材料科学、医药科学、环境科学等领域。
* 化学分子的研究和应用对于人类社会的发展和进步有着重要的作用。
为了更好地掌握化学分子相关的知识点,建议学生多进行题训练和实验探究,加深对化学分子的理解和应用能力。
> 答案:> 1. A> 2. C> 3. B> 4. D> 5. A以上是关于高考化学全国卷Ⅰ专题———化学分子的简要介绍和答案。
希望对您有所帮助!(字数:205)。
第1讲:原子结构【知识要求】1.认识人类探索原子结构奥秘经历的历史阶段和过程2.了解人类认识元素经历过的两个阶段:建立在道尔顿原子论基础上的元素概念和建立在同位素基础上的元素概念3.了解人类对相对原子质量概念的认识及变化【知识归纳】第1部分:知识背景●化学的研究对象:化学是研究物质的组成、结构、性质及其变化规律的一门科学●化学与人类的“衣、食、住、行”息息相关。
●化学发展进程古代化学——实用技术(冶金、火药、造纸、酿造等)↓近代化学——原子—分子论(发现大量元素、揭示元素周期律、合成物质大量涌现)↓现代化学——物质结构理论(对物质的研究深入到分子原子水平、向材料、能源、环境、生命等科学渗透)●衔接①高中化学和初中化学的知识点是一个完整的体系。
高中化学知识是在初中知识基础上的深入和展开。
②中考属于基础性考试,而高考属于选拔性考试,因此高中的考试要难于初中。
③高中三年中,学习方法的提升对学习效率至关重要。
【化学——人类进步的关键】这句话引自美国核化学家、1951 年诺贝尔化学奖获得者西博格(Glenn TheodoreSeaborg,1912~1999)教授,在1979年美国化学会成立100周年大会上的精辟论述。
第2部分:原子结构的发现历程:从葡萄干面包模型到原子结构的行星模型1、惠施,战国时期,“一尺之棰,日取其半,万世不竭”他认为物质是无限可分的;2、墨子,春秋末期,“物质分割是有条件的”。
3、德谟克利特,古希腊:认为物质分割能到原子为止。
即原子是构成物质的最小粒子。
4、道尔顿,英国,原子论:①化学元素有不可再分的微粒构成;②原子在化学变化中均保持不可再分性;③同一元素的原子在质量和性质上都相同,不同元素的原子在质量和性质上都不同;④不同元素化合时,这些元素的原子按简单的整数比结合成化合物。
19世纪后期,随着科技的进步,越来越多的发现让人们熟知,掀起一股科研高潮:5、伦琴,德国,X射线;贝克勒尔,法国,放射性发现;居里夫人,波兰裔法国科学家,发现了镭和钋。
结构化学知识点汇总结构化学是一门研究原子、分子和晶体结构以及结构与性能之间关系的学科。
它为我们理解物质的性质和化学反应提供了基础。
以下是对结构化学中一些重要知识点的汇总。
一、原子结构1、玻尔模型玻尔提出了原子的行星模型,认为电子在特定的轨道上绕核运动,轨道具有固定的能量。
2、量子力学模型薛定谔方程是描述微观粒子运动状态的基本方程。
电子具有波动性和粒子性,其运动状态用波函数来描述。
3、原子轨道原子轨道是波函数的数学表达式,常见的有 s、p、d、f 轨道。
4、电子排布遵循能量最低原理、泡利不相容原理和洪特规则,电子依次填充不同的原子轨道。
二、分子结构1、价键理论认为原子通过共用电子对形成共价键,包括σ 键和π 键。
2、杂化轨道理论原子在形成分子时,轨道会杂化,形成等性杂化和不等性杂化。
3、价层电子对互斥理论用于预测分子的几何构型,根据中心原子的价层电子对数和孤电子对数来判断。
4、分子轨道理论将分子看作一个整体,电子在分子轨道中运动,分子轨道有成键轨道和反键轨道。
三、化学键1、离子键由正负离子之间的静电引力形成,通常在金属和非金属元素之间形成。
2、共价键原子间通过共用电子对形成,具有方向性和饱和性。
3、金属键金属原子通过自由电子形成的化学键,具有良好的导电性和导热性。
4、氢键一种特殊的分子间作用力,比范德华力强,但比化学键弱。
四、晶体结构1、晶体的分类根据晶体中粒子的排列方式,可分为离子晶体、原子晶体、分子晶体和金属晶体。
2、晶胞晶体的基本重复单元,通过晶胞可以研究晶体的结构和性质。
3、晶体的堆积方式如金属晶体的面心立方堆积、体心立方堆积等。
4、晶体的缺陷包括点缺陷、线缺陷和面缺陷,对晶体的性能有重要影响。
五、结构与性能的关系1、熔点和沸点与晶体类型和化学键的强度有关。
2、硬度和强度与晶体的结构和化学键的类型有关。
3、导电性和导热性金属晶体具有良好的导电性和导热性,而离子晶体在熔融或溶液状态下导电。
4、光学性质晶体的结构会影响其对光的折射、反射和吸收。
高考化学结构化学知识点化学是一门科学,研究物质组成、性质和变化规律的科学。
而在高考中,结构化学是化学中的重要知识点之一。
结构化学研究物质的空间结构、分子的构成及其之间的相互作用。
接下来,我们将深入探讨高考中的结构化学知识点。
一、原子结构结构化学的起点是原子结构,它是构成物质的基本单元。
元素周期表是化学家们长期研究得出的重要成果。
元素周期表以其规律性和统一性而获得广大化学家的认可。
根据元素周期表,我们可以了解到不同元素的原子组成和结构特征,例如原子序数、原子量等。
二、分子结构分子是元素或化合物的最小化学单位,是由原子通过化学键结合而成。
在结构化学中,我们需要了解分子中原子的排列方式以及化学键的性质。
其中,共价键是最常见的化学键,两个或更多原子通过共用电子对结合在一起。
离子键是由带电离子之间的相互吸引所形成的。
金属键则是由金属原子之间的电子云相互作用所形成的。
三、键长和键能键长和键能是结构化学中的重要概念。
键长指的是两个相邻原子核之间的距离,键能则是化学键形成时释放或吸收的能量。
键长和键能与化学键的强度相关,例如,较短的键长和较大的键能表示较强的化学键。
四、分子构象分子构象是指分子在空间中的排列方式。
由于化学键的旋转和振动,许多分子具有不同的构象。
分子构象对于研究分子的性质和反应机制非常重要。
例如,立体异构体是指具有相同分子式但空间结构不同的分子,它们可能具有不同的物理和化学性质。
五、化学反应化学反应是物质之间发生的变化过程,是结构化学研究的核心内容之一。
在高考中,我们需要了解不同化学反应的机理和分类。
化学反应的速率、平衡和能量变化等也是结构化学的重要方面。
六、配位化学配位化学研究的是金属离子和其他原子或分子之间的相互作用。
通常,金属离子由配位体与之配对形成配合物。
在高考中,配位化学是一个重要的考点,我们需要了解金属配合物中金属离子的电子结构以及配位体对其形成稳定配合物的影响。
七、分子轨道理论分子轨道理论是研究分子的电子结构的关键理论之一。
考点逐项过关考点1﹒电子排布式和电子轨道示意图1.能层、能级和最多容纳电子数之间的关系各能层(1)轨道形状:①s电子的原子轨道呈球形。
②p电子的原子轨道呈纺锤形。
(2)能量关系:①相同能层上原子轨道能量的高低:n s<n p<n d<n f。
②形状相同的原子轨道能量的高低:1s<2s<3s<4s…③同一能层内形状相同而伸展方向不同的原子轨道如n p x、n p y、n p z 的能量相等。
3.原子核外电子的排布规律三个原理:①能量最低原理:原子核外电子排布遵循构造原理,使整个原子的能量处于最低状态。
构造原理示意图如上图1。
②泡利原理:在一个原子轨道里最多只能容纳2个电子,而且自旋状态相反。
③洪特规则:电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同。
4.电子的跃迁与原子光谱(1)电子的跃迁:①基态→激发态:当基态原子的电子吸收能量后,会从低能级跃迁到较高能级_,变成激发态原子。
②激发态→基态:激发态原子的电子从较高能级跃迁到低能级时会释放出能量。
(2)原子光谱:不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素原子的吸收光谱或发射光谱,总称原子光谱。
基态原子核外电子排布的表示方法【过关练习】1.基态B原子的电子排布式为_________________________________2.基态氮原子的价电子排布式是_________________________________3.基态Mn2+的核外电子排布式为________________________________4.Se的其核外M层电子的排布式为____________________________5.Ni2+的价层电子排布图为________________________________6.基态镓(Ga)原子的电子排布式为_____________________________7.三价铁离子的电子排布式为______________________________8.Cu的价层电子轨道示意图为_____________________________9.P原子的核外电子排布式为_______________________________答案:1.1s22s22p1 2.2s22p3 3.1s22s22p63s23p63d5或[Ar]3d54.3s23p63d10 5.6.1s22s22p63s23p63d104s24p17.1s22s22p63s23p63d5 8.9.1s22s22p63s23p3(或[Ne] 3s23p3)考点2﹒电负性和第一电离能大小比较元素第一电离能的递变性ⅡA族元素的第一电离能大于ⅢA族元素的第一电离能,ⅤA族元素的第一电离能大于ⅥA族元素的第一电离能。
(1)特例当原子核外电子排布在能量相等的轨道上形成全空(p0、d0、f0)、半充满(p3、d5、f7)和全充满(p6、d10、f14)的结构时,原子的能量较低,为稳定状态,该元素具有较大的第一电离能,如:第一电离能,Be>B;Mg>Al;N>O;P>S。
(2)应用①判断元素金属性的强弱。
电离能越小,金属越容易失去电子,金属性越强;反之越弱。
②判断元素的化合价。
如果某元素的I n+1≫I n,则该元素的常见化合价为+n,如铝元素I4≫I3,所以铝元素的化合价为+3。
而过渡元素的价电子数较多,且各级电离能之间相差不大,所以常表现多种化合价,如锰元素有+2价~+7价。
元素电负性的递变性(1)规律①同一周期,从左到右,元素的电负性递增;②同一主族,自上到下,元素的电负性递(2)应用①确定元素类型(电负性>1.8,非金属元素;电负性<1.8,金属元素);②确定化学键类型(两元素电负性差值>1.7,离子键;两元素电负性差值<1.7,共价键);③判断元素价态正负(电负性大的为负价,小的为正价);④电负性是判断元素金属性和非金属性强弱的重要参数之一。
电离能与电子的分层排布一般来说,对于一个原子I1<I2<I3<……这很容易理解,因为从正一价的气态阳离子中去掉一个电子需克服的电性引力比从中性原子中掉一个电子要大,消耗的能量就更多。
因此,一个原子的电离能是依次增大的,甚至是成倍增长,但增大的倍数并不相同。
有的增大的多,有的增大的很多(逐级递增,存在突跃)。
我们结合下表说明:Na,I3比I2增大不到一倍,但I2比I1却增大了近百倍。
这说明I1比I2、I3小得多,说明有一个电子能量较高,在离核较远的区域运动,容易失去。
另外的几个电子能量较低,在离核较近的区域运动。
Mg,按照上面的分析,I2比I1增大不到一倍、I4比I3增大不到一倍,但I3比I2却增大了好几倍。
因此可认为有两个电子能量较高,在离核较远的区域运动,另外的几个电子能量较低,在离核较近的区域运动。
至于Al元素,请同学自己分析一下。
通过分析电离能的数据,我们也可以看到I4比I3增大了好几倍,在多电子原子中,电子是分层排布的。
金属活动顺序与电离能大小顺序不一致的原因我们知道金属活动顺序中Ca元素排在Na元素的前面,而我们查的第一电离能的数据发现,钠元素的I1=496kJ/mol,钙元素的I1=590kJ/mol;I2=1145kJ/mol。
为什么第一电离能表现出来的金属性顺序与金属活动性顺序表现出来的不一样呢?其实,这是因为两个概念表达的内容不同并且测量的手段也不一样,金属活动性顺序指的是水溶液中金属单质中的原子失去电子的难易程度。
而电离能指的是气态的金属原子失去电子成为气态阳离子的能力,它是金属原子在气态时的活泼型量度。
二者所对应的条件不同,所以二者不可能完全一致。
由此可以知道,我们在分析某个问题时,一定要注意具体的条件。
对角线规则Li与Mg,Be与Al,B与Si这三对元素在周期表中处于对角线位置,相应的两元素及其化合物的性质有许多相似之处,这种相似性称为对角线规则。
Li与Mg的相似性★锂和镁在过量的氧气中燃烧均生成正常氧化物,而不是过氧化物★锂、镁都能与氮气直接化合而生成氮化物★锂、镁与水反应均较缓慢★锂、镁的氟化物、碳酸盐、磷酸盐均难溶于水★锂、镁的碳酸盐在加热时均能分解为相应的氧化物和二氧化碳★锂、镁的氯化物均能溶于有机溶剂中,表现出共价特性值得注意的是,锂的金属性比镁强,氢氧化锂为强碱,氢氧化镁为中强碱,锂与水反应平缓不剧烈,镁则缓慢,氢氧化锂易溶,20度是溶解度12.8g,氢氧化镁难溶20度时溶解度0.00095gBe与Al的相似性★铍、铝都是两性金属,既能溶于酸,也能溶于强碱★铍和铝都能被冷的浓硝酸钝化★铍和铝的氧化物均是熔点高、硬度大的物质★铍和铝的氢氧化物Be(OH)2>Al(OH)3,都是两性氢氧化物,而且都难溶于水B与Si的相似性★硼与硅的含氧酸盐都能形成玻璃且互熔★单质的制备,与酸碱的作用,氢化物的制备与性质等都相似★硼和硅的卤化物水解性也相似SiCl4+4H2O=H4SiO4+4HC1、BC13+3H2O=H3BO3+3HC1【过关练习】1﹒试用“>”、“<”、“=”表示元素C、N、O、Si的下列关系:(用元素符号表示,下同)(1)第一电离能:___________________________________(2)电负性:_______________________________________(3)非金属性:_____________________________________2﹒比较大小(1)第一电离能C、N、O、Si____________________ He、N、P、F____________________ (2)电负性Na、Mg、Al_____________________ O、S、P____________________答案:1﹒(1)N>O>C>Si (2)O>N>C>Si (3)O>N>C>Si2﹒(1)Si<C<O<N P<N<F<He (2)Na<Mg<Al P<S<O考点3﹒杂化方式、键角、构型、分子中σ键数的判断分子或离子的空间构型及杂化方式的判断方法一、价层电子对互斥理论分子或离子的空间构型与中心原子的价层电子对数目有关;价层电子对=成键电子对+孤对电子对;价层电子对尽可能远离,以使斥力最小。
1.杂化轨道类型的判断方法(1)看中心原子有没有形成双键或三键,如果有1个三键,则其中有2个π键,用去了2个p轨道,则为sp杂化;如果有1个双键则其中有1个π键,则为sp2杂化;如果全部是单键,则为sp3杂化。
(2)由分子的空间构型结合价电子对互斥理论判断。
没有填充电子的空轨道一般不参与杂化,1对孤电子对占据1个杂化轨道。
如NH3为三角锥形,且有一对孤电子对,即4个杂化轨道应呈四面体形,为sp3杂化。
(3)价电子法:对于AB m型分子,若A原子的价电子数目有x个,B原子的价电子数目有y个,则杂化轨道数目=(x+my)/2。
例如CH4杂化轨道数目=(4+4×1)/2=4,则碳原子为sp3杂化。
使用这个公式计算杂化轨道数目时:当O和S元素作为中心原子时提供6个电子,作为配位原子时提供0个电子;而F、Cl、Br、I等原子作为中心原子时提供7个电子,而作为配位原子时提供1个电子。
例如:CO2中中心碳原子的杂化轨道数目=(4+0×2)/2=2,则为sp杂化;又如BF3中中心硼原子的杂化轨道数目=(3+3×1)/2=3,则硼原子为sp2杂化。
(4)公式法:多原子的离子也可使用这个公式计算。
需要对阳离子(或阴离子)减去(或加上)所带电荷。
例如NH+4中N原子的杂化轨道数目=(5+4×1-1)/2=4,则N原子的杂化方式为sp3杂化;又如H3O+中。
原子的杂化轨道数目=(6+1×3-1)/2=4,则O 原子的杂化方式为sp3杂化;再如SO2-4中S原子的杂化轨道数目=(6+0+2)/2=4,则S 原子的杂化方式为sp3杂化。
2.价层电子对的空间构型由于价层电子对之间的相互排斥作用,它们趋向于尽可能的相互远离,于是价层电子对的空间构型与价层电子对数目关系如下3.分子空间构型价层电子对有成键电子对和孤对电子对之分,中心原子周围配位原子(或原子团)数,即AB n中n值就是成键对数,价层电子对的总数减去成键对数,得孤对电子对数。
若孤对电子对=0:分子的构型等于电子对的空间构型,孤对电子对≠0:分子的构型不同于电子对的空间构型。
相关:孤对-孤对>孤对-键对>键对-键对。
因此价层电子对空间构型为正三角形和正四面体时,孤对电子对对成键电子对斥力较大,使成键电子对夹角变小,所以SnBr2的键角应小于120°,NH3、H2O分子的键角应小于109.5°。