电能转化为化学能
- 格式:ppt
- 大小:2.56 MB
- 文档页数:19



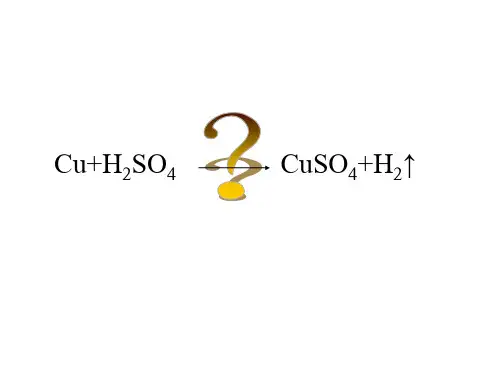

由电能转化为化学能的例子
电能转化为化学能的例子有:电解池,如氯碱工业、精炼金属、电镀等。
电动车在充电过程中,也是将电能转变为化学能储存在蓄电池中。
利用电池作为能量来源,可以得到具有稳定电压,稳定电流。
电能也可转换成其他所需能量形式,如热能、光能、动能等等。
电能可以靠有线或无线的形式,作远距离的传输。
三、电能单位电能的单位是“度”,它的学名叫作千瓦时,符号kw·h。
在物理学中,更常用的能量单位(也就是主单位,有时也叫国际单位)是焦耳,简称焦,符号是J。
电能指电以各种形式做功的能力(所以有时也叫电功)。
分为直流电能、交流电能,这两种电能均可相互转换。
电能,是指电以各种形式做功(即产生能量)的能力。
电能被广泛应用在动力、照明、冶金、化学、纺织、通信、广播等各个领域,是科学技术发展、国民经济飞跃的主要动力。
化学能主要作用:各种物质都储存有化学能。
不同的物质不仅组成不同、结构不同,所包含的化学能有不同。
在化学反应中,既有化学物中化学键的断裂,又有生成物中化学键的形成。
那么,一个确定的化学反应完成后的结果是吸收能量还是放出能量,决定于反应物的总能量于生成物的总能量的相对大小。
1。



《电能转化为化学能—电解》电解原理揭秘在我们的日常生活和工业生产中,电能与化学能之间的相互转化扮演着至关重要的角色。
其中,电解作为一种将电能转化为化学能的重要手段,具有广泛的应用和深刻的原理。
让我们先来了解一下什么是电解。
简单来说,电解就是在直流电的作用下,使电解质溶液或熔融电解质中的离子发生定向移动,并在电极上发生氧化还原反应的过程。
这个过程中,电能被转化为化学能,从而实现物质的合成、分解或者提纯。
为了更深入地理解电解原理,我们需要先认识电解质。
电解质是在水溶液或熔融状态下能够导电的化合物。
它们在溶液中或熔融状态下能够解离成自由移动的离子,这些离子在电场的作用下会定向移动。
当我们将两个电极插入电解质溶液中,并接通直流电源时,就形成了一个电解池。
电解池中与电源正极相连的电极称为阳极,与电源负极相连的电极称为阴极。
在阳极上,发生氧化反应,即失去电子的反应;在阴极上,则发生还原反应,即得到电子的反应。
以电解氯化铜溶液为例。
氯化铜在水溶液中会解离成铜离子(Cu²⁺)和氯离子(Cl⁻)。
当接通电源后,在阴极上,铜离子得到电子被还原为铜单质,反应式为:Cu²⁺+ 2e⁻= Cu。
而在阳极上,氯离子失去电子被氧化为氯气,反应式为:2Cl⁻ 2e⁻= Cl₂↑。
在电解过程中,离子的迁移和放电顺序是有一定规律的。
一般来说,在阴极上,金属离子的放电顺序与金属活动性顺序相反。
也就是说,越不活泼的金属离子越容易先得到电子被还原。
而在阳极上,通常是阴离子的放电顺序为:S²⁻> I⁻> Br⁻> Cl⁻> OH⁻>含氧酸根离子。
电解的应用非常广泛。
在工业上,电解可以用于金属的冶炼,如电解熔融的氯化钠制取金属钠,电解氧化铝制取金属铝等。
此外,电解还可以用于电镀,通过在阴极上沉积金属,从而在物体表面形成一层均匀、致密的金属镀层,起到保护和装饰的作用。
在化学研究中,电解也有着重要的意义。
通过电解实验,我们可以研究物质的氧化还原性质,探究化学反应的机理等。



《电能转化为化学能——电解》说课稿尊敬的各位评委老师:大家好!今天我说课的题目是“电能转化为化学能——电解”。
下面我将从教材分析、学情分析、教学目标、教学重难点、教法与学法、教学过程以及教学反思这几个方面来展开我的说课。
一、教材分析“电能转化为化学能——电解”这一内容是人教版高中化学选修 4《化学反应原理》中的重要组成部分。
它是在学生已经学习了氧化还原反应、原电池等知识的基础上,进一步深入探讨化学能与电能之间的相互转化。
通过对电解原理的学习,不仅可以帮助学生深化对电化学知识的理解,还能为后续学习金属的腐蚀与防护等内容奠定基础。
本节课的教材内容主要包括电解的概念、电解池的构成条件、电解原理以及电解的应用等。
教材通过实验探究和理论分析相结合的方式,引导学生逐步理解电解的本质和规律。
二、学情分析学生在之前的学习中已经掌握了氧化还原反应的基本概念和原电池的工作原理,具备了一定的化学知识基础和分析问题的能力。
然而,对于电解这一较为抽象的概念和原理,学生可能会感到理解困难。
此外,学生在实验操作和数据处理方面的能力还有待提高。
1、知识与技能目标(1)理解电解的概念,掌握电解池的构成条件。
(2)理解电解原理,能够正确书写电解池的电极反应式和总反应式。
(3)了解电解在工业生产中的应用。
2、过程与方法目标(1)通过实验探究,培养学生的观察能力、实验操作能力和分析问题的能力。
(2)通过对电解原理的分析,培养学生的逻辑思维能力和抽象概括能力。
3、情感态度与价值观目标(1)激发学生学习化学的兴趣,培养学生的创新精神和实践能力。
(2)培养学生的环保意识和可持续发展观念。
四、教学重难点1、教学重点(1)电解池的构成条件和工作原理。
(2)电极反应式和总反应式的书写。
(1)电解原理的理解。
(2)离子在电解池中的放电顺序。
五、教法与学法1、教法(1)实验探究法:通过实验让学生直观地感受电解的现象,从而引导学生思考和探究电解的原理。
电能转化为化学能的原子尺度的微观机制电能转化为化学能是一种常见的能量转换过程,常见于电池和电解池等设备中。
这一转化过程涉及到原子尺度的微观机制,其中包括电子的传递和原子的化学反应。
本文将从电子传递和化学反应两个方面探讨电能转化为化学能的微观机制。
我们来看电子的传递过程。
在电池和电解池中,电子从一个物质转移到另一个物质,实现了电能到化学能的转化。
这个过程涉及到电子在原子尺度上的运动和转移。
在电池中,电子从负极(阳极)通过导线传递到正极(阴极)。
在这个过程中,电子经过导线中的原子和分子,通过与它们的电子云相互作用,实现了电子的传递。
这个过程可以类比为一个热传导过程,通过原子和分子之间的碰撞和相互作用,电子从一个物质转移到另一个物质。
在电解池中,电子从外部电源通过电解质溶液中的离子传递到电极上。
这个过程涉及到离子的溶解和再结晶,以及电子和离子之间的反应。
电子的传递过程是电能转化为化学能的重要环节,它决定了能量转化的效率和速率。
我们来看化学反应过程。
在电能转化为化学能的过程中,化学反应是不可或缺的环节。
化学反应涉及到原子和分子之间的键的形成和断裂,以及化学键能的转化。
在电池中,正极和负极之间的化学反应导致了电子的传递和化学能的转化。
这个过程涉及到氧化还原反应、酸碱中和反应等多种类型的化学反应。
在电解池中,电解质溶液中的离子在电极上发生氧化还原反应,从而实现了电子的传递和化学能的转化。
化学反应的微观机制是电能转化为化学能的关键,它决定了能量转化的种类和产物。
电能转化为化学能的原子尺度的微观机制包括电子的传递和化学反应两个方面。
电子的传递涉及到电子在原子尺度上的运动和转移,通过与原子和分子的相互作用实现了电子的传递。
化学反应涉及到原子和分子之间的键的形成和断裂,以及化学键能的转化,从而实现了电能到化学能的转化。
电能转化为化学能的微观机制是一个复杂的过程,涉及到多个环节和多个因素的相互作用。
深入理解这一过程的微观机制,对于设计和优化电池和电解池等设备,提高能量转化效率具有重要意义。
电能转化为化学能——电解课标解读要点网络了解电解池的构成、工作原理及应用,能书写电极反应式和总反应方程式。
电解原理及其规律1.电解让直流电通过电解质溶液或熔融的电解质,在两个电极上分别发生氧化反应和还原反应的过程。
注意:电解与电离的区别①电解需通电才能进行而电离不需通电就能进行。
②电解是化学变化;而电离是在水中或熔融状态下断键离解为离子,属于物理变化。
2.电解池及其工作原理(1)概念:电解池是将电能转化为化学能的装置。
(2)构成条件①有与外接直流电源相连的两个电极。
②电解质溶液(或熔融电解质)。
③形成闭合回路。
(3)电解池工作原理(以电解CuCl2溶液为例)(4)电解池中电子和离子的移动 ①电子:从电源负极流出后,流向电解池阴极;从电解池的阳极流向电源的正极。
电子不能通过电解质溶液。
②离子:阳离子移向电解池的阴极,阴离子移向电解池的阳极。
③电流:从电源的正极流出,流入阳极,再通过电解质溶液流入阴极,最后流向负极,形成闭合回路。
3.阴阳两极上放电顺序(1)阴极:(与电极材料无关)。
氧化性强的先放电,放电顺序为――――――――――――――――――――――――――――――――――――――――→K +、Ca 2+、Na +、Mg 2+、Al 3+、Zn 2+、Fe 2+、Sn 2+、Pb 2+、H +、Cu 2+、Fe 3+、Ag +放电由难到易(2)阳极:若是活性电极作阳极,则活性电极首先失电子,生成金属阳离子,发生氧化反应。
若是惰性电极作阳极,放电顺序为――――――――――――――――――――――――――――――――→S 2-、I -、Br -、Cl -、OH -、含氧酸根离子(NO -3、SO 2-4、CO 2-3)、F -放电由易到难注意:①放电指的是电极上的得、失电子。
②活性电极指的是除去Au 、Pt 以外的金属,惰性电极指的是Pt 、Au 、C 电极,不参与电极反应。
③阴极材料若为金属电极,一般是增强导电性但不参与反应。
将电能转化为化学能的例子
1. 电池充电呀,这可是个超常见的将电能转化为化学能的例子!就像手机电池,你给它插上充电器,电就一点点存进去了,这不就是把电能变成了电池里可以储存的化学能嘛!哇塞,是不是很神奇?
2. 电解水制氢气,这也很厉害呢!通过电能把水分解成氢气和氧气,这过程不就像是一个魔法么,电能神奇地把水变了样,转化成了充满能量的化学物质,太酷了吧!
3. 电镀啊,比如给一些金属物品镀上一层其他金属。
电能让那些金属离子乖乖地附着在物品表面,形成好看又实用的镀层,这简直就是电能在大显神通,把能量转化为实实在在的化学变化呀!你说有趣不有趣?
4. 电动汽车的电池,那可是关键呀!在路上跑的时候消耗电能,停下来充电又把电能转化为化学能储存起来,这不就跟我们人吃东西储存能量一样嘛,只不过它储存的是化学能呢!
5. 铅酸蓄电池呀,好多设备都要用它。
电进去后被转化成能长期保存的化学能,等到需要的时候又能释放出来,这多像一个能量宝库呀,电能就是打开宝库的钥匙!
6. 电解食盐水生产氯气和烧碱,这也是电能的杰作呢!看着电能把普通的食盐水变得如此不同,转化出各种有用的化学物质,真的会让人惊叹不已呀!
7. 镍镉电池也是个典型呀!它能把电能好好地收藏起来变成化学能,随时准备为我们服务呢。
就像一个忠诚的小伙伴,默默地把电能转化好等待我们的召唤,是不是挺棒呀?
总之,将电能转化为化学能的例子就在我们身边,给我们的生活带来了很多便利和惊喜呢!。
电能与化学能之间的转换过程引言电能和化学能是我们日常生活中常见的能量形式。
电能可以通过电流进行利用,而化学能则储存在化学物质中。
本文将探讨电能与化学能之间的转换过程,并介绍几种常见的转换方式。
电能和化学能的定义电能是指由电荷运动带来的能量,它可以通过电流的流动进行释放。
化学能是指储存在化学物质中的能量,它可以通过化学反应进行释放。
电能和化学能都属于一种形式能,可以相互转换。
1. 电解电解是将电能转化为化学能的一种常见方式。
电解通过在电解质溶液中加入电流,使得溶解在溶液中的化学物质发生化学反应。
在电解过程中,正极吸收电子,负极释放电子,导致溶液中的化学物质发生电离和析出。
这个过程中,电能被转化为化学能,储存在生成的产物中。
2. 电池电池是将化学能转化为电能的装置,也可以实现电能向化学能的转换。
电池由两个电极和电解质组成。
电极由不同的材料制成,形成正极和负极。
电解质可以是液体、凝胶或固体。
当电池接通外部电路时,电解质中的化学物质发生氧化还原反应,电子从负极流经外部电路到正极,形成电流。
这个过程中,化学能被转换为电能。
1. 燃烧燃烧是将化学能转化为热能和电能的过程。
当有机物或其他可燃物与氧气发生化学反应时,会产生大量的热能。
这个热能可以用来蒸汽发电、驱动发动机等。
同时,在某些情况下,燃烧还可以直接产生电能。
例如,燃料电池是一种将燃料内部的化学能转换为电能的设备。
在燃烧过程中,发生氧化还原反应,电子从负极流经外部电路到正极,形成电流。
2. 化学电池化学电池是将化学能转换为电能的装置。
化学电池由两个半电池组成,每个半电池都有一个电极和电解质。
在化学电池中,两个半电池通过一个可导电的物质连接起来,形成电池的反应。
在电解质中发生氧化还原反应,电子从负极流经外部电路到正极,形成电流。
这个过程中,化学能被转换为电能。
结论电能与化学能之间的转换是一种能量转化的过程。
通过电解和电池,电能可以转化为化学能;而通过燃烧和化学电池,化学能可以转化为电能。