氯化氢采做讲义
- 格式:pptx
- 大小:245.49 KB
- 文档页数:28


目夺市安危阳光实验学校第二节 富集在海水中的元素——氯1.了解氯单质及其重要化合物的主要性质及应用。
(高频)2.了解氯单质及其重要化合物对环境质量的影响。
3.掌握氯气的实验室制法(包括所用试剂、仪器,反应原理和收集方法)。
(中频)氯气的性质、制法和应用1.物理性质氯气是一种有强烈刺激性气味的有毒气体,能溶于水,但在饱和食盐水中的溶解度很小,所以可用排饱和食盐水法收集氯气。
2.化学性质(写出有关化学方程式) 3.Cl 2的制法 (1)实验室制法化学方程式:MnO 2+4HCl(浓)=====△MnCl 2+Cl 2↑+2H 2O 。
(2)工业制法(电解法)化学方程式:2NaCl +2H 2O=====电解2NaOH +Cl 2↑+H 2↑。
4.应用(1)制盐酸:利用H 2在Cl 2中燃烧生成HCl ,然后溶于水制盐酸。
(2)制漂白液:利用Cl 2与NaOH 溶液反应制备,其有效成分为NaClO 。
(3)制漂白粉:利用Cl 2与Ca(OH)2乳浊液反应制备,其有效成分为Ca(ClO)2。
(4)制含氯有机物,如Cl 2与CH 4反应可生成CH 3Cl 、CH 2Cl 2、CHCl 3、CCl 4有机物。
氯的重要化合物1.次氯酸(1)不稳定性:2HClO=====光2HCl +O 2↑氯水须现用现配,保存在棕色试剂瓶中,置于冷暗处。
(2)强氧化性:①能将有色物质氧化为无色物质,有漂白性。
②杀菌、消毒。
(3)弱酸性:NaClO 溶液中通少量CO 2,化学方程式为:2NaClO +CO 2+H 2O===2HClO +Na 2CO 3。
2.次氯酸盐 (1) (2)3.今天人们不直接用Cl 2作漂白剂而常用漂白液或漂白粉的理由是Cl 2在水中的溶解度不大而且生成的HClO 不稳定,难以保存,使用不方便,效果不理想。
卤素及卤离子检验1.卤素(包括F 、Cl 、Br 、I 等)简介 (1)单质物理性质的递变规律①单质颜色逐渐变深(F 2:淡黄绿色气体;Cl 2:黄绿色气体;Br 2:深红棕色液体;I 2:紫黑色固体)。

氯化氢的实验室制取
教学目标
1.知识与技能
了解氯化氢的物理化学性质
掌握氯化氢的实验是制法
2.过程与方法
通过观察演示实验,提高学生的观察能力,准确应用化学语言纪录实验现象从喷泉实验的演示到尾气吸收装置,学生学会知识的迁移
3.情感态度价值观
通过实验活动,提高学生的实验设计能力以及创新精神.
教学重点
氯化氢的实验室制法
教学难点
实验室制取氯化氢气体的实验设计
板书
氧气的实验室制取 化学方程式:
二氧化碳的实验室制取 化学方程式:
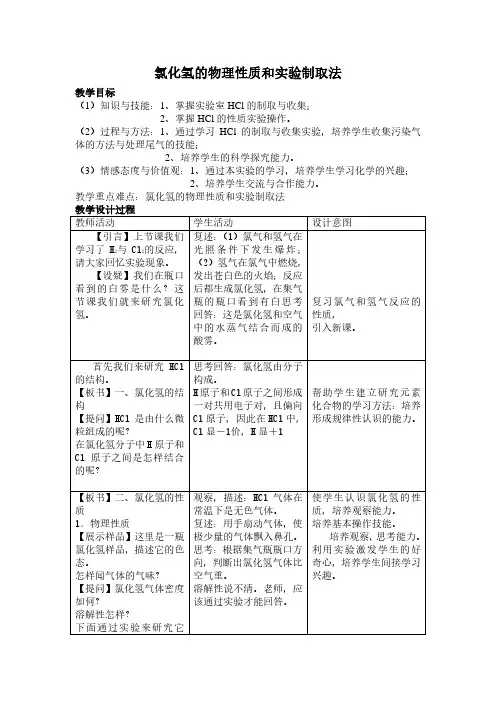
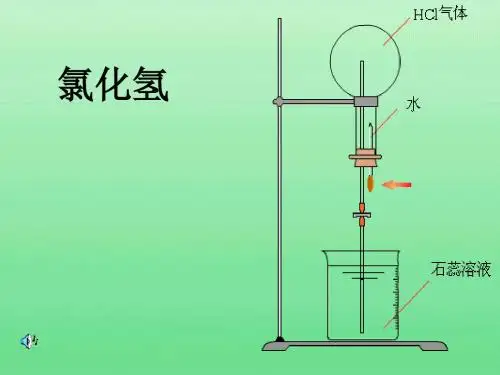
氯化氢气体的物理性质 无色气体 熔、沸点较低
密度略大于空气 是空气的1.26倍 有刺激性气味 溶解性? 极易溶于水
溶解比例 1:500
运用 氯化氢的尾气吸收
3O 2
2KCl + 2KClO CaCO 3+2HCl CaCl 2+H 2O+CO 2。





氯化氢提纯工艺流程
嘿,咱今儿来聊聊氯化氢提纯工艺流程这档子事儿哈!
你说这氯化氢啊,就像是个调皮的小孩子,得好好管教才能变得乖乖的。
那怎么管教呢?这就得靠一系列巧妙的步骤啦!
咱先得有个合适的容器来接纳这个小调皮,就好像给它准备一个温暖的家。
然后呢,通过一些特殊的手段,把那些混杂在里面的杂质给揪出来。
这就好比从一堆沙子里挑出金子,可得有点耐心和技巧呢!
想象一下,就像是在一个大杂烩里,要精准地把氯化氢这个宝贝给分离出来,不容易吧?但咱有办法呀!我们可以利用温度啦、压力啦这些因素,让氯化氢乖乖地按照我们的想法行动。
在这个过程中,每一个环节都得精心呵护,不能有丝毫马虎。
就跟做饭似的,火候、调料都得恰到好处,不然做出来的菜可就不好吃啦。
这氯化氢提纯也是一样的道理,稍微有点差错,可能就达不到我们想要的纯度啦。
你说这是不是很神奇?看似普通的气体,经过这么一番折腾,就能变得纯净无比。
这就好像一块普通的石头,经过雕琢就能变成精美的艺术品。
而且啊,这个过程还得不断地调整和优化,就像给孩子调整教育方式一样。
不能一成不变,得根据实际情况灵活应变。
有时候可能会遇到一些小麻烦,比如设备出点小故障啦,或者是一些突发情况,但咱可不能被这些打倒呀,得想办法解决。
等咱终于把氯化氢提纯好了,那感觉,就像是农民伯伯收获了满满的粮食一样,心里别提多高兴啦!这可都是咱的劳动成果呀!
所以说呀,氯化氢提纯工艺流程可真是个有趣又充满挑战的事儿呢!咱可得认真对待,好好钻研,让这个小调皮变得乖乖的,为我们所用!这就是我对氯化氢提纯工艺流程的看法,你觉得呢?。
氯化氢作业指导书(依据标准:HJ/T27-1999)废气氯化氢分析方法——硫氢酸汞分光光度法(HJ/T27-1999)空气中颗粒物含有氯化物,用微孔滤膜阻留颗粒物,以排除其对氯化氢气体测定的干扰.1 原理空气样品经过0.3μm微孔滤膜阻留含氯化物的颗粒物后,用稀氢氧化钠溶液吸收氯化氢气体。
样品溶液中的氯离子和硫氰酸汞反应,生成难电离的二氯化汞分子,置换出的硫氰酸根与三价铁离子反应,生成橙红色硫氰酸铁络离子,根据颜色深浅,用分光光度法测定。
溴离子、氟离子、硫化物、氰化物等干扰测定,使结果偏高。
在无组织排放样品的分析中,当采样体积为60L时,方法的检出限0.05mg/m3,定量测定浓度范围为0.16-0.80 mg/m3;在有组织排放样品分析中,当采样体积为10L 时,方法检出限为0.9mg/m3,定量测定浓度范围为3.0-24 mg/m3.2 仪器①滤膜采样夹滤膜直径30~40mm。
②大型气泡吸收管10ml。
③具塞比色管 I0ml。
④空气采样器流量0~1L/min。
⑤分光光度计。
3 试剂①乙酸纤维微孔滤膜 0.3μm。
②吸收液氢氧化钠溶液C(Ha0H) = 0.05mol/L。
③硫氰酸汞-乙醇溶液称取0.40g硫氢酸汞[Hg(SCN)2,用乙醇重结晶的],用无水乙醇配成100ml溶液。
放置一周后将上清液吸至另一棕色细口瓶中备用。
④高氯酸 70~72%。
⑤3.0%(m/v)硫酸铁铵溶液称取3.0g硫酸铁铵溶液,用(1+1.5)高氯酸溶液溶解并稀释至100ml,如浑浊应过滤。
⑥氯化钾标准溶液称取2.045g氯化钾(优级纯,110℃烘干2h),溶解于水,移人1000ml 容量瓶中,用水稀释至标线。
此溶液每毫升相当于含1000μg氯化氢。
再用吸收液稀释为每毫升含10.0μg氯化氢的标准使用溶液。
4 采样4.1 有组织排放样品的采集串连两支各装25ml氢氧化钠吸收液的多孔玻板吸收瓶,以0.5L/min流量,采样5~30min。
氯化氢合成生产工艺实用授课教材一、概述工序生产任务(1).供应合格的氯化氢给单体工段;为本厂及用户提供优质的高纯盐酸。
(2).平衡氯气,保证全厂正常生产。
本工序原料及其特性1、氢的化学性质氢气易燃,在空气中燃烧,生成水。
2H2+O2=2H2O氢气在氯气中含4~96%,或在氧气中含5~95%,或在空气中含5~7%时,均可构成爆炸气体,遇明火或强光即发生爆炸。
原料氯气的性质2、氯气的物理性质a) 分子式:Cl2b) 分子量:70.906c) 常温时是黄绿色、有刺激性气味。
d) 剧毒,国家规定空气中允许的浓度为0.001mg/Le) 易液化,能溶于水,溶解度随温度的升高而降低。
f) Cl2在一个大气压下100克水中溶解氯气克数g) 氯气易溶于许多有机溶剂,如酒精、庚烷、四氯化碳等。
氯的化学性质a) 氯气的化学性质很活泼,有很强的氧化性。
b) 氯气可以与所有金属和大多数非金属元素(N、O、C和稀有气体除外)直接化合。
2Ag+Cl2=2AgClc) 氯气可与一些气体反应:点燃Cl2+H2= 2HCl+Qd) 氯气与些有机化合物反应:紫外线C6H6+3Cl2—→C6H6Cl6e )氯气与无机化合物反应:2NaOH+Cl2=NaClO+NaCl+H2Of) 氯气易溶于水中,并生成次氯酸和盐Cl2+H2O→HClO+HClHClO→HCl+[O]所释放的初生态氧是强氧化剂,对金属的腐蚀性极大。
g)氯气能与氢按一定比例混合成炸性气体,在明火、高温及日光的触发下,猛烈爆炸。
氯气与氢气混合爆炸极限:下限H2为5%,Cl2为95%,上限H2为87.5%,Cl2为12.5%。
高纯盐酸的质量指标氯化氢(HCl)在常温下为无色、有刺激性嗅味的气体,熔点-114.6℃,沸点-84.1℃,比重 1.3。
极易溶于水,并强烈地放热,其水溶液就是盐酸,是常用的无机强酸之一。
纯的盐酸是无色液体,工业盐酸由于有铁、氯或有机杂质存在而呈黄色。