碳族元素基础知识点网络结构图
- 格式:pdf
- 大小:1.34 MB
- 文档页数:5


碳族元素、碳元素单质及化合物一、碳族元素碳族元素位于元素周期表 族,包括 、 、 、 、在元素周期表中的位置(周期、族、原子序数)表示方法:原子结构示意图Si原子结构相同点:最外层电子数相同,都是 个 不同点:电子层数不同相似性: 得失电子,易形成 键,难形成键,最高正价为,最低负价为。
主要性质递变性:随原子序数递增,元素金属性 ,非金属性;氢化物稳定性(CH 4可燃,SiH 4易自燃);最高价氧化物对应水化物酸性 ,碱性 ,Ge(OH)4呈两性。
碳族元素的金属性比同周期氮族元素 ,且自上而下由非金属性向金属性递变比氮族更为明显。
二、碳所形成的单质性质 1. 碳所形成的单质金刚石: 构型、空间网状结构的 晶体。
无色透明,熔沸点高,硬度大,难溶于溶剂,不导电。
用途: 石墨:层状结构,层间以 结合。
熔点很 ,质软,有滑腻感,电的良导体。
用途:C 60:形似足球,俗称"足球烯", 晶体。
用途: 三者互称 2.碳的化学性质完全燃烧 ①可燃性 不完全燃烧比较与CO2反应与CuO 反应②还原性 与H2O 反应与SiO2反应 与浓H2SO4反应3.碳的氧化物比较三、碳的氧化物1. 碳族元素的化合价常见化合价为+2和+4价,其中碳、硅、锗、锡的+4价化合物较稳定,而铅的+2价化合物稳定。
由氧化还原反应的化合价升降来研究碳族元素的物质性质,其相知规律如下:(1)单质以还原性为主。
如碳做还原剂,温度越高,还原性越强,高温时候可还原氧化铜;铅、锡都能与盐酸反应置换出氢气等。
(2)+2价化合物有还原性。
如一氧化碳高温时能还原某些金属氧化物(氧化铁、氧化铜)等。
(3)+4价化合物只有氧化性。
如二氧化碳和碳高温下反应生成一氧化碳,二氧化铅在化学反应中是强氧化剂等。
2.碳族元素的主要特征碳族元素由于位于周期表的第ⅣA族,易形成共价化合物(特别是碳和硅)。
碳元素形成的单质(金刚石)硬度最大;碳元素形成的化合物种类最多;在所有非金属形成的气态氢化物中,甲烷中氢元素的质量分数最大;碳-12是核素相对原子质量的标准院子;硅在地壳中含量仅次于氧,其单质晶体是一种良好的半导体材料。


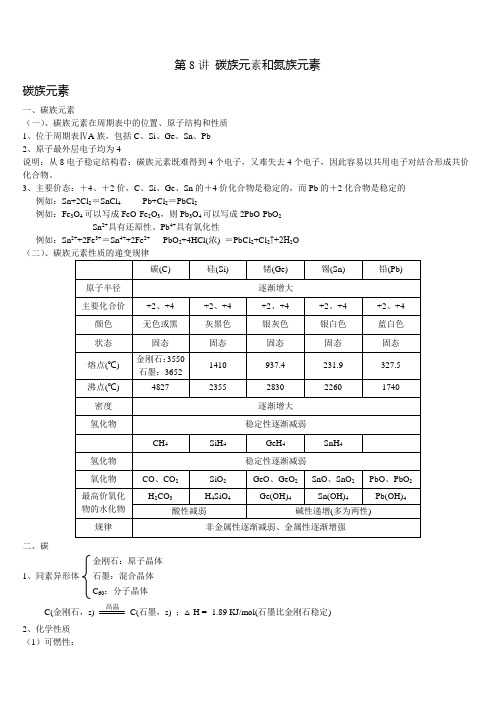
第8讲碳族元素和氮族元素碳族元素一、碳族元素(一)、碳族元素在周期表中的位置、原子结构和性质1、位于周期表ⅣA族,包括C、Si、Ge、Sn、Pb2、原子最外层电子均为4说明:从8电子稳定结构看:碳族元素既难得到4个电子,又难失去4个电子,因此容易以共用电子对结合形成共价化合物。
3、主要价态:+4、+2价,C、Si、Ge、Sn的+4价化合物是稳定的,而Pb的+2化合物是稳定的例如:Sn+2Cl2=SnCl4Pb+Cl2=PbCl2例如:Fe3O4可以写成FeO·Fe2O3,则Pb3O4可以写成2PbO·PbO2Sn2+具有还原性、Pb4+具有氧化性例如:Sn2++2Fe3+=Sn4++2Fe2+PbO2+4HCl(浓) =PbCl2+Cl2↑+2H2O(二)二、碳金刚石:原子晶体1、同素异形体石墨:混合晶体C60:分子晶体C(金刚石,s) 高温C(石墨,s) ;△H = -1.89 KJ/mol(石墨比金刚石稳定)2、化学性质(1)可燃性:C + O2点燃CO2 (O2足量) 2C + O2点燃2CO (O2不足) (2)还原性:C + 2CuO △2Cu + CO2 C + H2O 高温CO + H2(水煤气)CaO + 3C 通电CaC2 + CO↑(电石的制法)(3)与氧化性酸反应C + 2H2SO4(浓) △CO2↑+ 2SO2↑+ 2H2OC +4HNO3(浓)△CO2↑+4NO2↑+2H2O三、碳的化合物(一)CO的性质1、物理性质:无色无味气体,剧毒难溶于水。
中性氧化物(不成盐氧化物)2、化学性质(1)可燃性:2CO + O2点燃2CO2(用点燃的方法除去CO)(2)还原性:Fe2O3+3CO △+3CO2(炼铁)CuO+CO △Cu+CO2(除CO)CO+H2O 高温CO2+H2(工业上用于制H2)(3)毒性:CO能于人体中血红蛋白结合,使血红蛋白失去携氧的能力,使人缺氧死亡。
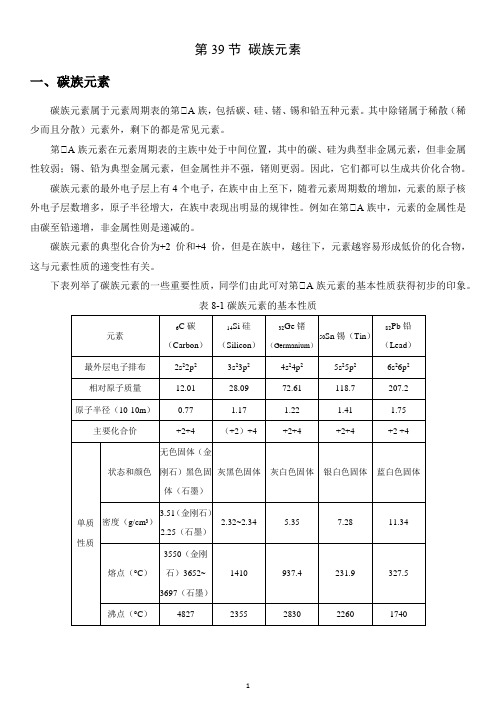
第39节碳族元素一、碳族元素碳族元素属于元素周期表的第ⅣA族,包括碳、硅、锗、锡和铅五种元素。
其中除锗属于稀散(稀少而且分散)元素外,剩下的都是常见元素。
第ⅣA族元素在元素周期表的主族中处于中间位置,其中的碳、硅为典型非金属元素,但非金属性较弱;锡、铅为典型金属元素,但金属性并不强,锗则更弱。
因此,它们都可以生成共价化合物。
碳族元素的最外电子层上有4个电子,在族中由上至下,随着元素周期数的增加,元素的原子核外电子层数增多,原子半径增大,在族中表现出明显的规律性。
例如在第ⅣA族中,元素的金属性是由碳至铅递增,非金属性则是递减的。
碳族元素的典型化合价为+2价和+4价,但是在族中,越往下,元素越容易形成低价的化合物,这与元素性质的递变性有关。
下表列举了碳族元素的一些重要性质,同学们由此可对第ⅣA族元素的基本性质获得初步的印象。
表8-1碳族元素的基本性质需要指出的是:碳族元素中,+2价稳定性由Si→Pb 增强,如2Sn +有强还原性,而4Pb +却是常用的强氧化剂。
Si 2+则不稳定。
碳族元素单质除以上的物理性质外,最早应用于半导体材料的锗和现在仍在大规模集成电路器件中用作基体的半导体硅,都在这一族。
其实可以作为半导体材料的无机物还有很多。
你知道半导体材料吗半导体材料是指导电能力在导体和绝缘体之间(一般规定其电导率为103~109 S/cm )的材料。
它与导体的差别还在于,当温度升高时导体的电导率下降而半导体材料的电导率升高。
半导体多以共价键结合为主,在晶格中多为四面体结构(与金刚石结构相似)。
作为半导体材料的物质类型很多,有单质、化合物、非晶材料、有机材料等。
其中以单质半导体应用较为广泛。
金刚石在适当掺杂后也可成为半导体材料。
第ⅣA 族中的灰锡也具有金刚石结构,在13.2Ⅳ以下时表现半导体性质。
在无机化合物半导体材料中,已经开发应用的半导体材料有一个特别明显的特点,即二元半导体中的两个元素所属的族号之和等于8.如Ⅳ-V 、Ⅳ-Ⅳ、Ⅳ-Ⅳ等。
碳族元素基础知识点网络结构图基础知识1.碳族元素①特征:碳族元素原子最外层电子数为4,既不容易失去电子,又不容易得到电子,易形成共价键,难形成离子键。
碳族元素形成的单质在同周期中硬度最大,熔沸点最高(如金刚石、晶体硅)。
②化合价:碳族元素的主要化合价有+2,+4,其中Pb+2价稳定,其余元素+4价稳定。
③递变规律:从上到下电子层数增多,原子半径增大,原子核对最外层电子的吸引能力减弱,失电子的能力增强,从上到下由非金属递变为金属的变化非常典型。
其中碳是非金属,Sn、Pb是金属,Si、锗Ge是半导体材料。
④自然界的存在:自然界里碳有游离态和化合态两种;硅在地壳里无游离态,主要以含氧化合物的形式存在⑤几种同素异形体:碳:金刚石、石墨、C60、C70等;硅:晶体硅,无定形硅2.碳在常温下碳很稳定,只在高温下能发生反应,通常表现为还原性。
①燃烧反应②与某些氧化物的反应:(CO、H2的混合气体叫水煤气);③与氧化性酸反应:C+2H2SO4(浓)CO2↑+2SO2↑+2H2O;C+4HNO3(浓)CO2↑+4NO2↑+2H2O3.CO不溶于水,有毒(CO和血红蛋白结合,使血红蛋白无法和O2结合,而使细胞缺氧引起中毒),但由于CO无色无味因此具有更大的危险性。
①可燃性②还原性:CO+CuOCO2+Cu,CO+H2O(g)CO2+H2O4.CO2直线型(O=C=O)非极性分子,无色能溶于水,密度大于空气,可倾倒,易液化。
固态CO2俗称干冰,能升华,常用于人工降雨。
实验室制法:CaCO3+2HCl=CaCl2+CO2↑+H2O。
①酸性氧化物一—酸酐Ca(OH)2+CO2=CaCO3↓+H2O(用于检验CO2)②氧化性:CO2+C2CO;2Mg+CO22MgO+C5.碳酸盐①溶解性:Ca(HCO3)2>CaCO3;Na2CO3>NaHCO3。
②热稳定性:Na2CO3>CaCO3;碱金属正盐>碱金属酸式盐: Na2CO3>NaHCO3。
碳族及其化合物知识归纳总结一、碳族元素结构和性质递变规律碳硅锗锡铅元素的非金属性和金属最高价氧化物对应的水二、碳和硅的化学性质比较三、CO2与SiO2的性质比较补记:1、除去CO、CO2气体中混有的杂质(括号内为杂质)(1)CO(CO2):通过盛有_____________的洗气瓶中。
(2)CO2(CO):通过盛放_____________的硬质玻璃管中。
(3)CO2(O2):通过盛有_____________的硬质玻璃管中。
(4)CO2(SO2):通过盛有________或_______的洗气瓶中。
(5)CO2(HCl):通过盛有_____________的洗气瓶中。
(6)CO2(H2S):通过盛有_____________的洗气瓶中。
2、碳酸盐性质的一般规律(1)溶解性规律:碱金属的正盐的溶解度大于酸式盐(如:Na2CO3___NaHCO3);碱土金属(第ⅡA族)的正盐溶解度小于酸式盐(如:CaCO3___Ca(HCO3)2)(2)稳定性:难溶性的碳酸盐、(NH4)2CO3及酸式盐受热易分解;可溶性的碳酸盐较稳定,受热不易分解;一般而言,稳定性大小顺序为正盐大于酸式盐。
(3)酸式盐与碱反应时产物要根据相对量判断。
如在Ca(HCO3)2溶液中滴加NaOH溶液:Ca(HCO3)2+NaOH(少量)=Ca(HCO3)2+2NaOH(过量)=(4)CO32-,HCO3-的检验①CO32-的检验方法:向待检验溶液中滴加过量的BaCl2溶液,生成白色沉淀,再加入稀HNO3,白色沉淀又溶解,且生成无色、无味气体,则测得溶液中有CO32-。
②HCO3-的检验方法:向待检验溶液中滴加过量的BaCl2溶液,若无明显现象,再向溶液中滴加足量的酸(如稀HNO3),溶液中逸出无色、无味的气体,则测得溶液中有HCO3-四、硅及其化合物的特性1. Si的还原性大于C,但C却能在高温下还原出Si:高温也能发生。
SiO22CSi++CO↑22. 非金属单质跟碱液作用一般无H放出,但Si却放出H2:2↑+=++232222H SiO Na O H NaOH Si3. 非金属单质一般不跟非氧化性酸作用,但Si 能与HF 作用: ↑+↑=+2424H SiF HF Si4. 非金属单质一般为非导体,但Si 为半导体。