生防菌的筛选
- 格式:doc
- 大小:35.00 KB
- 文档页数:2


《胡麻枯萎病生防菌拮抗物质的筛选和分离纯化研究》篇一一、引言胡麻枯萎病是一种严重影响胡麻产量的病害,对农业生产和经济效益造成了巨大损失。
生防菌是一种具有生物防治潜力的微生物,其拮抗物质对病原菌有显著的抑制作用,因此在病害防治中具有重要价值。
本文旨在研究胡麻枯萎病生防菌拮抗物质的筛选、分离纯化及其作用机制,以期为胡麻枯萎病的生物防治提供新的思路和方法。
二、材料与方法1. 材料(1)生防菌:从胡麻根际土壤中分离得到的生防菌株。
(2)培养基:营养琼脂培养基、马铃薯葡萄糖琼脂培养基等。
(3)试剂:各种化学试剂、抗生素等。
2. 方法(1)生防菌的培养与拮抗物质的产生:将生防菌接种于培养基上,培养一定时间后收集菌体,提取拮抗物质。
(2)拮抗物质的筛选:采用平板对峙法,将拮抗物质与胡麻枯萎病病原菌进行对峙培养,观察并记录生长情况。
(3)拮抗物质的分离纯化:采用薄层层析、高效液相色谱等方法对拮抗物质进行分离纯化。
(4)拮抗物质的结构鉴定:利用现代分析技术对纯化后的拮抗物质进行结构鉴定。
(5)拮抗物质的作用机制研究:通过生物学实验和分子生物学手段研究拮抗物质的作用机制。
三、结果与讨论1. 拮抗物质的筛选结果通过平板对峙法,我们发现某些生防菌株产生的拮抗物质对胡麻枯萎病病原菌有显著的抑制作用。
这些生防菌株在进一步的研究中具有较大的应用潜力。
2. 拮抗物质的分离纯化采用薄层层析、高效液相色谱等方法对拮抗物质进行分离纯化,得到了较为纯净的拮抗物质。
通过对比不同纯化方法的效果,我们发现高效液相色谱法具有较高的纯化效率和较好的纯化效果。
3. 拮抗物质的结构鉴定利用现代分析技术对纯化后的拮抗物质进行结构鉴定,发现其主要成分为一种具有抗菌活性的多肽类物质。
该多肽类物质具有较低的分子量和较好的水溶性,具有较高的生物活性。
4. 拮抗物质的作用机制研究通过生物学实验和分子生物学手段研究拮抗物质的作用机制,发现该多肽类物质主要通过破坏病原菌的细胞膜结构,抑制其生长和繁殖,从而达到防治病害的目的。


红提葡萄灰霉病8株不同生防菌的筛选及鉴定本文旨在筛选和鉴定对红提葡萄灰霉病具有有效防治作用的生防菌。
通过对8株不同生防菌对红提葡萄灰霉病的防治效果进行评估,最终选定了两株优异的生防菌L9和P27,并对其进行了鉴定。
实验方法:1.植物材料及病原菌本研究选用红提葡萄作为研究材料,购自当地农贸市场。
灰霉病菌采用从野外获得的灰霉病菌菌丝孢子接种,接种用液为0.1%甲基红丝绸液,接种浓度为2×10^6。
2.生防菌筛选在灰霉病病菌接种后24小时,将不同的生防菌接种在葡萄果实表面,接种浓度为1×10^7 CFU/mL。
进行不同生防菌的筛选实验,通过对不同生防菌防治效果的评估,最终选定了两株优异的生防菌L9和P27。
3.生防菌鉴定借助微生物学实验室提供的生化试剂,对选定的两株生防菌进行鉴定,并采用16S rRNA基因序列测定确定其分类地位。
实验结果:生防菌名称防治效果L1 Bacillus licheniformis 20.5%L2 Bacillus subtilis 38.9%L3 Bacillus cereus 28.3%L4 Streptomyces sp. 35.1%L5 Pseudomonas fluorescens 23.6%L6 Trichoderma koningii 39.4%L7 Paenibacillus polymyxa 31.8%L8 Bacillus amyloliquefaciens 39.2%L9 Bacillus velezensis 56.7%L10 Pseudomonas aeruginosa 25.7%P11 Paenibacillus sp. 41.8%P12 Brevibacillus agri 32.4%P13 Bacillus thuringiensis 27.2%P14 Bacillus pumilus 36.2%P15 Serratia marcescens 23.1%P16 Bacillus megaterium 33.7%P17 Pseudomonas putida 21.8%P18 Rhodococcus erythropolis 28.8%P19 Bacillus coagulans 34.6%P20 Pseudomonas striata 19.8%P21 Bacillus firmus 31.4%P22 Brevibacterium sp. 26.3%P23 Bacillus subtilis subsp. spizizenii 42.3%P24 Bacillus simplex 37.6%P25 Bacillus altitudinis 38.1%P26 Bacillus halotolerans 42.7%P27 Bacillus paralicheniformis 59.2%P28 Rhizobium sp. 30.1%P29 Bacillus tequilensis 20.8%P30 Bacillus safensis 35.5%通过对生防菌L9和P27进行鉴定,结果显示L9属于芽孢杆菌属(Bacillus),P27属于侧孢杆菌属(Paenibacillus)。

柑橘采后青霉病生防菌的筛选与鉴定
柑橘采后青霉病是柑橘果实在采摘后由于各种原因引起的真菌病害,严重影响柑橘的品质和市场价值。
为了防止柑橘采后青霉病的发生,需要筛选和鉴定一些生防菌,下面将从以下几个方面进行回答:
一、生防菌的筛选
1. 筛选菌株:可以从自然界中采集到一些具有抗青霉病能力的菌株,如链格孢、绿僵菌、白僵菌、木霉等。
也可以通过实验室筛选出具有生物防治潜力的菌株。
2. 筛选方法:通过对不同菌株进行对比试验,筛选出具有较高生物防治效果的菌株。
在试验中,可以采用不同的方法,如接种试验、涂片试验、土壤浸泡试验等。
3. 筛选指标:可以从菌株的生长速度、产孢量、致病菌的抑制率等方面进行评估,筛选出具有较高生物防治效果的菌株。
二、生防菌的鉴定
1. 鉴定方法:可以采用形态学、生理生化、分子生物学等多种方法进行鉴定。
其中,形态学鉴定是最基础的鉴定方法,通过观察菌落形态、产孢形态、孢子形
态等特征进行鉴定。
生理生化鉴定则是通过菌株的代谢特性、生长条件等方面进行鉴定。
分子生物学鉴定则是通过PCR扩增、DNA序列分析等方法进行鉴定。
2. 鉴定指标:可以从形态特征、生理生化特性、分子生物学特性等方面进行评估,鉴定出菌株的种属、亚种、菌株间的关系等信息。
以上是柑橘采后青霉病生防菌的筛选与鉴定的相关内容,需要注意的是,生防菌的筛选和鉴定需要进行科学合理的实验设计和严格的实验操作,确保结果的准确性和可靠性。

一株烟草青枯病生防菌的筛选鉴定及其发酵优化Screening and Fermentation Optimization ofAntagonistic Bacillus against Tobacco Bacterial WiltZHAO Xiao-yan1,YANG Huan2, CHEN Jian-gang1,WANGChang-jun3, JI Zhi-xia1, CHEN Shou-wen1(1. State Key Laboratory of Agricultural Microbiology, Huazhong Agricultural University , Wuhan430070, China;2. Wuhan Leyang Biotechnology Co., Ltd. ,Wuhan 430071, China;3. Hubei Tobacco Research Institute, Wuhan 430030, China):One bacterial stra in was scree ned for its a ntagonistic activity against Ralstonia solanacearum based on the size of the bacteriosta tic circle in vitro by the dua l culture and culture filtrat e tests,and named as XLA03. It s bacteriostatic circle could reach 13 mm. According t o determination and analysis of 16S rDNA, the strain XLA03 was identified as Bacillus amyloliqu efaciens. Based on the single factor experiments and orthog onalermentation medium for its bi experiments, an optimal fomass—production in flasks was composed of maize starch 15.0 g/L, soybean meal 50.0 g/L, K2HPO4 ?3H2O 1. 0 g/L, MgSO4 ? 7H2O0.75 g/L,MnSO4 ? H2O 0.01 g/L. T he optimal fermentation condi tion was initial pH of 7.0, ino culum size of 1% loaded liquid of 20 mL/250 mL.Key words: tobacco bacterial wilt; Bacillus amyloliquefa ciens; screening;fermentatio n optimization烟草青枯病[病原物为茄科雷尔氏菌( Ralstoniasolanacearum )]是一种典型的维管束病害,最显著的发病症状是烟草植株出现枯萎现象, 危害期大多出现在烟草旺长期或者旺长期以后,根、茎、叶部均会受害[1, 2]。


生防菌的筛选通过对向日葵根部土壤中微生物的分离、筛选、生物学测定和田间防治效果的系统的研究,分离筛选出对向日葵黄萎病菌具有防病作用的拮抗菌株,为向日葵黄萎病优良生防菌剂的研制和开发奠定基础。
1.1 材料与方法1.1.1 土样和病原菌来源向日葵黄萎病菌(Verticillium dahliae Kleb.):内蒙古农业大学植物病理实验室分离保存。
土壤样品:来自内蒙古农业大学农场的带有植株组织的根围土壤。
1.1.2 培养基1.1.2.1 真菌培养基PDA培养基:马铃薯(去皮)200 g,葡萄糖20 g,水1000 mL,琼脂20 g。
1.1.2.2 细菌培养基LB固体培养基:蛋白胨10 g,酵母膏5 g,NaCl5 g,蒸馏水1000 mL,琼脂20 g,pH自然。
LB液体培养基:蛋白胨10 g,酵母膏5 g,NaCl5 g,蒸馏水1000 mL,pH 自然。
1.1.3 向日葵品种及用具供试向日葵品种为实验室有的相关种子。
超净工作台,无菌培养皿,无菌吸管,三角瓶,试管,无菌水,酒精灯,接种环,接种针和记号笔等。
1.2 土样中细菌的分离采用梯度稀释法,将从病区采集的植物带根土壤,抖去浮土后称取根际土壤1 g置于盛有9 mL无菌水的试管内,剧烈振荡5 min,制成土壤悬浮液,梯度稀释10-4后,涂LB平板,28 ℃培养箱中黑暗培养,48 h后挑取不同菌落形态的单个菌落,经LB平板纯化后4 ℃保存于LB斜面待用。
1.3 拮抗菌的筛选采用平板对峙培养法,筛选拮抗菌。
将活化的向日葵黄萎病菌菌饼置于PDA 平板中央,在距离其2 cm处点接细菌,每皿接4个菌株,每个菌株重复3次。
设不接种拮抗菌的平板为对照(CK),置于25 ℃培养箱黑暗培养,待对照平板菌落半径超过3 cm时,测量并记录结果。
1.4 生防菌的筛选1.4.1 待测液的制备将有较好抑菌效果的拮抗菌接入50 mL LB液体培养基中,25 ℃恒温下150 r/ min震荡培养48 h,得到发酵液。


卫 甜,吕 敏,刘怀阿,等.抗稻瘟病生防细菌的分离与筛选[J].江苏农业科学,2021,49(7):106-111.doi:10.15889/j.issn.1002-1302.2021.07.017抗稻瘟病生防细菌的分离与筛选卫 甜,吕 敏,刘怀阿,朱锦磊,苏建坤(江苏里下河地区农业科学研究所,江苏扬州225007) 摘要:由病原真菌Magnaportheoryzae引起的稻瘟病是水稻生产上的一种毁灭性病害。
从稻瘟病发病严重的田块分别采集健康株和病株,从14个不同生境(土壤、根茎叶围、根茎叶内)中共分离得到304株潜在生防细菌。
通过对各细菌胞外产酶活性(葡聚糖酶、纤维素酶、蛋白酶)及产吲哚乙酸活性进行测定,并根据不同指标对细菌进行赋值,最终选择评分≥3分的114株细菌进行稻瘟病菌的平板拮抗试验,从中筛选得到15株对稻瘟病病菌有明显拮抗作用的生防细菌。
最终根据赋值评分结果及平板拮抗试验在实验室条件下对筛选出的17株具有防治稻瘟病潜在能力的生防细菌进行16SrDNA鉴定,鉴定结果表明,有15株为芽孢杆菌,1株为糖霉菌,另1株为水库杆菌。
本研究以此建立一个针对稻瘟病生防细菌筛选的系统,得到的生防细菌可以为田间防治稻瘟病并最终应用于实际生产提供理论基础。
关键词:稻瘟病;细菌筛选;酶活性测定;平板拮抗;生防细菌 中图分类号:S435.111.4+1 文献标志码:A 文章编号:1002-1302(2021)07-0106-05收稿日期:2020-06-04基金项目:江苏里下河地区农业科学研究所专项基金[编号:SJ(17)103]。
作者简介:卫 甜(1990—),女,山西运城人,硕士,助理研究员,主要从事植物病害的生物防治工作。
Tel:(0514)87302229;E-mail:weitian900128@163.com。
通信作者:苏建坤,硕士,研究员,主要从事植物病虫害的绿色防控工作。
Tel:(0514)87302325;E-mail:yzsujk@163.com。
从土壤,果实里筛选生防芽孢杆菌实验方案
从土壤和果实中筛选生防芽孢杆菌实验方案可以按照以下步骤进行:
1. 样本收集:从不同农田或果园收集土壤和果实样本。
确保样本来自不同地点和不同植物种类。
2. 样本处理:将土壤样本分为不同的小样本,将果实切块或切碎,以增加样本表面积。
3. 分离芽孢杆菌:使用适当的培养基,如蔗糖蛋白胨琼脂(PDA)、营养琼脂(NA)等,在室温下进行分离培养。
将土壤样本稀释后涂布在培养基上,并将果实样本直接放置于培养基表面。
4. 筛选生防菌株:观察培养皿上生长的菌落,筛选出具有抑制病原菌生长能力的菌株。
这可以通过观察形态特征、颜色、菌落大小等进行初步筛选。
5. 病原性测试:对初步筛选出的菌株进行病原性测试,验证其对目标病原菌的抑制效果。
可以采用小范围的接种试验或体外抑菌试验等方法进行。
6. 体外液态培养:对筛选出的生防菌株进行液态培养,以获得更多的培养物。
可以使用适当的培养基和培养条件。
7. 保存和鉴定:对有效的生防菌株进行保存和鉴定。
常见的保存方法包括低温冷冻保存和制备菌种备库。
以上是一般的筛选生防芽孢杆菌实验方案,具体的步骤和方法可以根据实验目的和条件进行调整。
在进行实验时,请遵守实验室的安全操作规范,并按照相关法律法规进行处理和处置实验废弃物。
红提葡萄灰霉病8株不同生防菌的筛选及鉴定
红提葡萄是世界上最重要的葡萄种植品种之一,但是其生产过程中常常会受到各种病
害的侵害,其中灰霉病是最为严重的一种病害之一。
传统的控制方法主要是依靠化学农药,但是由于长期使用化学农药会导致环境污染和农产品残留等问题,因此生防菌的筛选及鉴
定成为解决该问题的重要途径之一。
本研究旨在筛选出对红提葡萄灰霉病有良好防治效果的生防菌,并对其进行鉴定,为
红提葡萄灰霉病的生物防治提供有效的微生物资源。
材料与方法
1.植物材料
收集红提葡萄灰霉病叶片,进行病原菌分离与纯化。
2.菌株的保存与筛选
采集不同生防菌,分离培养纯化,并保存于琼脂平板培养基中。
3.生防菌的筛选
采用对照法比较不同生防菌对灰霉病的防效,筛选出具有良好防治效果的生防菌株。
4.生防菌的鉴定
采用形态学方法和生理生化特性对筛选出的生防菌进行鉴定。
结果与讨论
结论
研究意义
本研究的结果为红提葡萄灰霉病的生物防治提供了有效的微生物资源,有助于减少化
学农药的使用,减轻环境污染和农产品残留的问题。
这也为其他作物的生物防治提供了借
鉴和参考价值。
防治脐橙炭疽病生防菌的筛选材料与方法1.1试验材料1.1.1培养基细菌培养基采用牛肉膏蛋白胨培养基(牛肉膏3 g,蛋白胨10 g,氯化钠5 g,琼脂20 g,水1000 mL,pH值7.0~7.2,121℃灭菌20 min)。
真菌培养基采用PDA培养基(马铃薯200 g,葡萄糖20 g,琼脂20 g,水1 000 mL,121℃灭菌20 min)。
1.1.2供试菌株炭疽病致病菌株GXA5-1,分离自江西省赣州市赣县梅林果园脐橙炭疽病发病病叶。
按照科赫氏法则完成病原菌的分离纯化、鉴定及致病性测定,确认为胶孢炭疽菌。
枯草芽孢杆菌(Bacillus subtilis)、苏云金芽孢杆菌(Bacillus thuringiensis)、荧光假单胞菌(Pseudomonas fluores-cens)、木霉菌(Trichodermaspp)、瓦克青霉(Penicillium waks-manii)、白浅灰链霉菌(Streptomyces albogriseolus)购于中国农业微生物菌种保藏管理中心。
1.1.3生防菌处理液的制备枯草芽孢杆菌、苏云金芽孢杆菌、荧光假单胞菌于100 mL牛肉膏液体培养基37℃、150 r/min振荡活化12 h,取菌液5 mL加至95 mL牛肉膏液体培养基中,37℃、150 r/min振荡培养,浑浊后以4 000 r/min离心10 min,取上清备用。
木霉菌、瓦克青霉接种至查彼固体培养基,25℃培养3 d,再转接至液体培养基,25℃、150 r/min振荡培养,出现大量菌丝后过滤,4000 r/min离心10 min,取上清备用。
白浅灰链霉菌接种至高氏一号固体培养基,28℃活化培养2 d,再转接至液体培养基,28℃、150 r/min振荡培养,浑浊后以4 000 r/min离心10 min,取上清备用。
1.1.4菌株处理液对脐橙炭疽病病原菌菌丝生长的影响采用杯碟法,配制含有生防菌处理液的PDA平板,稀释度为10、100、200倍。
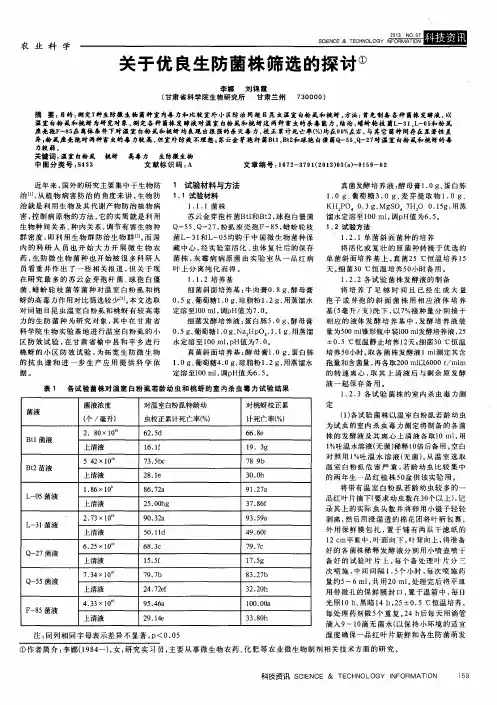
关于优良生防菌株筛选的探讨摘要:目的:测定7种生防微生物菌种室内毒力和比较室外小区防治同翅目昆虫温室白粉虱和桃蚜。
方法:首先制备各种菌株发酵液,以温室白粉虱和桃蚜为研究对象,测定各种菌株发酵液对温室白粉虱和桃蚜这两种害虫的杀毒能力。
结论:蜡蚧轮枝菌l-31、l-05和粉虱座壳孢f-85在离体条件下对温室白粉虱和桃蚜均表现出很强的杀灭毒力,校正累计死亡率(%)均在90%左右,与其它菌种间存在显著性差异;粉虱座壳孢对两种害虫的毒力较高,但室外防效不理想;苏云金芽孢杆菌bt1、bt2和球孢白僵菌q-55、q-27对温室白粉虱和桃蚜的毒力较弱。
关键词:温室白粉虱桃蚜高毒力生防微生物中图分类号:s433 文献标识码:a 文章编号:1672-3791(2013)03(a)-0159-02近年来,国外的研究主要集中于生物防治[1],从植物病害防治的角度来讲,生物防治就是利用生物及其代谢产物防治植物病害,控制病原物的方法。
它的实质就是利用生物种间关系、种内关系,调节有害生物种群密度,即利用生物群防治生物群[2]。
而国内的科研人员也开始大力开展微生物农药,生防微生物菌种也开始被很多科研人员看重并作出了一些相关报道,但关于现在研究最多的苏云金芽孢杆菌、球孢白僵菌、蜡蚧轮枝菌等菌种对温室白粉虱和桃蚜的高毒力作用对比筛选较少[3]。
本文选取对同翅目昆虫温室白粉虱和桃蚜有较高毒力的生防菌种为研究对象,其中在甘肃省科学院生物实验基地进行温室白粉虱的小区防效试验,在甘肃省榆中县和平乡进行桃蚜的小区防效试验,为拓宽生防微生物的抗虫谱和进一步生产应用提供科学依据。
1 试验材料与方法1.1 试验材料1.1.1 菌株苏云金芽孢杆菌btl和bt2,球孢白僵菌q-55、q-27,粉虱座壳孢f-85,蜡蚧轮枝菌l-31和l-05均购于中国微生物菌种保藏中心,经实验室活化、虫体复壮后的保存菌株,灰霉病病原菌由实验室从一品红病叶上分离纯化而得。
生防菌的筛选
通过对向日葵根部土壤中微生物的分离、筛选、生物学测定和田间防治效果的系统的研究,分离筛选出对向日葵黄萎病菌具有防病作用的拮抗菌株,为向日葵黄萎病优良生防菌剂的研制和开发奠定基础。
1.1 材料与方法
1.1.1 土样和病原菌来源
向日葵黄萎病菌(Verticillium dahliae Kleb.):内蒙古农业大学植物病理实验室分离保存。
土壤样品:来自内蒙古农业大学农场的带有植株组织的根围土壤。
1.1.2 培养基
1.1.
2.1 真菌培养基
PDA培养基:马铃薯(去皮)200 g,葡萄糖20 g,水1000 mL,琼脂20 g。
1.1.
2.2 细菌培养基
LB固体培养基:蛋白胨10 g,酵母膏5 g,NaCl5 g,蒸馏水1000 mL,琼脂20 g,pH自然。
LB液体培养基:蛋白胨10 g,酵母膏5 g,NaCl5 g,蒸馏水1000 mL,pH 自然。
1.1.3 向日葵品种及用具
供试向日葵品种为实验室有的相关种子。
超净工作台,无菌培养皿,无菌吸管,三角瓶,试管,无菌水,酒精灯,接种环,接种针和记号笔等。
1.2 土样中细菌的分离
采用梯度稀释法,将从病区采集的植物带根土壤,抖去浮土后称取根际土壤1 g置于盛有9 mL无菌水的试管内,剧烈振荡5 min,制成土壤悬浮液,梯度稀释10-4后,涂LB平板,28 ℃培养箱中黑暗培养,48 h后挑取不同菌落形态的单个菌落,经LB平板纯化后4 ℃保存于LB斜面待用。
1.3 拮抗菌的筛选
采用平板对峙培养法,筛选拮抗菌。
将活化的向日葵黄萎病菌菌饼置于PDA 平板中央,在距离其2 cm处点接细菌,每皿接4个菌株,每个菌株重复3次。
设不接种拮抗菌的平板为对照(CK),置于25 ℃培养箱黑暗培养,待对照平板菌落半径超过3 cm时,测量并记录结果。
1.4 生防菌的筛选
1.4.1 待测液的制备
将有较好抑菌效果的拮抗菌接入50 mL LB液体培养基中,25 ℃恒温下150 r/ min震荡培养48 h,得到发酵液。
将发酵液稀释50倍,为待测液。
1.4.2 向日葵黄萎病病土的制备
向日葵黄萎病菌在麦麸培养基中培养15 d,晾干,研碎后拌入灭菌土中,使向日葵黄萎病病土孢子数达到1.0×106个孢子/ g。
1.4.3 拮抗菌室内防治效果测定
向日葵幼苗长至两片真叶,移出营养钵,抖去根部土壤,用拮抗菌待测液蘸根30 min,移入装有病土(1.0×106个孢子/ g土)的营养钵中,每处理20株,3次重复。
设不经拮抗菌处理的为病对照(CK)。
7 d后开始调查植株发病情况;10d剖杆检查,记录调查结果。
筛选有生防效果的菌株。
1.4.4 拮抗菌株的田间防治效果测定
在内蒙古农业大学教学农场进行,采用人工接种向日葵黄萎病菌。
播种向日葵,待幼苗生长6~8叶期,在植株根部分别浇灌菌株的菌悬液,每株浇灌浓度为107 cfu/ mL 50 mL,12 h后在距植株根部2~5 cm处接入1.0 g浓度为1.0×106个孢子/ g黄萎病菌麦麸培养物,设不经拮抗菌处理的只接黄萎病菌麦麸培养物为病对照。
每处理30株,3次重复。
在向日葵开花盛期时调查叶片颜色的变化,记录发病情况。
2 菌株的鉴定
2.1 材料与方法
2.1.1 形态的鉴定
将筛选出菌株在固体LB平板上分别培养24 h,观察菌落形态,并在显微镜下观察菌体形态。
2.1.2 生理生化鉴定
参照东秀珠等的《常见细菌系统鉴定手册》[67]上的方法对菌株Y1-2和6-38分别进行pH值5.7营养肉汤、pH值6.8营养肉汤、接触酶、V-P测定、V-P培养物终pH< 6、V-P培养物终pH> 7、淀粉水解、硝酸盐还原到亚硝酸盐、柠檬酸盐利用、明胶液化、反硝化、酯酶(Tween 80)、NaCl和KCl利用、尿素利用、肌醇、七叶苷、鸟氨酸脱羧酶、非发酵半乳酶、非发酵甘露醇、山梨醇、生长温度等生理生化试验。
2.1.3 16S rDNA 片段的PCR 扩增和序列分析。