chapter9 离子化合物的结构化学习题解答
- 格式:pdf
- 大小:322.72 KB
- 文档页数:21


高中结构化学试题及答案一、选择题(每题2分,共20分)1. 原子半径最大的元素是:A. 氢B. 氧B. 钠D. 氟2. 以下哪个元素的电子排布不是按照能量最低原理排列的?A. 氢B. 锂C. 氮D. 氧3. 化学键中,哪种键的性质是“头对头”的?A. 离子键B. 共价键C. 金属键D. 氢键4. 以下分子中,哪个是极性分子?A. CO2B. CH4C. H2OD. C2H45. 以下哪种化合物属于共价化合物?A. NaClC. H2OD. Fe6. 原子核外电子的排布遵循哪一条规则?A. 能量最低原理B. 泡利不相容原理C. 洪特规则D. 所有上述规则7. 以下哪种物质是离子晶体?A. 金刚石B. 石墨C. 食盐D. 干冰8. 以下哪种物质是金属晶体?A. 金刚石B. 石墨C. 铜D. 石英9. 以下哪种物质是分子晶体?A. 金刚石B. 石墨C. 铜D. 冰10. 以下哪种物质是原子晶体?A. 金刚石B. 石墨D. 冰答案:1. C 2. D 3. B 4. C 5. C 6. D 7. C 8. C 9. D 10. A二、填空题(每空1分,共10分)11. 原子中电子数等于________,质子数等于________。
12. 化学键的类型主要有________、________和金属键。
13. 根据分子的极性,分子可以分为________分子和极性分子。
14. 离子晶体是由________构成的,而金属晶体是由________构成的。
15. 原子晶体具有高硬度和高熔点的特性,这是因为它们具有________结构。
答案:11. 中子数,质子数 12. 离子键,共价键 13. 非极性 14. 离子,金属原子 15. 紧密排列的原子三、简答题(每题5分,共10分)16. 请简述什么是共价键,并给出一个例子。
17. 请解释什么是金属键,并说明金属晶体的一般特性。
答案:16. 共价键是由两个原子之间共享一对电子而形成的化学键。


第九章分子结构课后习题参考答案2解:(1)Hg 原子的价电子构型是:5d 106s 2因中心原子Hg 采用sp 杂化,则分子为直线形。
(2)因中心原子Si 采用sp 3杂化,则分子构型为正四面体(3)因中心原子B 采用sp 2杂化,则分子构型为平面三角形(4)因中心原子N 采用sp 3杂化,有一对孤对占据杂化轨道,所以分子构型为三角锥形(5)因中心原子N 采用sp 2杂化,有一对孤对占据杂化轨道,所以分子构型为V 形(6)因中心原子Si 采用sp 3d 2杂化,所以分子构型为正八面体3解:(1)42414=⨯+=VP ,σ键数为4,无孤对电子对,则价电子对空间构型和分子空间构型相同,均为正四面体。
用杂化轨道理论说明:因分子中共有四对成键,则需提供四条杂化轨道,所以Si 采用sp 3杂化形成四条sp 3杂化轨道供四对成键电子占据,分子构型为正四面体。
(2)224=+=VP ,σ键数为2,无孤对电子对,则价电子对空间构型和分子空间构型相同,均为直线形。
杂化轨道理论:(3)32133⨯+=VP ,σ键数为3,无孤对电子对,则价电子对空间构型和分子空间构型相同,均为平面三角形。
用杂化轨道理论说明:因分子中共有三对成键,则需提供三条杂化轨道,所以B 采用sp 2杂化形成三条sp 2杂化轨道供三对成键电子占据,分子构型为平面三角形。
(4)42135=⨯+=VP ,σ键数为3,有1对孤对电子对,则价电子对空间构型为四面体,而扣除孤对电子占据的位置,分子空间构型为三角锥形。
杂化轨道理论:(5)42126=⨯+=VP ,σ键数为2,有2对孤对电子对,则价电子对空间构型为四面体,而扣除孤对电子占据的位置,分子空间构型为V 形。
杂化轨道理论:(6)326=+=VP ,σ键数为2,有1对孤对电子对,则价电子对空间构型为平面三角形,而扣除孤对电子占据的位置,分子空间构型为V 形。
杂化轨道理论:4解:(1)521127=+⨯+=VP ,σ键数为2,有3对孤对电子存在,其价电子对空间构型为三角双锥,扣除孤电子对所占据的位置,其离子几何构型为直线形。


1、 NaCl与CaF
2
晶体的相同之处是:( B)
(A) 结构基元 (B) 负离子堆积方式 (C) 点阵型式
2、 4:4是下列哪一种晶体的CN
+/CN
-
:( C)
(A) CsCl (B) NaCl (C) 六方ZnS
3、对于CaF
2
晶体,“简单立方”一词描述的是它的( B )
(A) 负离子堆积方式 (B) 点阵型式 (C) 正离子堆积方式
4、某种离子晶体AB被称为NaCl型, 这指的是( B)
(A) 它的化学组成 (B) 它的结构型式 (C) 它的点阵型式
5、立方和六方ZnS的CN
+/CN
-
都是4:4: 它们在下列哪一点上不同?
A. 负离子堆积方式
B. 正离子所占空隙种类
C. 正离子所占空隙分数
6、CsCl型与CaF
2
型晶体在哪一点上相同?(B )
+ / CN
-
B.正离子所占空隙种类
C.正离子所占空隙分数
7、正、负离子半径比大于等于0.225、小于0.414时,CN
+
理论值是:(B)
A. 6
B. 4
C. 8
8、在离子晶体中,决定正离子配位数的关键因素是( A )
(A) 正负离子半径比 (B) 正负离子电价比 (C) 正负离子电负性之
9、 4:4是下列哪一种晶体的CN
+/CN
-
:( C)
(A) CsCl (B) NaCl (C) 六方ZnS。

第九章离子化合物的结构化学习题一、填空题1.某二元离子晶体AB 具有立方硫化锌型结构,试填写:(1)该离子晶体的点阵型式:________________________;(2)正离子A 2+的分数坐标:_________________________;(3)负离子B 2-的分数坐标:_________________________;(4)晶胞中结构基元数目:__________________________;(5)每个结构基元由多少个A 2+和B 2-组成:____________;(6)负离子B 2-的堆积方式:_________________________;(7)正离子所占空隙类型:__________________________;(8)正离子所占空隙分数:__________________________;(9)正离子至负离子间的静电键强度为:_____________;(10)和负离子直接邻接的正离子与该负离子间的静电键强度总和:_______。
2.已知KCl 晶体具有NaCl 型结构,Cl -和K +离子半径分别为181pm 和133pm ,则KCl 晶体之晶胞参数a =___________________。
3.已知Ca 2+和O 2-的离子半径分别为99pm 和140pm ,CaO 晶体中O 2-按立方最密堆积排列,晶体结构完全符合离子晶体的结构规律。
Ca 2+填入____________空隙中,晶体所属的点群为_____________,晶胞参数为_________________,晶体密度为________________。
(Ca 的相对原子质量40.0)4.实验测得钙离子的半径=99pm ,硫离子的半径=184pm 。
根据Pauling 规则推测CaS+2Ca r −2S r 晶体中Ca 2+离子周围由S 2-离子构成_____________配位多面体,Ca 2+离子周围S 2-离子的配位数是_______________。
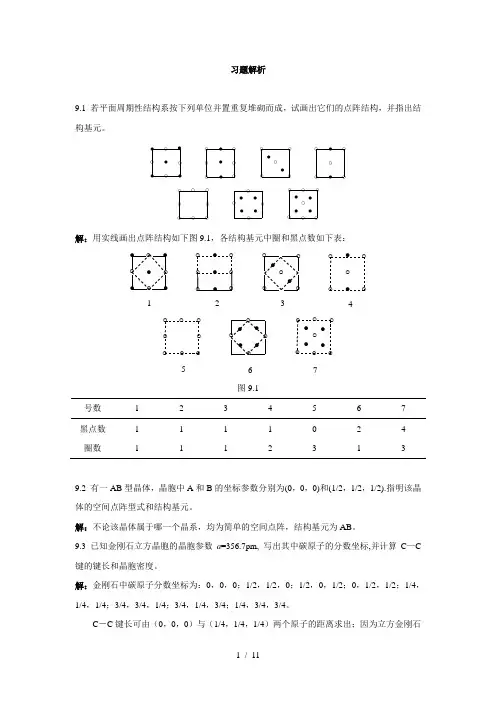
习题解析9.1 若平面周期性结构系按下列单位并置重复堆砌而成,试画出它们的点阵结构,并指出结构基元。
●●●●●●●●●●●●●●●●●●●●○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○解:用实线画出点阵结构如下图9.1,各结构基元中圈和黑点数如下表:●●●●●●●●●●●●●●●●●●●●○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○1234567图9.1号数 1 2 3 4 5 6 7黑点数 1 1 1 1 0 2 4 圈数 1 1 1 2 3 1 39.2 有一AB型晶体,晶胞中A和B的坐标参数分别为(0,0,0)和(1/2,1/2,1/2).指明该晶体的空间点阵型式和结构基元。
解:不论该晶体属于哪一个晶系,均为简单的空间点阵,结构基元为AB。
9.3 已知金刚石立方晶胞的晶胞参数a=356.7pm, 写出其中碳原子的分数坐标,并计算C—C 键的键长和晶胞密度。
解:金刚石中碳原子分数坐标为:0,0,0;1/2,1/2,0;1/2,0,1/2;0,1/2,1/2;1/4,1/4,1/4;3/4,3/4,1/4;3/4,1/4,3/4;1/4,3/4,3/4。
C-C键长可由(0,0,0)与(1/4,1/4,1/4)两个原子的距离求出;因为立方金刚石a=b=c =356.7pmr c-c=×356.7pm = 154.4pm 密度D =ZM/N A V=-1-10323-1812.0g mol (356.710cm)(6.022 10mol )⨯⋅⨯⨯⨯ = 3.51 g·cm -39.4 立方晶系的金属钨的粉末衍射线指标如下:110,200,211,220,310,222,321,400,试问:(a)钨晶体属于什么点阵形式?(b)X-射线波长为154.4pm, 220衍射角为43.62°,计算晶胞参数。

结构化学习题答案结构化学习题答案在学习过程中,结构化学习题是一种常见的形式,它能够帮助学生巩固知识,提高学习效果。
然而,有时候我们可能会遇到一些难题,不知道如何解答。
本文将为大家提供一些常见结构化学习题的答案,希望能够对大家的学习有所帮助。
一、化学方程式的平衡在化学方程式的平衡问题中,我们需要根据反应物和生成物的摩尔比例来确定化学方程式的系数。
例如,对于以下反应方程式:C6H12O6 + 6O2 → 6CO2 + 6H2O我们需要平衡方程式,使得反应物和生成物的原子数目相等。
根据反应物和生成物的原子数目,我们可以得到以下平衡方程式:C6H12O6 + 6O2 → 6CO2 + 6H2O这样,我们就平衡了方程式。
二、离子反应方程式的写法在离子反应方程式的写法中,我们需要根据反应物和生成物的离子式来写出方程式。
例如,对于以下反应方程式:NaCl + AgNO3 → AgCl + NaNO3我们需要根据反应物和生成物的离子式,写出离子反应方程式:Na+ + Cl- + Ag+ + NO3- → AgCl + Na+ + NO3-这样,我们就写出了离子反应方程式。
三、氧化还原反应方程式的平衡在氧化还原反应方程式的平衡问题中,我们需要根据氧化还原反应的电子转移来确定方程式的系数。
例如,对于以下反应方程式:Cu + AgNO3 → Cu(NO3)2 + Ag我们需要平衡方程式,使得电子数目相等。
根据电子转移的规律,我们可以得到以下平衡方程式:2Cu + 2AgNO3 → Cu(NO3)2 + 2Ag这样,我们就平衡了方程式。
四、化学计量问题在化学计量问题中,我们需要根据反应物的摩尔比例来计算生成物的量。
例如,对于以下反应方程式:2H2 + O2 → 2H2O我们需要根据反应物的摩尔比例,计算生成物的量。
假设我们有4 mol的H2,那么根据反应物的摩尔比例,我们可以计算出生成物的量为4 mol的H2O。
五、酸碱中和反应的计算在酸碱中和反应的计算中,我们需要根据反应物的摩尔比例来计算生成物的量。

离子化合物试题及答案一、选择题(每题2分,共10分)1. 下列化合物中,属于离子化合物的是()。
A. HClB. NaClC. H2OD. CO2答案:B2. 离子化合物中通常含有的化学键类型是()。
A. 共价键B. 离子键C. 金属键D. 氢键答案:B3. 离子化合物的晶体结构通常是()。
A. 分子晶体B. 离子晶体C. 金属晶体D. 共价晶体答案:B4. 离子化合物的熔点通常()。
A. 低于共价化合物B. 高于共价化合物C. 与共价化合物无关D. 无法确定答案:B5. 下列物质中,不属于离子化合物的是()。
A. MgOB. CaF2C. Na2OD. SO3答案:D二、填空题(每空1分,共10分)1. 离子化合物是由______和______通过静电作用力结合而成的化合物。
答案:阳离子;阴离子2. 离子化合物的熔点通常较高,这是因为离子化合物中的______需要被克服。
答案:离子键3. 在离子化合物中,阳离子通常是______元素,阴离子通常是______元素。
答案:金属;非金属4. 离子化合物的电导性通常在______状态下较好。
答案:熔融或水溶液5. 离子化合物的溶解性通常与______有关。
答案:离子的极性三、简答题(每题5分,共10分)1. 请简述离子化合物和共价化合物的区别。
答案:离子化合物是由阳离子和阴离子通过静电作用力结合而成的化合物,通常含有金属元素和非金属元素,熔点较高,电导性在熔融或水溶液状态下较好。
而共价化合物是由共用电子对形成的化合物,通常含有非金属元素,熔点较低,电导性较差。
2. 为什么离子化合物在水溶液中能导电?答案:离子化合物在水溶液中能导电是因为它们在水中能够离解成自由移动的阳离子和阴离子,这些离子在电场作用下可以移动,从而导电。
四、计算题(每题10分,共20分)1. 已知NaCl的摩尔质量为58.5g/mol,求1mol NaCl中含有多少个Na+离子和Cl-离子?答案:1mol NaCl中含有6.022×10^23个Na+离子和6.022×10^23个Cl-离子。

结构化学试题库及答案1. 请简述原子轨道的概念,并说明s、p、d轨道的形状。
答案:原子轨道是描述电子在原子核外的空间运动状态的数学函数。
s轨道呈球形,p轨道呈哑铃形,d轨道则有四个瓣状结构。
2. 什么是化学键?请列举三种常见的化学键类型。
答案:化学键是相邻原子之间强烈的相互作用,使得原子能够结合在一起形成分子或晶体。
常见的化学键类型包括离子键、共价键和金属键。
3. 描述分子轨道理论的基本原理。
答案:分子轨道理论是基于量子力学的化学键理论,认为分子中的电子不再属于单个原子,而是在整个分子范围内分布,形成分子轨道。
4. 什么是杂化轨道?请举例说明sp3杂化。
答案:杂化轨道是指原子轨道在形成化学键时,由于原子间的相互作用而重新组合成新的等价轨道。
sp3杂化是指一个s轨道和三个p轨道混合形成四个等价的sp3杂化轨道,常见于四面体构型的分子中。
5. 请解释价层电子对互斥理论(VSEPR)。
答案:价层电子对互斥理论是一种用来预测分子几何形状的理论,它基于中心原子周围的价层电子对(包括成键电子对和孤对电子)之间的排斥作用,从而推断出分子的空间几何结构。
6. 什么是超共轭效应?请给出一个例子。
答案:超共轭效应是指在有机分子中,非成键的σ电子与π电子之间的相互作用,这种效应可以增强分子的稳定性。
例如,在乙烷分子中,甲基上的σ电子可以与乙烯的π电子发生超共轭,从而稳定乙烯。
7. 描述共振结构的概念及其在化学中的重要性。
答案:共振结构是指分子中电子分布的两种或多种等效的描述方式,这些描述方式虽然不同,但都能合理地解释分子的性质。
共振结构在化学中的重要性在于它们提供了一种理解分子稳定性和反应活性的方法。
8. 什么是芳香性?请列举三个具有芳香性的化合物。
答案:芳香性是指某些环状有机化合物具有的特殊稳定性,这种稳定性来源于环上的π电子的离域化。
具有芳香性的化合物包括苯、吡啶和呋喃。
9. 请解释什么是分子的极性,并举例说明。
结构化学试题及答案一、选择题(每题2分,共10分)1. 以下哪个元素的原子核外电子排布遵循泡利不相容原理?A. 氢(H)B. 氦(He)C. 锂(Li)D. 铍(Be)答案:B2. 原子轨道的量子数l代表什么?A. 电子云的形状B. 电子云的径向分布C. 电子云的角动量D. 电子云的自旋答案:C3. 以下哪个化合物是离子化合物?A. 二氧化碳(CO2)B. 氯化钠(NaCl)C. 氮气(N2)D. 水(H2O)答案:B4. 共价键的形成是由于:A. 电子的共享B. 电子的转移C. 电子的排斥D. 电子的吸引答案:A5. 根据分子轨道理论,以下哪个分子是顺磁性的?A. 氮气(N2)B. 氧气(O2)C. 氟气(F2)D. 氢气(H2)答案:B二、填空题(每题2分,共10分)1. 原子轨道的量子数n=1时,可能的l值有______。
答案:02. 碳原子的价电子排布是______。
答案:2s^2 2p^23. 离子键是由______形成的。
答案:电子的转移4. 根据杂化轨道理论,甲烷(CH4)的碳原子采用______杂化。
答案:sp^35. 金属键的形成是由于______。
答案:电子的共享三、简答题(每题5分,共20分)1. 简述价层电子对互斥理论(VSEPR)的基本原理。
答案:价层电子对互斥理论认为,分子的几何构型是由中心原子周围的价层电子对之间的排斥作用决定的,这些电子对可以是成键电子对或孤对电子。
2. 什么是分子轨道理论?答案:分子轨道理论是一种化学理论,它将分子中的电子视为分布在整个分子空间内的轨道上,而不是局限于两个原子之间。
这些分子轨道是由原子轨道线性组合而成的。
3. 描述一下什么是超共轭效应。
答案:超共轭效应是指在有机分子中,通过σ键的π轨道与π键的π轨道之间的相互作用,从而降低π键的能级和增加σ键的稳定性的现象。
4. 什么是路易斯酸碱理论?答案:路易斯酸碱理论认为,酸是能够接受电子对的物种,而碱是能够提供电子对的物种。
结构化学习题答案结构化学是化学学科中的一个重要分支,它研究原子、分子和晶体的结构以及它们的性质。
以下是一些结构化学习题的答案示例:1. 原子轨道的能级顺序:- 根据量子力学理论,原子轨道的能级顺序通常遵循以下顺序:1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f。
2. 分子的几何构型:- 例如,水分子(H2O)的几何构型是弯曲的,因为氧原子与两个氢原子形成共价键,并且氧原子上有两对孤对电子。
3. 分子的极性:- 一个分子是否具有极性取决于其分子内电荷分布的对称性。
如果电荷分布不均匀,分子就是极性的。
例如,二氧化碳(CO2)分子是非极性的,因为它是线性的,电荷分布对称。
4. 晶体的点群对称性:- 晶体的点群对称性是指晶体结构中原子排列的对称性。
例如,立方晶体具有高对称性,其点群为O_h。
5. 分子轨道理论:- 分子轨道理论用于描述分子中电子的分布。
根据这一理论,原子轨道可以组合形成分子轨道,这些分子轨道可以是成键的、非键的或反键的。
6. X射线衍射分析:- X射线衍射是一种用于确定晶体结构的技术。
当X射线与晶体相互作用时,它们会被晶体中的原子散射,产生衍射图案,这个图案可以用来推断晶体的原子排列。
7. 化学键的类型:- 化学键主要包括共价键、离子键和金属键。
共价键是由两个原子共享电子对形成的,离子键是由电子从一个原子转移到另一个原子形成的,而金属键是由金属原子之间的电子云形成的。
8. 分子间力:- 分子间力包括范德华力、氢键和偶极-偶极相互作用。
这些力影响分子的物理性质,如沸点和溶解性。
9. 晶体缺陷:- 晶体缺陷包括点缺陷、线缺陷(如位错)和面缺陷(如晶界)。
这些缺陷可以影响晶体的物理和化学性质。
10. 配位化合物的结构:- 配位化合物是由中心金属原子或离子与配体通过配位键连接形成的。
结构化学课后习题答案结构化化学课后习题答案一、化学键与分子结构1. 选择题a) 正确答案:D解析:选择题中,选项D提到了共价键的形成是通过电子的共享,符合共价键的定义。
b) 正确答案:B解析:选择题中,选项B提到了离子键的形成是通过电子的转移,符合离子键的定义。
c) 正确答案:C解析:选择题中,选项C提到了金属键的形成是通过金属原子之间的电子云重叠,符合金属键的定义。
d) 正确答案:A解析:选择题中,选项A提到了氢键的形成是通过氢原子与高电负性原子之间的吸引力,符合氢键的定义。
2. 填空题a) 正确答案:共价键解析:填空题中,根据问题描述,两个非金属原子之间的键称为共价键。
b) 正确答案:离子键解析:填空题中,根据问题描述,一个金属原子将电子转移到一个非金属原子上形成的键称为离子键。
c) 正确答案:金属键解析:填空题中,根据问题描述,金属原子之间的电子云重叠形成的键称为金属键。
d) 正确答案:氢键解析:填空题中,根据问题描述,氢原子与高电负性原子之间的吸引力形成的键称为氢键。
二、有机化学1. 选择题a) 正确答案:C解析:选择题中,选项C提到了烷烃是由碳和氢组成的,符合烷烃的定义。
b) 正确答案:D解析:选择题中,选项D提到了烯烃是由含有一个或多个双键的碳原子组成的,符合烯烃的定义。
c) 正确答案:B解析:选择题中,选项B提到了炔烃是由含有一个或多个三键的碳原子组成的,符合炔烃的定义。
d) 正确答案:A解析:选择题中,选项A提到了芳香烃是由芳香环结构组成的,符合芳香烃的定义。
2. 填空题a) 正确答案:醇解析:填空题中,根据问题描述,含有羟基(-OH)的有机化合物称为醇。
b) 正确答案:醚解析:填空题中,根据问题描述,含有氧原子连接两个碳原子的有机化合物称为醚。
c) 正确答案:酮解析:填空题中,根据问题描述,含有羰基(C=O)的有机化合物称为酮。
d) 正确答案:酯解析:填空题中,根据问题描述,含有羧基(-COO)的有机化合物称为酯。
结构化学章节习题(含答案)第⼀章量⼦⼒学基础⼀、单选题: 1、32/sinx l lπ为⼀维势箱的状态其能量是:( a ) 22229164:; :; :; :8888h h h hA B C D ml ml ml ml 2、Ψ321的节⾯有( b )个,其中( b )个球⾯。
A 、3 B 、2 C 、1 D 、03、⽴⽅箱中2246m lh E ≤的能量范围内,能级数和状态数为( b ). A.5,20 B.6,6 C.5,11 D.6,174、下列函数是算符d /dx的本征函数的是:( a );本征值为:( h )。
A 、e 2xB 、cosXC 、loge xD 、sinx 3E 、3F 、-1G 、1H 、2 5、下列算符为线性算符的是:( c )A 、sine xB 、C 、d 2/dx 2D 、cos2x6、已知⼀维谐振⼦的势能表达式为V = kx 2/2,则该体系的定态薛定谔⽅程应当为( c )。
A [-m 22 2?+21kx 2]Ψ= E ΨB [m 22 2?- 21kx 2]Ψ= E Ψ C [-m 22 22dx d +21kx 2]Ψ= E Ψ D [-m 22 -21kx 2]Ψ= E Ψ 7、下列函数中,22dx d ,dxd的共同本征函数是( bc )。
A cos kxB e –kxC e –ikxD e –kx2 8、粒⼦处于定态意味着:( c )A 、粒⼦处于概率最⼤的状态B 、粒⼦处于势能为0的状态C 、粒⼦的⼒学量平均值及概率密度分布都与时间⽆关系的状态.D 、粒⼦处于静⽌状态9、氢原⼦处于下列各状态 (1)ψ2px (2) ψ3dxz (3) ψ3pz (4) ψ3dz 2 (5)ψ322 ,问哪些状态既是M 2算符的本征函数,⼜是M z 算符的本征函数?( c )A. (1) (3)B. (2) (4)C. (3) (4) (5)D. (1) (2) (5) 10、+He 离⼦n=4的状态有( c )(A )4个(B )8个(C )16个(D )20个 11、测不准关系的含义是指( d ) (A) 粒⼦太⼩,不能准确测定其坐标; (B)运动不快时,不能准确测定其动量(C) 粒⼦的坐标的动量都不能准确地测定;(D )不能同时准确地测定粒⼦的坐标与动量12、若⽤电⼦束与中⼦束分别作衍射实验,得到⼤⼩相同的环纹,则说明⼆者( b ) (A) 动量相同 (B) 动能相同 (C) 质量相同13、为了写出⼀个经典⼒学量对应的量⼦⼒学算符,若坐标算符取作坐标本⾝,动量算符应是(以⼀维运动为例) ( a )(A) mv (B) i x ?? (C)222x ?-? 14、若∫|ψ|2d τ=K ,利⽤下列哪个常数乘ψ可以使之归⼀化:( c )(A) K (B) K 2 (C) 1/K15、丁⼆烯等共轭分⼦中π电⼦的离域化可降低体系的能量,这与简单的⼀维势阱模型是⼀致的,因为⼀维势阱中粒⼦的能量( b )(A) 反⽐于势阱长度平⽅ (B) 正⽐于势阱长度 (C) 正⽐于量⼦数16、对于厄⽶算符, 下⾯哪种说法是对的( b )(A) 厄⽶算符中必然不包含虚数 (B) 厄⽶算符的本征值必定是实数(C) 厄⽶算符的本征函数中必然不包含虚数17、对于算符?的⾮本征态Ψ( c )(A) 不可能测量其本征值g . (B) 不可能测量其平均值.(C) 本征值与平均值均可测量,且⼆者相等18、将⼏个⾮简并的本征函数进⾏线形组合,结果( b )(A) 再不是原算符的本征函数(B) 仍是原算符的本征函数,且本征值不变 (C) 仍是原算符的本征函数,但本征值改变19. 在光电效应实验中,光电⼦动能与⼊射光的哪种物理量呈线形关系:( B )A .波长B. 频率C. 振幅20. 在通常情况下,如果两个算符不可对易,意味着相应的两种物理量( A)A .不能同时精确测定B .可以同时精确测定C .只有量纲不同的两种物理量才不能同时精确测定 21. 电⼦德布罗意波长为(C )A .λ=E /h B. λ=c /ν C. λ=h /p 22. 将⼏个⾮简并的本征函数进⾏线形组合,结果( A) A .再不是原算符的本征函数B .仍是原算符的本征函数,且本征值不变C .仍是原算符的本征函数,但本征值改变23. 根据能量-时间测不准关系式,粒⼦在某能级上存在的时间τ越短,该能级的不确定度程度ΔE (B)A .越⼩ B. 越⼤ C.与τ⽆关24. 实物微粒具有波粒⼆象性, ⼀个质量为m 速度为v 的粒⼦的德布罗意波长为:A .h/(mv)B. mv/hC. E/h25. 对于厄⽶算符, 下⾯哪种说法是对的 ( B )A .厄⽶算符中必然不包含虚数B .厄⽶算符的本征值必定是实数C .厄⽶算符的本征函数中必然不包含虚数 26. 对于算符?的⾮本征态Ψ (A ) A .不可能测得其本征值g. B .不可能测得其平均值.C .本征值与平均值均可测得,且⼆者相等 27. 下列哪⼀组算符都是线性算符:( C )A . cos, sinB . x, logC . x d dx d dx,,22⼆填空题1、能量为100eV 的⾃由电⼦的德布罗依波波长为( 122.5pm )2、函数:①xe ,②2x ,③x sin 中,是算符22dxd 的本征函数的是( 1,3 ),其本征值分别是( 1,—1;)3、Li 原⼦的哈密顿算符,在(定核)近似的基础上是:(()23213212232221223222123332?r e r e r e r e r e r e mH +++---?+?+?-= )三简答题1. 计算波长为600nm(红光),550nm(黄光),400nm(蓝光)和200nm(紫光)光⼦的能量。
结构化学课后习题答案结构化学是化学学科中的一个重要分支,它主要研究原子、分子以及晶体的结构和性质。
课后习题是帮助学生巩固和深化课堂知识的重要手段。
以下是一些结构化学课后习题的答案示例,请注意,这些答案仅为示例,具体习题的答案需要根据实际的习题内容来确定。
习题一:原子轨道的基本概念1. 描述s、p、d、f轨道的基本形状和特征。
- s轨道:球形,对称性高,只有一个轨道。
- p轨道:哑铃形,有两个主瓣,对称性较低,有三个轨道。
- d轨道:具有更复杂的形状,如四叶草形等,有五个轨道。
- f轨道:形状更为复杂,有七个轨道。
2. 解释原子轨道的量子数。
- 主量子数n:决定电子层,n越大,电子离原子核越远。
- 角量子数l:决定轨道形状,l的不同值对应不同的轨道类型。
- 磁量子数m:决定轨道在空间的取向。
- 自旋量子数s:描述电子自旋状态。
习题二:分子几何结构1. 描述价层电子对互斥理论(VSEPR)的基本原理。
- VSEPR理论基于电子对的排斥作用,认为电子对会尽可能地分布在原子周围,以减少排斥力,从而形成稳定的分子几何结构。
2. 根据VSEPR理论,预测CO2分子的几何形状。
- CO2分子中,碳原子有两个双键氧原子,没有孤对电子,根据VSEPR理论,分子呈线性结构。
习题三:晶体结构1. 解释晶体的布拉维格子和晶系。
- 布拉维格子:描述晶体中原子排列的几何结构,有简单立方、体心立方、面心立方等。
- 晶系:根据晶体的对称性,晶体可以分为立方晶系、四方晶系、六方晶系等。
2. 描述面心立方(FCC)晶体的特点。
- FCC晶体中,每个原子周围有12个相邻原子,形成紧密堆积结构,具有较高的对称性和密堆积度。
习题四:化学键1. 区分离子键、共价键和金属键。
- 离子键:由正负离子之间的静电吸引形成。
- 共价键:由原子间共享电子对形成,常见于非金属元素之间。
- 金属键:由金属原子与自由电子云之间的相互作用形成。
2. 描述氢键的特点及其在分子间作用中的影响。