二氧化氯的制备及注意事项
- 格式:docx
- 大小:18.22 KB
- 文档页数:12

二氧化氯的制备及注意事项一、原理:氯酸钠+盐酸法(全盐酸法或开斯汀法)。
反应方程式:NaClO3+2HCl= ClO2+1/2 Cl2+NaCl + H2O副反应为:2NaClO3+6HCl= 3Cl2+2NaCl+3 H2O通过理论计算可知:NaClO3+2HCl= ClO2+1/2 Cl2+NaCl + H2O106。
5/1。
56 +74/1.1= 67。
5/1+ 35。
5/.53+ 58.5/.87+ 18/.27 产生1吨二氧化氯需用1。
56吨氯酸钠、1.1吨氯化氢同时产生0。
53吨氯气、0。
87吨NaCl和0.27吨水.换算成氯酸钠溶液(1吨氯酸钠固体配2吨水),比重为1260kg/m3(20℃)体积为3.67m3。
氯化氢换算成盐酸(31%),比重为1160 kg/m3 (20℃)体积为3。
45m3.二、运行中的注意事项:1、反应温度:因为现场发生二氧化氯为化学反应,反应为吸热反应,所以对反应釜内温度要求较高。
据有关资料显示,反应釜内反应温度在50℃时原料转化率为50%。
在71℃时,原料转换率86%.当80℃时反应速度过快以副反应为主,氯气量大于二氧化氯量。
在现操作面板显示的温度为88℃—85℃为水浴温度不能真实代表反应釜内温度,特别在秋、春季当未点炉时,夜间氯库温度在—4—-5℃,点炉后氯库白天温度9℃,夜晚5℃。
而反应釜与水浴加热间隔着厚厚的PVC塑料板和聚四氟涂层(传热性不好),这一时期的加热如不及时,出液管温度会明显下降(反应效率特别低)。
建议对原料和进气加热,以弥补发生器加热量不足的问题,提高反应效率,降低副产物的产生量。
2、进气量的控制:进气的作用主要四个方面:(一)使原料充分混合,提高原料转换效率.(二)进气可降低二氧化氯的浓度,防止二氧化氯在发生器上部聚集发生爆炸。
(三)进气量的大小决定反应釜的液位,据厂家提供的资料,反应时间不应低于30min,但反应30min后,原料转换没有明显提高。

二氧化氯的制备方法二氧化氯(ClO2)是一种重要的化学品,具有强氧化性和消毒能力,广泛应用于水处理、工业生产和医疗卫生等领域。
下面将介绍几种常见的二氧化氯的制备方法。
1.二氯化钠酸化法:将二次氯化钠固体(NaClO2)溶解在水中,然后加入酸(如盐酸)进行酸化反应。
反应过程中生成的二氯化钠(NaCl)被进一步氧化为二氧化氯。
反应方程式如下:4NaClO2+4HCl→4ClO2+2H2O+2NaCl此方法操作简单,并且生成的二氧化氯浓度较高。
2.氢氧化钠酸化法:将二氯化钠固体溶解在水中,然后加入氢氧化钠进行酸化反应。
反应过程中生成的二氯化钠被氧化为二氧化氯。
反应方程式如下:3NaClO2+2NaOH→2ClO2+NaCl+NaClO3+H2O该方法中,氢氧化钠作为酸化剂,同时产生了多余的氯酸钠(NaClO3)。
3.过硫酸盐法:将过硫酸钠固体溶解在水中,然后加入二氯化钠进行反应。
反应过程中生成的过硫酸钠(Na2S2O8)与二氯化钠反应生成二氧化氯。
反应方程式如下:2NaClO2+Na2S2O8+2H2O→2ClO2+2NaHSO4+NaCl该方法中,过硫酸钠作为氧化剂,在反应中被还原为硫酸钠(NaHSO4)。
4.氯酸钠酸化法:将氯酸钠溶解在水中,然后加入酸进行酸化反应。
反应过程中生成的氯酸钠被氧化为二氧化氯。
NaClO3+2HCl→ClO2+H2O+NaCl该方法操作简单,但由于氯酸钠的价格相对较高,制备成本较高。
总结:以上是几种常见的二氧化氯的制备方法,它们有各自的特点和适用范围。
在实际应用中需根据具体情况选择适合的制备方法,并注意操作安全。
二氧化氯是一种有毒气体,应严格控制其浓度和排放,防止对环境和人体健康造成危害。

二氧化氯配制方法及记录二氧化氯是一种强氧化剂,具有强烈的氧化能力和杀菌作用。
它可以用于水处理、空气消毒、固体表面消毒等多个领域。
在使用过程中,正确的配制方法和记录是非常重要的。
下面,我将详细介绍二氧化氯的配制方法及记录。
一、二氧化氯配制方法1.材料准备-氯酸钠(NaClO3)或次氯酸钠(NaClO):作为原料,用来制备二氧化氯。
-氢酸(HCl)或者稀硫酸(H2SO4):用于反应过程中的酸化反应。
-水:作为溶剂,用来配制二氧化氯溶液。
2.配制过程-步骤1:将一定量的氯酸钠或次氯酸钠溶解在一定体积的水中,生成次氯酸钠溶液。
-步骤2:在次氯酸钠溶液中加入适量的氢酸或稀硫酸,使其酸化,生成二氧化氯。
3.反应方程式反应1:2NaClO3+4HCl→2ClO2+Cl2+2H2O+2NaCl反应2:5NaClO+4HCl→4ClO2+Cl2+2H2O+5NaCl二、二氧化氯配制记录配制二氧化氯时,需要进行相应的记录,以确保配制的准确性和追溯性。
以下是配制二氧化氯的记录信息的详细格式:日期:记录配制二氧化氯的日期。
配制人员:记录参与配制工作的人员信息。
配制原料及用量:-氯酸钠(或次氯酸钠):记录使用的氯酸钠或次氯酸钠的批号、使用量等信息。
-氢酸(或稀硫酸):记录使用的氢酸或稀硫酸的批号、使用量等信息。
配制过程:-步骤1:记录溶解氯酸钠或次氯酸钠的过程,包括使用的容器、溶解时间等信息。
-步骤2:记录加入氢酸或稀硫酸酸化的过程,包括使用的容器、酸化时间等信息。
反应情况:-反应方程:记录配制二氧化氯的反应方程式。
-反应时间:记录反应的时间,包括酸化反应和反应生成二氧化氯的时间。
-反应温度:记录反应过程中的温度变化。
配制结果:-生成物:记录配制过程中生成的二氧化氯的质量、浓度等信息。
-配制状态:记录配制成功、失败或有异常情况。
清理及储存:-清理过程:记录清理反应容器的过程,包括使用的清洗剂、清洗时间等信息。
-储存方式:记录储存二氧化氯溶液的方式,包括储存容器、储存条件等信息。

二氧化氯的制备
二氧化氯是一种常见的清洁剂和消毒剂。
二氧化氯的制备比较简单,只需要几个步骤即可完成。
第一步:准备原料:碱性水溶液、氯气及9%盐酸。
碱性水溶液可以用消石灰或碱性盐溶液制成,氯气可以从冶金或化学分销商处购买,9%盐酸可以在药店里买到。
第二步:用胶水将一只玻璃瓶的顶部和侧边部分完全密封,使瓶
子成为一个完整的密封空间,避免气体的泄漏。
第三步:将氯气慢慢地吹入密闭的玻璃瓶内,直到瓶内的气压达
到6-7 Kg/平方厘米为止,瓶内的气压应当接近于现实空气的温度。
第四步:将4000 ml碱性溶液放入玻璃瓶内,然后用一根细管,
把9%盐酸慢慢地倒入瓶内,保持9%盐酸的浓度在1-1.2摩尔/升。
第五步:将玻璃瓶内的气体放出,然后再把氯气慢慢地吹入瓶内,直到瓶内的压力再次升到6-7 Kg/平方厘米为止。
第六步:加热瓶内的溶液,达到60-80摄氏度,并保持一段时间,直到溶液发现无毒的盐酸消失,二氧化氯的溶液出现为止。
第七步:将溶液过滤,过滤液即为饱和的二氧化氯溶液,应在室
温下作为清洁剂和消毒剂使用。
以上就是二氧化氯的制备过程,尽管比较简单,但应当根据每一
步骤操作认真,并注意避免接触氯气,以免造成损伤。

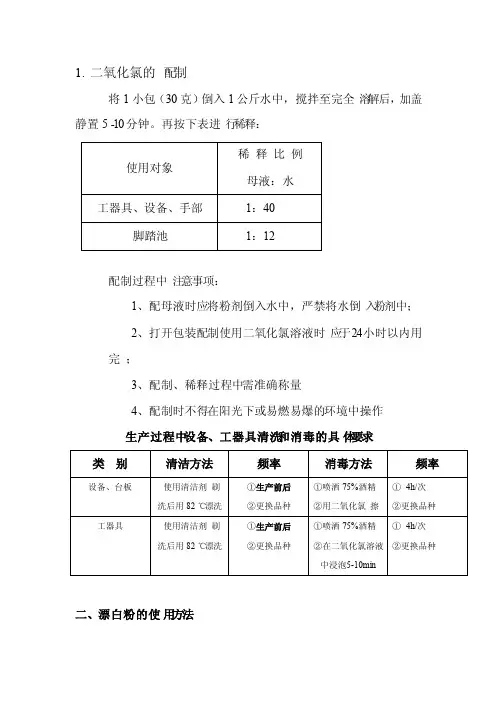
二氧化氯配制及使用作业指导书
1.用500g二氧化氯粉剂倒入25KG水中(严禁将水倒入粉剂中)搅
拌均匀。
2.溶液静置15分钟,直至粉剂完全溶解;既得25KG(浓度为
2000mg/L)的母液;待母液按规定比例加水稀释使用。
使用范围
2.1、母液不再次稀释,用于生产环境的空间、地面、墙面的熏蒸,每天熏蒸2-4小时。
2.2、车间入口处,鞋靴消毒池池水配比为1:16(用于鞋靴浸泡,约30秒);
2.3、车间环境喷洒液体配比为1:100(用于车间空间喷洒消毒);2.4、生产线设备、操作台喷洒液体配比为1:16(用于设备喷洒、擦拭至浸润30分钟);
2.5、容器、桶等杀菌消毒配比比例为1:13(喷洒、擦拭、浸泡5-10分钟);
2.6、半成品、成品传送工具杀菌消毒,溶液配比比例为1:13(喷洒、擦拭至浸润为30分钟);
2.7、设备操作员净手液配比比例为1:25(浸泡1-2分钟后自然风干或者吹干);
2.8、工作服日常消毒液配比比例为1:33(工作服浸泡约1分钟)。

二氧化氯的制取一、引言二氧化氯是一种强氧化剂,具有广泛的应用领域,如水处理、消毒、漂白等。
本文将介绍二氧化氯的制取方法及其工艺流程。
二、二氧化氯的制取方法1. 常温常压法常温常压法是制取二氧化氯的一种常用方法。
具体步骤如下:(1)将氯气通过液体二氧化硫中,生成氯气溶液。
(2)将氯气溶液通过激光照射或电解的方式,将氯气转化为二氧化氯气体。
(3)利用冷凝器将二氧化氯气体冷却成液态二氧化氯。
2. 高温高压法高温高压法是另一种常用的制取二氧化氯的方法。
具体步骤如下:(1)将氯气通过液体二氧化硫中,生成氯气溶液。
(2)将氯气溶液通过高温高压反应器,反应生成二氧化氯。
(3)利用冷凝器将二氧化氯冷却成液态。
三、二氧化氯的工艺流程1. 氯气制备氯气是二氧化氯制备的原料之一。
常见的氯气制备方法有电解法和氯化法。
其中,电解法是最常用的方法,通过电解食盐水或氯化铵溶液,产生氯气。
2. 二氧化硫制备二氧化硫是二氧化氯制备的另一个原料。
常见的二氧化硫制备方法有燃烧硫磺和矿石还原法。
其中,燃烧硫磺是最常用的方法,通过将硫磺燃烧产生二氧化硫气体。
3. 氯气溶液制备将氯气通过液体二氧化硫中,生成氯气溶液。
这一步骤可以在常温常压下进行。
4. 二氧化氯制备将氯气溶液通过激光照射或电解的方式,将氯气转化为二氧化氯气体。
这一步骤可以在常温常压下进行,也可以通过高温高压反应器进行。
5. 二氧化氯液体制备利用冷凝器将二氧化氯气体冷却成液态二氧化氯。
这一步骤可以在常温常压下进行。
四、二氧化氯的应用领域1. 水处理二氧化氯可以用于水处理,能有效杀灭水中的细菌、病毒和寄生虫等微生物,净化水质。
2. 消毒由于二氧化氯具有强氧化性,可以用于消毒。
它可以杀灭空气中的细菌、病毒,保持空气清洁。
3. 漂白二氧化氯也可以用于漂白过程。
它可以去除纸浆中的色素和杂质,使纸张更加白净。
五、结论二氧化氯的制取方法主要包括常温常压法和高温高压法。
其工艺流程包括氯气制备、二氧化硫制备、氯气溶液制备、二氧化氯制备和二氧化氯液体制备。

二氧化氯的工业制备二氧化氯是一种常用的强氧化剂,具有较强的杀菌消毒能力,在工业上被广泛应用于水处理、漂白剂生产等领域。
下面将介绍二氧化氯的工业制备过程。
一、工业制备二氧化氯的原理二氧化氯可以通过以下反应得到:2NaClO3 + 4HCl → 2ClO2 + Cl2 + 2H2O + 2NaCl二、工业制备二氧化氯的步骤1. 选用合适的原料和设备。
通常使用氯酸钠(NaClO3)和盐酸(HCl)作为原料,同时需要选择合适的反应设备,保证反应的安全进行。
2. 混合原料。
按照一定的比例将氯酸钠和盐酸混合,形成反应物溶液。
通常采用连续进料的方式,即将氯酸钠和盐酸分别加入反应槽中,控制好进料速度和比例。
3. 反应生成二氧化氯。
混合原料后,通过控制反应温度和反应时间,使得反应物发生化学反应,生成二氧化氯。
4. 分离纯化二氧化氯。
由于反应产物中可能还包含其他气体或杂质,需要对反应产物进行分离纯化。
通常采用冷凝、吸附等方法,将二氧化氯从反应混合物中分离出来,得到纯净的二氧化氯。
三、工业制备二氧化氯的注意事项1. 安全操作。
由于二氧化氯具有较强的氧化性和毒性,操作人员应佩戴防护设备,并按照安全操作规程进行操作。
2. 控制反应条件。
反应温度、反应时间等条件的控制对于反应效果和产物纯度具有重要影响,需要合理调控。
3. 设备维护保养。
反应设备需要定期维护保养,防止设备老化或损坏对反应过程产生影响。
4. 废气处理。
二氧化氯反应产生的废气需要经过处理,避免对环境造成污染。
四、工业制备二氧化氯的应用领域1. 水处理。
二氧化氯具有较强的杀菌消毒能力,广泛应用于自来水、游泳池、污水处理等领域,可以有效杀灭细菌、病毒和藻类。
2. 漂白剂生产。
二氧化氯作为一种强氧化剂,可用于漂白剂的生产,如纸浆漂白、织物漂白等。
3. 化工原料。
二氧化氯还可以用作一些化工反应的氧化剂,参与有机合成反应等。
总结:工业制备二氧化氯是通过混合氯酸钠和盐酸,控制反应温度和时间,分离纯化产物等步骤完成的。

二氧化氯使用方法二氧化氯是一种具有强氧化性能的化学物质,可用于消毒和净化水源、空气等环境中的有害物质。
下面将从二氧化氯的定义、制备方法、使用注意事项以及常见的应用领域等方面进行详细介绍。
一、二氧化氯的定义二氧化氯(ClO2)是一种黄绿色气体,其化学式为ClO2。
它具有很强的氧化性能,能有效杀灭细菌、病毒、真菌和其他有害微生物,同时能分解有机物和氯化副产物。
二、二氧化氯的制备方法常见的二氧化氯制备方法有两种:酸法和碱法。
1. 酸法制备:将硫酸与亚氯酸反应,生成亚氯酸氯根离子和离子氧并释放出二氧化氯气体,然后通过净化设备去除杂质得到纯净的二氧化氯气体。
2. 碱法制备:将氯气气体通入氢氧化钠溶液中,经氧化反应生成二氧化氯溶液,再通过蒸发和冷凝得到纯净的二氧化氯气体。
三、二氧化氯的使用方法1. 水源消毒:将适量二氧化氯粉末或液体投入水中,通过搅拌或循环泵进行混合,使二氧化氯充分接触水体中的有害微生物,起到杀菌消毒的作用。
具体投药量根据水质、水量和所需消毒效果而定。
2. 空气净化:可以将二氧化氯溶液或气体喷洒或释放到空气中,使其接触空气中的有害气体和微生物,具有净化空气、消除异味的效果。
使用时注意通风,避免浓度过高对人体造成伤害。
3. 食品消毒:对生鲜食品、水果、蔬菜等进行消毒处理。
可以将食品浸泡在含有二氧化氯的水中,或使用二氧化氯溶液喷洒在食品表面,消除细菌、病毒和其他有害微生物。
4. 医疗领域:二氧化氯可以用于医疗设施、手术室、病房、药品包装等的消毒和灭菌。
注意在使用时选择适当的剂量和处理方法,以确保消毒效果和安全性。
5. 工业应用:二氧化氯广泛应用于造纸、纺织、化工、食品加工等工业领域,用于漂白纸浆、除去颜色、净化废水等。
四、二氧化氯的注意事项1. 二氧化氯具有一定的毒性,使用时要佩戴适当的防护用品,如手套、口罩、护目镜等,以确保安全。
2. 使用时要遵循正确的使用方法和剂量,严禁超量使用。
3. 二氧化氯遇到明火或高温会发生爆炸,存储和使用时要注意避免接触火源。

二氧化氯的制备一.实验原理2NaClO3+2H2C2O4→2CO2+2ClO2+2H2O+Na2C2O4二.实验试剂氯酸钠草酸去离子水冰块三.实验仪器水浴锅三口瓶(250mL)搅拌器温度计(两支)蒸馏烧瓶(250mL)玻璃杯(500mL)分析天平插管(两支)橡胶管橡胶接头铁架台通风橱等。
四.实验步骤1.按顺序连接好反应仪器。
(将搅拌器放入三口瓶,再把三口瓶放入水浴锅中,用玻璃管和橡胶管连接三口瓶和蒸馏烧瓶。
将反应仪器固定于铁架台上。
)2.用分析天平称取200mg氯酸钠和250mg草酸晶体放置于水浴锅的三口瓶中,再放入10mL去离子水。
在蒸馏烧瓶中放入100mL去离子水。
将蒸馏烧瓶置于烧杯中冷水浴。
3.打开三口瓶中的搅拌器,控制水浴温度为90。
C条件进行反应。
同时控制冷水浴温度为0。
C--2。
C。
4.控制反应时间约为20分钟。
5.将制得的二氧化氯水溶液低温密闭放置暗处备用。
五.实验注意事项:1.氯酸钠与草酸的投加量之比为1:1.5,反应温度为90--95。
C时二氧化氯产量为最大,可达90%以上。
控制冷水浴温度为0。
C--2。
C时可完全吸收产生的二氧化氯。
三口瓶中加入10mL去离子水时,二氧化氯产率为50%.2.该实验的二氧化氯产率约为50%.制得的二氧化氯浓度约为0.5g/L。
3.反应应在通风橱中进行。

二氧化氯的制法二氧化氯是一种强氧化剂,具有广泛的应用价值。
它可以用于水处理、消毒、漂白等领域。
本文将介绍二氧化氯的制法。
一种常见的二氧化氯制法是通过电解盐酸钠溶液来制备。
具体步骤如下:准备好所需的材料和设备。
需要准备的材料包括食盐(氯化钠)、盐酸和纯净水。
需要准备的设备有电解槽、电源、电极等。
接下来,将盐酸和纯净水按一定比例混合,制备成一定浓度的盐酸溶液。
这一步骤是为了提供所需的氯离子。
然后,将制备好的盐酸溶液倒入电解槽中,并将电解槽的两个电极分别连接到电源上。
通电后,电解槽中的盐酸溶液会发生电解反应。
在电解过程中,电极会释放出氯离子。
正极上的氯离子会与水分子发生反应,生成次氯酸根离子(ClO-)。
而负极上的水分子会发生水解,生成氢气和氢氧根离子(OH-)。
次氯酸根离子(ClO-)是二氧化氯的前体。
在电解槽中,次氯酸根离子会与盐酸溶液中的氯离子反应,生成二氧化氯(ClO2)。
通过适当的处理,可以将生成的二氧化氯气体收集起来。
二氧化氯气体可以用于水处理、消毒、漂白等不同的应用领域。
除了电解法,还有其他一些制备二氧化氯的方法。
例如,可以通过氯气与二氧化硫反应来制备二氧化氯。
这种方法需要严格控制反应条件,以确保反应的安全和高效进行。
二氧化氯是一种重要的化学品,具有广泛的应用。
通过电解盐酸钠溶液可以制备二氧化氯,这是一种常见的制备方法。
无论是电解法还是其他方法,制备二氧化氯都需要严格控制反应条件和操作过程,以确保安全和高效。
希望本文的介绍对您了解二氧化氯的制法有所帮助。
二氧化氯的制备二氧化氯是一种极易爆炸的强氧化性气体,在生产和使用时必须尽量用稀有元素气体进行稀释,同时需要避免光照、震动或加热。
因此,二氧化氯的制备方法一直科学家长期寻求解决的问题。
目前,世界常用的二氧化氯制备方法主要集中为三种。
1.氯酸钠与浓盐酸反应法(Kestiog法)目前,欧洲一些国家主要采用氯酸钠(NaClO3)氧化浓盐酸的制备方法,化学反应方程式为:2NaClO3+4HCl(浓)=2NaCl+Cl2↑+2ClO2↑+2H2O。
此法的缺点主要是同时产生了大量的氯气,不仅产率低,而且产品难以分离,同时很有可能造成环境污染。
2.亚氯酸钠与氯气反应法我国的科学家经过科学探索,发现一种优于欧洲的制备方法,将经干燥空气稀释的氯气通入填充有固体亚氯酸钠(NaClO2)的反应柱内制得。
化学反应方程式为:2NaClO2+Cl2=2NaCl+2ClO2。
此法的特点是安全性好,没有产生毒副产品。
3.草酸还原法最近,科学家又研究出了一种新的制备方法,在酸性溶液中用草酸(H2C2O4)还原氯酸钠,化学反应方程式为:H2C2O4+2NaClO3+H2S O4 =△= Na2SO4+2CO2↑+2ClO2↑+2H2O和2KClO3+H2C2O4=K2CO3+CO2↑+2ClO2↑+H2O此法的最大特点是由于反应过程中生成的二氧化碳的稀释作用,大大提高了生产及储存、运输的安全性。
4.亚氯酸钠与盐酸反应法目前,常用的制备高纯二氧化氯的方法,化学反应方程式为:5NaClO2+4HCl=4ClO2+5NaCl+2H2O,此工艺产物中纯度一般高达95%以上,需要现场制备现场使用。
运用高耐腐材料制作的二氧化氯发生器能够满足应用。
5.氯酸钾与二氧化硫反应法优点是可以利用二氧化硫减少空气污染,化学反应方程式为:2KClO3+SO2=2ClO2+K2SO4、6.氯酸钠与亚硫酸钠反应法实验室常用氯酸钠(NaClO3)和亚硫酸钠(Na2SO3)用硫酸酸化,加热制备二氧化氯,化学反应方程式为:2NaClO3+Na2SO3+H2SO4==△==2ClO2↑+2Na2SO4+H2O编辑本段二氧化氯的用途二氧化氯因为其具有杀菌能力强,对人体及动物没有危害以及对环境不造成二次污染等特点而备受人们的青睐。
制备二氧化氯的安全要求1. 了解化学品的特性在制备二氧化氯之前,必须了解该化学品的特性。
二氧化氯是一种强氧化剂,具有不稳定性和易爆性。
它应该被视为危险化学品,遵循相关的安全操作规程。
2. 保持良好通风制备二氧化氯必须在通风设施良好的实验室中进行。
二氧化氯在水中溶解时会释放出大量气体,会造成空气中二氧化氯的浓度升高,对人体健康造成危害。
因此,在制备过程中要确保良好的通风环境,向室外排放有害气体。
3. 做好安全防护措施制备二氧化氯的过程中应当穿戴适当的个人防护装备,如防护面罩、防护手套、防护服等。
同时,建议在实验室内放置应急设备和急救药品,以便在发生意外事故时立即处理。
4. 分离制备区域考虑到二氧化氯的易燃性和毒性,为了保证实验人员的安全,制备区域应当与实验室内其他区域分离。
在这个区域内,应当单独放置制备所需的化学试剂,并按照正确的实验方法操作。
5. 严格控制通风由于二氧化氯具有气态,需要严格控制通风,以避免它积聚在空气中,导致无法预料的爆炸和健康危害。
在制备过程中,应当使用适当的排风系统、透风设备,以及正确的实验室操作方法,确保安全。
6. 正确使用化学试剂在制备二氧化氯的过程中,涉及到多个化学试剂的使用。
实验人员应当对化学试剂的性质、用量、操作方法等进行充分了解,并严格按照操作规程进行操作。
7. 做好废弃物处理制备过程中可能会产生有害废弃物,包括二氧化氯,以及与二氧化氯反应的其它氯化物等。
这些废弃物应当严格按照规定处理,以减少对环境和工作人员的危害。
8. 合适地存储化学品在制备之后,二氧化氯应当存储在特定的容器内,在干燥、阴凉、通风的区域内。
禁止长时间接触阳光、热源、火源等高温及火灾易发区域。
制备二氧化氯是一项较危险的实验,严格遵守安全操作规程是非常必要的。
通过合理的实验准备工作和安全防范措施,可以降低事故的风险,保障人身安全和实验室的环境安全。
二氧化氯的制法二氧化氯是一种强氧化剂,可以用于消毒、漂白、污水处理等领域。
它具有高效、快速、无毒、无臭的特点,被广泛应用于饮用水处理、游泳池消毒、食品加工等领域。
下面将介绍二氧化氯的制法。
一、二氧化氯的制法1. 氯酸钠和硫酸反应制取二氧化氯二氧化氯可以通过氯酸钠和硫酸的反应制取。
具体步骤如下:将氯酸钠溶解在水中,生成氯酸钠溶液。
然后,在搅拌的过程中,将硫酸缓慢地加入氯酸钠溶液中。
反应过程中会产生氯气和二氧化氯。
将氯气和二氧化氯的混合气体通过冷凝器冷却,得到液态的二氧化氯。
这种方法制取的二氧化氯纯度较高,适用于工业生产。
2. 氯酸钠和次氯酸钠反应制取二氧化氯除了与硫酸反应制取二氧化氯外,氯酸钠还可以与次氯酸钠反应制取二氧化氯。
具体步骤如下:将氯酸钠溶解在水中,生成氯酸钠溶液。
然后,将次氯酸钠溶液加入氯酸钠溶液中,通过搅拌使两者充分混合。
在反应过程中,次氯酸钠会被还原为氯酸钠,同时生成二氧化氯气体。
将二氧化氯气体通过冷凝器冷却,得到液态的二氧化氯。
这种方法制取的二氧化氯适用于小规模的生产和实验室使用。
3. 双氯酸钠反应制取二氧化氯双氯酸钠是一种常见的二氧化氯制剂,可以通过双氯酸钠的分解反应制取二氧化氯。
具体步骤如下:将双氯酸钠溶解在水中,生成双氯酸钠溶液。
然后,加热双氯酸钠溶液,使其分解为氯酸钠和二氧化氯。
将生成的二氧化氯气体通过冷凝器冷却,得到液态的二氧化氯。
这种方法制取的二氧化氯操作简单,适用于小规模的制备。
二、二氧化氯的应用1. 饮用水处理二氧化氯可以有效杀灭饮用水中的细菌、病毒和其他微生物,保证水质安全。
它比氯气和次氯酸钠更稳定,不会产生氯味,也不会形成有害的副产物。
2. 游泳池消毒二氧化氯可以快速杀灭游泳池中的细菌和其他病原体,保持水质清洁卫生。
与传统的氯气和次氯酸钠相比,二氧化氯无臭味,不刺激眼睛和皮肤。
3. 食品加工二氧化氯可以用于食品加工过程中的消毒和漂白。
它可以有效杀灭食品中的细菌和其他微生物,延长食品的保鲜期。
二氧化氯的制备方法二氧化氯是一种具有强氧化性和高效杀菌能力的化学物质,常用于水处理、消毒、漂白等方面。
下面将介绍三种常见的制备二氧化氯的方法。
1.氯酸钠和氯化钾法:原料:-氯酸钠(NaClO3)(固体)-氯化钾(KCl)(固体)-浓硫酸(H2SO4)(液体)步骤:(1)将氯酸钠和氯化钾以适当的摩尔比例混合,通常为氯酸钠与氯化钾的摩尔比为1:1(2)加入足够量的浓硫酸来与氯酸钠反应,生成二氧化氯。
(3)反应中产生的二氧化氯气体可以通过收集和液化的方式进行收集和储存。
氯酸钠和氯化钾法制备二氧化氯的优点是原材料易得,反应条件简单,反应产生的二氧化氯纯度较高。
但是,需要注意的是,制备过程中需要严格控制反应温度和浓硫酸用量,以确保反应的安全性和高效性。
2.连续电解法:原料:-浓盐酸(HCl)(液体)-硫酸(H2SO4)(液体)-铂电极步骤:(1)将浓盐酸和硫酸以适当的比例混合,通常为1:1(2)在电解槽中装填好阳极(一般为铂电极),并将阴极与阳极分隔。
(3)通入电解液并加热至适当温度,开始电解。
(4)通过电解,电解液中的氯化物离子被氧化生成氯气,并与硫酸反应生成二氧化氯。
连续电解法制备二氧化氯的优点是反应过程简单,操作容易控制,产品纯度较高。
然而,需要注意的是,该方法的装置和电源要求较高,且电解液的浓度、温度等参数需要精确控制。
3.超声波法:原料:-氯酸(HClO3)(液体)步骤:(1)将氯酸加入超声波反应器。
(2)通过超声波作用,将氯酸分解为氯离子和氧离子。
(3)氧离子进一步分解为次氯酸根离子和氢离子。
(4)次氯酸根离子与氯离子反应生成二氧化氯。
超声波法制备二氧化氯的优点是反应时间短,反应效率高。
但是,这种方法需要较高的超声波频率和功率,且设备成本较高。
总结:制备二氧化氯的方法有很多,以上介绍了常见的三种方法。
选择适合的方法需要考虑反应条件、原料成本、产品纯度等多个方面的因素。
在实际应用中,还需要考虑到安全性和环保性,选择最合适的制备方法。
二氧化氯介绍及配制方法
一、介绍
本品是以二氧化氯为主要有效成分的高效消毒剂,含量为10%。
可杀灭肠道致病菌、化脓性球菌、致病性酵母菌和枯草杆菌黑色变种芽孢。
适用于一般物体表面消毒,餐饮具消毒,生活饮用水消毒及医院污水处理消毒。
食品饮料,乳制品,肉类,水产品,食用菌,果蔬等食品加工生产过程中的环境,设备,容器具,CIP管道的消毒,以及人员,衣物,手足部的消毒.非金属医疗器械的消毒,灭菌。
二、配制方法
取二氧化氯50克倒入装有2。
5公斤清水的容器中,(100g-5Kg;50g-2.5Kg;30g-1。
5Kg20g-1Kg)(严禁将水倒入粉剂)搅拌至溶解,加盖活化大约15-30分钟,即得到2.5公斤含量为2000mg/L的二氧化氯消毒剂母液,然后将消毒剂母液按下表所列比列稀释至对应的使用浓度使用。
二氧化氯消毒剂母液配制记录。
二氧化氯制备原理一、引言二氧化氯(ClO2)是一种强氧化剂,具有广泛的应用领域,包括水处理、消毒、漂白等。
其制备方法有多种,其中以二氯类化合物的氧化反应是最常用的制备二氧化氯的方法之一。
二、二氧化氯制备原理二氧化氯的制备原理基于二氯类化合物的氧化反应,一般采用二氧化氯发生器进行制备。
二氧化氯发生器是由二氧化氯发生剂和酸性活化剂组成的系统。
1. 二氧化氯发生剂二氧化氯发生剂一般是指含有氯的化合物,常用的发生剂有二氧化氯钠(NaClO2)和次氯酸钠(NaClO)。
其中,二氧化氯钠是最常用的发生剂之一。
二氧化氯钠在酸性条件下可以发生以下反应:2NaClO2 + 4HCl → ClO2 + Cl2 + 2NaCl + 2H2O反应中,二氧化氯钠被酸性条件下的氯离子还原为氯气和氯化钠,同时生成二氧化氯和水。
2. 酸性活化剂酸性活化剂的作用是提供酸性环境,促进二氧化氯发生剂的氧化反应。
常用的酸性活化剂有硫酸(H2SO4)、盐酸(HCl)等。
酸性活化剂与二氧化氯发生剂反应的化学方程式如下:H2SO4 + 2NaClO2 → ClO2 + Na2SO4 + H2O反应中,酸性活化剂与二氧化氯发生剂发生反应,生成二氧化氯和相应的盐酸。
三、二氧化氯制备的操作步骤二氧化氯的制备通常经过以下几个步骤:1. 酸性环境的建立在二氧化氯发生器中,首先需要建立酸性环境。
此步骤中,将酸性活化剂(如硫酸)加入发生器中,并与水混合,调整pH值为酸性。
2. 二氧化氯发生剂的加入在建立酸性环境后,将二氧化氯发生剂(如二氧化氯钠)加入发生器中。
同时,根据实际需要,控制发生剂的加入量。
3. 混合搅拌加入二氧化氯发生剂后,通过搅拌使其充分混合,并促进反应的进行。
4. 二氧化氯的收集在反应进行过程中,二氧化氯会被释放出来。
需要使用适当的装置将二氧化氯进行收集和处理,以便后续的应用。
四、安全注意事项在二氧化氯的制备过程中,需要注意以下安全事项:1. 酸性活化剂的使用需要小心,避免与皮肤和眼睛接触,必要时应佩戴防护手套和护目镜。
二氧化氯的制备及注意事项一、原理:氯酸钠+盐酸法(全盐酸法或开斯汀法)。
反应方程式:NaClO3+2HCl= ClO2+1/2 Cl2+NaCl + H2O副反应为:2NaClO3+6HCl= 3Cl2+2NaCl+3 H2O通过理论计算可知:NaClO3+2HCl= ClO2+1/2 Cl2+NaCl + H2O106.5/1.56 +74/1.1= 67.5/1+ 35.5/.53+ 58.5/.87+ 18/.27 产生1吨二氧化氯需用1.56吨氯酸钠、1.1吨氯化氢同时产生0.53吨氯气、0.87吨NaCl和0.27吨水。
换算成氯酸钠溶液(1吨氯酸钠固体配2吨水),比重为1260kg/m3 (20℃)体积为3.67m3。
氯化氢换算成盐酸(31%),比重为1160 kg/m3 (20℃)体积为3.45m3。
二、运行中的注意事项:1、反应温度:因为现场发生二氧化氯为化学反应,反应为吸热反应,所以对反应釜内温度要求较高。
据有关资料显示,反应釜内反应温度在50℃时原料转化率为50%。
在71℃时,原料转换率86%。
当80℃时反应速度过快以副反应为主,氯气量大于二氧化氯量。
在现操作面板显示的温度为88℃—85℃为水浴温度不能真实代表反应釜内温度,特别在秋、春季当未点炉时,夜间氯库温度在-4—-5℃,点炉后氯库白天温度9℃,夜晚5℃。
而反应釜与水浴加热间隔着厚厚的PVC塑料板和聚四氟涂层(传热性不好),这一时期的加热如不及时,出液管温度会明显下降(反应效率特别低)。
建议对原料和进气加热,以弥补发生器加热量不足的问题,提高反应效率,降低副产物的产生量。
2、进气量的控制:进气的作用主要四个方面:(一)使原料充分混合,提高原料转换效率。
(二)进气可降低二氧化氯的浓度,防止二氧化氯在发生器上部聚集发生爆炸。
(三)进气量的大小决定反应釜的液位,据厂家提供的资料,反应时间不应低于30min,但反应30min后,原料转换没有明显提高。
在实际运行中应根据生产条件,适当延长反应时间以提高转换效率。
(四)二氧化氯具有遇曝气即从溶液中逸出的特性,可降低反应液中的二氧化氯含量,防止因反应液内二氧化氯含量超30%发生的爆炸。
3、原料的进料量:通过理论计算可知: 3.67 :3.45 (溶液体积比)。
但厂家规定1:1。
酸过量,主要提高氯酸钠转换率,防止未反应的氯酸钠进入出厂水污染水质。
在实际工作中要严格掌握原料进料比例,防止因进料比例不当,而导致的原料转换率低,并产生大量副产物污染水质和生产成本的不必要增加。
三、关于二氧化氯在水厂使用的建议随着水质标准的提高及水源微污染日益严重,二氧化氯必将替代氯气在水厂大量使用。
二氧化氯在水厂应用后将出现新的问题,为了更好的应用二氧化氯应加强以下几方面的工作。
⒈加强操作人员技术水平。
由于二氧化氯须现场发生,所以二氧化氯发生器的运行效率取决于操作人员的技术水平。
应组织他们进行系统的培训,包括性质、原理、反应条件、操作要点等。
(厂家没有这方面的经验尤其用户使用目的各不相同,应编写相应的教材及操作规程。
)⒉建立科学规范的管理体系。
由于二氧化氯现场发生是化学变化,不象氯气是简单的物理变化。
应建立一套相应管理体系如原料质量的检测、复配、进料数量、反应时间、反应温度、设备清洗、维护等管理标准和管理手段。
⒊针对二氧化氯的特点进行工艺改造。
由于二氧化氯的化学性质较氯气有很大不同,所以在应用时针对其特性相应的进行改造。
例如低浓度杀菌效果突出、遇光分解、遇瀑气溢出、自身分解等。
相应的调整投加点、避光、缩短工艺流程时间等。
⒋针对二氧化氯发生器的情况及现场条件进行适应性改造。
二氧化氯发生器的效率是厂家在标准条件下测定出来的,在生产实际工作中应达不到相应条件。
实际工作中,应根据发生器的特点及本身实际工作条件,抓住影响效率的主要因素,进行相应的进行调整、改造,使发生器在高效率状态下运行。
如反应温度、反应时间等,从而提高效率,降低生产成本,提高水质。
四、二氧化氯发生器操作规程:⑴、设备运行中的检查:1、操作面板数据是否正常。
(温度,频率等)2、检查进气量是否正常,反应釜液位及反应液颜色是否正常。
(保证有充足的反应时间)3、检查计量泵声音及机温是否正常有无泄露。
4、检查水浴液位是否正常。
5、检查氯酸钠及盐酸罐液位是否正常。
(不要低于计量泵中心线)6、观察出液管单流阀是否有异物及动作是否灵活。
7、防爆塞是否正常。
8、出液管温度是否正常。
(不低于35℃)(2)、开机:1、检查水浴及反应釜内液位应在1/3处。
(液位管)2、开启温控器使水浴温度升至设定温度。
(85~88℃)3、排除计量泵内空气并校定计量泵(校定应以背压阀后出液量为准,同时应保持同一机器的两台泵计量泵背压一致)背压应高于进口最大压力1bar。
4、调整动力水压力至稳定状态,使水射器稳定工作。
5、运行计量泵,并逐步调整至所需流量。
6、待运行稳定后调整反应釜处于最佳液位。
(保证最少反应时间30分钟以上)7、观察反应釜液位管颜色,单流阀工作状态及出液管温度是否正常。
(3)、关机及发生器清冲:1、停止计量泵工作。
2、打开进水阀,稀释反应釜内反应液浓度将反应釜内浓度降至安全浓度(反应釜内颜色基本无色),关闭进水阀。
3、停止水射器工作。
4、停止水浴加热。
5、将进气孔用堵死,从安全塞进水,将反应釜内注满水浸泡十分钟,后将水从排污阀排出。
6、重新进水至反应釜1/3处。
(液位管)负压复合型发生器适用4)、原料的配制与添加:氯化钠:1、氯酸钠配制工作人员应穿戴好防护用具。
(防酸碱工作服、护目镜、口罩、防酸碱手套、长统胶鞋)2、配制过程中有严禁吸烟及明火。
(不许使用摔砸等方法)3、配制过程必须按照氯酸钠与水按1:2的比例混合。
(例如:1公斤氯酸钠加2公斤水)4、必须保证氯酸钠完全溶解。
5、配制后的液体经比重检测合格后方可抽入原料罐中。
(例如:1260kg/m320℃)盐酸:(1)、盐酸进厂后应检测①氯化氢含量是否达到标准31%。
②检测其密度是否合格。
例如:1160kg/m320℃③目测盐酸的颜色是否正常有无杂质。
(工业品盐酸因含有铁、氯等杂质略带微黄色、清澈、透明)(2)、盐酸绝对不可含有无机物,否则因此而产生的问题将十分严重。
(3)、盐酸储存不宜过长时间,否则易发生因储存时间过长而造成的氯化氢含量降低。
(氯化氢极易挥发)(4)、操作盐酸时,应穿戴好防护用品。
(耐酸碱工作服,护目镜、口罩、橡胶手套,长统胶鞋)五、型号的意义:—20000型→指额定产量为20000g/h,有效氯的化学二氧化氯复合消毒发生器。
1克二氧化氯等效于2.63克氯(厂家以1克二氧化氯等效于2.5克有效氯计算)按此计算:1台20000 g/h满负荷发生器实际产量ClO2≈6.73kg/h Cl2≈3.3kg/h1台10000 g/h满负荷发生器实际产量ClO2≈3.35kg/h Cl2≈1.65kg/h1台5000 g/h满负荷发生器实际产量ClO2≈1.675kg/h Cl2≈0.825kg/h20000g/h发生器的实际进料NaClO3=10.5 kg(固体)NaClO3≈25L (溶液)HCl=7.37kgHCl=23.7L10000g/h发生器的实际进料NaClO3=5.25 kg (固体)NaClO3≈12.5L (溶液)HCl=3.665kgHCl=11.65L5000g/h发生器的实际进料NaClO3=2.625 kg (固体)NaClO3≈6.25L (溶液)HCl=1.8325kgHCl=5.825L六、二氧化氯系统的维护与保养:根据生产实际情况(原料质量、温度等)定期进行清洗。
(一)、清洗发生器:发生器的清洗将进气口用胶皮堵死,将发生器注满水,浸泡二十分钟,在排污阀将水排净。
如果原料杂质较多,可用氢氧化钠5%溶液浸泡,确保发器内部清洗干净管路畅通无阻。
(二)、计量泵的维护:将进出口的单向阀拆下,清洗干净如小球损坏或底座破损(用放大镜观察),以免因单向阀不严造成的计量不准。
膜片每8000小时更换一次。
(三)、清洗原料过滤器滤网及管线。
(四)、清洗原料罐可每一年进行一次。
故障表现防暴塞暴开故障原因及排除①进气量过小,造成反应釜液位过高,部分位置二氧化氯浓度过高发生暴塞,增加水射气吸力。
②原料、进气温度过低,反应不充分,提高进料、进气温度。
③因发生器内杂质过多造成管路堵塞,彻底清洗发生器。
④压力水突然中断,停止进料加水稀释反应釜内反应液。
反应效率过低①进料比例不对,校计量泵及调整背压阀,清洗原料管线过滤器。
②原料、进气温度过低,反应不充分。
③反应釜液位过低,反应时间不足,降低水吸器吸力,提高反应釜液位。
七、氯酸钠:1、无色或白色立方晶系结晶,相对密度2.490G/m3,熔点255℃,易溶于水,加热到300℃以上易分解放出氧气,有极强的氧化能力,与硫、磷及有机物混合或受撞击易引起燃烧和爆炸。
有潮解性,在湿度很高的空气中能吸水气而成溶液有毒。
2、粉尘能刺激皮肤、粘膜和眼睛,如不慎将氯酸钠溶液溅入眼睛或皮肤上,应立刻用大量清水冲洗干净。
吸入氯酸钠粉尘,因积累在体内而引起中毒,会出现恶心、大量呕吐、下泻、呼吸困难、,肾损害等症状;误食时,要立即饮服食盐水或温肥皂水使其吐出,然后速送医院治疗,致死量10克。
生产人员工作时,应穿工作服、戴防护口罩和乳胶手套、穿塑料或橡皮围裙、穿长统胶靴等劳保用品,以保护呼吸器官和皮肤,车间应通风良好,下班后要洗淋浴。
3、应贮存在阴凉、通风、干燥的库房内,注意防潮,如有散落,必须立即用湿黄砂拌和后扫干净,不得与糖类、油类、木炭等有机物、硫黄、赤磷等还原剂、酸类(尤其是硫酸)和一切易燃物品共贮,装卸时要轻拿轻放,防止磨擦,严禁撞击。
失火时,先用砂土,再用雾状水和各种灭火器扑救,但不可用高压水。
八、盐酸:高浓度盐酸对鼻粘膜和结膜有刺激作用,会出现角膜浑浊,嘶哑,窒息感,胸痛,鼻炎,咳嗽,有时痰中带血,盐酸雾可导致眼脸部皮肤剧烈疼痛,如发生事故,应立即将受伤者移到新鲜空气处输氧,清洗眼睛和鼻,并用2%的苏打水漱口,浓盐酸溅到皮肤上,应立即用大量水冲洗5-10分钟,在烧伤表面涂上苏打浆,严重者送医院治疗。
操作人员工作时要穿耐酸工作服、穿长统胶靴、戴防护眼镜、口罩、橡胶手套、袖套、围裙以保护呼吸器官和皮肤,工作人员应每半年体检一次,纯盐酸无色,工业品因含有铁、氯等杂质略带微黄色,相对密度1.160,氯化氢熔点-114.8℃,沸点-84.9℃,失火时,可用水砂土和二氧化碳灭火器扑救。
二氧化氯附属设备工作原理一、计量泵基本工作原理:计量泵主要由动力驱动,流体输送和调节控制三部分组成,动力驱动装置经由机械联杆系统带动流体输送隔膜实现往复运动,隔膜于冲程的前半周将被输送流体吸入并于后半周将流体排出泵头,所以改变冲程的往复运动频率或每一次往复运动的冲程长度即可达到调节流体输送量的目的。