高一化学必修一:离子共存、离子的检验和推断考点汇总(1)
- 格式:doc
- 大小:107.50 KB
- 文档页数:8

基础课3 离子共存离子的检验和推断【明确考纲】1.掌握常见离子的检验方法。
2.了解离子反应发生的条件,正确判断常见离子在溶液中能否大量共存。
【理清主干】考点一、离子共存1.离子共存的本质所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
23加水稀释,c+c-减小某溶液的lg c+c-=12【判一判】(1)OH-不能和_____________________________大量共存(填具体离子,下同)。
(2)H+不能和________________________________________________大量共存。
(3)CO2-3不能和________________________________________________大量共存。
(4)SO2-3不能和____________________________________________大量共存。
(5)Fe3+不能和____________________________________________大量共存。
(6)Al3+不能和_______________________________________________大量共存。
(7)I-不能和_________________________________________________大量共存。
(8)NO-3(H+)不能和_____________________________________________大量共存。
1.下列各组离子在溶液中因发生复分解反应而不能大量共存的是________。
①Na+、H+、CH3COO-、Cl-②Ba2+、Na+、CO2-3、NO-3③Na+、HCO-3、H+、NO-3④Al3+、Fe3+、NO-3、SO2-4⑤K+、Na+、AlO-2、NO-3⑥Na+、H+、Cl-、OH-⑦Cu2+、Fe2+、Cl-、SO2-4⑧K+、Na+、SiO2-3、NO-32.下列各组离子在溶液中因发生氧化还原反应而不能大量共存的是________。

离子共存与离子推断知识点
离子共存与离子推断,这可真是个奇妙的世界啊!就好像一个复杂而又充满魅力的谜题,等待着我们去揭开它神秘的面纱。
在这个世界里,各种离子相互交织,有的能和谐共处,有的却一见面就“打架”。
你说神奇不神奇?比如说,氢离子和氢氧根离子,那可真是水火不容啊,碰到一起就会发生反应,生成水。
这就好比两个脾气不对付的人,见面就掐!但有些离子呢,却能友好地呆在一起,就像好朋友一样。
离子共存有着严格的条件呢!比如溶液的酸碱性,某些离子在酸性环境中能愉快玩耍,到了碱性环境可能就不行啦。
这多像人换了个环境,有的适应得很好,有的就会水土不服。
再比如离子之间的反应,有些会生成沉淀,有些会产生气体,这些都会影响它们能不能共存。
这就如同生活中的各种规则和限制,决定了我们的行为和选择。
离子推断就更有意思啦!通过一些已知的信息,像侦探一样去推断出未知的离子。
这就像是拼图游戏,每一个线索都是一块拼图,我们要把它们拼凑起来,才能看到完整的画面。
有时候一个小小的实验现象,或者一个数据,都可能是关键的线索呢!难道这还不够让人兴奋吗?
我们来想想,如果没有对离子共存和离子推断的深入理解,那化学世界会变成什么样呢?很多化学反应可能就无法进行准确的分析和解释,就好像失去了方向的船只。
而且,在实际应用中,比如在环境监测、医学检测等领域,离子共存和离子推断可是起着至关重要的作用呢!难道我们不应该好好掌握它们吗?
总之,离子共存与离子推断是化学中非常重要且有趣的部分,它们就像一把钥匙,能打开化学世界的大门,让我们看到其中的精彩和奥秘。
我们要不断探索,不断学习,才能真正领略到它们的魅力啊!。





离子共存、离子的检验和推断在化学中,离子共存也是很常见的现象。
因此,对离子的检验和推断起着至关重要的作用。
下面我们将深入探讨离子共存、离子的检验和推断的相关知识。
离子共存的原因在实验化学中,离子共存较为常见。
离子在其溶液中相互作用,形成共存体系。
通常,离子共存有以下几个原因:1.离子的化学性质:具有相同化学性质的离子,在同一条件下,会倾向于在同一溶液中存在,形成离子共存体系。
2.溶质溶剂间的相互作用:离子与溶质、溶剂之间的相互作用也会导致离子的共存。
3.实验条件:控制不佳、实验条件差等原因,也可能导致离子的共存。
离子的检验离子检验指的是通过化学方法,检测出样品中是否存在某些特定的离子。
其中,常用的离子检验包括:阳离子1.铵离子:加入Nessler试液,若出现黄色,则存在铵离子。
2.钠离子:加入酸性铁氰化钠试液和苯酚红指示剂,若出现红色,则证明存在钠离子。
3.钙离子:加入硫酸铵试液和草酸试液,若出现白色沉淀,则存在钙离子。
4.铁离子:加入硫氰酸钾试液和苯酚红指示剂,若出现红色,则证明存在铁离子。
阴离子1.氯离子:加入银氨试液,若出现白色沉淀,则存在氯离子。
2.硫酸根离子:加入钡盐试液,若出现白色沉淀,则存在硫酸根离子。
3.硝酸根离子:加入密度较大的硝酸银试液,若出现白色沉淀,则存在硝酸根离子。
4.碳酸根离子:加入盐酸,若产生气体,则证明存在碳酸根离子。
离子推断离子推断指的是通过已知的离子检验结果,推测出未知物质样品中的离子种类和数量。
离子的推断通常按照递推法进行。
确定阳离子1.质量作用定律:根据它和阴离子的相对比例,从几个阳离子中确定一组可能的组合。
2.离子比例法:通过阳离子和阴离子的相对比例,推断出组成物质的阳离子的种类。
3.等电点法:根据相对质量和等电点,选择出可能存在的阳离子组合。
确定阴离子1.除去有机酸根离子、硝酸根离子、碳酸根离子:根据阳离子的推断结果,排除掉已知的有机酸根离子、硝酸根离子、碳酸根离子。


2025年高考化学复习考点突破及考法探究—离子共存、离子的检验与推断(解析版)考点一离子共存知识点1离子共存的实质几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
知识点2离子不能大量共存的原因1.离子之间相互结合生成难溶物质或微溶物。
如Ca2+和C O32−生成CaCO3,H+和Si O32−生成H2SiO3,Cu2+和OH-生成Cu(OH)2等。
阳离子不能大量共存的阴离子Ba2+、Ca2+、Pb2+、Ag+CO2-3、SO2-3、SO2-4、SiO2-3、PO3-4Cu2+、Fe2+OH-、S2-、CO2-3、SiO2-3Mg2+、Zn2+OH-、CO2-3、AlO-2、SiO2-3H+SiO2-3、AlO-22.离子之间相互结合生成气态物质及挥发性物质。
如H+和S2-生成H2S,H+和HC O3-生成CO2等。
离子不能大量共存的离子H+S2O2-3、SO2-3、HSO-3、CO2-3、HCO-3、S2-、HS-OH-NH+43.离子之间相互结合生成弱电解质。
如H与CH3COO、OH、P O43−等分别结合生成弱电解质CH3COOH、H2O、H3PO4等。
4.离子之间彼此促进水解。
①常见的因发生相互促进的水解反应而不能大量共存的离子如下:a.Al3+与CO2-3、HCO-3、S2-、HS-、AlO-2、SiO2-3。
b.Fe3+与CO2-3、HCO-3、AlO-2、SiO2-3。
②NH+4与CH3COO-、CO2-3、HCO-3、S2-等能发生相互促进的水解反应,但反应程度仍较小,能大量共存。
5.离子之间发生氧化还原反应。
如Fe2+、S2-、I-、S O32−分别与N O3-(H+)、ClO-因发生氧化还原反应而不能大量共存;Fe3+与S2-、I-等因发生氧化还原反应而不能大量共存。
氧化性离子还原性离子ClO-、MnO-4(H+)、NO-3(H+)、Fe3+、Cr2O2-7、FeO2-4Fe2+(可与Fe3+共存)、S2-、I-、SO2-3、HS-、HSO-3 6.离子之间能发生络合反应。
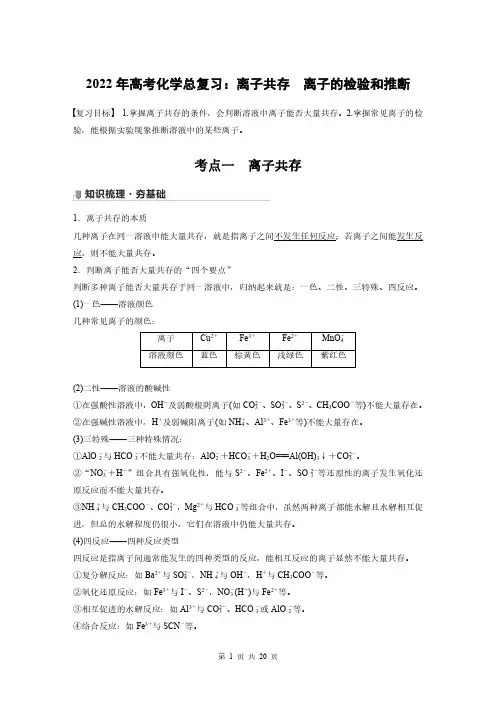
2022年高考化学总复习:离子共存离子的检验和推断复习目标 1.掌握离子共存的条件,会判断溶液中离子能否大量共存。
2.掌握常见离子的检验,能根据实验现象推断溶液中的某些离子。
考点一离子共存1.离子共存的本质几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
2.判断离子能否大量共存的“四个要点”判断多种离子能否大量共存于同一溶液中,归纳起来就是:一色、二性、三特殊、四反应。
(1)一色——溶液颜色几种常见离子的颜色:离子Cu2+Fe3+Fe2+MnO-4溶液颜色蓝色棕黄色浅绿色紫红色(2)二性——溶液的酸碱性①在强酸性溶液中,OH-及弱酸根阴离子(如CO2-3、SO2-3、S2-、CH3COO-等)不能大量存在。
②在强碱性溶液中,H+及弱碱阳离子(如NH+4、Al3+、Fe3+等)不能大量存在。
(3)三特殊——三种特殊情况:①AlO-2与HCO-3不能大量共存:AlO-2+HCO-3+H2O===Al(OH)3↓+CO2-3。
②“NO-3+H+”组合具有强氧化性,能与S2-、Fe2+、I-、SO2-3等还原性的离子发生氧化还原反应而不能大量共存。
③NH+4与CH3COO-、CO2-3,Mg2+与HCO-3等组合中,虽然两种离子都能水解且水解相互促进,但总的水解程度仍很小,它们在溶液中仍能大量共存。
(4)四反应——四种反应类型四反应是指离子间通常能发生的四种类型的反应,能相互反应的离子显然不能大量共存。
①复分解反应:如Ba2+与SO2-4,NH+4与OH-,H+与CH3COO-等。
②氧化还原反应:如Fe3+与I-、S2-,NO-3(H+)与Fe2+等。
③相互促进的水解反应:如Al3+与CO2-3、HCO-3或AlO-2等。
④络合反应:如Fe3+与SCN-等。
指出下列离子组不能大量共存的原因。
(1)Na+、OH-、SO2-4、Fe3+____________________________________________________。
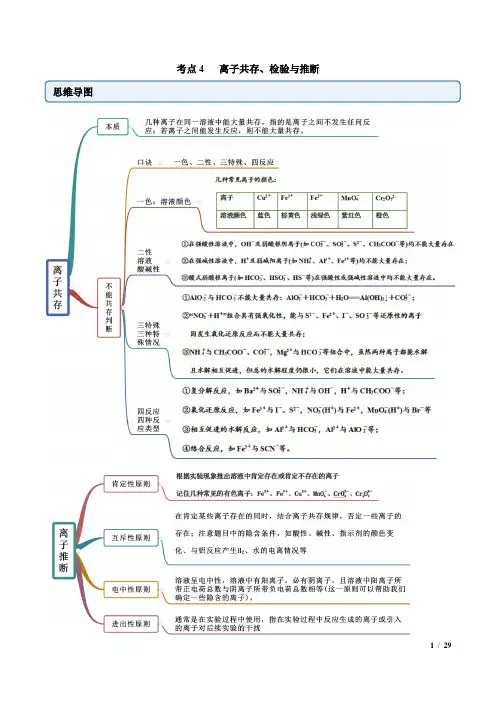
考点4 离子共存、检验与推断思维导图考点一 离子共存【例1】(1)(2020·汪清县汪清第六中学月考)下列各组离子能在水溶液中大量共存的是( ) A .Na +、Mg 2+、Cl -、OH - B .H +、Ca 2+、NO 3-、CO 23-C .Cu 2+、Na +、SO 24-、NO 3-D .Na +、HCO 3-、OH -、Ca 2+(2)(2020·平遥县综合职业技术学校月考)常温下,下列溶液中可能大量共存的离子组是( ) A .加入金属镁能产生H 2的溶液中:Na +、Fe 3+、S 2−、NO 3-B .c(H +)=1×10−13mol·L −1的溶液中:Mg 2+、Cu 2+、S 2−、NO 3-C .能使Al 3+生成沉淀的溶液中:NH 4+、Na +、SiO 23-、HCO 3-D .水电离产生的c(OH -)=1×10−10mol·L −1的溶液中:Al 3+、SO 24-、NO 3-、Cl - 【答案】(1)C (2)D【解析】(1)A .Mg 2+和OH -反应生成Mg(OH)2沉淀而不能大量共存,故A 不符合题意;B .Ca 2+和CO 23-反应生成CaCO 3沉淀,H +和CO 23-反应生成水和二氧化碳而不能大量共存,故B 不符合题意;C .Cu 2+、Na +、SO 24-、NO 3-之间不会发生化学反应,能大量共存,故C 符合题意; D .HCO 3-和OH -反应而不能大量共存,故D 不符合题意; 答案选C 。
(2)A .加入金属镁能产生H 2的溶液,说明是酸溶液,H +、NO 3-与S 2−发生氧化还原反应而不共存,故A 不符合题意;B .c(H +)=1×10−13mol·L −1的溶液中,说明是碱溶液,OH -与Mg 2+、Cu 2+生成沉淀而不共存,故B 不符合题意;C .能使Al 3+生成沉淀的溶液,可能为碱性、也可能含有AlO 2-等弱酸根离子,它们之间能发生相互促进的水解,且SiO 23-、HCO 3-两者反应而不共存,故C 不符合题意;D .水电离产生的c(OH -)=1×10−10mol·L −1的溶液,说明可能是酸性,也可能是碱性,在酸性中Al 3+、SO 24-、NO 3-、Cl -大量共存,故D 符合题意。
课时6离子共存、离子检验和推断考点一离子共存的判断【考必备·清单】1.离子共存的含义所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
2.熟记常考离子的性质[名师点拨]①无色溶液中,有色离子不能存在;透明溶液中可能含有有色离子。
②既能与酸反应又能与碱反应的离子,一般为多元弱酸的酸式酸根离子。
3.熟记相互促进的水解反应4.离子共存判断中常见的限制条件加水稀释,c H+c OH-减小某溶液的lgc H+c OH-=12【提素能·好题】1.判断正误(正确的打“√”,错误的打“×”)。
(1)透明的溶液即无色溶液,不含有任何有颜色的离子()(2)Fe3+和Al3+在中性溶液中能大量存在()(3)加入铝粉能够发生反应产生氢气的溶液,一定是酸性溶液()(4)水电离出c(H+)=1×10-13 mol·L-1的溶液呈碱性()(5)次氯酸能电离产生H+,故在溶液中H+和ClO-能够大量共存()答案:(1)×(2) ×(3)×(4)×(5)×2.下列各组离子在溶液中因发生复分解反应而不能大量共存的是。
①K+、H+、CH3COO-、Br-②Ba2+、Na+、CO2-3、NO-3③Na+、HCO-3、H+、Cl-④Al3+、Fe3+、NO-3、SO2-4⑤Na+、K+、AlO-2、NO-3⑥Na+、H+、Cl-、OH-答案:①②③⑥3.下列各组离子在溶液中因发生氧化还原反应而不能大量共存的是。
①H3O+、NO-3、Fe2+、Na+②Na+、Fe3+、I-、Cl-③H+、S2-、SO2-3、SO2-4④SO2-4、NO-3、Na+、H+⑤I-、ClO-、K+、H+⑥Na+、K+、MnO-4、Cl-答案:①②③⑤⑥4.下列各组离子在溶液中因水解相互促进而不能大量共存的是。
第06讲离子共存、离子检验与推断01掌握离子共存的条件,会判断溶液中离子能否大量共存。
①1.向某溶液中加入溶液,有白色沉淀生成,再加入稀盐酸,沉淀不消失,则溶液中一定存在2.向某溶液中加入2溶液,产生不溶于稀HNO3的白色沉淀,则溶液中一定存在3.向某溶液中加入溶液,有白色沉淀生成,则溶液中一定存在CO2-3(4.某溶液的焰色试验呈黄色,则溶液中一定有钠元素,不能确定是否有钾元素无现象,滴加氯水后CCl4层呈紫红色,则溶液中一定存在③向另一份溶液中加入过量氢氧化钠溶液,产生沉淀质量与加入碱液的体积关系如图所示。
_____________________________________________填化学符号),它具有的性质是【解析】A .4Ti +与HCOO -会发生双水解而不能大量共存,A 项错误;B .24CrO -与Ag +会形成24Ag CrO 沉淀不能共存,B 项错误;C .2Ba +与23SO -会生成3BaSO 沉淀而不能大量共存,C 项错误;D .选项中所给离子相互都不反应,可以大量共存,D 项正确;本题选D 。
7.(23-24高三下·浙江·阶段练习)在溶液中能大量共存的离子组是A .-10.2mol L ×的4NH Cl 溶液:+-2-2-343Na CH COO SO SiO 、、、B .-10.2mol L ×的24H SO 溶液:2+2+--3MgFe Br NO 、、、C .-10.1mol L ×的3FeCl 溶液:+4--463NH K Fe(CN)NO +、、、D .-10.1mol L ×的2Ba(OH)溶液:-+--3Cl Na ClO CH OOC 、、、【答案】D【解析】A .4NH +和2-3SiO 因发生彻底的双水解而不能大量共存,故A 错误;B .+2+-3H Fe NO 、、三种离子会发生氧化还原反应而不能大量共存,故B 错误;C .3+Fe 与4-6Fe(CN)反应生成Fe 4[Fe(CN)6]3蓝色沉淀,故C 错误;D .各种离子之间均不反应,可大量共存,故D 正确;故选D 。
第3讲 离子共存、离子的检验和推断[考纲要求] 1.应用离子反应发生的条件,正确判断常见离子在溶液中能否大量共存。
2.利用离子的特征反应,能鉴别常见离子以及进行综合推断。
考点一 离子共存1.离子共存问题是离子反应条件和本质的最直接应用所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
2.熟记常考离子的性质颜色 MnO -4(紫)、Cu 2+(蓝)、Fe 2+(浅绿)、Fe 3+(黄)氧化性 ClO -、MnO -4、NO -3(H +)、Fe 3+、Cr 2O 2-7 还原性 S 2-(HS -)、SO 2-3(HSO -3)、I -、Br -、Cl -、Fe 2+水解显酸性 NH +4、Mg 2+、Al 3+、Cu 2+、Fe 2+、Fe 3+水解显碱性 AlO -2、S 2-、SO 2-3、CO 2-3、SiO 2-3、ClO -、CH 3COO -两性离子HCO -3、HS -、HSO -3、HPO 2-4、H 2PO -4注意 “两性离子”指既能与酸反应又能与碱反应的离子,一般为多元弱酸的酸式酸根离子。
3.常见溶液酸、碱性的判断酸性溶液:pH<7(常温);能使pH 试纸呈红色的溶液;能使甲基橙呈红色或橙色的溶液;能使石蕊溶液呈红色的溶液。
碱性溶液:pH>7(常温);能使pH 试纸呈蓝色的溶液;能使石蕊溶液呈蓝色的溶液;能使酚酞溶液呈红色的溶液。
呈酸性或碱性的溶液:和Al 反应放出H 2的溶液(HNO 3除外);能使甲基橙呈黄色的溶液;c(H +)水或c(OH -)水等于10-a mol·L -1(a>7)的溶液。
深度思考(1)OH -不能和________________________________________________________大量共存(填具体离子,下同)。
答案 H +、NH +4、Fe 2+、Fe 3+、Cu 2+、Zn 2+、Mg 2+、Al 3+、Cr 3+、HCO -3、HS -、HSO -3、H 2PO -4、HPO 2-4 (2)H +不能和_____________________________________________________________________大量共存。
第3讲离子共存、离子的检验和推断[考纲要求] 1.应用离子反应发生的条件,正确判断常见离子在溶液中能否大量共存。
2.利用离子的特征反应,能鉴别常见离子以及进行综合推断。
考点一离子共存1.离子共存问题是离子反应条件和本质的最直接应用所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
2.熟记常考离子的性质注意“两性离子”指既能与酸反应又能与碱反应的离子,一般为多元弱酸的酸式酸根离子。
3.常见溶液酸、碱性的判断酸性溶液:pH<7(常温);能使pH试纸呈红色的溶液;能使甲基橙呈红色或橙色的溶液;能使石蕊试液呈红色的溶液。
碱性溶液:pH>7(常温);能使pH试纸呈蓝色的溶液;能使石蕊试液呈蓝色的溶液;能使酚酞试液呈红色的溶液。
呈酸性或碱性的溶液:和Al反应放出H2的溶液(HNO3除外);能使甲基橙呈黄色的溶液;c(H+)水或c(OH-)水等于10-a mol·L-1(a>7)的溶液。
深度思考(1)OH-不能和________________________________________________________大量共存(填具体离子,下同)。
答案H+、NH+4、Fe2+、Fe3+、Cu2+、Zn2+、Mg2+、Al3+、Cr3+、HCO-3、HS-、HSO-3(2)H+不能和______________________________________________________大量共存。
答案OH-、CO2-3(HCO-3)、S2-(HS-)、SO2-3(HSO-3)、SiO2-3、[Al(OH)4]-、ClO-、F-、CH3COO-、NO-2(3)CO2-3不能和________________________________________________大量共存。
答案H+、Mg2+、Ba2+、Ca2+、Fe3+、Al3+、Fe2+、Cu2+(4)SO2-3不能和__________________________________________大量共存。
答案H+、MnO-4、NO-3(H+)、Mg2+、Ba2+、Fe3+、Al3+、Fe2+、Cu2+(5)Fe3+不能和______________________________________________大量共存。
]答案OH-、I-、SO2-3、ClO-、CO2-3(HCO-3)、S2-(HS-)、[Al(OH)4]-、SCN-(6)Al3+不能和______________________________________________大量共存。
答案OH-、SO2-3、ClO-、CO2-3(HCO-3)、S2-(HS-)、[Al(OH)4]-(7)I-不能和____________________________________________大量共存。
答案Fe3+、NO-3(H+)、MnO-4、ClO-、Cr2O2-7(8)NO-3(H+)不能和______________________________________大量共存。
答案CO2-3(HCO-3)、SiO2-3、ClO-、CH3COO-、S2-(HS-)、Fe2+、SO2-3(HSO-3)、I-反思归纳判断一些常见离子能否和其他离子大量共存时,一般从以下几个方面考虑:(1)CO2-3考虑生成气体和沉淀;(2)SO2-3考虑生成气体、沉淀和其还原性;(3)Fe3+考虑生成Fe(OH)3、双水解及其氧化性;(4)Al3+考虑生成Al(OH)3、双水解;(5)I-只考虑其还原性;(6)NO-3(H+)考虑酸性及NO-3在酸性条件下的强氧化性。
题组一无限制条件的离子大量共存的判断1.在水溶液中能大量共存的一组离子是() A.HCO-3、H+、NO-3、Na+B.Na+、Cu2+、OH-、SO2-4C.Mg2+、H+、[Al(OH)4]-、SO2-4D.NH+4、K+、Br-、NO-3答案 D解析A项,H+与HCO-3反应;B项,Cu2+与OH-反应;C项,H+与[Al(OH)4]-反应。
2.在水溶液中能大量共存的一组是() A.Ba2+、Na+、SO2-4、Cl-B.MnO-4、SO2-3、H+、K+C.[Al(OH)4]-、Mg2+、K+、HCO-3D.K+、Na+、NO-3、SO2-4答案 D解析A项,Ba2+与SO2-4反应;B项,MnO-4、H+、SO2-3发生氧化还原反应;C项,[Al(OH)4]-存在于强碱溶液中,Mg2+、HCO-3不能存在。
题组二题干中有限制条件的离子大量共存的判断3.将足量的SO2通入下列各溶液中,所含离子还能大量共存的是() A.K+、SiO2-3、Cl-、NO-3B.H+、NH+4、Al3+、SO2-4C.Na+、Cl-、MnO-4、SO2-4D.Na+、CO2-3、CH3COO-、HCO-3答案 B能与SO2反应;C中MnO-4能与SO2发生氧化还原反应;D中CO2-3、解析A中SiO2-3CH3COO-、HCO-3均能与SO2反应。
4.在酸性溶液中,下列各组离子能大量共存且溶液为无色透明的是() A.Na+、K+、OH-、Cl-B.Na+、Cu2+、SO2-4、NO-3C.Mg2+、Na+、SO2-4、Cl-D.K+、Na+、NO-3、CO2-3答案 C解析A项,H+与OH-反应;B项,Cu2+有颜色;D项,H+与CO2-3反应。
题组三选项中有限制条件的离子大量共存的判断5.下列各组离子在指定的溶液中,能大量共存的打“√”,不能大量共存的打“×”(1)含有大量Fe3+的溶液:Na+、SCN-、Cl-、I-()(2)含有大量NO-3的溶液:H+、Fe2+、Cl-、SO2-4()(3)常温下,pH=12的溶液:K+、Cl-、SO2-4()(4)c(H+)=0.1 mol·L-1的溶液:Na+、NH+4、SO2-4、S2O2-3()(5)使pH试纸显蓝色的溶液:Cu2+、NO-3、Fe3+、SO2-4()(6)与铝粉反应放出H2的无色溶液:NO-3、Al3+、Na+、SO2-4()(7)使红色石蕊试纸变蓝的溶液:SO2-4、CO2-3、Na+、K+()(8)常温下c(H+)c(OH-)=1×10-12的溶液:K+、[Al(OH)4]-、CO2-3、Na+()(9)中性溶液:Fe3+、Al3+、NO-3、SO2-4()(10)使甲基橙变红色的溶液:Mg2+、K+、SO2-4、SO2-3()(11)c(H+)水=10-12 mol·L-1的溶液:Na+、K+、CO2-3、SO2-4()(12)使酚酞变红色的溶液:Na+、Cu2+、Fe2+、NO-3()(13)0.1 mol·L-1的Na2CO3溶液:Al3+、SO2-4、Cl-、K+()答案(1)×(2)×(3)√(4)×(5)×(6)×(7)√(8)√(9)×(10)×(11)×(12)×(13)×反思归纳警惕题干中的常见“陷阱”条件类型高考中的常见表述误点点悟常见的限制条件“无色”[来源:学科网][来源:学科网][来源:]有色离子不能大量存在[来源:学&科&网][来源:Z§xx§] “pH=1”或“pH=13”溶液显酸性或碱性“因发生氧化还原反应而不能大量共存”只能是氧化性离子和还原性离子考点二离子的检验和推断1.常见离子的检验方法根据离子性质不同而在实验中所表现出的现象不同,可把检验离子的方法归纳为三种类型:①生成沉淀;②生成气体;③显现特殊颜色。
2常见的溶液中有颜色的离子有MnO-4——呈紫色,Cu2+——呈蓝色,Fe2+——呈浅绿色,Fe3+——呈黄色。
沉淀的颜色:Cu(OH)2——蓝色沉淀,Fe(OH)3——红褐色沉淀。
解题时特别注意题干条件是“无色透明”还是“澄清透明”。
深度思考1.向某溶液中加入BaCl2溶液,有白色沉淀生成,再加入稀盐酸,沉淀不消失,能否判断溶液中存在SO2-4?答案不能,若溶液中存在Ag+,也有相同的现象发生。
2.向某溶液中加入Ca(OH)2溶液,有白色沉淀生成,能否判断溶液中一定存在CO2-3?答案不能,若溶液中存在SO2-3、HCO-3,也有相同的现象。
3.向某溶液中滴入稀盐酸,产生能使澄清石灰水变浑浊的气体,能否判断溶液中一定存在CO2-3?答案不能,若溶液中存在HCO-3、SO2-3、HSO-3,也有相同的现象。
4.向某溶液中滴入BaCl2溶液,产生白色沉淀,再加入稀HNO3,白色沉淀不溶解,能否确定溶液中一定存在SO2-4?答案不能,若溶液中存在SO2-3或Ag+,也有相同现象。
5.向某溶液中加入稀NaOH溶液,把湿润无色酚酞试纸放在试管口,试纸不变红,则溶液中一定不存在NH+4,该判断是否正确?为什么?答案判断错误,检验NH+4时,应加入浓NaOH溶液,并加热,且用湿润的红色石蕊试纸。
6.向某溶液中滴加氯水,再加入KSCN溶液,溶液变血红色,则溶液中一定存在Fe2+,该判断是否正确?为什么?答案判断错误,检验Fe2+时,应先加KSCN,再加氯水,否则,Fe3+干扰结果的判断。
7.做某溶液的焰色反应实验,火焰呈黄色,则溶液中一定存在钠元素,不存在钾元素,该判断是否正确?为什么?答案判断错误,钾的焰色反应必须透过蓝色钴玻璃片才能观察到。
题组一排除干扰,确定离子1.关于某无色溶液中所含离子的鉴别,下列判断正确的是() A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不溶解时,可确定有Cl-存在B.通入Cl2后,溶液变为深黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在C.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸后沉淀不溶解时,可确定有SO2-4存在D.加入稀盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO2-3存在答案 B解析Cl-、SO2-4均能与Ag+形成不溶于稀盐酸的白色沉淀,A错;I2遇淀粉变蓝,通入Cl2后,溶液变为深黄色,加入淀粉溶液后溶液变蓝,则溶液中有I-存在,B对;SO2-3与Ba(NO3)2反应形成BaSO3沉淀,加入稀盐酸后在H+、NO-3的作用下可转化为BaSO4沉淀,C错;能使澄清石灰水变浑浊的CO2-3、HCO-3、SO2-3或HSO-3,D错。
2.向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是()解析本题主要考查常见离子的鉴别,意在考查学生的实验能力。
A项加入BaCl2溶液得到白色沉淀,原溶液中可能含有SO2-3或SO2-4或Ag+;B项溶于CCl4呈紫色的为I2,即原溶液中含有I-;C项观察K+的焰色反应应透过蓝色钴玻璃,排除Na+的干扰;D 项检验NH+4应加入浓NaOH溶液,且需要加热。