有机合成-毕业答辩
- 格式:ppt
- 大小:1.79 MB
- 文档页数:30

合成工艺优化毕业答辩PPT两分钟大家好,我是小杨。
非常荣幸又跟大家见面了。
感谢大家一路以来对我的支持,也谢谢大家对我的包容和信任。
感谢大家一直以来对我的关心与支持!现在答辩也快结束了,需要一份好看的答辩 PPT来作为答辩者和答辩人。
PPT是最常用的文档制作工具之一,但很多人都不知道如何制作 PPT,今天给大家分享一份实用且好用的 PPT制作工具——合成工艺优化,如果你还不知道怎么制作的话,就赶快来看看吧!首先要说的就是合成工艺优化这份 PPT制作是非常简单的,在选择好素材之后,点击“确定”按钮就可以了。
但是很多人并不是很喜欢这个方法,感觉做完之后还需要再调试一下才行。
1、在 PPT工具界面,找到“合成工艺优化”,选择需要的素材,点击“开始”,选择“合成工艺优化”,然后点击“添加页面”,打开并勾选“填充内容”,然后点击“合并页面”,选择需要的页面。
如果觉得效果不满意的话,可以再选一次,这样的话就可以完成合并了。
这个方法简单且快捷,很适合平时需要修改格式或者是需要写 ppt等等用。
这个方法我是用在答辩 PPT上面用的,很方便。
然后打开 PPT工具,选择需要的模板,进行一个调整。
具体调整方法如下:这个方法比较简单,就是把 PPT页面合并到一起,然后复制一份到 PPT文件夹中。
然后新建一个 PPT 文件,然后复制一个页面作为新文档,这个方法也很快,几分钟就完成了。
当然了,如果你没有足够经验,也可以用上述方法。
2、在新建的文章文本框内输入文字,点击“文字填充”-“引用内容填充”即可。
当然也可以直接使用其他图片的方式。
然后在新建标题框内输入一段文字。
“主题”为“工艺优化”,其他内容均为“工艺优化”。
接着在文本框内填充内容即可。
接着在空白文档内填充完成后,再在文本框内使用【设置文本大小】按钮进行调整即可。
最后在填充完毕后,就可以进行点击【文件】按钮,弹出【更改文件格式】对话框,勾选【格式】-【颜色】选项。
接着在弹出聊天窗口后,点击【新建】按钮,在弹出【编辑文件】对话框中,将【文档格式】改为【颜色】。

关于有机合成的毕业论文目录第一章 前言 .......................................................................................................................................... (22) (22)1.1 3,3',5,5'-四甲基联苯胺的概述 ......................................................................................1.2 国内外有关3,3',5,5'-四甲基联苯胺的研究进展 (4)1.3 选题意义 ....................................................................................................................................... (55)第二章 实验部分 .................................................................................................................................. (66)2.1仪器和试剂 ................................................................................................................................... (66) (66)2.1.1实验仪器实验仪器 ................................................................................................................................. (66)2.1.2实验试剂实验试剂 .................................................................................................................................2.2 3,3',5,5'-四甲基联苯胺的合成与研究 (7)2.2.1合成原理 (77)合成原理 ................................................................................................................................. (77)2.2.2合成方法合成方法 ................................................................................................................................ 第三章 结果与讨论 ............................................................................................................................ (1010) (10)103.1 溴化反应 ..................................................................................................................................... (10)103.2 偶联反应 .....................................................................................................................................3.2.1 反应温度对偶联反应的影响反应温度对偶联反应的影响 (11) (1212)3.2.2 原料配比对偶联反应的影响原料配比对偶联反应的影响 ..............................................................................................12 (12)3.3 溴化产物的表征图谱 .................................................................................................................第四章 结论 ........................................................................................................................................ (1313)参考文献 ................................................................................................................................................ (1414)致 谢 .................................................................................................................. 错误!未定义书签。

精细有机合成工艺学课题答辩一.、答辩题目二、目标产物的分解(1) (2)(3)三、总合成路线总反应分三步进行,首先:NHOONHMeNNNNHRCH 2CH 2OHNHRCH 2CH 2OHNNNHRCH 2CH 2OH HOH 2CH 2CRHN ClNH 2NO 2OO NHCH 3BrHN+NH 2NO 2NO 2O ONHCH 3BrHNNH 2N NNNHRCH 2CH 2OHHOH 2CH 2CRHNCl+NHHNOONHMeN NNNHRCH 2CH 2OH2CH 2CRHNN-酰化3.1 1-甲氨基-4-对硝基甲氨基蒽醌的合成:3.1.1 首先对反应物1-甲氨基-4-溴蒽醌的合成,总步骤如下:分两步进行:(1)第一步反应:1-硝基蒽醌和甲胺的反应 反应原理:反应类型:亲核取代反应反应原料:1-硝基蒽醌、甲胺、氧化钙(催化剂) 溶剂:甲苯反应温度和时间:120℃,4h 温度、时间的选择依据如下: 反应温度反应时间对反应的影响:OONHCH 3HN +NH 2NO 2O 2NOONHCH 3BrONO 2O +H 2NCH 3甲苯ONHCH O3NCH 3ONHCH 3O可以看出:在温度为120℃,反应时间为4小时时,收率最高。
预设工艺条件如下:操作压力:0.24Mp物质量之比:n(1-硝基蒽醌):n(甲胺):n(氧化钙)=1.0: 1.6:1.0加料方式:混合,一起加入可能的副产物:1一羟基蒽醌分离过程过程:反应完成后,过滤;水洗至滤液呈中性;干燥实验操作:将1一硝基蒽醌101.2g(0.4mo1)、碳酸钙22.4g (0.4mol)、尿素24g、甲胺水溶液(2 5~30%)54mL、甲苯100mL 混合,倾入2L高压釜中,封釜,加热至120℃,保温4小时,此时压力为0.24MPa,开釜,过滤,水洗,干燥得红色固体。
(2)第二步反应:1-甲氨基蒽醌和溴的反应反应原理:反应类型:亲电取代反应 反应原料:1-甲氨基蒽醌、溴素 溶剂:二氯乙烷 预设工艺条件如下:反应时间和温度:-6 ~ -5℃;1.5h 操作压力:常压物质量之比:n(1-甲氨基蒽醌):n(溴)= 1 .0: 1.1 加料方式:将溴素滴加到反应体系中 可能的副产物:和少量分离过程:用半小时左右的时间滴加亚硫酸钠饱和溶液50ml , 温度控制在0℃以下,此时测定反应体系pH 值应为中性。


有机合成答辩考试第五题:合成7-氯-2-氧代庚酸乙酯组长:于盼副组长:余路路评委:于晓讲解:许晓辉、张环成员:于盼、余路路于晓、许晓辉张环、张凯乐肖文、占珊珊7-氯-2-氧代庚酸乙酯的制备方法一:格氏试剂法第一步:格氏试剂的制备●反应机理:由表面镁到相邻的RX的单电子转移引发的,然后形成和表面镁自由基阳离子结合的阴离子,也认为自由基R·在某个地方先形成,然后生成RMgX和R2Mg。
(RMgX在R2Mg之前生成,两者快速达到平衡)。
R X MgR·+X·X·+Mg XMg·RX RMgX+X·●反应类型:自由基取代反应●反应方程式:Cl Br+Mg Cl MgBr无水乙醚●原料与溶剂:原料:1-溴-5-氯戊烷、镁屑、溶剂:无水乙醚、溴甲烷或碘●反应简述:先减压抽真空,再通入氮气补充保护反应体系微正压,再把1-溴-5-氯戊烷和乙醚的混合液慢慢滴加到镁的乙醚溶液中,由溴甲烷或加入少量碘引发反应,温度35℃以保持乙醚缓慢回流,直至镁屑消失反应完成为止,然后密封冰存。
●注意事项:此步工艺必须在无水无氧条件下进行,所以要在干燥的惰性气体保护条件下低温进行。
镁屑不能有镁锈,一般情况下现用现制,若需提前,务必把制好的镁屑储存在干燥密闭的环境下。
滴加的顺序不能反过来,反应速度不宜过快,否则副反应增多。
镁屑与1-溴-5-氯戊烷的摩尔比1.1-1.2:1为宜,观察确定反应引发后,就立刻开始搅拌和冷却水控温。
●副产物:烷烃,双格氏试剂●降低成本:反应引发前,纯醚作溶剂易于引发,反应引发后,溶剂不一定需要纯醚,可以用芳烃或烷烃代替,混合溶剂的使用降低了反应的成本,且不影响其回收和利用。
第二步:7-氯-2-氧代庚酸乙酯的合成●反应机理:O O+Cl(CH2)5MgBrO OMgBrEtO(CH2)5ClOEt-EtOMgBr O O2)5Cl在羰基中,O稍显电负性;在格氏试剂中,C-Mg相连,Mg稍显电正性,C 是亲核部位。
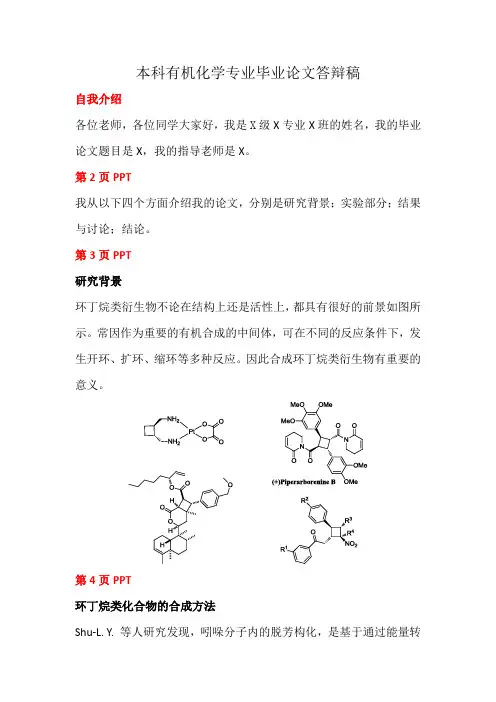
本科有机化学专业毕业论文答辩稿自我介绍各位老师,各位同学大家好,我是X级X专业X班的姓名,我的毕业论文题目是X,我的指导老师是X。
第2页PPT我从以下四个方面介绍我的论文,分别是研究背景;实验部分;结果与讨论;结论。
第3页PPT研究背景环丁烷类衍生物不论在结构上还是活性上,都具有很好的前景如图所示。
常因作为重要的有机合成的中间体,可在不同的反应条件下,发生开环、扩环、缩环等多种反应。
因此合成环丁烷类衍生物有重要的意义。
第4页PPT环丁烷类化合物的合成方法Shu-L. Y. 等人研究发现,吲哚分子内的脱芳构化,是基于通过能量转移机制实现了经过可见光来促进[2+2]环加成衍生物的制备,而此反应在热力学条件下通常是无法获得的。
反应拥有高收益率(最多99 %)以及具有优异的非对映选择性(> 20:1 dr)且条件温和。
该方法兼容多样化功能组和灵活的转换,是可见光诱导,构成吲哚官能化的罕见例子。
第5页PPTThe Meyer-Schuster Rearrangement反应研究Baire等人经深入研究,开发了一种条件温和的,分子内截获的Meyer-Schuster (M-S)重排反应。
用于从相应的顺式-6-羟基己-2-烯-4-醛合成2-酰基呋喃[15]。
发现该反应非常普遍,并且起始原料炔丙醇易于获得。
通过该方法,还可以分三步实现脱氧-去甲-喹吖嗪B (倍半萜)的首次合成。
并介绍了在M-S重排过程中添加两个亲核试剂的概念。
第6页PPT实验部分邻炔丙醇苯甲酸苄酯与二苯乙炔在催化剂Na2S2O8,2 mL的二噁烷进行发生重排得到产率*的目标化合物。
第7页PPT我们对反应条件进行优化,邻炔丙醇苯甲酸苄酯与二苯乙炔为原料,考察了不同的溶剂,催化剂,温度最后发现以Na2S2O8为催化剂,二噁烷作为溶剂的条件,产率达到*。
最终反应结果如下表所示:第8页PPT对目标产物氢谱进行归属如表 3.1所示,Ha的化学位移7.51到7.48ppm,Hb的化学位移5.20ppm, 甲基上的Hc的化学位移3.86ppm.化学位移7.94到7.00ppm为苯环上的氢第9页PPT对目标产物碳谱进行归属如表3.3所示,羰基碳化学位移192.67ppm,炔基碳C2化学位移87.10ppm,C3化学位移83.20ppm,C4化学位移化学位移83.20ppm 。


《有机合成实验答题模板》教学设计正自己的错误。
学提供一些有价值的参考。
更重要的是帮助学生巩固这节课所学的知识。
[讲评]就学生错得比较多的题目稍作讲评,指出学生常犯的一些错误,使学生认识到自己错误的地方。
听讲、思考、改正自己的错误。
指出学生一些比较常犯的错误,帮助学生认识自己的错误。
[小结]本节课我们一起探究有机合成实验答题模板。
在有机合成实验考查的内容有:仪器的名称;基本操作;混合物的分离提纯[回忆、总结]对本节课的学习内容作一个总结帮助学生总结这节课所学的内容,加深记忆。
七、教学评价设计八、板书设计:附件1:有机合成实验题解答模板例1、(2014·新课标全国卷Ⅰ,26)乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:相对分子质量密度/(g·cm-3) 沸点/℃水中溶解性异戊醇88 0.812 3 131 微溶乙酸60 1.049 2 118 溶乙酸异戊酯130 0.867 0 142 难溶在A中加入4.4 g异戊醇、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50 min。
反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:(1)仪器B的名称是________。
(2)在洗涤操作中,第一次水洗的主要目的是_________,第二次水洗的主要目的是________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后__(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出b.直接将乙酸异戊酯从分液漏斗的下口放出c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出(4)本实验中加入过量乙酸的目的是___________。


各位老师好!我叫xxx,来自xxxx老师课题组,我的毕业课题是《xxxxxxxx的设计、合成及电致发光性质的研究》。
我的毕业答辩包括四部分内容,OLEDs的发展背景、研究工作、结论等四部分内容。
总所周知,OLED因为具备轻薄、省电、自发光、广视角等特性而被广泛应用于显示和照明等领域。
今年六月,韩国LG再创纪录,推出了世界上首款柔性透明OLED屏幕,尺寸高达77英寸。
经过几十年的快速发展,OLEDs技术在照明显示领域的应用水平不断提高,但是发光材料的短缺以及器件的效率和稳定性等问题仍然制约着OLEDs的发展,而且发光层直接决定了器件的效率.它的器件基本结构大致上是由玻璃基层(Glass)、空穴注入层(HIL)、空穴传输层(HTL)、有机发光层(EML)、电子传输层(ETL)以及阴极材料层(Cathode),共六层组成,厚度不到1毫米,相比上述的LCD结构更加简洁和轻薄。
其中有机发光层是最为最核心的材料,也是是整个OLED 产业链中技术壁垒最高的领域,在OLED中的面板成本占比约为12%,国内外也一直把开发多种主客体材料作为研究的热点和重点。
目前,高效率的磷光OLEDs在制备发光层时,主要是通过主客体掺杂的方式来调控OLEDs器件发光的色调,通过能量转移引起掺杂分子的激发,从而引起(客体)的发光。
在本论文中,将以磷光OLEDs发光层中的材料为主要研究内容,设计合成出不同功能的有机小分子材料,如高效率的黄绿光客体材料、高三线态的红光主体材料,并对材料的各项性能进行了详细的研究。
在磷光材料中,通过充分利用重金属离子会产生强的自旋-轨道耦合作用,让本来禁阻的三重态跃迁至基态成为可能,理论上可实现近100%的内量子效率。
目前,设计和制备第三过渡金属(如Ir和Pt)配合物作为发光材料正在快速的发展。
我的第一个课题是,基于金属铂的磷光客体材料的研究,设计合成了具有刚性结构的环金属四齿铂配合物,并对其性质变化以及器件性能进行了详细的研究,对以后的分子设计具有重要参考价值。

1、为什么是要用混合氧化剂?氧化剂DTBP的作用?
单用氧化剂TBHP时,反应能够进行,但是当只用DTBP时,只能得到微量的产物。
所以可以证明反应的进行跟TBHP有关联。
通过自由基捕获试剂TEMPO,并且捕获到了自由基,所以可以证明得到DTBP的加入,能够促进TBHP产生羟基自由基。
2、如何证明是该反应是涉及自由基历程?
用自由基捕获试剂TEMPO参与反应,结果得到了一种加合物,通过TLC、NMR、GC-Mass 的检测,验证了TEMPO与丙酮自由基的加合物。
所以可以证明该反应式涉及自由基的反应。
1、写出DTBP\TBHP\TEMPO的化学式?
O
O
H TBHP O
O
DTBP
N
TEMPO
2、该反应的意义及用途?
可以广泛应用于材料化学领域,是一种很好的中间体。