第2课时 金属的活动顺序 置换反应
科粤版·九年级化学下册
复习导入
思考:金属主要有哪些的化学性质?
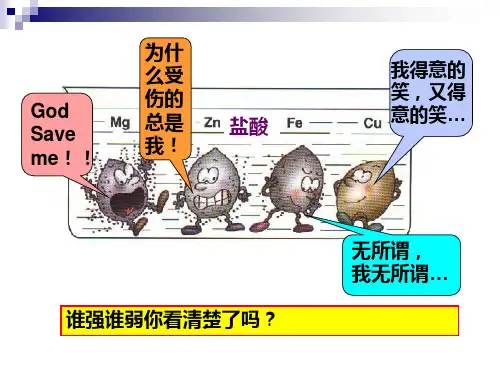
金属与稀酸的反应、金属与金属化合 物溶液的反应都与金属活动性强弱有关。
思考 那么,如何比较金属活动性的强弱呢?
推进新课
一、金属活动性顺序
经过多方面的研究,科学家将常见金属按其活动性 强弱排列如下,称为金属活动性顺序。
在下面的反应中,反应物和生成物哪些是单质, 哪些是化合物? 请将答案填在下方的空格内。
单质 化合物
化合物
单质
上述反应都属于“置换反应”, 你能不能说一 说什么叫置换反应?
由一种单质与一种化合物反应,生成另一 种单质与另一种化合物的反应叫做置换反应。
特点: ①形式上:单质+化合物→单质+化合物。 一般形式可表示为:A+BC→B+AC。是化学 反应基本类型之一。
方法2:将金属活动性居中的金属盐溶液, 例如取CuSO4溶液,而Cu两边的金属取其 单质,如Zn片和Ag片,然后分别将Zn片 和Ag片放入CuSO4溶液中,根据是否有紫 红色的铜被置换出来,确定金属的活动性。
即中间的溶液,两端的金属的方法。
自由讨论 2.如何验证Mg、Zn、Cu、Ag的活动性?
K Ca Na Mg Al Zn Fe Sn Pb〔H〕Cu Hg Ag Pt Au
K Ca Na Mg Al Zn Fe Sn Pb〔H〕Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
K Ca Na Mg Al Zn Fe Sn Pb〔H〕Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
说明:
1.金属的位置越靠前,它的活动性就越强。 2.位于氢前的金属能置换出盐酸、稀硫酸中的氢。 3.位于前面的金属能把位于后面的金属从它们的盐溶 液中置换出来。