糖尿病肾病的诊断和分期
- 格式:docx
- 大小:896.51 KB
- 文档页数:2

糖尿病肾脏病指南及专家共识解读糖尿病肾脏病(DKD)是糖尿病最主要的微血管并发症之一,已成为慢性肾脏病和终末期肾病的主要原因。
随着对 DKD 认识的不断深入,相关的指南和专家共识也在不断更新和完善。
本文将对糖尿病肾脏病的指南及专家共识进行解读,旨在帮助大家更好地了解这一疾病的诊治要点。
一、糖尿病肾脏病的定义与诊断糖尿病肾脏病是指由糖尿病引起的慢性肾脏病,主要表现为尿白蛋白排泄增加和(或)肾小球滤过率下降,并伴有肾脏结构和功能的异常。
诊断 DKD 通常需要综合考虑患者的糖尿病病史、尿蛋白水平、肾功能以及肾脏影像学检查等。
目前,临床上常用的诊断指标包括尿白蛋白肌酐比值(UACR)和估算肾小球滤过率(eGFR)。
UACR 升高(≥30mg/g)是诊断 DKD 的重要依据之一,但需要在 3-6 个月内重复检测,以排除其他可能导致尿蛋白增加的原因。
同时,eGFR 持续低于 60ml/min/173m²也提示可能存在 DKD。
此外,肾脏病理检查对于明确 DKD 的诊断和分型具有重要意义,但由于其为有创性检查,通常在临床诊断不明确或需要进一步评估病情时进行。
二、糖尿病肾脏病的危险因素糖尿病患者发生肾脏病的危险因素众多,主要包括血糖控制不佳、高血压、高血脂、肥胖、吸烟、遗传因素以及糖尿病病程等。
其中,长期高血糖是导致 DKD 发生和发展的关键因素。
血糖波动过大也会加重肾脏损伤。
高血压不仅是 DKD 的常见并发症,也是促进 DKD 进展的重要危险因素。
严格控制血压可以显著延缓 DKD 的进展。
高血脂会导致肾脏内脂质沉积,引起肾小球硬化和肾小管间质损伤。
肥胖可通过多种机制影响肾脏功能,如增加肾脏的代谢负担、引发胰岛素抵抗等。
吸烟会损伤血管内皮细胞,导致肾脏血液循环障碍,增加 DKD 的发病风险。
遗传因素在 DKD 的发生中也起着一定作用,某些基因变异可能使个体更容易患上 DKD。
三、糖尿病肾脏病的筛查早期筛查对于 DKD 的诊断和治疗至关重要。
糖尿病肾病的诊断和分期糖尿病肾病(DKD)是糖尿病的常见并发症,也是重要的终末肾衰竭病因之一。
由于DKD的管理和治疗和非糖尿病肾病(NDKD)有较大的不同,因此,临床医生应根据临床表现和辅助检查,必要时进行肾穿刺活检病理检查,准确诊断DKD,识别NDKD,从而对患者采取及时正确的治疗。
DKD的诊断标准糖尿病患者合并的肾脏损害包括DKD和NDKD,正确诊断对治疗及预后意义重大,肾活检病理检查是确诊的重要依据。
DKD是由糖尿病引起的肾脏损害,其诊断目前仍存在争议及不完善之处,主要根据《糖尿病肾病防治专家共识》(2014年版)建议,主要包括尿白蛋白/肌酐比值(ACR)> 30 mg/g或肾小球滤过率(GFR)< 60 ml/min/1.73 m2持续超过3个月。
糖尿病性肾小球肾病(diabetic glomerulopathy)指经肾脏活检证实的由糖尿病引起的肾小球病变,不采纳单纯的尿微量白蛋白浓度测定来诊断尿白蛋白异常。
有关尿白蛋白异常的定义见下表:DKD的诊断标准如下表,诊断DKD时要排除非NDKD ,鉴别困难时需肾脏穿刺病理检查来鉴别。
DKD的临床分期根据临床与病理过程,Mogensen分期法将DKD分为5期:Ⅰ期:肾小球肥大,呈高滤过状态,肾小球滤过率升高,无肾脏病理组织学改变。
Ⅱ期:间歇性微量白蛋白尿期,尿蛋白排泄率正常或运动后增高,肾脏病理可有肾小球基底膜增厚和系膜扩张;同时,需排除其他因素引起的尿白蛋白排泄一过性增加,如糖尿病酮症酸中毒、泌尿系感染、运动、高血压、心力衰竭、全身感染、发热、妊娠等。
Ⅲ期:持续性微量白蛋白尿期,肾小球滤过率正常,病变仍为可逆性。
Ⅳ期:显性蛋白尿期,尿常规检查尿蛋白水平从(+)~(++++),可多达肾病范围的蛋白尿,肾小球滤过率下降,病理有典型的弥漫性肾小球硬化改变。
Ⅴ期:肾功能衰竭期,尿蛋白排泄可减少,肾功能异常。
DKD的病理分级DKD的病理分级见下表:值得注意的是,DKD的肾脏病理分级和临床表现通常相一致,但是也有不一致的例外情况。

糖尿病肾病的诊断及分期(一)糖尿病肾病的表现及分期Mongensen将1型糖尿病肾损害分为5期,约每5年进展一期,该分期现已被临床医师广泛采用。
其实,2型糖尿病肾损害过程也与此相似,只不过2型糖尿病肾损害进展比1型糖尿病快(约每3~4年进展一期),这可能与2型糖尿病多发生于中、老年人,肾脏已有退行性变,且多合并高血压及高脂血症相关。
现将这5期的临床病理表现简述如下:1.肾小球高滤过期此期主要表现为肾小球滤过率(GFR)增高。
如果及时纠正高血糖,GFR 变化仍可逆转。
此期病理检查除可见肾小球肥大外,无其他器质性病变。
2.无临床表现的肾损害期此期可出现间断微量白蛋白尿,患者休息时尿白蛋白排泄率(UAER)正常(<20μg/min或<30mg/d),应激时(如运动)增多,超过正常值。
在此期内患者GFR可仍较高或降至正常,血压多正常。
此期病理检查可发现(常需电镜检查确定)肾小球早期病变,即肾小球系膜基质轻度增宽及肾小球基底膜(GBM)轻度增厚。
3.早期糖尿病肾病期出现持续性微量白蛋白尿(UAER持续在20~200μg/min或30~300mg/d)为此期标志,但是尿常规化验蛋白仍阴性。
此期患者GFR大致正常。
血压常开始升高。
病理检查肾小球基质增宽及肾小球基底膜(GBM)增厚更明显,小动脉壁出现玻璃样变。
一般认为从此期起肾脏病变已不可逆。
4.临床糖尿病肾病期尿常规化验蛋白阳性即标志进入该期,此期病情进展迅速,三四年内出现大量蛋白尿(>3.5g/d)及肾病综合征。
严重肾病综合征病例常呈现大量腹水及胸腔积液,利尿治疗疗效差。
此期患者GFR减低,血压明显升高。
病理检查肾小球病变更重,部分肾小球已硬化,且伴随出现灶性肾小管萎缩及肾间质纤维化。
5.肾衰竭期从出现大量蛋白尿开始,患者肾功能加速恶化直至肾衰竭。
患者出现肾性贫血。
糖尿病肾病与多数原发性肾小球疾病不一样,患者虽已进入肾衰竭期,可是尿蛋白量却不减,可呈现肾病综合征。

糖尿病肾病的分期和临床表现糖尿病肾病是严重危害糖尿病⼈的并发症之⼀,据统计,糖尿病患者中约1/3患有糖尿病肾病,糖尿病肾病严重影响了糖尿病患者的⽣活质量及寿命,并带来了⾼额的医疗费⽤。
⽬前,糖尿病肾病还⽆较好的治疗⽅法,因此,糖尿病肾病的预防尤为重要!糖尿病肾病属于糖尿病的微⾎管病变。
今天我们就给⼤家说说糖尿病肾病的分期及临床表现。
第⼀期肾⼩球滤过率(GFR)增⾼,⼤于120ml/min甚⾄可达到150ml/min;尿蛋⽩排泄率正常,应激时(运动、⾎糖控制不良、发热、⾼⾎压)增加;肾活检肾脏体积增⼤;⾎压正常;见于糖尿病的发病初期。
这些反应在经严格控制⾎糖和接受胰岛素治疗⼏周到⼏个⽉以后可以恢复正常。
此期临床⽆特殊表现。
第⼆期肾⼩球滤过率(GFR)增⾼或接近正常⽔平;尿蛋⽩排泄率(UAE)正常,剧烈运动后可增⾼;“肾活检”肾⼩球基底膜增厚,系膜基质增加;⾎压正常;此期也可逆转。
临床仍⽆特殊表现。
第三期⼜称为早期糖尿病肾病。
肾⼩球滤过率正常或升⾼;持续性微量⽩蛋⽩尿,24⼩时尿微量⽩蛋⼤于30mg(或20ug/min);肾活检肾⼩球和肾⼩管基底膜增厚,肾⼩球和肾⼩管上⽪细胞肥⼤,系膜基质增宽,⼩动脉壁玻璃样变;⾎压可轻度升⾼,但仍在正常范围。
5~7年后进⼊第四期。
第四期为明显的糖尿病肾病,也称临床糖尿病肾病期。
此期出现持续性蛋⽩尿,尿常规可检测出尿蛋⽩,尿蛋⽩定量⼤于0.5克/24⼩时;肾⼩球滤过率下降,并伴⾼⾎压。
如果不很好地控制⾎压,肾⼩球滤过率会以平均每⽉每分钟下降约1~1.22毫升的速度不断恶化,使患者会在5~8年内发展为末期肾衰竭。
肾活检提⽰肾⼩球硬化。
此期即使经严格治疗也不可逆转。
第五期为终末期糖尿病肾病,⾎压明显增⾼,尿蛋⽩并不像其它原因所致肾脏疾病那样到了肾功能衰竭晚期会下降,肾⼩球滤过率下降可达10ml/min以下,尿素氮及肌酐升⾼,⽔肿及⾼⾎压进⼀步加重,出现低蛋⽩⾎症。
以上就是糖尿病肾病的分期,从⽂中可以看出在三期之前,如果经过适当的治疗,患者是可以逆转肾病的。

糖尿病肾病的诊断与治疗糖尿病是一种常见的代谢疾病,由于血糖水平长期升高,糖尿病会对身体产生许多不良影响,其中之一就是引起肾脏疾病,也称为糖尿病肾病。
糖尿病肾病是糖尿病并发症中的一种严重病症。
它是由于高血糖水平引起的肾脏病变,其病理特征是肾小球滤过膜和肾小管上皮细胞的损伤,严重时导致肾脏功能衰竭。
本文将介绍糖尿病肾病的诊断与治疗。
一、糖尿病肾病的诊断糖尿病肾病的诊断通常包括以下几个方面。
1. 临床表现糖尿病肾病的早期症状不明显,患者可能感觉到夜间尿频、尿急、失眠、身体疲劳等非特异性症状。
但是,随着疾病的进展,患者会出现蛋白尿、高血压、水肿等典型表现。
2. 尿检糖尿病肾病的尿液检查是诊断糖尿病肾病的重要手段之一,包括检测尿蛋白、尿酸、基质金属蛋白酶等。
3. 血液检查血液检查是诊断糖尿病肾病不可或缺的方法之一,包括检测血糖、肌酐、尿素氮等指标。
另外,还应检测胆固醇、甘油三酯、脂蛋白等脂代谢指标。
4. 影像学检查影像学检查对于糖尿病肾病的早期诊断也是非常重要的。
肾脏超声、CT及MRI等影像学检查可以帮助了解肾脏的形态、大小、结构及血流情况。
二、糖尿病肾病的治疗针对糖尿病肾病的治疗主要包括以下几个方面。
1. 控制血糖首要的方法就是控制血糖,建议将餐后血糖控制在7.8mmol/L以下,糖化血红蛋白(HbA1c)控制在6.5%以下的水平,以降低糖尿病肾病的发生率和减缓病情进展。
2. 药物治疗糖尿病肾病的药物治疗主要包括血糖降、降压和减少蛋白尿等。
常用药物包括口服降糖药、胰岛素、ACEI/ARB类降压药、钙通道阻滞剂等。
3. 饮食调节饮食是糖尿病治疗过程中不可或缺的组成部分,糖尿病患者应该控制饮食,减少摄入高糖、高脂的食物,多食用五谷杂粮、蔬菜、水果等富含膳食纤维以及低脂、低盐、低糖的食品。
4. 过滤性治疗糖尿病肾病的过滤性治疗主要包括透析和肾移植等。
严重糖尿病肾病患者一般会选择肾脏透析、肾脏移植等治疗方式,但是这些治疗方式都需要花费较高的经济成本和医治时间。

糖尿病肾病分期标准5期
据糖尿病肾病的病程和病理生理演变过程,一般糖尿病肾病分为以下五期:(1)肾小球高滤过和肾脏肥大期。
这种初期改变与高血糖水平一致,血糖控制后可以得到部分缓解。
本期没有病理组织学损伤。
(2)正常白蛋白尿期:GFR高出正常水平。
肾脏病理表现为GBM 增厚,系膜区基质增多,运动后尿白蛋白排出率(UAE)升高(>20
μg/min),休息后恢复正常。
如果在这一期能良好的控制血糖,病人可以长期稳定处于该期。
(3)早期糖尿病肾病期,又称“持续微量白蛋白尿期”。
GFR开始下降到正常。
肾脏病理出现肾小球结节样病变和小动脉玻璃样变。
UAE持续升高至20~200μg/min 从而出现微量白蛋白尿。
本期病人血压升高。
经ACEI或ARB类药物治疗,可减少尿白蛋白排出,延缓肾脏病进展。
(4)临床糖尿病肾病期。
病理上出现典型的K-W结节。
持续性大量白蛋白尿(UAE>200μg/min)或蛋白尿大于500mg/d,约30%病人可出现肾病综合征,GFR持续下降。
该期的特点是尿蛋白不随GFR下降而减少。
病人一旦进入IV期,病情往往进行性发展,如不积极加以控制,GFR将平均每月下降
1ml/min。
(5)终末期肾衰竭。
GFR<10ml/min。
尿蛋白量因肾小球硬化而减少。
尿毒症症状明显,需要透析治疗。

糖尿病肾病的诊断标准糖尿病肾病是糖尿病患者最常见的并发症之一,对患者的生活质量和生存率造成了严重影响。
因此,及早发现和诊断糖尿病肾病对于患者的治疗和管理至关重要。
下面将介绍糖尿病肾病的诊断标准,希望能对临床医生和患者有所帮助。
1. 尿蛋白定量。
尿蛋白定量是诊断糖尿病肾病的重要指标之一。
通常情况下,成年人每日排泄的尿蛋白量应该在30mg以下,若患者连续3个月内尿蛋白定量大于30mg/24h,则可以诊断为糖尿病肾病。
2. 肾小球滤过率。
肾小球滤过率(GFR)是评估肾功能的重要指标,对于诊断糖尿病肾病也具有重要意义。
一般情况下,GFR低于60ml/min/1.73m²可以诊断为慢性肾脏疾病,结合糖尿病患者的临床症状和其他检测指标,可以进一步确认是否为糖尿病肾病。
3. 血肌酐和尿素氮。
血肌酐和尿素氮是评估肾功能的常用指标,对于诊断糖尿病肾病也有一定的参考价值。
一般情况下,血肌酐和尿素氮水平升高可能提示肾功能受损,结合其他临床表现和检测指标,可以帮助医生进行诊断。
4. 肾脏超声检查。
肾脏超声检查是诊断糖尿病肾病的常用影像学检查方法,可以帮助医生了解肾脏的结构和形态,发现肾脏的异常情况。
结合临床症状和其他检测指标,肾脏超声检查有助于诊断糖尿病肾病。
5. 肾脏活检。
肾脏活检是诊断糖尿病肾病的“金标准”,通过直接观察肾脏组织的病理学改变,可以明确诊断糖尿病肾病,并且评估肾脏病变的程度和类型,指导临床治疗。
综上所述,诊断糖尿病肾病需要综合运用尿蛋白定量、肾小球滤过率、血肌酐和尿素氮水平、肾脏超声检查以及肾脏活检等多种方法,结合患者的临床表现和病史,进行综合分析和判断。
希望临床医生和患者能够重视糖尿病肾病的诊断工作,及早发现并进行治疗,以减轻病情和提高生活质量。

糖尿病肾病确诊标准通常是根据肾小球滤过率出现下降或者白蛋白/肌酐比值出现增高,并同时排除其他慢性肾脏病的情况下可做出诊断。
糖尿病肾病的诊断,可通过检测随机尿来测定白蛋白/肌酐比值,如果范围≥30mg/g,则提示尿白蛋白排泄增加的情况。
可以在3~6个月内在重复检查白蛋白/肌酐比值,如果3次中有2次尿蛋白排泄增加,那么在排除感染等其他因素即可诊断白蛋白尿。
另外,还可以通过肾脏肾小球滤过率来判断糖尿病肾病,肾脏肾小球滤过率即肾脏的排泄功能,当患者肾小球滤过率小于60ml·min-1·(1.73m2)-1时,可诊断为肾小球滤过率下降。
当出现其中任何一种情况异常时,在结合排除其他慢性肾脏病后,就可以临床诊断糖尿病肾病。
此外,糖尿病肾病诊断的金标准是病理诊断,不过,这个一般是在病因难以鉴别的时候,才考虑行肾穿刺病理检查,由于这是一种有创操作,一般是不推荐糖尿病患者进行常规的肾脏穿刺活检。

2型糖尿病肾病分期标准2型糖尿病肾病是指由于2型糖尿病引起的肾脏病变。
肾脏是人体重要的排泄器官,负责排除代谢废物和调节水盐平衡。
然而,当糖尿病患者患上肾病时,肾脏功能受损,会导致水盐代谢紊乱、尿毒症等严重后果。
因此,对2型糖尿病肾病进行准确的分期和评估,对于及时干预和治疗具有重要意义。
目前,国际上对2型糖尿病肾病的分期标准主要采用了肾小球滤过率(eGFR)和尿蛋白排泄率(UACR)两个指标进行评估。
根据这两个指标的不同组合,将2型糖尿病肾病分为不同的阶段,以便临床医生更好地进行干预和治疗。
首先,根据eGFR的水平,将2型糖尿病肾病分为5个阶段。
eGFR是反映肾小球滤过功能的指标,通常情况下,eGFR的数值越高,表示肾小球滤过功能越好。
在2型糖尿病肾病的分期标准中,eGFR的水平被划分为,≥90ml/min/1.73m²为1期,60-89ml/min/1.73m²为2期,30-59ml/min/1.73m²为3期,15-29ml/min/1.73m²为4期,<15ml/min/1.73m²为5期。
通过eGFR的分期,可以更好地了解肾小球滤过功能的损害程度,为临床医生制定治疗方案提供重要参考。
其次,根据UACR的水平,也可以将2型糖尿病肾病分为3个阶段。
UACR是尿蛋白排泄率的指标,正常情况下,尿中排泄的蛋白质很少,但在肾脏病变时,尿中的蛋白质排泄率会明显增加。
根据UACR的水平,将2型糖尿病肾病分为,A1期(正常/微量白蛋白尿),<30mg/g,A2期(中度白蛋白尿),30-300mg/g,A3期(重度白蛋白尿),>300mg/g。
通过UACR的分期,可以更好地了解肾脏蛋白质排泄的情况,为临床医生评估肾脏病变的程度提供重要依据。
综合考虑eGFR和UACR两个指标,可以将2型糖尿病肾病分为6个阶段,A1期,eGFR≥90ml/min/1.73m²,UACR<30mg/g;A2期,eGFR≥90ml/min/1.73m²,UACR≥30mg/g;A3期,eGFR60-89ml/min/1.73m²,UACR≥30mg/g;B1期,eGFR30-59ml/min/1.73m²,UACR≥30mg/g;B2期,eGFR15-29ml/min/1.73m²,UACR≥30mg/g;C期,eGFR<15ml/min/1.73m²,UACR≥30mg/g。

如何评估和管理糖尿病慢性肾脏病及其风险糖尿病肾脏病的诊断糖尿病肾病通常是根据白蛋白尿和/或 eGFR降低的存在,在没有其他主要肾脏损害原因的体征或症状的情况下做出的临床诊断。
糖尿病肾病的典型表现被认为包括长期糖尿病、视网膜病变、无肉眼血尿的白蛋白尿,以及渐进性eGFR 下降。
然而,2 型糖尿病患者在诊断时可能存在糖尿病肾病征象,或没有视网膜病变。
eGFR 降低但无白蛋白尿在1型和2型糖尿病中经常被报道,而且随着美国糖尿病患病率的增加,eGFR 降低也越来越普遍。
活动性尿沉渣(含红细胞或白细胞或细胞管型)、蛋白尿快速增加或肾病综合征、eGFR快速降低或无视网膜病变(1型糖尿病),对于具有这些特征的患者,应考虑转诊至肾病专科医生进行进一步诊断,包括肾活检的可能性。
1型糖尿病患者很少发生无视网膜病变的肾脏疾病。
在2型糖尿病,如肾活检所证实,视网膜病变对糖尿病引起的CKD仅具有中度敏感性和特异性(20)。
慢性肾脏病的分期1-2期CKD定义为eGFR ≥60 mL/min/1.73 m2的高蛋白尿证据,而3-5期CKD定义为eGFR范围逐渐降低(21)(图 11.1 )。
在任何eGFR水平下,蛋白尿程度与心血管疾病(CVD)、CKD进展和死亡率的风险相关(7)。
因此,KDIGO(肾病:改善全球结局)建议采用更全面的CKD分期,纳入eGFR所有阶段的蛋白尿;该系统与风险更密切相关,但是也更复杂并且不直接转化为治疗决定(2)。
因此,根据当前的分类系统,必须对eGFR和蛋白尿进行量化,以指导治疗决策。
这一点也很重要,因为eGFR水平对于调整药物剂量或限制使用是必不可少的。
白蛋白尿的程度应影响降压药物选择或降糖药物的选择。
观察到的 eGFR 损失病史(这也与 CKD 进展和其他不良健康结局风险有关)和肾脏损害的原因(包括糖尿病以外的可能原因)也可能影响这些决定。
急性肾脏损伤急性肾损伤(Acute kidney injury,AKI)的诊断标准是血清肌酐在短时间内持续增加 50%或更多,这也反映为 eGFR 的快速下降(25,26)。

糖尿病肾病诊疗1糖尿病肾病的分期2007年2月,美国国立肾脏病基金(NationalKidneyFoundation)发表的枟糖尿病及慢性肾脏病临床实践指南及专家建议枠(下称“指南”)指出,既往临床常用的“糖尿病肾病”(diabeticnephropathy,DN)这一专业术语应被“糖尿病肾脏疾病”(diabetickidneydisease,DKD)所替代。
DKD是指临床考虑由糖尿病引起的肾脏病变,如经肾穿刺病理检查证实则称为糖尿病肾小球病变(diabeticglomerulopa-thy),但是在内分泌界的指南中并没有对DKD这个名词特别重视,中文名称就更不用说了。
目前糖尿病肾病的分期参照1型糖尿病肾损害改变进行分期。
1型糖尿病肾损害的病理改变首先表现为肾小球高滤过,肾脏体积增大;然后肾小球基底膜轻度增厚及系膜基质轻度增宽;再者肾小球基底膜增厚及系膜基质增宽明显,小动脉壁出现玻璃样变;随着肾小球病变加重,部分肾小球硬化,灶状肾小管萎缩及间质纤维化;最后出现肾衰竭。
一系列的病理改变对应出现的临床指标分别是正常蛋白尿,持续出现的尿微量蛋白(30~300μg/d),继而持续大量蛋白尿(>300μd/d或尿蛋白>0畅5g),最后血肌酐升高,估算的肾小球滤过率(eGFR)降低,尿毒症相关的临床表现。
2002年美国肾脏病基金会(NKF)组织撰写的肾脏病/透析临床实践指南(KDOQI)中正式提出了慢性肾脏病(CKD)的定义及分期。
经过多次修改和确认,CKD取代了慢性肾衰竭(CRF)、慢性肾损伤(CRI)等名称,成为对各种原因所致慢性肾脏疾病(病程>3个月)的统称。
指南推荐糖尿病肾损害的程度和分级参照CKD分级(表1),根据患者的CKD分期制订定期监测的项目和治疗的计划。
表1临床常用的慢性肾功能不全分期及建议我国慢性肾功能不全分期GFR(ml/min)分期描述KDOQI分期GFR[ml/(min·1r .73m2)]分期描述临床建议≥90S 正常治疗合并症;延缓疾病进展;减少心血管疾患危险因素50~80代偿期60~89肾功能轻度下降估计疾病是否会进展和进展速度25~50失代偿期30~59肾功能中度下降评价和治疗并发症10~25肾衰竭期15~29肾功能重度下降准备肾脏替代治疗10尿毒症期15肾衰竭肾脏替代治疗注:KDOQI:肾脏病/透析临床实践指南DOI:10.3760/cma.j.issn.1008- 1372.2014.02.005作者单位:510080广州,广东省人民医院(广东省医学科学院)内分泌科作者简介:裴剑浩,广东省人民医院内分泌科主任医师,一病区主任,医学博士,广东省医学会糖尿病学术委员会委员,广东省医师协会代谢内分泌分会副主任委员,南方医科大学兼职教授,曾以访问学者身份在澳大利亚墨尔本大学附属的圣文森医学研究所和悉尼大学医学院附属皇家爱尔弗雷德王子医院访问学习在糖尿病指南中,无论美国还是我国的有关糖尿病肾病指南章节中并没有将CKD分期作为糖尿病肾病的主要临床分期,可能还是考虑到真正意义上的糖尿病肾病主要是考虑由血糖引起的肾病,其主要表现是以先出现微量蛋白尿后出现大量蛋白尿,最后出现肾功能衰竭的临床过程,这在1型糖尿病中表现非常典型,但是在2型糖尿病就相对复杂,因为患者可能合并高血压,血脂异常等对肾脏有很大影响的混杂因素,因此可能临床表现差异很大。
糖尿病肾病分期诊断与治疗新进展糖尿病是由于胰岛素缺乏或作用不足引起的以高血糖为特征的一组代谢性疾病。
糖尿病可由不同的途径损害肾脏,这些损害可以累及肾脏所有结构,从肾血管、肾小球到间质,可以有不同的病理改变和临床意义。
从广义上讲,与糖尿病有关的肾脏病包括糖尿病性肾小球硬化症、肾小管上皮细胞空泡变性、小动脉性肾硬化症,以及感染性的肾盂肾炎和肾乳头坏死。
但其中只有肾小球硬化症与糖尿病有直接关系,故又称为“糖尿病性肾病”(diabetic nephropathy,简称DN),是糖尿病全身性微血管合并症之一,其余均非糖尿病所特有。
病理改变:糖尿病病人肾脏损害的病理改变主要有以下几个方面,但其中仅“结节型肾小球硬化”为糖尿病病人所特有。
㈠肾脏肥大:在糖尿病早期甚至新诊断的Ⅰ型糖尿病病人,在X线和超声波检查下肾脏体积增大约20%~40%,伴有肾小球滤过率(GRF)增高。
㈡病理性肾小球硬化症:为DN的病理改变,其基本病变为肾小球基底膜(GBM)增厚和系膜基质增生。
1、结节型糖尿病肾小球硬化:为典型的Kimmelstiel与Wilson损害,约见于48%的DN病人。
2、弥漫型糖尿病性肾小球硬化:约见于75%糖尿病病人。
3、肾小球的渗出性损害:较少见,质见于严重的结节型和弥漫型损害的糖尿病病人,出现于糖尿病肾病进展时。
㈢肾小管-间质损害:肾小管上皮细胞内可见颗粒样和空泡样变性,一般属退行性改变,有的空泡内含有糖原或脂质,在糖尿病肾病晚期可发生小管萎缩,基底膜增厚。
肾间质损害包括水肿,淋巴细胞、单核细胞、浆细胞及多形核白细胞浸润,并在晚期纤维化。
㈣血管损害:一般认为糖尿病的肾小球和肾血管损害实际代表了两种不同的病理过程,它们往往同时发生。
多数损害是动脉硬化。
发病机制:糖尿病肾病是糖尿病全身性微血管病变表现之一,发病机制是多因素的,主要有以下几方面:㈠血流动力学改变。
㈡蛋白非酶糖化在糖尿病肾病发生中的作用:高血糖可以引起循环蛋白,如血红蛋白、血清白蛋白,以及包括细胞外基质和细胞膜成分的组织蛋白发生非酶糖化。
糖尿病肾病的检查诊断第一篇:糖尿病肾病的检查诊断糖尿病肾病的检查诊断:糖尿病是一种慢性的代谢性疾病,也被认为是一种养性病,常伴有多器官的机构变化等。
发展的过程比较漫长隐蔽。
需要定期做各项检查,而糖尿病肾病是由糖尿病发展而来的,那么糖尿病肾病的检查诊断是怎样的呢?下面是长沙普济肾病医院的解答:对于糖尿病肾病的早期诊断主要依赖于尿蛋白的测定,蛋白尿的出现成为糖尿病肾病早期诊断的标志特征。
尿糖定性是筛选糖尿病的一种简易方法,但在糖尿病肾病可出现假阴性或假阳性,故测定血糖是诊断的主要依据。
尿白蛋白排泄率(UAE)20~200μg/min,是诊断早期糖尿病肾病的重要指标;当UAE持续大于200μg/min或常规检查尿蛋白阳性(尿蛋白定量大于 0.5g/24h),即诊断为糖尿病肾病。
尿沉渣一般改变不明显,较多白细胞时提示尿路感染;有大量红细胞,提示可能有其他原因所致的血尿。
糖尿病肾病晚期,内生肌酐清除率下降和血尿素氮、肌酐增高。
长沙普济肾病医院专家表示,希望患者以正确积极的心态配合检查治疗,关于检查前是否需要做些准备工作,可听取检查医院的建议。
第二篇:糖尿病肾病的护理查房一.病史汇报:患者张思成,男性,79岁,退休工人,入院时间:2015.04.22,供病史者:本人现病史:患者现精神尚可,双下肢轻度浮肿,生命体征平稳,血糖波动较大,入院第二晚睡前血糖3.1mmol/l,检查结果:全腹部CT:双肾多发性囊肿、胃窦间质瘤可能。
超声心动图示:高血压性心脏病,心电图正常。
血红蛋白107g/l,肌红蛋白1200ng/ml,Cr102.7umol/l,Bun12.71mmol/l,磷酸肌酸激酶489u/l,尿蛋白1+。
既往史:T:36.7℃P:80次/分R:20次/分BP:130/60mmhg 患者既往糖尿病、高血压20余年,3年前有白内障手术史,无食物和药物过敏史,患者曾因糖尿病、高血压多次入住内分泌科,给予降糖降压治疗,血糖血压控制一般,7年前无明显诱因下体检时发现肾功能异常,肌酐160umol/l,明确为慢性肾衰,后不正规治疗,入院前在外院查肌酐170.9umol/l,同时查CT示:胃小弯占位性病灶,建议行胃镜进一步检查。
糖尿病肾脏病的诊断、辨证分型及疗效评定标准如下:一、诊断标准基于2007年美国肾脏病基金会(NKF)制定的肾脏病生存质量指导指南(简称NKF/KDOQI),重点参照中华医学会糖尿病学分会微血管并发症学组工作建议:1. 凡1型糖尿病或2型糖尿病患者,符合任何一项者,即可考虑为糖尿病肾脏病变。
大量白蛋白尿。
糖尿病视网膜病变伴任何一期慢性肾脏病。
在10年以上糖尿病病程的1型糖尿病中出现微量白蛋白尿。
2. 但应该指出的是,如出现以下情况之一,则应考虑其慢性肾脏病是由于其他原因引起的。
无糖尿病视网膜病变。
GFR较低或迅速下降。
蛋白尿急剧增多或出现肾病综合征。
顽固性高血压。
尿沉渣活动表现。
其他系统性疾病的症状或体征。
血管紧张素转换酶抑制剂(ACEI)或血管紧张素Ⅱ受体拮抗剂(ARB)类药物开始治疗后2~3个月内,肾小球滤过率下降超过30%。
二、辨证分型1. 脾肾阳虚证:具体表现为畏寒怕冷,肢体浮肿特别是双下肢最为显著,夜尿明显增多,脸色光白,拉肚子,同时伴有舌头淡、舌头胖大且有齿痕。
2. 气血两虚证:具体表现为面色淡白或发黄,嘴唇和指甲颜色较淡,腰膝酸痛,失眠和心慌等。
3. 肝肾阴虚证:具体表现为眩晕、耳鸣、小便短赤、手脚心发热、胸部发热、眼睛干涩,同时伴有舌头发红且舌苔少。
4. 气阴两虚证:具体表现为全身乏力、精神状态差、心悸、手脚心发热、咽喉干燥、气短、不爱运动等。
三、疗效评定标准1. 早期糖尿病肾脏病证候判定标准:显效:临床主要症状积分减少≥50%。
有效:临床主要症状积分减少≥30%。
无效:未达到上述有效标准者。
2. 早期糖尿病肾脏病相关指标判定标准:显效:UACR减少≥50%,或恢复正常。
有效:UACR≥30%。
无效:未达到上述有效标准者。
3. 中期糖尿病肾脏病疾病疗效判定标准:显效:临床主要症状积分减少≥50%,尿蛋白定量减少≥50%,或恢复正常。
有效:临床主要症状积分减少≥30%。
无效:未达到上述有效标准者。
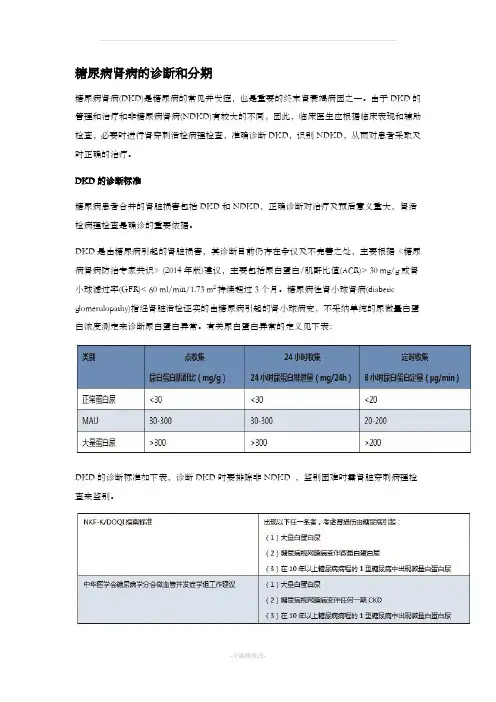
糖尿病肾病的诊断和分期
糖尿病肾病(DKD)是糖尿病的常见并发症,也是重要的终末肾衰竭病因之一。
由于DKD的管理和治疗和非糖尿病肾病(NDKD)有较大的不同,因此,临床医生应根据临床表现和辅助检查,必要时进行肾穿刺活检病理检查,准确诊断DKD,识别NDKD,从而对患者采取及时正确的治疗。
DKD的诊断标准
糖尿病患者合并的肾脏损害包括DKD和NDKD,正确诊断对治疗及预后意义重大,肾活检病理检查是确诊的重要依据。
DKD是由糖尿病引起的肾脏损害,其诊断目前仍存在争议及不完善之处,主要根据《糖尿病肾病防治专家共识》(2014年版)建议,主要包括尿白蛋白/肌酐比值(ACR)> 30 mg/g或肾小球滤过率(GFR)< 60 ml/min/1.73 m2持续超过3个月。
糖尿病性肾小球肾病(diabetic glomerulopathy)指经肾脏活检证实的由糖尿病引起的肾小球病变,不采纳单纯的尿微量白蛋白浓度测定来诊断尿白蛋白异常。
有关尿白蛋白异常的定义见下表:
DKD的诊断标准如下表,诊断DKD时要排除非NDKD ,鉴别困难时需肾脏穿刺病理检查来鉴别。
DKD的临床分期
根据临床与病理过程,Mogensen分期法将DKD分为5期:
Ⅰ期:肾小球肥大,呈高滤过状态,肾小球滤过率升高,无肾脏病理组织学改变。
Ⅱ期:间歇性微量白蛋白尿期,尿蛋白排泄率正常或运动后增高,肾脏病理可有肾小球基底膜增厚和系膜扩张;同时,需排除其他因素引起的尿白蛋白排泄一过性增加,如糖尿病酮症酸中毒、泌尿系感染、运动、高血压、心力衰竭、全身感染、发热、妊娠等。
Ⅲ期:持续性微量白蛋白尿期,肾小球滤过率正常,病变仍为可逆性。
Ⅳ期:显性蛋白尿期,尿常规检查尿蛋白水平从(+)~(++++),可多达肾病范围的蛋白尿,肾小球滤过率下降,病理有典型的弥漫性肾小球硬化改变。
Ⅴ期:肾功能衰竭期,尿蛋白排泄可减少,肾功能异常。
DKD的病理分级
DKD的病理分级见下表:
值得注意的是,DKD的肾脏病理分级和临床表现通常相一致,但是也有不一致的例外情况。
随着糖尿病病程的延长肾小球病理分级增加,蛋白尿也相应增加,高血压发生率增加,肾小球滤过率降低,但是也有一些特殊病例,比如病理肾小球病变表现严重而临床未达到肾病综合征诊断标准的大量蛋白尿,或病理肾小球病变轻微而临床有大量蛋白尿的情况。
信源:中华全科医师杂志.2017,16(10): 750-752.。