降钙素原测定试剂盒(磁微粒化学发光法)产品技术要求meilianke
- 格式:docx
- 大小:16.83 KB
- 文档页数:4

2022年修订第一版(本试剂盒仅供体外研究使用,不用于临床诊断!)产品货号:E-EL-H1492c产品规格:96T/48T/24T/96T*5Elabscience 人降钙素原(PCT)酶联免疫吸附测定试剂盒使用说明书Human PCT(Procalcitonin) ELISA Kit使用前请仔细阅读说明书。
如果有任何问题,请通过以下方式联系我们:销售部电话技术部电话************电子邮箱(销售)********************电子邮箱(技术)**************************网址:具体保质期请见试剂盒外包装标签。
请在保质期内使用试剂盒。
联系时请提供产品批号(见试剂盒标签),以便我们更高效地为您服务。
Copyright ©2021-2022 Elabscience Biotechnology Co.,Ltd. All Rights Reserved目录用途 (3)基本性能 (3)检测原理 (3)试剂盒组成及保存 (4)试验所需自备物品 (5)样品收集方法 (5)注意事项 (6)■ 试剂盒注意事项 (6)■ 样品注意事项 (6)样本稀释方案 (6)检测前准备工作 (7)操作步骤 (8)结果判断 (10)技术资源 (10)典型数据 (10)性能 (11)■ 精密度 (11)■ 回收率 (11)■ 线性 (11)声明 (12)Intended use (13)Character (13)Test principle (13)Kit components & Storage (14)Other supplies required (15)Sample collection (15)Note (16)■ Note for kit (16)■ Note for sample (16)Dilution Method (17)Reagent preparation (17)Assay procedure (18)Calculation of results (20)Technical resources (20)Typical data (20)Performance (21)■ Precision (21)■ Recovery (21)■ Linearity (21)Declaration (22)用途该试剂盒用于体外定量检测人 血清、血浆或其他相关生物液体中PCT浓度。

2性能要求
2.1外观和性状
2.1.1颜色性状
质控品复溶前应为浅黄色冻干粉末,复溶后应为清澈浅黄色液体,无沉淀、悬浮物和絮状物。
2.1.2包装
试剂瓶应无泄漏;盒贴、瓶贴、标签标识应完整、清晰。
2.2装量
质控品质量(含瓶重)均应不少于18 g。
2.3均一性
2.3.1瓶内均一性
质控品瓶内均一性应不大于表 2 的要求(SD 和CV 值满足其一即可)。
表 2 质控品瓶内均一性要求
2.3.2瓶间均一性
质控品瓶间均一性应不大于表3 的要求(SD 和CV 值满足其一即可)。
表3 质控品瓶间均一性要求
2.4参考值及参考范围
每批质控品均应提供本批产品的参考值表。
经迈瑞校准品校准的BS 系列生化分析仪及配套试剂对质控品进行测定,测定结果应在给定的参考范围内。
2.5生物安全性
质控品使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂
灵敏度的检测试剂,HBsAg、HIV 抗体、HCV 抗体、梅毒螺旋体TP 抗体检测应为阴性。
1。
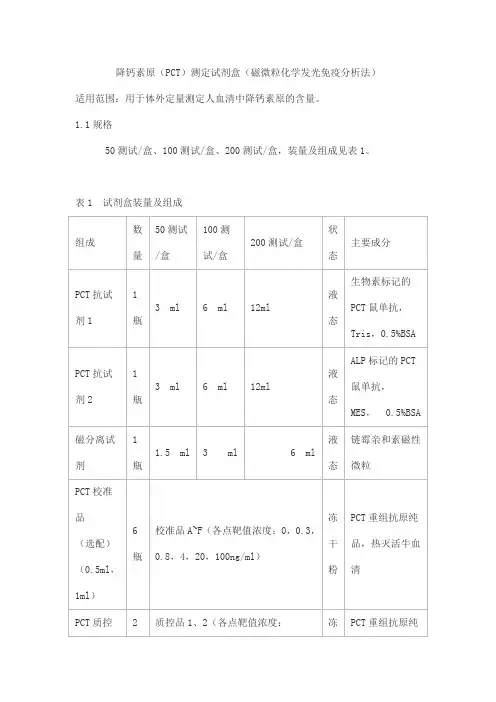
降钙素原(PCT)测定试剂盒(磁微粒化学发光免疫分析法)适用范围:用于体外定量测定人血清中降钙素原的含量。
1.1规格50测试/盒、100测试/盒、200测试/盒,装量及组成见表1。
表1 试剂盒装量及组成2.1 外观2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后为均匀悬浊液,无明显凝集;2.1.3 液体组分应澄清,无沉淀或絮状物;2.1.4 包装标签应清晰,无磨损。
2.2准确度将已知浓度的PCT抗原加入到样本中,其回收率应在(85%~115%)范围内。
2.3空白检测限应不大于0.02ng/ml。
2.4线性在(0.02,100)ng/ml的测量范围内,试剂盒的相关系数r应≥0.99。
2.5重复性变异系数(CV)应不大于10%。
2.6质控品测值测值应在质控范围内。
2.7批间差批间变异系数(CV)应不大于15%。
2.8校准品瓶间差校准品的瓶间变异系数(CV)应不大于10%。
2.9分析特异性2.9.1 浓度不低于5000pg/ml白介素(IL-6)的零浓度PCT样本,在本试剂盒上测定结果应不高于0.03ng/ml。
2.9.2 浓度不低于10ng/ml降钙素(CT)的零浓度PCT样本,在本试剂盒上测试结果应不高于0.02ng/ml。
2.10稳定性2.10.1效期稳定性:试剂盒在2℃~8℃贮存,有效期为12个月,到效期后的试剂盒检测外观、准确度、空白检测限、线性、重复性和质控品测值,应符合2.1~2.6的要求。
2.10.2复溶稳定性:校准品与质控品复溶后,在2℃~8℃环境下保存3天后进行以下检测:a)校准品:进行准确度、质控品测值的检测,结果应符合2.2,2.6的要求。
b)质控品:进行质控品测值的检测,结果应符合2.6的要求。

人降钙素原(PCT)酶联免疫吸附测定试剂盒使用说明书厦门慧嘉生物科技有限公司本试剂盒仅供体外研究使用、不用于临床诊断!预期应用ELISA法定量测定人血清、血浆或其它相关生物液体中PCT含量。
实验原理用纯化的PCT抗体包被微孔板,制成固相载体,往微孔中依次加入标本或标准品、生物素化的PCT抗体、HRP标记的亲和素,经过彻底洗涤后用底物(TMB)显色。
TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的PCT呈正相关。
用酶标仪在450nm波长下测定吸光度(值),计算样品浓度。
试剂盒组成及试剂配制1、酶标板:一块(96孔)2、标准品(冻干品): 2瓶,请临用前15分钟内配制。
每瓶以样品稀释液稀释至1ml,盖好后室温静置大约10分钟,同时反复颠倒/搓动以助溶解,其浓度为2,000 pg/ml,将其稀释为1,000 pg/ml后,再做系列倍比稀释(注:不要直接在板中进行倍比稀释),分别配制成1,000 pg/ml,500 pg/ml,250 pg/ml,125 pg/ml,62.5 pg/ml,31.2 pg/ml,15.6 pg/ml,样品稀释液直接作为空白孔 0 pg/ml。
如配制500 pg/ml标准品:取0.5ml(不要少于0.5ml )1,000 pg/ml的上述标准品加入含有0.5ml样品稀释液的Eppendorf 管中,混匀即可,其余浓度以此类推。
3、样品稀释液:1×20ml。
4、检测稀释液A:1×10ml。
5、检测稀释液B:1×10ml。
6、检测溶液A:1×120/瓶(1:100)。
临用前以检测稀释液A 1:100稀释(如:10 检测溶液A / 990检测稀释液A),充分混匀,稀释前根据预先计算好的每次实验所需的总量配制(100/孔),实际配制时应多配制 0.1-0.2ml。
7、检测溶液B:1×120/瓶(1:100)。

医疗器械产品技术要求编号:降钙素原(PCT)测定试剂盒(时间分辨荧光免疫层析法)1.产品型号/规格及其划分说明1.1包装规格25人份/盒。
1.2主要组成成分由PCT测试卡、降钙素原(PCT)质控品、ID卡组成。
其中,PCT测试卡由试纸条、塑料盒组成;试纸条上的主要成分有硝基纤维素膜、吸水纸、样本垫、偶合物垫及PVC板;硝基纤维素膜包被有鼠抗人PCT抗体和羊抗鸡IgY抗体;样本垫上有鼠抗人红细胞抗体;偶合物垫上有荧光标记的鼠抗人PCT抗体和荧光标记的鸡IgY抗体。
降钙素原(PCT)质控品:重组人PCT蛋白。
ID卡:内含校准曲线信息。
1.3适用范围:用于体外定量测定人全血、血浆或血清中降钙素原(PCT)的含量。
临床上主要用于细菌感染性疾病的辅助诊断。
2.产品性能指标2.1试剂盒性能指标2.1.1外观a)试剂盒外观应整洁,文字符号标识清晰,封装无破损,内容物齐全。
b)测试卡外观应平整、色泽均匀、边缘无毛刺,无色斑或污渍,卡固定紧密。
2.1.2膜条宽度膜条宽度应不小于 1.4mm。
2.1.3液体移行速度液体移行速度应不低于10mm/min。
2.1.4准确度测定具有溯源性的PCT工作校准品,测量结果与标定浓度的相对偏差应不超过±10%。
2.1.5空白限应不大于0.04ng/mL。
2.1.6线性范围在0.05ng/mL~100ng/mL区间内,线性相关系数r≥0.9900。
2.1.7批内精密度用同一批次的试剂盒,两个浓度工作校准品测定结果的变异系数CV<10.0%。
2.1.8批间精密度用三个不同批次的试剂盒测试,两个浓度工作校准品测定结果的变异系数CV<15.0%。
2.2质控品性能指标2.2.1外观无色澄清透明液体。
2.2.2装量质控品装量为0.5mL,应不少于标示值。
2.2.3准确度和赋值程序质控品测试结果应在靶值范围之内,赋值程序见附录1。
2.2.4均一性对一瓶质控品重复10次检测,对同一批号的10瓶质控品进行检测,批内瓶间差CV应≤15%。
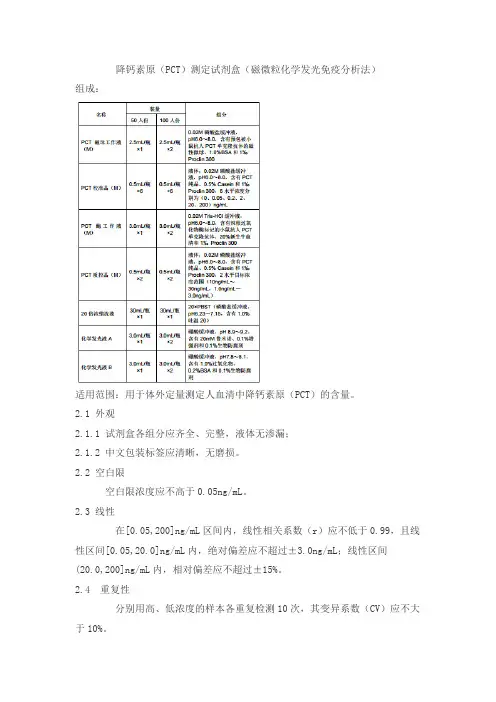
降钙素原(PCT)测定试剂盒(磁微粒化学发光免疫分析法)组成:适用范围:用于体外定量测定人血清中降钙素原(PCT)的含量。
2.1 外观2.1.1 试剂盒各组分应齐全、完整,液体无渗漏;2.1.2 中文包装标签应清晰,无磨损。
2.2 空白限空白限浓度应不高于0.05ng/mL。
2.3 线性在[0.05,200]ng/mL区间内,线性相关系数(r)应不低于0.99,且线性区间[0.05,20.0]ng/mL内,绝对偏差应不超过±3.0ng/mL;线性区间(20.0,200]ng/mL内,相对偏差应不超过±15%。
2.4 重复性分别用高、低浓度的样本各重复检测10次,其变异系数(CV)应不大于10%。
2.5 准确度将纯品配制的溶液(A)加入到人源样本(B)中,其回收率应在85%~115%之间。
2.6 分析特异性将下表规定浓度的干扰物质用试剂盒进行测定,检测结果的浓度值不得超过0.05ng/mL。
2.7 溯源性根据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确定度等内容。
校准品溯源至企业工作校准品,并与已上市产品比对赋值。
2.8 质控品赋值有效性本试剂盒质控品的测定结果应在质控范围内。
2.9 批间差用3个批号的产品分别检测同一份样本,3批产品间的相对极差(R)应不大于15%。
2.10稳定性试剂盒在(2~8)℃储存条件下的有效期为12个月,试剂盒在规定的条件下保存,取到效期后的试剂盒进行检测,检验结果应符合2.1、2.2、2.3、2.4、2.5、2.6的规定。

降钙素原(PCT)测定试剂盒(胶体金免疫层析法)适用范围:用于体外定量检测人血清中的降钙素原,与南京美宁康诚生物科技有限公司生产的Mokosensor-A300型胶体金免疫分析仪配套使用。
1.1 包装规格20人份/盒、100人份/盒。
1.2 主要组成成分由相应人份的检测卡组成,其中,检测卡:检测线包被来源于小鼠的降钙素原单克隆抗体A、质控线包被羊抗鼠IgG多克隆抗体、金标垫上固定胶体金标记来源于小鼠的降钙素原单克隆抗体B。
2.1外观2.1.1外观平整,材料附着牢固,内容齐全,包装标签应清晰;2.1.2膜条宽度为4mm±0.2mm;2.1.3液体移行速度应不低于10mm/min。
2.2 空白限不高于0.10μg/L。
2.3 线性2.3.1试剂盒线性范围为[0.10,100.00]μg/L,线性相关系数r不低于0.9900;2.3.2 [0.10,0.25]μg/L绝对偏差不超过±0.02μg/L,(0.25,100.00]μg/L 线性偏差在±10%范围内。
2.4重复性检测高、低两个浓度的样本,变异系数(CV)应不大于10% 。
2.5准确度回收率在85%~115%。
2.6分析特异性检测浓度为100.00μg/L超敏C反应蛋白中降钙素原的浓度,计算交叉反应率,应小于10%。
2.7批间差检测一个高浓度的样本,相对极差应在±10%范围内。
2.8稳定性:常温(10℃~30℃)保存,有效期12个月,有效期末分别检测2.2~2.5项,其结果应符合各项要求。
2.9 校准品溯源性试剂盒校准信息所用校准品按照GB/T 21415-2008 《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,溯源到本公司工作校准品,工作校准品通过已上市产品试剂盒比对赋值。

医疗器械产品技术要求编号:
降钙素原(PCT)检测试剂盒(免疫层析法)
1.产品型号/规格及划分说明
1.1产品型号/规格
20人份/盒。
1.2结构组成
由检测卡、干燥剂、比色卡、使用说明书组成。
其中:检测卡由检测区(T)(鼠抗PCT单抗)、质控区(C)(羊抗鼠IgG)和胶体金结合物(胶体金鼠抗PCT单抗)和硝酸纤维素膜支持物等组成。
1.3 适用范围
适用于体外检测全血、血浆或血清样本中的降钙素原(PCT)的含量。
2.性能指标
2.1外观及性状
2.1.1检测卡应无明显划痕、气泡、外观平整,材料附着牢固。
2.1.2检测卡的文字和标记应清晰、准确。
2.2膜条宽度
检测条的宽度应≥2.5mm。
2.3液体移行速度
液体移行速度应不低于 10mm/分钟。
2.4灵敏度(最低检出限)
本试剂盒对 PCT 最低检出限为 0.1ng/mL。
2.5检测范围
本试剂盒对 PCT 检测范围为 0.1ng/mL~250.0ng/mL。
2.6特异性
当样本中血红蛋白(Hb)浓度≤9mg/mL,胆红素(Bil)浓度≤0.5mg/mL,甘油三酯(TG)浓度≤18mg/mL 时,对试剂盒检测结果无干扰。
2.7精密度
2.7.1批内精密度
取同一批号试剂对精密度参考品分别进行 10 次测定,反应结果应一致,且显色度应均一。
2.7.2批间精密度
分别取连续三个批号试剂对精密度参考品分别进行 10 次测定,反应结果应一致,且显色度应均一。
1。
2.性能指标
2.1外观和性状
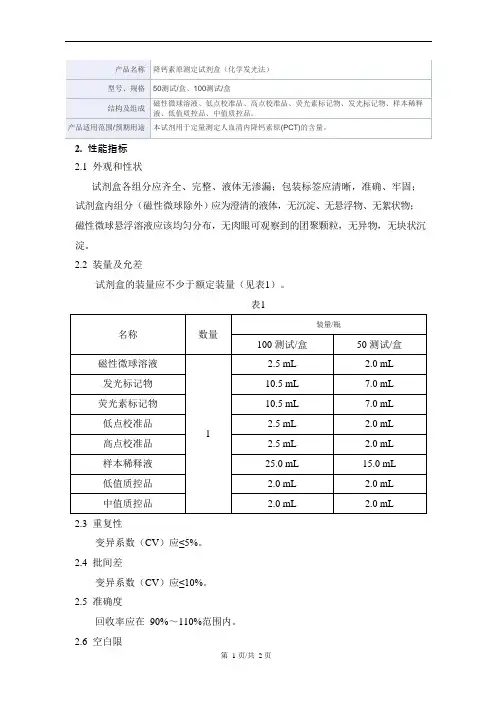
试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;试剂盒内组分(磁性微球除外)应为澄清的液体,无沉淀、无悬浮物、无絮状物;磁性微球悬浮溶液应该均匀分布,无肉眼可观察到的团聚颗粒,无异物,无块状沉淀。
2.2装量及允差
试剂盒的装量应不少于额定装量(见表1)。
表1
2.3重复性
变异系数(CV)应≤5%。
2.4批间差
变异系数(CV)应≤10%。
2.5准确度
回收率应在90%~110%范围内。
2.6空白限
试剂盒的空白限应≤0.01 ng/mL。
2.7检出限
试剂盒的检出限应≤0.04 ng/mL。
2.8线性
在(0.06~100.0)ng/mL 浓度范围内,线性相关性系数(r)绝对值应大于0.9900。
2.9校准品均一性
校准品均一性变异系数(CV 均一性)应≤5%。
2.10质控品预期结果
低值质控品每次检测结果应在(0.330~0.770)ng/mL 范围内,中值质控品每次检测结果应在(5.82~10.8)ng/mL 范围内。
2.11质控品均一性
质控品均一性变异系数(CV
)应≤5%。
均一性。

降钙素原测定试剂盒(荧光免疫层析法)产品技术要求乐普降钙素原测定试剂盒(荧光免疫层析法)适用范围:该产品用于体外测定全血/血清/血浆中降钙素原的含量。
1.产品规格及其划分说明1.1规格卡型1人份、10人份/盒、20人份/盒、50人份/盒。
1.2组成每盒含1/10/20/50 人份检测卡、1 份批号卡和1/10/20/50 人份样品缓冲液。
其中:每人份检测卡包括1 份降钙素原检测卡和1 包干燥剂。
降钙素原检测卡由样品垫、硝酸纤维素膜(T 线包被鼠抗人降钙素原单克隆抗体;C 线包被羊抗鼠抗体)、荧光垫(含有荧光标记的鼠抗人降钙素原单克隆抗体)、吸水纸、塑料载板组成。
样品缓冲液每支装定量为150ul/支,由0.1%的表面活性剂和0.1mol/L的Tris (pH7.0)溶液组成。
2. 性能指标2.1物理性状2.1.1膜条外观检测卡应整洁完整、无毛刺、无破损、无污染;材料附着牢固;标签字迹清晰,无破损。
2.1.2 膜条宽度检测卡的膜条宽度≥2.5mm。
2.1.3液体移行速度液体移行速度应不低于10mm/min。
2.1.4样品缓冲液样品缓冲液体积应不少于标示值,pH值6.5~8.0 。
2.2空白限空白限应不高于0.5ng/mL。
2.3重复性CV(%)应不高于15.0%。
2.4批间差CV(%)应不高于15.0%。
2.5线性在【0.5,50】ng/ml的范围内,用线性拟合公式拟合,剂量-反应曲线相关系数应不低于0.990。
2.6准确度样本回收率应在85%~115%范围内。
2.7分析特异性检测浓度为100ng/mL的抗钙素、35mg/mL的白蛋白,检测结果应小于0.5ng/mL。
2.8稳定性将检测试剂盒在2℃~8℃的环境中放置18个月后,分别检测2.1、2.2、2.3、2.5、2.6、2.7项,结果应符合各项目的要求。

医疗器械产品技术要求编号:降钙素原(PCT)测定试剂盒(化学发光免疫分析法)2.性能指标2.1外观和性状试剂盒各组分齐全、内外包装应完整无破损,外观整洁,标识清晰,无液体渗漏。
2.2装量表 1 PCT试剂盒的装量2.3 空白限(LoB)试剂盒的空白限(LoB)≤0.01 ng/mL。
2.4 检出限(LoD)试剂盒的检出限(LoD)≤0.02 ng/mL。
2.5 准确度将已知浓度的降钙素原加入到样本中,其回收率应在100.0 %±10.0 %范围内。
2.6 线性测量浓度在0.03~100 ng/mL范围内的PCT样本,线性相关系数r≥0.990。
2.7 重复性测试(0.5±0.1)ng/mL和(10±1)ng/mL两个企业参考品,所得结果的变异系数(CV)应不大于8.0 %。
2.8 批间差用3个批号试剂盒,分别测试(0.5±0.1)ng/mL和(10±1)ng/mL两个企业参考品,3个批号试剂盒之间的批间变异系数(CV)应不大于10.0 %。
2.9 校准品外观和性状(1)校准品及复溶剂包装应完整无破损,外观整洁,标识清晰,无液体渗漏;(2)校准品C0及复溶剂应为清澈透明液体,无沉淀、无悬浮物、无絮状物;(3)校准品C1应为白色或者淡黄色冻干粉,无凹陷和未冻干痕迹;复溶后液体均匀、无肉眼可见颗粒、无沉淀。
2.10 校准品装量(1)校准品C0的装量不少于其标示体积;(2)复溶剂的装量应在其标示体积的±10.0 %范围内。
2.11赋值准确性用经高一级测量程序定值的工作校准品,对化学发光免疫分析系统定标后,再使用同一批次试剂盒测试校准品,测试值与校准品的标示值的偏差在±10.0 %范围内。
2.12 校准品均一性2.12.1 瓶内均一性校准品C0的瓶内均一性,以标准偏差(SD)为指标,满足SD≤0.02 ng/mL;校准品C1的瓶内均一性,以变异系数(CV)为指标,满足CV≤8.0 %。
降钙素原测定试剂盒(上转发光法)
适用范围:与本公司生产的上转发光免疫分析仪配套使用,用于体外定量测定人血清、血浆和全血样本中降钙素原(PCT)的含量。
1.1规格:20人份/盒和40人份/盒。
1.2组成:
2.1 外观
2.1.1 液体组分应澄清透明、无沉淀或絮状物,铝箔袋应无破损漏气现象。
2.1.2 液体试剂的净含量应不少于标示值。
2.1.3 试纸条宽度应为4.0±0.1mm。
2.1.4 液体移行速度应不低于10mm/min。
2.2准确性
检测降钙素原(PCT)纯品,其回收率应在(85%~115%)范围内。
2.3线性范围
[0.02ng/mL,50ng/mL]范围内,相关系数(r)应不低于0.9900。
2.4 精密度
2.4.1 批内变异系数(CV):分别检测(10±1)ng/mL、(0.35±0.035)ng/mL 的样本,批内变异系数应均不高于12.0%。
2.4.2 批间变异系数(CV):检测(0.35±0.035)ng/mL的样本,批间变异系数应不高于15.0%。
2.5空白检测限
试剂盒空白检测限应不大于0.02ng/mL。
2.6 特异性
与人血清白蛋白(HSA)、胆红素无显著交叉反应。
表1 与其它物质的交叉反应数据
2.7 稳定性
本产品在 4-30℃保存有效期为18个月,取到效期产品测定结果应符合上述2.1、2.2、2.3、2.4.1、2.5、2.6项要求。
人降钙素原(PCT) 酶联免疫分析试剂盒使用说明书【产品名称】通用名称:人降钙素原(PCT)酶联免疫分析试剂盒英文名称:PCT Quantitative Enzyme-linked Immunosorbent Assay Kit【包装规格】96人份/盒【预期用途】本试剂盒采用ELISA双抗体酶联免疫夹心法定量检测人血清、血浆及相关液体样本中降钙素原(PCT)含量。
适用于严重感染或脓毒血症的早期诊断;全身性感染与非细菌性炎症反应(如自身免疫性疾病)的鉴别诊断;全身性细菌性感染与病毒感染的鉴别诊断;全身性细菌/真菌感染与器官移植排斥和移植后病毒感染的鉴别诊断;作为高危患者(如ICU、器官移植术后或接受免疫抑制治疗的患者)感染性疾病的监测指标。
【临床意义】人降钙素原(PCT)是人降钙素的前体物,无激素活性,其在健康人血清中水平极低,但在全身性细菌感染患者血清中含量迅速升高,感染后两个小时即可检测到,且持续时间长,其在血清中的水平与感染性疾病的严重程度呈正相关,经有效抗生素治疗后,PCT水平可迅速下降,而病毒感染、肿瘤、自身免疫性疾病、外伤(多创伤或手术创伤)、临床用药、慢性炎症以及局部感染者,PCT水平维持在正常范围内或者有轻度升高。
因此,PCT是细菌感染所致重症全身性炎症反应的良好指标,在全身性细菌感染和脓毒症辅助鉴别诊断、预后判断、疗效观察等方面有很高的临床价值。
在局限性感染、病毒感染、自身免疫性疾病、手术创伤和慢性炎症时,其血浆浓度正常或轻度升高;严重细菌感染或霉菌、寄生虫感染(如腹膜炎、软组织感染、蜂窝组织炎、吻合口漏、肺炎、ARDS)时大量上升,特别是脓毒性休克时PCT时浓度成倍升高。
因此,利用它能有效地评估感染和炎症的严重程度及进展情况,还能监测药物疗效,指导外科围手术期的处理以及抗生素正确应用。
作为高危患者(如ICU、器官移植术后或接受免疫抑制治疗的患者)感染性疾病的监测指标;早期预测脓毒性休克、多器官功能不全综合征(MODS)、成人呼吸窘迫综合征(ARDS)及多器官功能障碍(MOF)的发生及判断疾病预后等。
2. 性能指标
2.1物理性状
2.1.1 外观
试剂盒表面应整洁完整、无毛刺、无破损、无污染,无峰棱,上下盖附着应牢固,拔脱应轻松。
2.1.2 尺寸
2.1.2.1 试剂盒的长度不应超过100mm。
2.1.2.2 试剂盒的宽度不应超过34mm。
2.1.3 移动速度
液体移动速度应不低于10mm/min。
2.2 准确度
用标准溶液进行检测,在检测仪上测试结果的平均值与标示浓度值的偏差应不超过±12%。
2.3 线性
2.3.1 试剂盒在0.02ng/ml~100ng/ml的线性范围内,试剂盒的线性相关性系数应≥0.9。
2.3.2 试剂盒在<1ng/ml的范围内线性绝对偏差应不大于±0.2ng/ml,在
1ng/ml~100ng/ml的范围内线性相对偏差应不大于±10%。
2.4 批内精密度
在检测仪上的测试结果的变异系数CV(%)应不超过12%。
2.5 批间精密度
对3个批号的试剂盒各5个进行检测,三个批号在检测仪上的测定均值的变异系数CV(%)应不超过15%。
2.6 分析灵敏度
应不高于0.02ng/ml。
2.7 分析特异性
2.7.1 浓度为5mg/ml的血红蛋白,对测定结果的影响应不大于±10%。
2.7.2 浓度为0.2mg/ml的胆红素,对测定结果的影响应不大于±10%。
2.7.3 浓度为10mg/ml的甘油三酯,对测定结果的影响应不大于±10%。
人降钙素原(PCT)酶联免疫分析试剂盒使用说明书本试剂盒仅供研究使用检测范围:0.312ng/ml-20ng/ml最低检测限:0.078ng/ml特异性:本试剂盒可同时检测天然或重组的人PCT,且与其他相关蛋白无交叉反应。
有效期:6个月预期应用:ELISA法定量测定人血清、血浆、细胞培养上清或其它相关生物液体中PCT含量。
说明1.试剂盒保存:-20℃(较长时间不用时);2-8℃(频繁使用时)。
2.浓洗涤液低温保存会有盐析出,稀释时可在水浴中加温助溶。
3.中、英文说明书可能会有不一致之处,请以英文说明书为准。
4.刚开启的酶联板孔中可能会含有少许水样物质,此为正常现象,不会对实验结果造成任何影响。
概述降钙素原(procalcitonin,PCT)是上世纪九十年代才发现的细菌、真菌性感染的特异性标志物。
PCT是降钙素(calcitonin,CT)的前体物,由116个氨基酸组成的糖蛋白,分子量约为13kD,包括59个氨基酸的N端、32肽的活性CT和21肽的下钙素。
血清PCT的半衰期为25-30小时,在体内外较稳定,不受体内激素水平的影响,在健康小鼠血清中的含量极低,常低于0.1ng/ml。
PCT的表达主要受细菌内毒素、炎性细胞因子,如肿瘤坏死因子α(TNF-α)、IL-6、IL-8等调节。
因此,当有细菌、真菌重症感染时,血清中的PCT浓度在2-6小时内迅速升高,一般高于1.0ng/ml,而且持续时间长。
而病毒性感染和免疫等其他非细菌性感染,患者血清中PCT水平不升高或仅有轻度升高。
因此,PCT是鉴别细菌、真菌性感染与病毒感染的良好指标。
实验原理用纯化的抗体包被微孔板,制成固相载体,往包被抗PCT抗体的微孔中依次加入标本或标准品、生物素化的抗PCT抗体、HRP标记的亲和素,经过彻底洗涤后用底物TMB显色。
TMB 在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的PCT呈正相关。
2 性能指标
2.1 外观
试剂盒各组分应齐全、完整,液体无渗漏;包装标签应清晰、准确、牢固。
2.2 检出限
空白限(limit of blank,LoB)不大于0.01ng/mL,检出限(limit of detection,LoD)为0.02ng/mL。
2.3 准确度
将已知浓度的降钙素原样本加入到低值样本中,其回收率应在[85%,115%]。
2.4 线性
在0.05ng/mL~100ng/mL 范围内,线性相关系数|r|应不低于0.990。
2.5 重复性
测试(0.5±0.1)ng/mL 和(10±1)ng/mL 两个区间参考品,所得结果的变异系数(CV)应不大于8%。
2.6 批间差
测试(0.5±0.1)ng/mL 和(10±1)ng/mL 两个区间参考品,所得结果的批间变异系数(CV)应不大于10%。
2.7 稳定性
效期内试剂盒于37±1℃放置 6 天后,检测结果应符合 2.2~2.5 的要求。
人降钙素原(PCT)酶联免疫分析试剂盒使用说明书使用目的:本试剂盒用于测定人血清、血浆及相关液体样本中降钙素原(PCT)含量。
实验原理本试剂盒应用双抗体夹心法测定标本中人降钙素原(PCT)水平。
用纯化的人降钙素原(PCT)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入降钙素原(PCT),再与HRP 标记的降钙素原(PCT)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB 显色。
TMB 在HRP 酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的降钙素原(PCT)呈正相关。
用酶标仪在450nm 波长下测定吸光度(OD值),通过标准曲线计算样品中人降钙素原(PCT)浓度。
试剂盒组成1 30 倍浓缩洗涤液20ml×1 瓶7 终止液6ml×1 瓶2 酶标试剂6ml×1 瓶8 标准品(2400 ng/L)0.5ml×1 瓶3 酶标包被板12 孔×8 条9 标准品稀释液1.5ml×1 瓶4 样品稀释液6ml×1 瓶10 说明书1 份5 显色剂A 液6ml×1 瓶11 封板膜2 张6 显色剂B 液6ml×1/瓶12 密封袋1 个标本要求1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上进行试验,可将标本放于-20℃保存,但应避免反复冻融2.不能检测含NaN3 的样品,因NaN3 抑制辣根过氧化物酶的(HRP)活性。
操作步骤1. 标准品的稀释:本试剂盒提供原倍标准品一支,用户可按照下列图表在小试管中进行稀释。
1200ng/L 5 号标准品150μl 的原倍标准品加入150μl 标准品稀释液600ng/L 4 号标准品150μl 的5 号标准品加入150μl标准品稀释液300ng/L 3 号标准品150μl 的4 号标准品加入150μl 标准品稀释液150ng/L 2 号标准品150μl 的3 号标准品加入150μl 标准品稀释液75ng/L 1 号标准品150μl 的2 号标准品加入150μl 标准品稀释液2. 加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、待测样品孔。
降钙素原测定试剂盒(磁微粒化学发光法)
适用范围:本试剂盒用于体外定量测定人血清、血浆或全血样本中降钙素原(PCT)的含量。
1.1包装规格
10人份/盒
1.2主要组成成分
试剂盒由检测试剂条、质控品(冻干品)、校准品1(冻干品)、校准品2(冻干品)、盒签二维码组成。
表1 试剂盒主要组分
表2 单人份检测试剂条组分
2.1外观
试剂盒组分应齐全、完整;检测试剂条应无漏液、无破损、无污染;中文包装标签应清晰,易识别。
2.2 校准品溯源性
根据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,该校准品溯源至出厂商的工作校准品。
2.3准确度
将已知浓度的降钙素原(PCT)加入到低值人血清样本中,其回收率应在[85%,115%]范围内。
2.4检出限
检出限不高于0.08ng/mL。
2.5线性
在[0.08,100] ng/mL的线性范围内,相关系数r应≥0.990。
2.6重复性
测试(0.5±0.1)ng/mL和(10±1)ng/mL两个区间样本,CV≤10%。
2.7批间差
用三个批号的试剂盒测试(0.5±0.1)ng/mL和(10±1)ng/mL两个区间样本,CV≤15%。
2.8 特异性
浓度为1ng/mL的人降钙素、0.6ng/mL的人降钙素基因相关肽交叉反应率应小于5%。
2.9质控品赋值有效性
测定值在质控品质控范围内。
2.10校准品和质控品瓶间差
校准品和质控品瓶间差CV<10%
2.11稳定性
2.11.1效期稳定性
取效期后的试剂盒检测外观、准确度、检出限、线性、重复性、特异性,应符合2.1、2.3~2.6、2.8的要求。
2.11.2 质控品复溶稳定性
质控品开瓶复溶后,在2℃~8℃密封避光保存,可以稳定3天,在第4天检测质控品重复性和赋值有效性,应符合2.6、2.9的要求。
2.11.3校准品复溶稳定性
校准品开瓶复溶后,在2℃~8℃密封避光保存,可以稳定3天,在第4天检测准确度和线性区间,应符合2.3、2.5的要求。