(完整word版)初三化学溶质质量分数与化学方程式的综合计算专题训练含答案.doc
- 格式:doc
- 大小:208.01 KB
- 文档页数:5

(化学)初三化学化学方程式的计算专题训练答案及解析一、中考化学方程式的计算1.要用溶质质量分数为19.6%的稀硫酸与金属锌反应制取氡气,请回答下列问题(1)用水和浓硫酸来配制500g 溶质质量分数为19.6%的稀硫酸。
需溶质质量分数为98%的浓硫酸的质量为__________g;(2)配制溶液时,用玻璃棒不断搅拌,玻璃棒的作用是_______________;(3)取配制后的溶液50g 与足量的金属锌反应,生成氢气的质量为_________g。
【答案】 100散热,以免水沸腾造成液滴飞溅0.2【解析】【分析】【详解】(1)设需溶质质量分数为98%的浓硫酸的质量为x,根据溶液稀释前后溶质的质量不变,则 500g×19.6%=x× 98% x=100g。
(2)配制溶液时。
用玻璃棒不断搅拌,玻璃棒的作用是散热,以免水沸腾造成液滴飞溅。
(3)设生成氢气的质量为 xZn+H 2SO4=ZnSO4 +H ↑2982 50g19.6%x50g 98=2 19.6% xx=0.2g故答案为:(1) 100;(2)散热,以免水沸腾造成液滴飞溅;(3) 0.2。
2.为测定某石灰石矿中碳酸钙的含量,进行了如下实验:称取10g 石灰石样品,高温煅烧至质量不再改变,称得剩余固体质量为 6.7g(假设杂质不参与反应)。
请计算:(1)反应生成的 CO2的质量 ______________。
(2)该石灰石样品中碳酸钙的质量分数____________。
【答案】 3.3g 75%【解析】【分析】【详解】(1)由质量守恒定律,反应生成的CO2的质量为10g-6.7g=3.3g,故填: 3.3;(2)解:设该石灰石样品中碳酸钙的质量为xCaCO 3+2HCl = CaCl 2+H 2O+CO 2↑10044x 3.3g10044=x3.3gx=7.5g7.5g该石灰石样品中碳酸钙的质量分数为× 100%=75%10g答:该石灰石样品中碳酸钙的质量分数为75%。

精品基础教育教学资料,仅供参考,需要可下载使用!备战中考化学专题练习(全国通用)-溶质的质量分数及相关计算(含答案)一、单选题1.将50g 98%的浓硫酸溶于450g水中,所得溶液中溶质的质量分数为()A. 9.8%B. 10.2%C. 10.8%D. 19.6%2.t℃时,甲物质的饱和溶液的溶质质量分数为15%,乙物质的溶解度为15g,丙物质的10g 饱和溶液蒸干后可得1.5g丙.当这三种物质的饱和溶液的质量相等时,含溶质的质量多少的顺序是()A. 丙>甲=乙B. 甲>乙>丙C. 乙>甲=丙D. 甲=丙>乙3.如图是A、B、C三种物质的溶解度曲线.下列说法错误的是()A. C的溶解度随温度的升高而减小B. t2℃时A、B、C的溶解度大小为A=B>CC. t2℃时,A、C的饱和溶液降温到t1℃时,A、C两溶液中溶质的质量分数相等D. t1℃时,A的饱和溶液中溶质质量分数为20%4.向100g溶液质量分数为10%的氯化钠溶液中加入10g硝酸钾,并完全溶解,该溶液中氯化钠的溶质质量分数会()A. 变大B. 变小C. 不变D. 无法确定5.要使20℃时饱和氢氧化钙溶液的溶质质量分数发生改变,可采取的措施有()①升高温度至30℃;②降低温度至10℃;③加入10g水;④加入1g氢氧化钙;⑤加入1g氧化钙;⑥蒸发掉10g的水,再恢复温度到20℃.A. ①③④B. ②⑤⑥C. ①③⑤D.②④⑤6.向100g水中不断加入固体A或改变温度,得到相应的溶液①~⑤。
下列说法正确的是()③④⑤资料:A的溶解度温度20 30 40 50 60/℃溶解度37.2 41.4 45.8 50.4 55.2/gA. ②中A的质量分数最大B. ③⑤中A的质量分数相等C. ②④⑤的溶液为饱和溶液D. ①③④⑤中没有固体存在7.已知20℃时100g水中最多能溶解36g氯化钠。
20℃时向100g水中加50g氯化钠,充分溶解后,所得溶液中溶质的质量分数为()A. 36%B. 50%C. 33.3%D. 26.5%二、填空题8. 现有1000g溶质质量分数为10%的氯化钠溶液,其中所含溶质的质量是________g;若将此溶液稀释为4%的稀溶液,需加水________g。

初三中考复习溶质质量分数的计算专题检测题含解析人教版化学初三中考复习溶质质量分数的计算专题测试题一、选择题(每小题5分,共50分)1.如图为实验室新购置的盐酸试剂瓶标签上的内容,用掉一部分盐酸后(忽略盐酸的挥发),不能再表示试剂瓶中剩余盐酸信息的是( )盐酸 化学纯(CP)(500 mL)品名:盐酸化学式:HCl 相对分子质量:36.5密度:1.19 g/cm3 质量分数:37%A.37% B.36.5 C.1.19 g/cm3 D.500 mL【解析】本题考查了溶液中各个量的变化。
由标签中信息可知,该瓶盐酸的体积为500 mL,其密度为1.19 g/cm3,溶质质量分数为37%,溶质HCl的相对分子质量为36.5。
用去一部分盐酸后(忽略盐酸的挥发),其体积小于 500 mL,而盐酸的溶质质量分数(37%)、溶质HCl的相对分子质量(36.5)和盐酸的密度(1.19 g/cm3)均不发生变化。
【答案】D2.下列说法正确的是( )A.凡是均一的、稳定的液体一定是溶液B.洗涤剂能够洗涤油污是因为洗涤剂能够溶解油污C.饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液D.5 g某物质完全溶于水配成100 g溶液,所得溶液的溶质质量分数一定是5%【解析】均一稳定的混合物属于溶液,均一的、稳定的液体,不一定是混合物,例如蒸馏水,不一定是溶液;洗涤剂能够洗涤油污是因为洗涤剂的乳化作用;溶液的浓稀与是否饱和没有关系,饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液;有的物质溶于水,能与水反应,例如氧化钠与水反应生成氢氧化钠,所以5 g氧化钠完全溶于水配成100 g溶液,所得溶液的溶质质量分数一定大于5%。
【答案】C3.(下列叙述不正确的是( )A.在水的电解实验中与电源负极相连的导管中产生氢气B.常用肥皂水检验硬水和软水C.用5%的过氧化氢溶液制氧气,为加快该反应的速率常加少量二氧化锰作催化剂D.用密度约为1.04 g/cm3的6%的氯化钠溶液配制3%的氯化钠溶液一定要使用托盘天平【解析】在水的电解实验中与电源负极相连的导管中产生氢气;常用肥皂水检验硬水和软水,遇肥皂水产生的泡沫少的是硬水,遇肥皂水产生的泡沫多的是软水;用5%的过氧化氢溶液制氧气,为加快该反应的速率常加少量二氧化锰作催化剂;用密度约为 1.04 g/cm3的6%的氯化钠溶液配制3%的氯化钠溶液一定要使用量筒,不用托盘天平。

经典例题例1.将100mL98%的浓硫酸(密度为1.84g/mL)缓缓倒入100mL水中,搅拌均匀,计算所得溶液中溶质的质量分数。
浓硫酸的质量=100mL×1.84g/mL=184g 浓硫酸中溶质的质量=184g×98%=180.32g稀硫酸的质量是浓硫酸质量加上水的质量184g+100mL×1g/mL=284gω(H2SO4)=(180.32g/284g)×100%=63.5%【答案】稀释后浓硫酸溶液中硫酸的质量分数为63.5%。
例2.常温下将10g下列固体与90g水充分混合,所得溶液的溶质质量分数最小的是()A.胆矾B.氧化钙C.氧化钠D.硝酸钾【分析】计算溶液中溶质的质量分数关键在于判断溶液中溶质是什么,同时求出溶质和溶液的质量各是多少。
物质溶解在水中有下列几种情况需要考虑:①物质在溶解时没有生成新物质且该不含有结晶水,溶质为物质本身,如KNO3,其质量分数等于[10g/(10g+90g)]×100%=10%;②结晶水合物溶于水,溶质应为无水物,结晶水成为溶剂的一部分,如CuSO4·5H2O,这种情况溶质的质量减少了,故溶质质量分数小于10%;③物质溶解时发生化学变化,生成了新物质,溶质为生成物,如Na2O溶于水,溶质质量为NaOH,溶质的质量分数>10%;④溶质质量分数还受溶解度的影响,如常温下将10g氧化钙溶于90g水充分混合,虽然CaO与水混合后溶液中溶质为Ca(OH)2,但其质量分数却比胆矾溶液水所得溶液得溶质质量分数小,这是因为CaO溶于水生成的Ca(OH)2微溶于水,只有极少量的Ca(OH)2溶解于水。
【答案】 B例3.一定量溶质质量分数为8%的食盐水蒸发掉50g水后,溶质质量分数增大一倍,则原溶液中溶质的质量为()A. 8gB. 6.4gC. 3.2gD. 4g【分析】欲使某溶液中溶质质量分数增大一倍,在恒温下蒸发掉的溶剂质量应等于原溶液质量的一半,故本题蒸发50g水以前溶液的质量为100g,故溶质质量为100g×8%=8g。

(化学)初三化学化学方程式的计算专项训练100(附答案)含解析一、中考化学方程式的计算1.请根据如图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),回答下列问题:计算稀盐酸中溶质质量。
【答案】7.3g【解析】【分析】【详解】根据质量守恒反应前后物质总质量不变可得二氧化碳的质量等于12g+100g+100g-207.6g=4.4g设稀盐酸中溶质质量为x3222CaCO2HCl=CaCl CO H O7344x 4.4g73x=,x=7.3g44 4.4g++↑+答:稀盐酸中溶质质量7.3g【点睛】根据质量守恒,求出二氧化碳质量,根据二氧化碳质量求稀盐酸中溶质质量2.某研究性学习小组为测定铜锌合金中铜的质量分数,进行如下实验:取合金 10g,向其中不断加入稀硫酸,产生的气体与所加稀硫酸的质量关系如图所示:求:合金中铜的质量分数______。
【答案】67.5%【解析】 【分析】铜不能和稀硫酸反应,锌和稀硫酸反应生成硫酸锌和氢气,根据图示数据可以得出生成氢气的质量,根据氢气的质量可以计算出锌的质量,进一步计算出铜锌合金中铜的质量分数。
【详解】由图示数据可知,当加入20g 稀硫酸时,合金中的锌恰好反应完全,产生0.1g 氢气。
设参加反应的锌的质量为ag 。
2442n +H SO nSO H 652ag0.1gZ Z =+↑65a =20.1,解得a=3.25g 则合金中铜的质量为10g-3.25g=6.75g , 合金中铜的质量分数=6.75g10g×100%=67.5%, 答:合金中铜的质量分数为67.5%。
3.某兴趣小组为测定一批石灰石样品中碳酸钙的质量分数,取16g 石灰石样品,把80g 稀盐酸分4次加入样品中(样品中的其它成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥、称量等操作,实验数据如下表:(1)表中X 的值为________g ;(2)所用盐酸的质量分数_____(写出计算过程,结果保留一位小数); (3)充分反应后最终所得溶液中钙元素的质量为_______g 。

2019备战中考化学专题练习(全国通用)-溶质的质量分数及相关计算(含答案)一、单选题1.将50g 98%的浓硫酸溶于450g水中,所得溶液中溶质的质量分数为()A. 9.8%B. 10.2%C. 10.8%D. 19.6%2.t℃时,甲物质的饱和溶液的溶质质量分数为15%,乙物质的溶解度为15g,丙物质的10g饱和溶液蒸干后可得1.5g丙.当这三种物质的饱和溶液的质量相等时,含溶质的质量多少的顺序是()A. 丙>甲=乙B. 甲>乙>丙C. 乙>甲=丙D. 甲=丙>乙3.如图是A、B、C三种物质的溶解度曲线.下列说法错误的是()A. C的溶解度随温度的升高而减小B. t2℃时A、B、C的溶解度大小为A=B>CC. t2℃时,A、C的饱和溶液降温到t1℃时,A、C两溶液中溶质的质量分数相等D. t1℃时,A的饱和溶液中溶质质量分数为20%4.向100g溶液质量分数为10%的氯化钠溶液中加入10g硝酸钾,并完全溶解,该溶液中氯化钠的溶质质量分数会()A. 变大B. 变小C. 不变D. 无法确定5.要使20℃时饱和氢氧化钙溶液的溶质质量分数发生改变,可采取的措施有()①升高温度至30℃;②降低温度至10℃;③加入10g水;④加入1g氢氧化钙;⑤加入1g氧化钙;⑥蒸发掉10g的水,再恢复温度到20℃.A. ①③④B. ②⑤⑥C. ①③⑤D. ②④⑤6.向100g水中不断加入固体A或改变温度,得到相应的溶液①~⑤。
下列说法正确的是()①②③④⑤A. ②中A的质量分数最大B. ③⑤中A的质量分数相等C. ②④⑤的溶液为饱和溶液D. ①③④⑤中没有固体存在7.已知20℃时100g水中最多能溶解36g氯化钠。
20℃时向100g水中加50g氯化钠,充分溶解后,所得溶液中溶质的质量分数为()A. 36%B. 50%C. 33.3%D. 26.5%二、填空题8. 现有1000g溶质质量分数为10%的氯化钠溶液,其中所含溶质的质量是________g;若将此溶液稀释为4%的稀溶液,需加水________g。

有关溶质质量分数的计算一、单选题1.20℃时食盐的溶解度为36 g,在该温度下,将20 g食盐溶于100 g水中配制溶液甲。
取30 g甲溶液,加入6 g食盐晶体得到溶液乙。
则甲、乙两种溶液中溶质的质量分数正确的一组是 ( )A.甲:16.7% 乙:30.6% B.甲:20% 乙:30.6%C.甲:20% 乙:26.5% D.甲:16.7% 乙:26.5%【答案】D2.【2018届中考化学复习(某某):第九单元溶液】20 ℃时,有质量分数为5%的食盐溶液A和质量分数为26.47%的食盐溶液B,下列有关A、B两种食盐溶液的判断正确的是( )A.向m g溶液B中加入x g食盐,振荡后,溶液的质量不变,则食盐在20 ℃时的溶解度为36B.等质量的A、B中,溶剂质量:B>AC.m g溶液B中的溶质质量为 gD.向m g溶液A中加入x g食盐,振荡后,溶液的质量>m g【答案】D【解析】A、向m g溶液B中加入x g食盐,振荡后,溶液的质量不变,说明此时B溶液已经饱和。
则食盐在20 ℃时的溶解度为36g。
物质的溶解度应带有单位,错误;B、由于A溶液的溶质质量分数小于B 的溶质质量分数,故等质量的A、B中,溶剂质量A>B,错误;C、m g溶液B中的溶质质量为m×26.47%=26.47100mg;D、由题某某息可知,20 ℃时,5%的A溶液为不饱和溶液。
向m g溶液A中加入x g 食盐,振荡后,溶液的质量>m g ,正确。
故选D 。
3.【 2018年某某乐陵实验中学九年级化学期末模拟】某溶液可能含4CuSO 、HCl 、2MgCl 、23Na CO 中的几种,向其中加质量分数为34.2%的2()Ba OH 溶液,反应中加入的2()Ba OH 溶液质量与产生沉淀的质量关系如图.下列说法正确的是()A .原溶液含4CuSO 和HClB .产生的沉淀可能是3BaCOC .a 点溶液只有一种溶质D .b 中溶液含溶质41.6g【答案】D4.40 g 15%的NaCl 溶液和40g 5% 的NaCl 溶液混合后,则所得混合溶液的溶质质量分数为( )A .10%B .5%C .15%D .20%【答案】A【解析】40 g 15%的NaCl 溶液中溶质的质量=40 g× 15%=6g;40g 5% 的NaCl 溶液中溶质质量=40g ×5%=2g;混合后溶质质量分数=6g 24040g g g++×100%=10%。

溶质质量分数与化学方程式的综合计算练习卷1.将硫酸钠和硫酸铜的混合固体溶于199.2克水中配成溶液,完全溶解后加入溶质质量分数为10%的氢氧化钠溶液至恰好完全反应,生成19.6克沉淀,过滤后将滤液蒸干后所得固体质量为56.8克,试计算:(1)加入氢氧化钠溶液的质量;(2)原混合固体的质量;(3)反应后所得滤液中溶质质量分数。
【答案】:(1)160g (2) 60.4g (3)14.2%2.测定某Na2CO3样品(混有KCl)中Na2CO3的质量分数,甲、乙两同学分别设计了以下方案:(1)甲同学称取样品11.8 g,于烧杯中加水溶解后向其中加入过量的16%的CaCl2溶液,充分反应后将生成的沉淀过滤、洗涤、干燥,称其质量为1.00 g,试通过计算确定样品中Na2CO3的质量分数ω(Na2CO3)。
(用百分数表示,结果保留1位小数)(2)乙同学同样取样品11.8g,于烧杯中加水溶解后向其中加入一定量10%的盐酸溶液,充分反应,通过测定生成的的CO2的质量来确定Na2CO3的质量分数。
试计算反应到少需要该盐酸溶液多少g?【答案】:(1)89.8%(2)73.0g3.为测定实验室硫酸废液中硫酸的质量分数,小刚同学做了如图1所示实验,将硫酸废液全部加入锥形瓶中,天平示数的变化如图2所示,(废液中其它成分不与锌发生反应)请计算:(1)生产氢气的质量;(2)该废液中硫酸的质量分数。
【答案】:(1)0.2g (2)9.8%4.(1)实验室用浓盐酸(溶质质量分数为37%,密度是1.18g·mL-1)配制成110g溶质质量分数为10%的稀盐酸,需要浓盐酸______mL。
(计算结果保留到0.1mL) (2)某化学兴趣小组同学为回收一块质量为30 g的铜锌合金中的铜,将该合金放人烧杯中,逐渐加入稀硫酸至不再产生气泡时,恰好用去稀硫酸100 g,烧杯内剩余固体17 g。
请完成下列计算:①30 g铜锌合金中锌的质量是_____g。

2019-2020年中考化学第一部分第9单元课时2 溶质质量分数的计算备考全能演练(含答案)1.配制4000 g生理盐水(溶质质量分数为0.9%),需要称取NaCl的质量为( D )A.9 g B.18 gC.27 g D.36 g2.将100 g 98%的浓硫酸溶于900 g水中,所得溶液中溶质的质量分数为( A )A.9.8% B.10.2%C.10.8% D.19.6%3.如图是A、B、C三种物质的溶解度曲线。
下列说法不正确的是( D )A.t1℃时,A的溶解度小于C的溶解度B.t1℃时,100 g水溶解了40 g A就达到了饱和状态C.t2℃时,A和C的饱和溶液中溶质的质量分数相等D.A、 B、C的饱和溶液从t2℃降到t1℃时,所得溶液的溶质质量分数从大到小是C>B>A 4.(xx·呼和浩特)20 ℃时,将等质量的a、b两种固体,分别加入到盛有100 g水的烧杯中,充分搅拌后现象如图甲,升温到50℃时,现象如图乙,a、b两种固体的溶解度曲线如图丙。
下列说法正确的是( C )A.图丙中M表示b的溶解度曲线B.图甲溶液中溶质的质量分数a大于bC.图乙中a、b溶液一定是不饱和溶液D. 30 ℃时a、b溶液溶质质量分数不相等5.30 ℃时,将一杯接近饱和的硝酸钾溶液不断恒温蒸发水分,其溶质质量分数随时间的变化关系符合下列曲线中( A )6.请根据图中A、B两种固体物质的溶解度曲线,回答下列问题。
(1)在__t1__℃时,A、B两种物质溶解度相同。
(2)t2℃时,向100 g水中加入30 g A,该溶液中溶质的质量分数为__20%__,若要把该饱和溶液恒温蒸发10 g水,则析出晶体的质量为__2.5__g。
7.如图为a、b两种物质在水中的溶解度曲线。
(1)10 ℃时,a的溶解度__<__(填“>”“<”或“=”)b的溶解度。
(2)30 ℃时,两种物质的溶解度曲线有交点,由此可获取的信息是:30 ℃时,a、b 两种物质的溶解度相同。
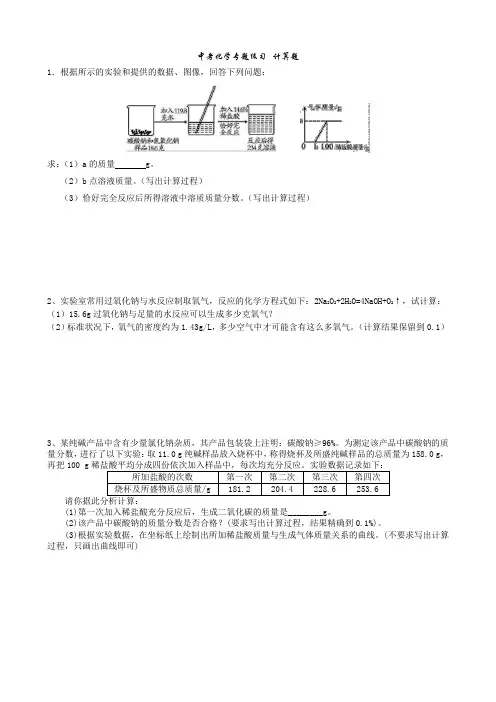
中考化学专题练习--计算题1.根据所示的实验和提供的数据、图像,回答下列问题:求:(1)a的质量 g。
(2)b点溶液质量。
(写出计算过程)(3)恰好完全反应后所得溶液中溶质质量分数。
(写出计算过程)2、实验室常用过氧化钠与水反应制取氧气,反应的化学方程式如下:2Na2O2+2H2O=4NaOH+O2↑,试计算:(1)15.6g过氧化钠与足量的水反应可以生成多少克氧气?(2)标准状况下,氧气的密度约为1.43g/L,多少空气中才可能含有这么多氧气。
(计算结果保留到0.1)3、某纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%。
为测定该产品中碳酸钠的质量分数,进行了以下实验:取11.0 g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0 g,再把100 g(1)第一次加入稀盐酸充分反应后,生成二氧化碳的质量是________g。
(2)该产品中碳酸钠的质量分数是否合格?(要求写出计算过程,结果精确到0.1%)。
(3)根据实验数据,在坐标纸上绘制出所加稀盐酸质量与生成气体质量关系的曲线。
(不要求写出计算过程,只画出曲线即可)4.工业盐酸中通常溶有少量的FeCl3而呈黄色,小红为测定某工业盐酸中HCl的含量进行如下实验:取某工业盐酸l00g,滴加一定溶质质量分数的NaOH溶液,测得加入NaOH溶液质量与反应生成的沉淀质量关系如图所示。
请回答下列问题:(1)FeCl3与NaOH恰好完全反应时,生成沉淀的质量是________g。
(2)计算氢氧化钠溶液的溶质质量分数。
(写出计算过程)(3)该工业盐酸中HCl的质量分数是_________。
5、钙是人体中的常量元素,缺钙时可通过食用保健药剂来增加摄入量。
某补钙药剂主要成分为碳酸钙,现将100g盐酸分成5等份,逐次加到用40g该药剂制成的粉末中(其他成分不与盐酸反应),得到部分数据与图象。
请根据有关信息回答问题:序号第1次第2次第3次第4次第5次加入盐酸的质量/g 20 20 20 20 20剩余固体的质量/g 35 30 25 20 a(1)a的数值为________,该品牌补钙药剂中CaCO3的质量分数是_________。

溶质质量分数计算一、单选题(共10道,每道10分)1.把15 g固体硝酸钾放入85 g水中,完全溶解后,溶液中硝酸钾的质量分数为( )A.15%B.17.6%C.21.4%D.85%答案:A解题思路:溶质质量分数等于溶质质量与溶液质量之比,可表示为(无论溶液是否饱和均适用)。
其中,溶液质量=溶质质量+溶剂质量。
把15 g固体硝酸钾放入85g水中,完全溶解后,溶质质量为15g,溶剂质量为85g,则溶液质量为15g+85g=100g。
故选A。
试题难度:三颗星知识点:溶质质量分数的计算2.向50 g溶质质量分数为5%的硫酸钠溶液中加入5g硫酸钠,完全溶解后,溶液中硫酸钠的溶质质量分数为( )A.5%B.10%C.13.6%D.15%答案:C解题思路:溶质质量分数等于溶质质量与溶液质量之比,可表示为(无论溶液是否饱和均适用)。
其中,溶液质量=溶质质量+溶剂质量。
50 g溶质质量分数为5%的硫酸钠溶液中,溶质质量为50g×5%=2.5g,溶液质量为50g。
向原溶液中又加入5g硫酸钠,完全溶解后,溶质质量为 2.5g+5g=7.5g,溶液质量为50g+5g=55g。
故选C。
试题难度:三颗星知识点:溶质质量分数的计算3.现有100g20%的某溶液,要使其溶质质量分数增大一倍,可采取的方法是( )A.加入20g溶质B.蒸发掉一半溶剂C.蒸发掉50g水D.加100g50%的该溶液答案:C解题思路:溶质质量分数等于溶质质量与溶液质量之比,可表示为(无论溶液是否饱和均适用)。
其中,溶液质量=溶质质量+溶剂质量。
要使溶质的质量分数增大,方法有加入溶质、蒸发溶剂、加入浓度较大的同种溶液。
使100 g 20%的某溶液溶质质量分数增大一倍,即增大到40%。
100 g 20%的溶液中,溶质质量为100g×20%=20g,溶液质量为100g,溶剂的质量为100g-20g=80g。
①若采用加入溶质的方法,设需要加入溶质的质量为x,则加入溶质后的溶液中溶质的质量为20g+x,溶液的质量为100g+x,溶质的质量分数为40%,,解得x=33.3g,故需要加入溶质的质量为33.3g,A错误。
精品整理页脚内容第十一讲 质量分数的相关计算核心知识1、溶质质量分数定义:溶质质量分数就是溶质质量与溶液质量的比值,其表达式为:%100⨯=溶液质量溶质质量溶质质量分数或2、溶解度与饱和溶液的溶质质量分数的关系在一定温度下,饱和溶液的溶质质量分数可由溶解度得到:3、配制一定质量分数的溶液的计算方法配制前的溶质质量=配制后的溶质质量,有两种情况: (1)用固体配制:固体质量=溶液质量×溶质质量分数;(2)用浓溶液配制稀溶液:浓溶液质量×浓溶液的溶质质量分数 =稀溶液质量×稀溶液的溶质质量分数 4、化学反应中的质量分数计算,核心要点就是找准溶质,并算出溶质和溶液的质量,常用的方法就是质量守恒和由化学方程式计算。
质量分数的基本计算1、将10.8g 固体氢氧化钠完全溶于49.2g 水,配成密度为1.2g/cm 3的溶液,则该溶液的质量分数为多少?2、要配制200g 质量分数为0.9%的NaCl 溶液,需要NaCl 多少g 和H 2O 多少mL ?3、配制980g 10%的稀硫酸需要多少mL 质量分数为98%的浓硫酸?(98%的浓硫酸密度为1.84g/cm 3)4、把200g 质量分数为10%的CaCl 2溶液稀释为4%的溶液,应该加水多少mL ?5、已知某物质的水溶液中有90g 水,取样5g 检测,发现其中有溶质2g ,则原溶液中有溶质多少g ? 溶解度与饱和溶液的质量分数6、已知在20o C 时氯化钠的溶解度为36g ,求20o C 时: (1)9g 氯化钠溶于25g 水中,所得溶液的质量分数; (2)12g 氯化钠溶于25g 水中,所得溶液的质量分数; (3)5g 氯化钠溶于25g 水中所得溶液的质量分数。
7、已知50o C 时氯化铵的溶解度为50g ,则此温度下1800g 氯化铵饱和溶液中含水多少g ?8、已知硝酸钾10o C 时的溶解度为22g ,80o C 时的溶解度为170g ,问:把一瓶10o C 时的硝酸钾饱和溶液升温到80o C 后的溶质质量分数为多少?9、已知硝酸钾10o C 时的溶解度为22g ,80o C 时的溶解度为170g ,问:把一瓶80o C 时的硝酸钾饱和溶液降温到10o C 后的溶质质量分数为多少?有多少g 固体析出?10、已知硝酸钾10o C 时的溶解度为22g ,80o C 时的溶解度为170g 。
初三化学化学方程式的计算综合练习含答案一、初中化学利用化学方程式选择题1.用镁和铝分别同稀硫酸反应,若要各制得10克氢气,则需要用去的镁和铝的质量比是A.4∶3 B.8∶9 C.3∶1 D.1∶32.质量守恒定律是帮助我们学习认识化学反应实质的重要理论,在化学反应aA+bB═cC+dD中,下列说法正确的是A.化学计量数a与b之和一定等于c与d之和B.若A和C都是盐,则该反应一定是复分解反应C.反应物A和B的质量比一定等于生成物C和D的质量比D.若取xgA和xgB反应,生成C和D的质量总和不一定是2xg3.科学家最新发现,可以将树木纤维素转变为超级储能装置,该反应的微观示意图如下。
下列说法正确的是A.反应前后分子总数不变B.反应中 X、Z 两种物质的质量比为 3:7C.反应中 Y 和 W 的物质的量之比为 4:5D.参加反应的 Y 中氮元素的质量一定等于生成 Z 的质量4.物质X的化学式为H2C2O4,可发生如下反应:aH2C2O4 bH2O↑+cCO2↑+dY↑取45g X,在t℃完全分解,产物通过足量浓硫酸,浓硫酸增重9g,另取45gX,在t℃完全分解,产物通过足量碱石灰(CaO和NaOH的固体混合物),碱石灰增重31g,则下列说法错误的是(已知气体Y不与浓硫酸或碱石灰发生反应)()A.CO2的质量为22g B.气体Y的质量为14gC.化学方程式中b∶c=1∶1D.气体Y可能为甲烷5.关于化学反应2X+Y=2Z的叙述正确的是()A.Z可能是单质,也可能是化合物B.反应中X、Y、Z三种物质的质量比是2:1:2C.若X和Y的相对分子质量分别为M和N,则Z的相对分子质量为M+ND.若ag的X完全反应生成bg的Z,则同时消耗(b﹣a)g 的Y6.己知A+3B=2C+3D中,已知2.3gA跟4.8gB恰好完全反应生成4.4gC。
又知D的相对分子质量为18,则C的相对分子质量为()A.22 B.44 C.88 D.92CO的混合物10g,测得其中氧元素含量为7.如图所示:在密闭容器中充入CO和264%,再向密闭容器中通入足量的氧气,通电使电火花塞点火让其中的一氧化碳完全燃烧成二氧化碳。
2019年九年级化学关于溶质质量分数计算一、基础知识计算 1、公式:溶液质量=溶质质量+溶剂质量2、计算类型:⑴根据概念计算:直接利用公式求溶液中溶质质量分数(或三个量中的其他任意一个量) ⑵溶液的稀释或蒸发浓缩⑶与化学方程式计算结合进行一定的拓展(这是中考的主要命题均势)3、在饱和溶液中:溶质质量分数 × 100%(C < S )(注:S 表示固体物质的溶解度),质量分数就不变。
3.常见题型及基本思路: (1)溶液加水稀释的计算:根据稀释前后溶质的质量相等,可用以下计算式计算:m(浓)×a%(浓)=[m(浓)+m(水)] ×a%(稀) (2)溶质质量分数不同的同溶质溶液混合问题: 一般可用下式计算:m(浓)×a%(浓)+m(稀)×a%(稀)=m(混)×a%(混) 溶液质量=溶液体积×溶液密度二、典型练习1:现有100g溶质质量分数为15%的过氧乙酸溶液,欲配制成溶质质量分数为1.5%的溶液来使用,需加水多少克?2:配制2000g20%的稀硫酸用以除锈,需98%的浓硫酸和水各多少毫升?3:实验室用95%的浓硫酸与5%的稀硫酸来配制20%的硫酸180g,需要95%的硫酸和5%的硫酸各多少克?4:200g稀硫酸与足量锌反应,生成0.4g氢气.求:①原硫酸溶液中溶质的质量分数.②所得溶液中溶质质量分数.5:把16.9gNaCl和Na2CO3的混合物加入到100g7.3%的盐酸中,恰好完全反应.求反应后所得溶液中溶质的质量分数.典型练习答案1:现有100g溶质质量分数为15%的过氧乙酸溶液,欲配制成溶质质量分数为1.5%的溶液来使用,需加水多少克?解:设需加水质量为x,100g×15%=(100g+x)×1.5%x=900g答:略.2:配制2000g20%的稀硫酸用以除锈,需98%的浓硫酸和水各多少毫升?解:设需浓硫酸的质量为x2000g×20%=x×98%x=408.2g浓硫酸体积=408.2g÷1.84g/cm3=221.8mL水的体积=(2000g-408.2g)÷1g/cm3=1591.8mL答:略.3:实验室用95%的浓硫酸与5%的稀硫酸来配制20%的硫酸180g,需要95%的硫酸和5%的硫酸各多少克?解:设需要95%,5%硫酸的质量分别为x,yx=30g y=150g答:略.4:200g稀硫酸与足量锌反应,生成0.4g氢气.求:①原硫酸溶液中溶质的质量分数.②所得溶液中溶质质量分数.解:设参加反应的H2SO4质量为x,生成ZnSO4的质量为y.Zn+H2SO4=ZnSO4+H2↑98 161 2x=19.6gy=32.2g(1)(2)答:略.5:把16.9gNaCl和Na2CO3的混合物加入到100g7.3%的盐酸中,恰好完全反应.求反应后所得溶液中溶质的质量分数.解:盐酸中溶质质量为:100g×7.3%=7.3g设Na2CO3质量为x,生成NaCl质量为y,CO2质量为m,Na2CO3+2HCl=2NaCl+H2O+CO2↑106 73 117 44x 7.3g y mx=10.6g y=11.7gm=4.4g所得溶液溶质质量分数为:答:略.巩固练习(一)选择题:1.配制90g10%的NaNO3溶液后,向其中加入10gNaNO3搅拌至完全溶解,所得溶液中NaNO3质量分数是( )A.19%B.10%C.9%D.无法计算2.把40g5%的CaCl2溶液溶质质量分数增大到10%,应采用的方法是( )A.把溶剂蒸发掉一B.加入2gCaCl2固体C.加入40g15%的CaCl2溶液 D.把溶剂蒸发掉20g3.配制5000g20%的盐酸,需要38%的盐酸(密度为1.19g/cm3)的体积为( )A.2211mLB.1000mLC.2200mLD.2632mL4.某酒精溶液中乙醇所含的氢原子数与水所含的氢原子数相等,则该酒精溶液中溶质的质量分数为( )A.50%B.25%C.46%D.33.3%5.一份2%的NaCl溶液蒸发掉40g水后,溶质质量分数变为10%,则原溶液中溶质质量为( )A.1gB.2gC.5gD.8g6.20℃时,NaCl的溶解度为36g,该温度下,NaCl溶液中溶质质量分数不可能为( )A.20%B.26.5%C.25%D.30%(二)填空题:1.配制360.0g 10%的盐酸,需要36%的盐酸(密度为1.18g/cm3)____毫升,水____毫升.2.向90g10%的NaCl溶液中加入10gK2SO4搅拌至完全溶解,所得溶液中NaCl的质量分数为____.3.向40g5%的NaOH溶液中,加入60g10%的NaOH溶液,混合后溶液中NaOH质量分数为____.4.右图是一瓶葡萄糖注射液标签,试根据给出的数据计算该溶液中含水____g,溶液的密度约为____g/cm3.(三)计算题:1.为了给水果消毒,某同学要把30g15%的KMnO4溶液稀释成0.3%的溶液,需加水多少克?2.将9gKNO3完全溶于21g水中,并将其均分为三份,计算:(1)取一份,其中溶质质量分数是多少?(2)取一份,使其溶质质量分数增大一倍,需加入KNO3多少克?(3)取一份,欲使其溶质质量分数减小一半,需加水多少克?3.t℃时,4.8g镁与一定量的稀盐酸恰好完全反应,所得溶液溶质质量分数为25%.求所用盐酸中氯化氢的质量分数.4.取22.2g石灰石样品,放入盛有126g稀盐酸的烧杯中,石灰石中的CaCO3与盐酸恰好完全反应(杂质不反应,也不溶解),烧杯内物质质量变为139.4g.求反应后所得溶液中溶质的质量分数.5.常温下,将18.9gKCl和K2CO3的混合物溶于149g水中,向其中加入36.5g稀盐酸,恰好完全反应,得到200g不饱和溶液.求反应后所得溶液中溶质的质量分数.6.将10g不纯的MgCl2样品(杂质不溶于水),放入50g水中,充分搅拌,待样品中MgCl2全部溶解后过滤.将所得滤液与63.3gNaOH溶液恰好完全反应,生成5.8g白色沉淀.求:(1)样品中MgCl2的质量(2)反应后所得溶液中溶质的质量分数7.甲、乙、丙三位同学分别取铁粉和铜粉的均匀混合物与某稀硫酸反应,所得数据如下:计算:(1)金属混合物中铁的质量分数;(2)甲制得硫酸亚铁质量;(3)该稀硫酸中溶质的质量分数.巩固练习参考答案(一)选择题:1.A 2.CD 3.A 4.C 5.A 6.D(二)填空题:1.84.7 260.0 2.9% 3.8% 4.237.5 1(三)计算题:1.1470g 2.30% 7.5g 10g 3.20.4%4.16.2%5.10%6.(1)9.5g (2)10g7.(1)80% (2)21.7g (3)14%。
九年级初三化学专题-溶质的质量分数(含答案)1.盐水选种是把种子放在一定浓度的盐水里,利用浮力把好坏种子分开来。
20℃时,技术员将一包氯化钠【20℃,S(NaCl)=36g】放入容器中,分三次加入水,充分搅拌,记录情况如下:次数第一次第二次第三次加水质量1000g1000g1000g烧杯内NaCl晶体剩余情况有无无则第三次加水后,烧杯中所得NaCl溶液的溶质质量分数ω的范围是()A.10.71%<ω≤19.35%B.12%<ω≤24%C.10.71%≤ω<21.43%D.12%≤ω<24%2.NaCl和KNO3在不同温度时的溶解度如下表。
下列说法错误的是()温度/℃0204060NaCl的溶解度/g35.736.036.637.3KNO3的溶解度/g13.331.663.9110 A.20℃时,100g H2O最多能溶解36.0g NaClB.40℃时,KNO3饱和溶液的溶质质量分数小于63.9%C.可用冷却海水的方法获取大量食盐D.其他条件不变,升温可将KNO3饱和溶液变为不饱和溶液3.不同温度下KNO3的溶解度如下表所示。
下列说法正确的是()温度/℃203040溶解度/g31.645.863.9A.20℃时,100g KNO3饱和溶液中溶质质量为31.6gB.30℃时,100g KNO3饱和溶液的溶质质量分数为45.8%C.30℃时,将50g KNO3放入100g水中得到150g溶液D.40℃时,100g水最多溶解63.9g KNO34.农业上常用溶质质量分数为16%的NaCl溶液选种。
实验室配制100g该溶液的过程如图所示。
下列说法不正确的是()A.实验操作顺序为④②①⑤③B.②中需称量NaCl的质量为16.0gC.选用100mL量筒量取所需水的体积D.用量筒量取水时仰视读数所得溶液的溶质质量分数偏大5.国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,75%酒精可有效灭活病毒。
现用95%的酒精配制75%的酒精,一般不会用到的仪器是()A.B.C.D.6.20℃时,NaCl的溶解度为36g。
初中化学溶质的质量分数练习题(含答案)1.溶液质量分数是表示溶质质量与溶液总质量之比的一种方法。
例如,一个溶质质量分数为20%的氯化钠溶液,其20%表示每克溶液中含有0.2克氯化钠。
2.将30克氯化钠溶解在70克水中,制得氯化钠溶液,其溶质的质量分数为:溶质质量 = 30克,溶液总质量 = 30克 + 70克 = 100克质量分数 = (30克 / 100克) × 100% = 30%3.100克溶质质量分数为20%的硫酸溶液中含有H2SO420克,水80克;100毫升20%的硫酸溶液(密度1.14克/毫升)的质量是11.4克,其中含有溶质H2SO4 2.28克,含有溶剂水9.12克。
4.现有80克质量分数为10%的硝酸钠溶液,回答下列问题:1)上述硝酸钠溶液中含有溶质的质量为8克,溶剂的质量为72克。
2)加入20克水后,所得溶液中溶质的质量分数为8%。
3)加入20克硝酸钠后,所得溶液中溶质的质量分数为13.33%。
4)为使上述溶液中溶质的质量分数变为20%,应加入硝酸钠16克。
5)为使上述溶液中溶质的质量分数变为20%,应蒸发水20克。
6)为使上述溶液中溶质的质量分数变为5%,应加水128克。
5.配制一定质量分数的氯化钠溶液的正确操作顺序是①②③④⑤。
6.将溶质质量分数为10%的氢氧化钠溶液100克,欲将其溶质的质量分数增大一倍,可采用的方法是加入12.5克固体氢氧化钠。
7.在将mg硝酸钾的不饱和溶液恒温蒸发水分至有晶体析出的过程中,溶液中溶质质量分数p%与时间t的关系应为p%随着t的增加而逐渐增加。
8.在45克质量分数为20%的KCl溶液中加入8克KCl后再加入14克水,所得溶液恰好为20℃的饱和溶液,则所得溶液中溶质的质量为17克。
9.上图中的错误为①和②。
2)可能造成配制的生理盐水中NaCl质量分数小于0.9%的原因有:①称量不准确;②误差发生在配制过程中;③水量加多或少。
10.用1升浓硫酸配制稀硫酸溶液的步骤如下:先取出98克浓硫酸(98%质量分数),加入适量的水,再将稀硫酸溶解在其中,最后加入足够的水,调整溶液体积至1升。
第十一讲 质量分数的相关计算核心知识1、溶质质量分数定义:溶质质量分数就是溶质质量与溶液质量的比值,其表达式为:或%100⨯+=溶剂质量溶质质量溶质质量溶质质量分数2、溶解度与饱和溶液的溶质质量分数的关系在一定温度下,饱和溶液的溶质质量分数可由溶解度得到:%100g100⨯+=溶解度溶解度饱和溶质质量分数3、配制一定质量分数的溶液的计算方法配制前的溶质质量=配制后的溶质质量,有两种情况:(1)用固体配制:固体质量=溶液质量×溶质质量分数;(2)用浓溶液配制稀溶液:浓溶液质量×浓溶液的溶质质量分数=稀溶液质量×稀溶液的溶质质量分数4、化学反应中的质量分数计算,核心要点就是找准溶质,并算出溶质和溶液的质量,常用的方法就是质量守恒和由化学方程式计算。
质量分数的基本计算1、将10.8g 固体氢氧化钠完全溶于49.2g 水,配成密度为1.2g/cm3的溶液,则该溶液的质量分数为多少?2、要配制200g 质量分数为0.9%的NaCl 溶液,需要NaCl 多少g 和H2O 多少mL ?3、配制980g 10%的稀硫酸需要多少mL 质量分数为98%的浓硫酸?(98%的浓硫酸密度为1.84g/cm3)4、把200g 质量分数为10%的CaCl2溶液稀释为4%的溶液,应该加水多少mL ?5、已知某物质的水溶液中有90g 水,取样5g 检测,发现其中有溶质2g ,则原溶液中有溶质多少g ?溶解度与饱和溶液的质量分数6、已知在20oC 时氯化钠的溶解度为36g ,求20oC 时:(1)9g 氯化钠溶于25g 水中,所得溶液的质量分数;(2)12g 氯化钠溶于25g 水中,所得溶液的质量分数;(3)5g 氯化钠溶于25g 水中所得溶液的质量分数。
7、已知50oC 时氯化铵的溶解度为50g ,则此温度下1800g 氯化铵饱和溶液中含水多少g ?8、已知硝酸钾10oC 时的溶解度为22g ,80oC 时的溶解度为170g ,问:把一瓶10oC 时的硝酸钾饱和溶液升温到80oC 后的溶质质量分数为多少?9、已知硝酸钾10oC时的溶解度为22g,80oC时的溶解度为170g,问:把一瓶80oC时的硝酸钾饱和溶液降温到10oC后的溶质质量分数为多少?有多少g固体析出?10、已知硝酸钾10oC时的溶解度为22g,80oC时的溶解度为170g。
人教版化学九年级下册第九单元溶液溶质质量分数与化学方程式的综合计算专题训练
方法指导
1.求反应后所得溶液的溶质质量分数,关键是求出反应后溶液中溶质的质量和溶液的质量。
2.求反应后溶液中溶质的质量时,一方面要看生成的溶质的质量,另一方面要看原固体中所含溶质
的质量。
3.求反应后溶液的质量时,要用反应物溶液的质量和减去生成气体以及沉淀的质量,同时要注意杂
质的质量。
1.实验室取68 g 过氧化氢溶液和 2 g 二氧化锰混合制取氧气,充分反应后,称量剩余溶液和滤渣
为 68.4 g 。
求:
(1)充分反应后,生成氧气的质量为______g;
(2)参加反应的过氧化氢溶液中溶质的质量分数。
2.取氯酸钾和二氧化锰的混合物26 g ,加热至混合物固体质量不再减少为止,冷却后称得剩余固
体质量为 16.4 g ,将剩余固体加入到 134.1 g 水中,充分搅拌后过滤。
计算 ( 已知氯化钾易溶于水,二氧化
锰不溶于水 ) :
(1)生成氧气的质量;
(2)二氧化锰的质量;
(3)最终所得滤液中溶质的质量分数。
3.向盛有 20.0 g 稀硫酸的烧杯中倒入 5.0 g 黄铜 ( 铜锌合金 ) 样品粉末,恰好完全反应。
称得未溶物质量
为 3.7 g 。
完成下列计算:
(1)该黄铜样品中含 Zn 的质量为 ______g。
(2)所用稀硫酸中溶质的质量分数。
(3)反应后所得溶液中溶质质量分数 ( 结果保留一位小数 ) 。
4.实验室用石灰石与稀盐酸反应制取二氧化碳。
若要制取 4.4 g 二氧化碳,需要溶质质量分数为
10%的稀盐酸多少克?
5.硫酸铜溶液对过氧化氢的分解有催化作用,取一定质量 8.5%的过氧化氢溶液倒入烧杯中,加入一定质
) 。
量 15%的硫酸铜溶液,过氧化氢完全分解,有关实验数据如表所示 ( 不考虑气体在水中的溶解请计算:
(1)生成氧气的质量为 ________g。
(2)反应后烧杯中溶液溶质的质量分数。
( 写出计算过程,结果精确到0.1%)
6.某兴趣小组用下图所示装置制取氧气,试管中固体的质量随时间变化的数据见下表。
制取结束后,将剩余固体用适量水充分溶解后,过滤,回收二氧化锰固体,并得到氯化钾溶液100 g 。
(1) 共制得氧气 ________g;
(2) 计算所得氯化钾溶液的溶质质量分数。
加热时间 / min 0 t 1 t 2 t 3
固体质量 /g 28.0 23.2 18.4 18.4
7.某校学习小组的同学为了测定某石灰石中碳酸钙的质量分数,他们取该石灰石样品 10 g 加入烧杯中,再把80 g 稀盐酸分四次加入,实验过程所得数据如下表 ( 已知石灰石样品中含有的杂质既不溶于水,也不与稀盐酸反应 ) :
分析表中数据,完成下列问题:
(1)表中 m的数值为____g;
(2)该石灰石样品中碳酸钙的质量分数为____;
(3) 计算第一次试验反应结束后所得溶液中溶质质量分数( 计算结果精确到0.1%) 。
实验次数第 1 次第 2 次第3 次第 4 次
加入稀盐酸的质量 /g 20 20 20 20
剩余固体的质量 /g 7 4 2.6 m
8.向盛有一定质量稀硫酸的烧杯中逐渐加入10 g 锌粒,产生气体质量与锌粒质量的关系如图所示;
充分反应后,称得烧杯中剩余物质总质量为109.8 g 。
请根据关系图分析并计算。
(1)稀硫酸反应完时,产生氢气的质量为____g,消耗锌粒质量为 ____。
(2)该稀硫酸中溶质的质量分数 ( 写出计算过程 ) 。
答案:
1. 解: (1)
生成氧气的质量为: 68 g + 2 g - 68.4 g
= 1.6 g
(2) 设过氧化氢溶液中过氧化氢的质量为 x
MnO 2
2H 2O 2=====2H 2O + O 2↑
68
32 x
1.6 g
68 =
32 x = 3.4 g
x 1.6 g
3.4 g 过氧化氢溶液中溶质的质量分数为:
×100%= 5%
68 g
答:参加反应的过氧化氢溶液中溶质的质量分数为 5%。
2. 解: (1) 生成氧气的质量为 26 g - 16.4 g = 9.6 g ; (2) 设原混合物中氯酸钾的质量为x ,生成氯化钾的质量为 y ,则
MnO 2 2KClO 3=====2KCl + 3O 2↑
△
245
149 96 x
y
9.6 g
245 149
96
x = y =
9.6 g
3. 解: (1) 黄铜中锌的质量为: 5.0 g - 3.7 g = 1.3 g
(2) 设所用稀硫酸中溶质的质量分数为
x ,设生成
ZnSO 4 的质量为
y ,生成
H 2 的质量为
z 。
Zn + H 2SO 4===ZnSO 4+H 2↑
65
98
161
2
1. 3 g
20 g × x
y
z
65 1.3 g
98
= 20 g × x =
161 2 =
y z
x = 9.8%
y = 3.22 g
z =0.04 g
(3) 反应后所得溶液中溶质的质量分数=
3.22 g
×100%≈15.1%
20 g + 1.3 g - 0.04 g
4. 解:设需要稀盐酸的质量为 x 。
CaCO 3+ 2HCl===CaCl + H 2O + CO 2↑
73 44
10% x 4.4 g
73 10% x 解得 x = 73 g
44 =
4.4 g
答:需要溶质质量分数为 10%的稀盐酸 73 g 。
5. 解: (1) 根据题意,生成氧气的质量为 60 g +3.3 g - 62.5 g = 0.8 g
(2) 溶液中 CuSO 4的质量为: 3.3 g ×15%= 0.495 g
设过氧化氢溶液的质量为
x 。
CuSO 4 2H 2O 2=====2H 2O + O 2 ↑
68
32 x × 8.5%
0.8 g
68 ∶ 32= ( x × 8.5%) ∶0.8 g x =20 g
反应后溶液中溶质质量分数为:
0.495 g
×100%= 2.2%
20 g
+ 3.3 g - 0.8 g 6. 解: (1) 根据题意,制得氧气质量为 28.0 g -18.4 g =9.6 g (2) 设反应生成氯化钾的质量为 x 。
MnO 2 2KClO 3=====2KCl + 3O 2↑
△
149 96
x
9.6 g
149x
x = 14.9 g
96 =
9.6
14.9 g
所得氯化钾溶液的溶质质量分数为
100 g ×100%= 14.9 % 答:所得氯化钾溶液的溶质质量分数为 14.9%。
7. ( 1) 2.6
10 g -2.6 g
(2)
解: (2) 样品中 CaCO 3的质量分数=
=74%
10 g
(3) 第一次试验中,参加反应的CaCO 3的质量为 3 g ,设生成 CaCl 2 的质量为 x ,生成 CO 2的质量
为 y 。
CaCO 3+ 2 HCl===CaCl 2+ H 2O + CO 2↑
100
111 44
3 g
x y 100 111 44
x = 3.33 g y = 1.32 g
3 g =
x = y
3.33 g 溶质质量分数= 3 g + 20 g - 1.32 g
×100%≈15.4%
答:第一次实验结束所得溶液的溶质质量分数为 15.4%。
8. (1) 0.2 6.5
解: (2) 设参加反应的硫酸的质量为
x
Zn + H 2SO 4===ZnSO 4+H 2↑
98
2 x 0.2 g
98x
x = 9.8 g
2
=
0.2 g
根据质量守恒定律得稀硫酸的质量:
109.8 g + 0.2 g - 10 g = 100 g
9.8 g
故稀硫酸中溶质的质量分数= 100 g ×100%= 9.8%
答:该稀硫酸中溶质的质量分数为
9.8%。