高中化学选修5烃的含氧衍生物知识点总结
- 格式:doc
- 大小:499.50 KB
- 文档页数:3


高中化学选修5第三章烃的含氧衍生物知识点总结------------------------------------------作者xxxx------------------------------------------日期xxxx醇酚一、认识醇和酚羟基与相连的化合物叫做醇;羟基与直接相连形成的化合物叫做酚。
二、醇的性质和应用1.醇的分类(1)根据醇分子中羟基的多少,可以将醇分为饱和一元醇的分子通式:(2)根据醇分子中羟基所连碳原子上氢原子数目的不同,可以分为2.醇的命名(系统命名法)一元醇的命名:选择含有羟基的最长碳链作为主链,把支链看作取代基,从离羟基最近的一端开始编号,按照主链所含的碳原子数目称为“某醇”,羟基在1位的醇,可省去羟基的位次。
多元醇的命名:要选取含有尽可能多的带羟基的碳链作为主链,羟基的数目写在醇字的前面。
用二、三、四等数字表明3.醇的物理性质(1)状态:C1-C4是低级一元醇,是无色流动液体,比水轻。
C5-C11为油状液体,C12以上高级一元醇是无色的蜡状固体。
甲醇、乙醇、丙醇都带有酒味,丁醇开始到十一醇有不愉快的气味,二元醇和多元醇都具有甜味,故乙二醇有时称为甘醇(Glycol)。
甲醇有毒,饮用10毫升就能使眼睛失明,再多用就有使人死亡的危险,故需注意。
(2)沸点:醇的沸点比含同数碳原子的烷烃、卤代烷。
且随着碳原子数的增多而。
(3)溶解度:低级的醇能溶于水,分子量增加溶解度就降低。
含有三个以下碳原子的一元醇,可以和水混溶。
4.乙醇的结构分子式:C2H6O结构式:结构简式:CH3CH2OH5.乙醇的性质(1)取代反应A.与金属钠反应化学方程式:化学键断裂位置:对比实验:乙醇和Na反应现象:水和钠反应现象:乙醚和钠反应:无明显现象结论:①② B .与HX 反应化学方程式: 断键位置: 实验(教材P68页) 现象:实验注意:烧杯中加入自来水的作用: C .乙醇的分子间脱水化学方程式:化学键断裂位置:〖思考〗甲醇和乙醇的混合物与浓硫酸共热生成醚的种类分别为 D .酯化反应化学方程式: 断键位置: (2)消去反应化学方程式: 断键位置: 实验装置:(如图)注:乙醇的消去反应和卤代烃的消去反应类似,都属于β-消去,即羟基的β碳原子上必须有H 原子才能发生该反应 (3)氧化反应 A .燃烧CH 3CH 2OH + 3O 2 C x H y O z + O 2[思考]某饱和一元醇与氧气的混合气体,经点燃后恰好完全燃烧,反应后混合气体的密度比反应前减小了1/5,求此醇的化学式(气体体积在105℃时测定) B .催化氧化化学方程式:点燃温度计必须伸入断键位置:说明:醇的催化氧化是羟基上的H 与α-H 脱去[思考]下列饱和一元醇能否发生催化氧化,若能发生,写出产物的结构简式OH CH 3CH 3CCH 3CH 3CH 2CHCH 3(CH 2)5CH 2OHCH 3CH 3CCH 3OHA B C 结论:伯醇催化氧化变成 仲醇催化氧化变成 叔醇 C .与强氧化剂反应乙醇能使酸性KMnO 4溶液褪色 三、其它常见的醇 (1)甲醇结构简式:物理性质:甲醇俗称木精,能与水任意比互溶,有毒,饮用10毫升就能使眼睛失明,再多用就有使人死亡的危险,故需注意。
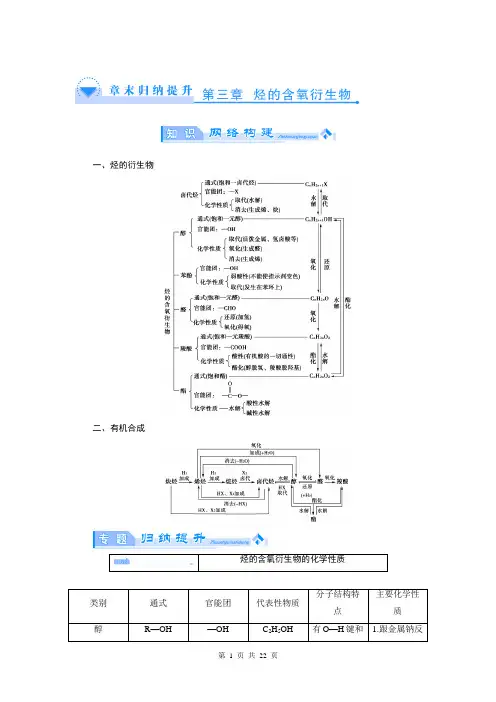
一、烃的衍生物二、有机合成(2013·长安一中高二期末)2011年西安世园会期间对大量盆栽鲜花施用了诱抗素剂,以保持鲜花盛开。
诱抗素的分子结构如图,下列关于该分子说法正确的是( )A .含有碳碳双键、羧基、酯基三种官能团B .1 mol 该物质在催化剂加热条件下最多可与4 mol H 2发生加成反应C .1 mol 该有机物与足量的溴水反应能消耗4 mol Br 2D .该分子中所有碳原子可能位于同一平面上【解析】 该分子含有碳碳双键、羧基和羰基三种官能团,A 项错误;1 mol 该有机物最多消耗3 mol Br 2,C 项错误;分子内部有饱和碳原子,D 项不正确;分子中三个碳碳双键和羰基能够与H2发生加成反应,—COOH中的碳氧双键不能与H2反应,B项正确。
【答案】 B醇、由于与—OH相连的基团不同,—OH受相连基团的影响也不同,这些羟基上的氢原子活性也就不同,表现在性质上也就有较大差异。
如下表:2332 ROH。
(2012·上海高考)过量的下列溶液与水杨酸(COOHOH)反应能得到化学式为C7H5O3Na的是()A.NaHCO3溶液B.Na2CO3溶液C.NaOH溶液D.NaCl溶液【解析】由于酸性:COOH>H2CO3>OH,可知水杨酸与NaHCO3溶液反应时只是—COOH作用转化为—COONa,产物的分子式为C7H5O3Na,A项正确;水杨酸与Na2CO3溶液反应时—COOH、—OH均反应,生成产物的分子式为C7H4O3Na2,B项错误;水杨酸与NaOH溶液反应时—COOH、—OH均反应,生成产物的分子式为C7H4O3Na2,C项错误;与NaCl溶液不反应,D项错误。
【答案】 A现有4种液态有机物A、B、C、D,分子式均为C3H6O2,请根据下表所给出的实验结果,判断这4种物质为何物质(写出结构简式)。
A________;B________;C________;D________。




第三章 烃的含氧衍生物最全最经典知识点§1醇与酚一、醇概况1、 官能团:—OH (醇羟基);通式: C n H 2n+2O (一元醇 / 烷基醚);代表物: CH 3CH 2OH2、 结构特点:羟基取代链烃分子(或脂环烃分子、苯环侧链上)的氢原子而得到的产物。
3、物理性质(乙醇):无色、透明,具有特殊香味的液体(易挥发),密度比水小,能跟水以任意比互 溶(一般不能做萃取剂)。
是一种重要的溶剂,能溶解多种有机物和无机物。
二、酚概况1、 官能团:—OH (酚羟基);通式:C n H 2n-6O (芳香醇 / 酚 / 芳香醚)2、物理性质:纯净的苯酚是无色晶体,但放置时间较长的苯酚往往是粉红色的,这是由于苯酚被空气 中的氧气氧化所致。
具有特殊的气味,易溶于乙醇等有机溶剂。
有毒、有强烈腐蚀性(用酒精洗)。
三、乙醇与苯酚的化学性质1、乙醇的化性(取代反应、消去反应、氧化反应、酯化反应、卤代反应) ①金属钠:2C 2H 5OH+2Na2C 2H 5ONa+H 2↑②消去:CH 3CH 2OH CH 2=CH 2 +H 2O ③氧化:2CH 3CH 2OH+ O 2 2CH 3CHO+2H 2O④酯化:RCOOH+HOCH 2CH 3 RCOOCH 2CH 3 + H 2O⑤卤代(取代) CH 3CH 2-OH +H-Br →CH 3CH 2-Br+H 2O ⑥醚化C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O ⑦ 2-丙醇的性质(取代、消去、氧化、酯化、卤代) 2、苯酚的化性(3)苯酚的性质(取代反应、中和反应、氧化反应、加成反应、显色反应) ①C 6H 5OH+NaOH →C 6H 5ONa+H 2O ②C 6H 5ONa+H 2O+CO 2→C 6H 5OH+NaHCO 3 ③2C 6H 5OH+2Na →2C 6H 5ONa+H 2↑④6C 6H 5OH+Fe 3+→[Fe(C 6H 5OH)6]3-(紫色溶液)+6H + 显紫色四、乙醇的重要实验 2、乙烯2 CH 3-CH-CH3 +O 2OH| 催化剂2 CH 3-C-CH3 +2H 2O| | O浓硫酸 140℃⑤—Br (白色)+3HBrOH+3Br 2(浓) OHBr — Br⑥OH+3H 2 OH催浓硫酸170℃ 浓硫酸△(1)反应 CH 3CH 2OH C 2H 4 ↑+H 2O (2)装置①发生:液+液(△) [有液反应加热] ②收集:排水法,不可用排气法收集 (3)注意点①温度计位置:反应液中 ②碎瓷片作用:防暴沸③迅速升温170℃:防副产物乙醚生成④乙烯(含SO 2、CO 2):浓硫酸氧化有机物的产物,用碱洗除去。

第十章 烃的含氧衍生物10.1 醇、酚高考考点:醇、酚的性质与结构是高考的重点和热点,在有机合成与推断中处于中心枢纽位置。
一.烃的含氧衍生物1. 定义:从结构上说,可以看作是烃分子里的氢原子被含氧原子的原子团取代而衍生二.乙醇1.分子结构:结构式:电子式:分子式:C 2H 6O 结构简式:CH 3CH 2OH 官能团:-OH(羟基)2.物性:无色透明有特殊香味的液体,ρ(CH 3CH 2OH )>ρ(H 2O )易挥发,沸点78.5℃ 熔点:-117.3℃ 能与水以任意比互溶,能溶解多种有机物和无机物,工业酒精含乙醇96%,用工业酒精与生石灰混合蒸馏可制取无水酒精 3.化学性质:(1)与活泼金属反应2CH 3CH 2OH+2Na 3CH 2ONa+H 2↑ (2)氧化反应: CH 3CH 2OH+O 2 2+3H 2O 2CH 3CH 2OH+O 2 3CHO+2H 2O乙醇可以使酸性KMnO 4溶液褪色,能与酸性重铬酸钾(K 2Cr 2O 7)溶液反应,被直接氧化成乙酸。
(3)消去反应: ↑+H 2OCH 3CH 2OH(4)取代反应: CH 3CH 2 2Br +H 2O (浓氢溴酸)CH 3CH 2OH+CH 3COOH CH 3COOCH 2CH 3+H 2O2CH 3CH 23CH 2OCH 2CH 3 +H 2O4.工业制法:CH 2=CH 2 CH 3CH 2OH发酵法:淀粉 3CH 2OH+2CO 2 三.醇类1. 2. 分类※ 乙二醇、丙三醇都是无色粘稠、有甜味的液体,易溶于水和乙醇3. 物理性质:饱和一元醇(C n H 2n+2O )随着碳原子数的递增沸点逐渐升高4. 化学性质:与乙醇相似能与活泼金属反应、氢卤酸反应、能发生氧化反应和消去反应。
※ 催化氧化:-OH 在端上氧化成醛、在链中氧化成酮、与-OH 相连的C 上无氢则不能被催化氧化。
消去反应:CH 3-CH=CH-CH 3 +H 2O (查依采夫规则)10.1‘酚一.苯酚(石炭酸)1.分子结构分子式:C6H6O 结构简式:或C6H5OH2.物理性质:纯净的苯酚是无色的晶体,但放置时间较长的苯酚往往是粉红色,这是由于部分苯酚被空气中氧气氧化所致。

第一节醇酚醇的结构、通式和性质一、烃的含氧衍生物烃的衍生物,从组成上看,除了碳(C),氢(H)元素之外,还含有氧(O)。
从结构上看,可以认为是烃分子里的氢原子被氧原子的原子团取代而衍生而来的。
烃的含氧衍生物的种类繁多,可以分为醇,酚,醛,羧酸,酯等(目前高中化学所学)烃的含氧衍生物的性质由所含官能团决定。
二醇类(1)概念:分子中含有跟链烃基结合着的羟基化合物。
(2)饱和醇通式:C n H2n+1OH,简写为R-OH。
碳原子数相同的饱和一元醇与饱和一元醛互为同分异构体(3)分类①按羟基个数分:一元醇、二元醇、多元醇。
一般将分子中含有两个或者以上醇羟基的醇称为多元醇。
②按烃基类别分:甲醇、乙醇、丙醇。
(4)醇类物理性质沸点变化也是随分子里碳原子数的递增而逐渐升高;沸点、密度不是很规律。
一般醇为无色液体或固体,含碳原子数低于12的一元正碳醇是液体,12或更多的是固体,多元醇(如甘油)是糖浆状物质。
一元醇溶于有机溶剂,三个碳以下的醇溶于水。
低级醇的熔点和沸点比同碳原子数的烃高得多,这是由于醇分子中有氢键存在,发生缔合作用。
饱和醇不能使溴水褪色。
醇化学性质活泼,分子中的碳-氧键和氢-氧皆为极性键。
以羟基为中心可进行氢-氧键断裂和碳-氧键断裂两大类反应。
另外,与羟基相连的碳原子容易被氧化,生成醛、酮或酸。
(5)几种重要的醇①甲醇甲醇又称木精,易燃,有酒精气味,与水、酒精互溶,有毒,饮后会使人眼睛失明,量多使人致死。
②乙二醇乙二醇是无色、粘稠、有甜味的液体,凝固点低,可作燃机抗冻剂,同时是制造涤纶的原料,舞台上的发雾剂。
③丙三醇丙三醇俗称甘油,没有颜色,粘稠,有甜味,吸湿性强——制印泥、化装品:凝固点低——防冻剂;制硝化甘油——炸药。
乙醇一、乙醇的物理性质和分子结构1.乙醇的物理性质乙醇俗名酒精,无色、透明、有特殊香味的液体;沸点78℃;易挥发;密度比水小;能跟水以任意比互溶;能溶解多种无机物和有机物。
2.乙醇的分子结构a.化学式:C2H6O;结构式:b.结构简式:CH3CH2OH或C2H5OH二、乙醇的化学性质1.乙醇与钠的反应①无水乙醇与Na的反应比起水跟Na的反应要缓和得多;②反应过程中有气体放出,经检验确认为H2。

第三章烃的含氧衍生物
课标要求
1.了解醇、酚、醛、羧酸、酯的典型代表物的组成和结构特点以及它们的相互联系。
2.能列举事实说明有机分子中基团之间的相互影响。
3.结合实际了解某些有机物对环境和健康可能产生的影响,关注有机化合物的安全使用问题。
要点精讲
一、烃的衍生物性质对比
1.脂肪醇、芳香醇、酚的比较
2.苯、甲苯、苯酚的分子结构及典型性质比较3.醛、羰酸、酯(油脂)的综合比较4.烃的羟基衍生物性质比较5.烃的羰基衍生物性质比较
6.酯化反应与中和反应的比较7.烃的衍生物的比较
三、烃及其重要衍生物之间的相互转化关系
二、有机反应的主要类型
友情提示:本资料代表个人观点,如有帮助请下载,谢谢您的浏览!。