阴极极化曲线的测定(精)PPT课件
- 格式:ppt
- 大小:861.50 KB
- 文档页数:18
实验一极化曲线的测定一实验目的1.1掌握用“三电极”法测定金属沉积过程的电极电势。
1.2 通过对镍在玻碳电极上的沉积电势的测量加深理解过电位和极化曲线的概念。
1.3 了解控制电位法测量极化曲线的方法。
二实验原理2.1当把金属插入其盐溶液中时,金属表面上的正离子受到极性水分子的作用,有变成溶剂化离子进入溶液而将电子留在金属表面的倾向。
与此同时,溶液中的金属离子也有从溶液中沉积到金属表面的倾向。
当这种溶解与沉积达到平衡时,形成了双电层,在金属/溶液界面上建立起一个不变的电位差值,这个电位差值就是金属的平衡电位,E R表示。
当有电流通过电极时,电极电势偏离平衡电极电势,成为不可逆电极电势,用E IR表示;电极的电极电势偏离平衡电极电势的现象称为电极的极化。
通常把某一电流密度下的电势E R与E IR 之间的差值的绝对值称为超电势,即:η=│E IR-E R│。
影响超电势的因素很多,如电极材料,电极的表面状态,电流密度,温度,电解质的性质、浓度及溶液中的杂质等。
测定镍沉积超电势实际上就是测定电极在不同外电流下所对应的极化电极电势,以电流对电极电势作图I~E(阴极),所得曲线称为极化曲线。
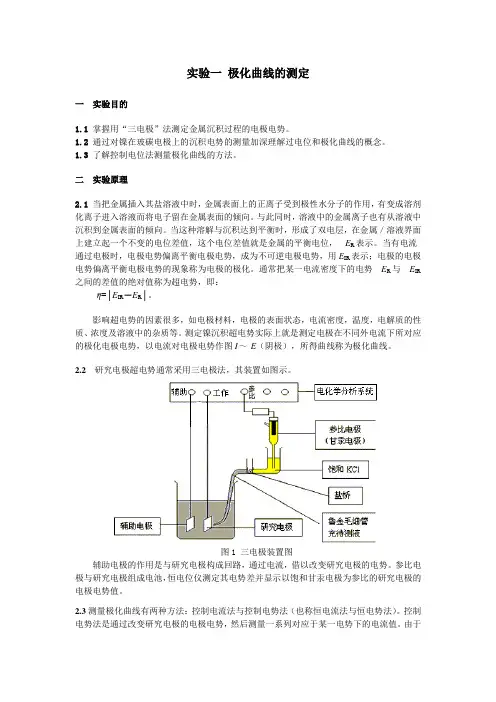
2.2研究电极超电势通常采用三电极法,其装置如图示。
图1 三电极装置图辅助电极的作用是与研究电极构成回路,通过电流,借以改变研究电极的电势。
参比电极与研究电极组成电池,恒电位仪测定其电势差并显示以饱和甘汞电极为参比的研究电极的电极电势值。
2.3测量极化曲线有两种方法:控制电流法与控制电势法(也称恒电流法与恒电势法)。
控制电势法是通过改变研究电极的电极电势,然后测量一系列对应于某一电势下的电流值。
由于电极表面状态在未建立稳定状态前,电流会随时间改变,故一般测出的曲线为“暂态”极化曲线。
本实验采用控制电势法测量极化曲线:控制电极电势以较慢的速度连续改变,并测量对应该电势下的瞬时电流值,以瞬时电流对电极电势作图得极化曲线。
图2 阴极极化曲线三仪器与试剂LK98A微机电化学分析系统一台;甘汞电极一枝;铂电极一枝;玻碳电极一枝;100ml 烧杯3个,500ml烧杯1个;瓦特型镀镍液50ml;稀硝酸50ml;乙醇50ml;蒸馏水500ml。

阴极极化曲线是用于描述电极的极化过程的一种图示方法。
它是通过对电压和电流的关系进行测量和分析,揭示电化学反应的机理和特征。
在电化学系统中,阴极是电化学反应的位置,它是电流的输出端。
当电化学反应进行时,阴极的电压会发生变化,这种变化被称为阴极极化。
是用电流密度和电压之间的关系描绘阴极极化过程的图形。
图中,电流密度是沿着X轴,电压是沿着Y轴。
可以提供许多有用的信息,可以用来分析电化学反应的特性和参数,比如活化能、扩散系数、反应机理、反应速率等。
它还可以用来评估电极表面的性能和稳定性,以及设计和优化电化学过程。
的形状和斜率取决于电化学系统中的许多因素,包括反应物和产物的浓度、反应速率、电解质浓度和性质、电极表面活性和形态等。
因此,可以被用来描述不同环境条件下的电极反应过程,如酸性、碱性和中性环境等。
的常见形式有三种:Tafel曲线、极限电流密度曲线和电流电位曲线。
Tafel曲线是许多电化学反应表现出来的典型曲线,它是用来描述电极氢化和氧化反应过程的。
这种曲线通常是呈线性的,其斜率可以用来计算电极的kinetic 参数,如反应速率系数和表观活化能等。
极限电流密度曲线是用于描述电极间电荷传递速率的,它可以用来衡量反应速率的极限和表征电极的过极反应。
此外,这种曲线还可以用来评估电极表面的催化性能和电极材料的稳定性。
电流电位曲线是用于测量电极的极化电压的,它可以反映电极极化的整个过程和性质,包括耗散、临界和热力学稳定性等。
在使用的过程中,我们需要注意以下几点:首先,我们需要选择一种合适的电化学系统和电极,并使其达到稳定状态。
此外,我们还需要控制好电压和电流的范围,以避免电解质的电解效应和电极的不可逆反应。
其次,我们需要准确地测量电流密度和电势,并通过对数据进行处理和分析,得出的参数和特征。
最后,我们需要根据的特点和参数来判断电极反应的机理和稳定性,并进行相应的改进和优化。
总之,是一种非常重要的测量和分析工具,它可以帮助我们更好地理解电化学反应的本质和特性,从而优化电化学系统和电极的设计和运用。




电化学电极过程动力学复习、难点、习题传质过程(扩散极限电流)j d 影响传(电)荷过程传质过程(扩散极限电流)j d 影响传(电)荷过程电极过程动力学电极过程动力学控制电化学过程加快或减缓电化学反应速度(电流)控制电化学过程加快或减缓电化学反应速度(电流)超电势(电化学、浓差)极化现象三(二)电极体系j 0 ,η,α,B-V 方程,Tafel 公式极化曲线超电势--电流曲线jja =j= 10-3Acm-2’b =j= 10-6Acm-2’c =j= 10-9Acm-2’交换电流密度对i-η曲线的影响电荷传递系数对i-η曲线的影响Tafel曲线阳极超电势阴极超电势E=ϕa-ϕcI/A电解电池I-V曲线液相中的三种传质过程注意其所传输的物种及发生在溶液体相或在固/液界面电极界面溶液层的几部分反应物浓度体相电极溶液δ氢电极的极化曲线示意图H+ 离子的还原和析出氢气过程H3O+H3O+ H3O+adH adH2H2H3O+ + M + e M-H + H2O 迟缓放电机理Volmer反应氢超电势Hydrogen OverpotentialH 3O ++ M + e M-H + H 2O迟缓放电机理Volmer 反应(a) H 3O ++M-H+e M+H 2O+H 2Heyrovsky 反应(b) M-H + M-H 2M + H2Tafel反应4.(a) H 3O ++M-H+e M+H2O+H 2电化学脱附机理Heyrovsky 反应(b) M-H + M-H 2M + H 2Tafel 反应3. H 3O + + M + e M-H + H 2O 迟缓放电机理Volmer 反应3, 4(a), 4(b) 皆可能为速度控制步骤2H ++ 2e 2H ad (2M-H) M-H + M-H 2M + H (2][2irad Fk j Η=(忽略逆过程)][][ln '+ΗΗ−=r ad o r F RT ϕϕ][][ln '+ΗΗ−=ir ad o ir F RT ϕϕ][][ln '+ΗΗ−=ir ad o ir F RT ϕϕ⎭⎬⎫⎩⎨⎧−Η=ΗRT F c r ad ir ad ηexp ][][2][2irad Fk j Η=⎭⎬⎫⎩⎨⎧−Η=RT F Fk j c r ad η2exp ][22⎭⎬⎫⎩⎨⎧−=RT F j c η2exp 0jzF RT j zFRT c lg 303.2lg 303.20−=η注意: 没有α!21=α电化学方法的主要优点1. 通过方便调节电极电势显著地改变反应速度2. 较易控制电极反应方向3. 电极反应一般在常温常压下进行4. 反应所用氧化剂或还原剂为电子,环境污染少电化学学习重点物理化学固态电化学光电化学生物电化学量子化学统计热力学溶液电化学(电解质溶液)平衡态电化学热力学。