《化学工艺流程中的条件控制》2020.4.16
- 格式:pptx
- 大小:2.53 MB
- 文档页数:30
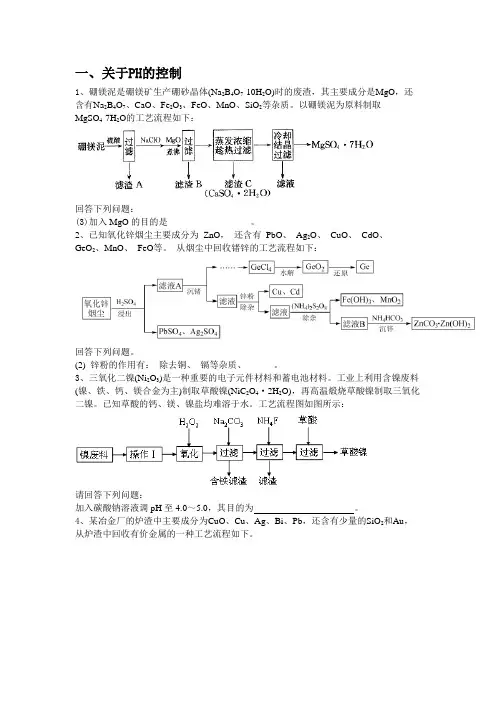
一、关于PH的控制1、硼镁泥是硼镁矿生产硼砂晶体(Na2B4O7·10H2O)时的废渣,其主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3、FeO、MnO、SiO2等杂质。
以硼镁泥为原料制取MgSO4·7H2O的工艺流程如下:回答下列问题:(3)加入MgO的目的是__________________。
2、已知氧化锌烟尘主要成分为ZnO,还含有PbO、Ag2O、CuO、CdO、GeO2、MnO、FeO等。
从烟尘中回收锗锌的工艺流程如下:回答下列问题。
(2) 锌粉的作用有:除去铜、镉等杂质、______。
3、三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。
工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。
已知草酸的钙、镁、镍盐均难溶于水。
工艺流程图如图所示:请回答下列问题:加入碳酸钠溶液调pH至4.0~5.0,其目的为。
4、某冶金厂的炉渣中主要成分为CuO、Cu、Ag、Bi、Pb,还含有少量的SiO2和Au,从炉渣中回收有价金属的一种工艺流程如下。
回答下列问题:(2)加入NaOH溶液的目的是调节滤液的pH,水解时通入水蒸气的目的是。
(4)氨浸实验时,需要在常温下进行的原因是5、B a(N O3)2常用于军事上生产绿色信号弹、曳光弹等。
某生产BaCO3的化工厂生产排出大量的钡泥(主要含有BaCO3、BaSO3、Ba(FeO2)2等,该厂利用钡泥制取B a(N O3)2晶体(不含结晶水),部分工艺流程如下:已知:pH=3.2时,可使Fe3+沉淀完全反应I6、我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:相关金属离子[c0(M n+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:后果是________________。


化学技术使用中的常见实验条件控制方法化学技术是现代社会不可或缺的一部分,它在工业生产、医药领域和日常生活中都有广泛的应用。
在化学实验过程中,实验条件的控制是保证实验结果准确可靠的重要因素之一。
本文将介绍化学技术使用中常见的实验条件控制方法,并探讨它们的作用。
一、温度控制温度是化学反应速率和平衡的重要影响因素之一。
在化学实验中,通常会通过控制反应体系的温度来控制反应速率和产物选择性。
有三种常见的温度控制方法:恒温槽、外加热和冷却装置。
恒温槽是一种常见的温度控制设备,通过控制槽内液体的温度来实现对反应体系温度的控制。
在实验中,我们可以将反应混合物放入恒温槽中,并将槽内温度设定为所需的反应温度。
这样可以确保反应在稳定的温度下进行,从而提高反应的可控性。
另一种常见的温度控制方法是外加热。
在一些实验中,反应速率较慢,需要升高反应体系的温度才能使反应正常进行。
这时,可以通过在反应容器外部施加热源来提高反应的温度。
但需要注意的是,外加热要控制好温度和加热速度,避免过快或过慢导致实验结果的偏差。
冷却装置常用于需要低温条件下进行的实验。
例如,某些化合物在较低温度下反应会产生更高的产物选择性。
在这种情况下,可以使用冷却装置将反应体系保持在低温条件下。
一般情况下,冷却装置通过冷却剂来降低反应体系的温度,如乙二醇、氮气等。
二、压力控制压力是一些气体相反应的重要影响因素之一。
在一些实验中,需要对反应体系的压力进行控制,以调节反应速率和提高产率。
常见的压力控制方法有减压和增压。
减压常用于需要降低反应速率或去除产物的实验中。
通过将系统的压力降低,可以使气体相反应速率变慢。
减压可以使用真空泵或减压阀来实现,具体的操作需要根据实验要求决定。
增压常用于一些气相反应中,通过增加反应系统的压力,可以提高反应速率和产物选择性。
增压可以使用气缸和压缩机等设备来实现,但需要注意保证系统的密封性和安全性。
三、pH值控制pH值是表示溶液酸碱性强弱的指标。



化学工艺流程化学工艺流程是指在化学工业生产中,按照一定的工艺路线和操作步骤,将原料通过一系列化学反应和物理过程,转化成所需的目标产品的过程。
化学工艺流程的设计和优化对于提高生产效率、降低能耗、减少环境污染具有重要意义。
下面将介绍化学工艺流程的基本步骤和相关要点。
首先,化学工艺流程的第一步是原料准备。
原料的选择和准备对于后续的反应过程至关重要。
在这一步中,需要对原料进行严格的筛选和检验,确保其质量和纯度符合生产要求。
同时,还需要根据反应方程式计算原料的配比和用量,确保反应能够顺利进行。
接下来是反应过程。
在反应过程中,原料经过一系列化学变化,最终转化成目标产品。
这一步需要严格控制反应条件,包括温度、压力、反应时间等参数。
同时,还需要考虑反应过程中可能产生的副产物和不良反应,采取相应的措施进行控制和处理。
随后是产品分离和纯化。
在反应结束后,通常会得到含有目标产品的混合物。
这时需要通过物理或化学方法对混合物进行分离和纯化,得到高纯度的目标产品。
这一步通常包括蒸馏、结晶、萃取等操作,需要根据产品性质和生产规模选择合适的分离方法。
最后是产品收集和包装。
经过分离和纯化后的产品需要进行收集和包装,以便储存和运输。
在这一步中,需要对产品进行质量检验,确保产品符合相关标准和规定。
同时,还需要选择合适的包装材料和方式,保证产品在运输和储存过程中不受污染和损坏。
综上所述,化学工艺流程是一个复杂而精细的过程,需要对原料、反应、分离和产品进行全面的考虑和规划。
只有通过合理的工艺设计和严格的操作控制,才能实现高效、低能耗、环保的生产目标。
希望本文介绍的内容能对化学工艺流程的理解和应用有所帮助。
高三化学总复习微型专题《化学工艺流程中的条件控制》教学案吴县中学 毕晓昀 2012年10月情境一:《化学反应原理》P52 工业合成氨已知:N 2(g)+3H 2(g) 2NH 3(g) ,△H<0。
工业合成氨温度一般控制在400~500℃,原因是:__________________________________________________________________。
演练1、(2012南京市高三学情调研测试 19 节选)实验室用硫酸铵、硫酸和铁屑制备硫酸亚铁铵晶体(NH 4)2SO 4·FeSO 4·6H 2O 的方法如下: 步骤1:依次用热的碳酸钠溶液.......、蒸馏水洗涤废铁屑。
(使用热的碳酸钠溶液是为了洗去铁屑表面的______________________。
)步骤2:向盛有洁净铁屑的烧杯中加入稀H 2SO 4溶液,水浴加热....,反应至基本不再冒出气泡为止。
趁.热过滤...。
(水浴加热的目的是:_____________________________; 趁热过滤的目的是_________________________________________________。
)步骤3:向滤液中加入一定量(NH 4)2SO 4固体。
步骤4:蒸发浓缩,冷却结晶,过滤、冰水洗涤....、干燥,得到硫酸亚铁铵晶体。
(冰水洗演练2、(2011江苏高考 19 节选)高氯酸按(NH 4ClO 4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取:NaClO 4 (aq)+NH 4Cl(aq)℃90NH 4ClO 4 (aq)+NaCl(aq)。
若 NH 4Cl 用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是:___________________________________。
情境二:(2012无锡零模 16 节选)用金属钴板(含少量Fe 、Ni )制备氯化钴的工艺流程如下:金属钴与盐酸反应极慢,需加入催化剂硝酸才可能进行实际生产。

例谈“化学工艺流程”题中化学反应条件控制作者:严仕军来源:《课程教育研究·学法教法研究》2019年第16期【摘要】近几年,以现代化工生产为背景的“化学工艺流程”题已成为理综化学试卷的主流题型,“化学工艺流程”题中涉及很多的化学反应,这些化学反应都需要在一定条件下进行,因此,化学反应条件的控制是决定生产效益高低和产品是否纯净的关键环节。
下面是结合高考复习备考和高考真题的研究,反思总结得出的“化学工艺流程”中化学反应条件的控制之pH控制的几种情况,通过典型例子对反应条件控制之pH控制的原理、方法及作用进行简单的分析,力求突破“化学工艺流程”题中pH控制的瓶颈,提高学生的化学工程素养和“化学工艺流程”题的得分。
【关键词】工艺流程;化学反应;条件控制;Ph【中图分类号】G632.41 ;;;;;;【文献标识码】A【文章编号】2095-3089(2019)16-0267-02一、促使某些离子水解形成氢氧化物而被除去根据不同金属阳离子完全沉淀的pH数据,改变溶液的pH使之处于某范围内,使杂质金属离子沉淀,并确保所需要的金属离子依旧存留在溶液中。
这一点,在2015年新课标全国II 卷第26题第(4)问中有很好的体现:由于Fe2+沉降时要求的溶液pH较高,或与一些其他离子沉淀pH范围重叠,一般是加入H2O2、酸性高锰酸钾溶液、氯水等氧化剂将其氧化成易沉降的Fe3+。
例题1:(2015年新课标全国卷Ⅱ第26题第(4)问)酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物。
该电池放电过程产生MnOOH。
回收处理该废电池可得到多种化工原料。
有关数据如表所示:回答下列问题:(4)用废电池的锌皮制备ZnSO4·7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是加稀H2SO4和H2O2溶解,铁变为〖CD#2〗,加碱调节至pH为〖CD#2〗时,铁刚好沉淀完全(离子浓度小于1×10-5mol·L-1时,即可认为该离子沉淀完全),继续加碱至pH为〖CD#2〗时,锌开始沉淀(假定Zn2+浓度为0.1mol·L-1)。


热练(五)化工流程中反应条件的控制与目的1.(1)一种由菱镁矿(主要成分MgCO3、CaCO3、FeCO3、SiO2)制备高纯氢氧化镁的工艺如图:若要得到高纯Mg(OH)2,需对“沉镁”步骤所得的固体进行洗涤,检验固体已洗净的方法是________________________________________________________________________________________________________________________________________________。
(2)碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。
以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如图:则加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是____________________________ _______________________________________________________________________________。
答案(1)取最后一次洗涤滤液,加入硝酸酸化的BaCl2溶液,若无白色沉淀生成,则已洗净(其他合理答案也可)(2)静置,在上层清液中继续滴加1~2滴Na2CO3溶液,无沉淀生成解析(1)加入MgSO4使CaCl2转化为CaSO4除去,再通入NH3,使Mg2+形成沉淀,过滤即可得氢氧化镁,滤液为NH4Cl和少量(NH4)2SO4溶液,可循环利用。
(2)确认Ni2+已经完全沉淀,即溶液中无Ni2+的实验方法是静置,在上层清液中继续滴加1~2滴Na2CO3溶液,无沉淀生成。
2.以粉煤灰(主要成分为Al2O3、SiO2,还含少量Fe2O3等)为原料制取氧化铝的部分工艺流程如图:(1)“酸浸”过程发生的主要反应的离子方程式是________________________________。
“酸浸”在恒容密闭反应釜中进行,温度不宜过高的原因是_______________________。

2018——2019学年北京高三化学二轮复习 化学工艺流程中的条件控制【目标】知道化学工艺中通常控制哪些条件?为什么要控制条件?怎么控制条件?通常从哪些角度来认识生产的最佳条件?知识梳理:1、温度、浓度、压强的控制减压蒸馏减小压强,降低液体的沸点,防止(如浓分解;2、PH 的控制控温(用水浴或油浴控温) ①防止某种物质温度过高时会分解或挥发; ②为了使某物质达到沸点挥发出来; ③使催化剂的活性达到最好; ④防止副反应的发生;⑤降温或减压可以减少能源成本,降低对设备的要求,达到绿色化学的要求。
⑥如果题目中出现了包括产物在内的各种物质的溶解度信息,则要根据它们的溶解度随温度升高而改变的情况,寻找合适的结晶分离方法 ( 蒸发结晶或浓缩结晶) 。
3、体系环境氛围及其它条件的控制强化训练(2019年北京海淀)金是一种用途广泛的贵重金属。
某化工厂利用氰化法从一种含金矿石中提取金的工艺流程如下:资料:PH 包括两个方向:⑴目的:调节pH 值实质上是利用沉淀溶解平衡把某些离子转化成沉淀。
(2)原则:不管是调高还是调低,原则都是加过量的除杂剂而不引进新的杂质,这里分两种情况①如果要得到滤液,可加固体沉淀剂消耗H +或OH —,如除去含Cu 2+溶液中混有的Fe 3+,可通过加入CuO 、Cu(OH)2、Cu(OH)2CO 3等;②要得到滤渣,则需加入碱性溶液,如氨水或氢氧化钠溶液。
调低PH 值的原则与调高PH 的原则相同。
⑶题目呈现方式:题中通常会以表格数据形式,或“已知信息”给出需求的“适宜PH 范围”的信息;⑷解题步骤:①判断溶液呈酸(或碱)性; ②判断调高还是调低; ③选择合适的调节剂。
①===②Zn2+(aq)CN -Zn(CN)2(s)CN -Zn(CN)42-(aq)(1)步骤2中发生的反应有:① 2Au(s) + 4CN-(aq) + 2H2O(l) + O2(g) === 2Au(CN)2-(aq) + 2OH-(aq) + H2O2(aq)∆H = -197.61 kJ·mol-1② 2Au(s) + 4CN-(aq)+ H2O2(aq) === 2Au(CN)2-(aq) + 2OH-(aq) ∆H = -386.93 kJ·mol-1则2Au(s) + 4CN-(aq)+ H2O(l) + 1/2O2(g) === 2Au(CN)2-(aq) + 2OH-(aq)的∆H = 。