Cu的显色与药物分析
- 格式:ppt
- 大小:2.12 MB
- 文档页数:16
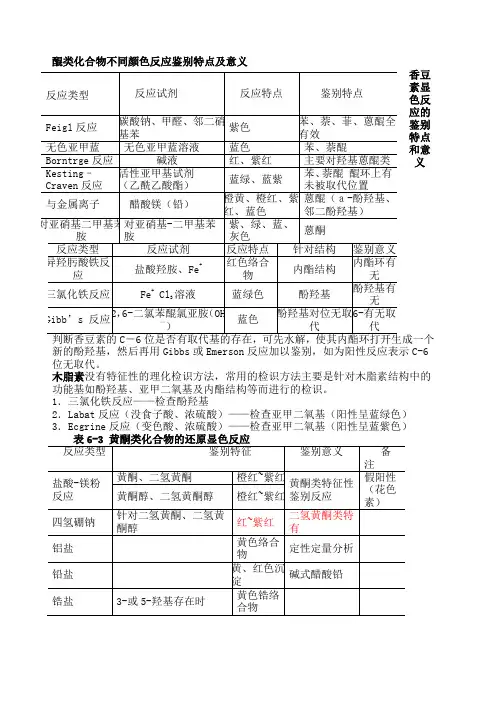
醌类化合物不同颜色反应鉴别特点及意义
香豆素显色反应的鉴别
特点
和意
义
新的酚羟基,然后再用Gibbs 或Emerson 反应加以鉴别,如为阳性反应表示C-6位无取代。
木脂素没有特征性的理化检识方法,常用的检识方法主要是针对木脂素结构中的功能基如酚羟基、亚甲二氧基及内酯结构等而进行的检识。
1.三氯化铁反应——检查酚羟基
2.Labat 反应(没食子酸、浓硫酸)——检查亚甲二氧基(阳性呈蓝绿色)
3.Ecgrine 反应(变色酸、浓硫酸)——检查亚甲二氧基(阳性呈蓝紫色)
3-OH、后黄色减褪,若有3-OH,则加枸橼酸后黄色不变,因此可用于区分黄酮和黄酮醇。
用的存在。
二酚羟基或兼有3-羟基、4-酮基或5-羟基、4-酮基结构。
而碱式醋酸铅的沉淀能力要大得多,一般酚类化合物均可与
②黄酮醇类在碱液中先呈黄色,通入空气后变为棕色。
③分子结构中有邻二酚羟基或3,4’-二羟基取代时,在碱液中不稳定,易被氧化,
按作用部位分:
作用于五元不饱和内酯
)、
C-1
7位
不
饱和内酯环的颜色反应
甲型强心苷的特征反应,因为五元不饱和内酯环上的双键位移产生C-22活性亚甲
基乙型强心苷为六元不饱和内酯环,故不能反应。
T(Girard T)或吉拉尔P(Girard P)两种试剂。
借此与不含羰基的皂苷元分离。

砷、锑、秘、汞、银化物的速测技术—铜片显色法和氰化物的速测技术1.速测原理在酸性条件下,某些无机化合物可与金属铜作用产生色彩变幻,由此推想可能存在的某些有害化合物。
本办法最低检出限砷为10ug,汞为100ug,按取样量5g计,最低检出量砷为2mg/kg,汞为20mg/kg。
2.速测范围本办法适用于食物中毒残留物中砷、锑、秘、汞、银、硫化物的迅速检测,以及保障性监测。
3.试验用器材电热板(也可用酒精灯等其他加热装置)、三角烧瓶、99.99%以上纯度的铜片、优级纯盐酸、氯化亚锡等。
4.速测步骤取样品5g于三角烧瓶中,加入25mL蒸馏水或纯净水,加入5mL盐酸,加入约0.5g混合试剂,将三角烧瓶放在加热装置上,使样液微沸约10min(目的是驱除可能存在的硫化物或亚硫化物),加入2片铜片,保持样液微沸约20min。
假如液体蒸发较快,注重补加一些热的蒸馏水或纯净水。
5.结果判定若加热30min后铜片表面变色,可按表5-5所示推想样品中可能存在的化合物,并保留样品,有条件时分离加以确证。
表5-5 铜片变色后预示可能存在的金属化合物 6.解释 (1)温控调到样液微沸即可,避开高温。
(2)加热过程中,注重观看铜片色彩变幻状况,如铜片已显然变黑时,应停止加热,否则当砷含量较高时会使沉积在铜片上的黑色物质脱落。
(3)溶液中浓度以2%~8%为宜,过低反应不能举行,过高会导致砷、汞的挥发损失。
(4)含蛋白质、油脂高的样品,会降低办法的敏捷度,应将样品消化处理后测定。
二、氰化物的速测技术氰化物属于烈性毒物,在食品中的来源有污染和人为投毒等。
有些植物本身含有氰昔,如木薯、苦杏仁、银杏、批把仁等。
氰苷经酶、酸或加热分解后产生剧毒的具挥发性的或氢氰酸。
氢氰酸的致死量约为60mg,或的致死量在200~300mg,苦杏仁的成人致死量平均50粒,儿童平均11粒。
1.速测原理氰化物遇酸产生氢氰酸,氢氰酸与加载在试纸上的苦味酸钠作用生成橘红色异氰紫酸钠。

本类药物具烃氨基侧链,显弱酸性,游离碱溶于有机溶剂,其盐可溶于水;分子中具有邻苯二酚(或苯酚)结构的药物可与重金属离子络合呈色,露置空气中或遇光易氧化,色渐变深,在碱性溶液中更易变色;多数药物分子中有手性碳原子,具有光学活性;苯环上的取代基也各具特性均可供分析用。
有紫外及红外吸收特性。
鉴别:三氯化铁反应。
肾上腺素:翠绿色,加氨试液,显紫色→紫红色。
重酒石酸去甲肾上腺素:翠绿色,加碳酸氢钠试液,显蓝色→红色。
盐酸去氧肾上腺素:紫色。
盐酸异丙肾上腺素:深绿色,滴加新制的5碳酸氢钠试液,显蓝色→红色。
氧化反应:盐酸异丙肾上腺素:在偏酸性条件下被碘迅速氧化,生成异丙基肾上腺素红,加硫代硫酸钠使碘的棕色消退,溶液显淡红色。
重酒石酸去甲肾上腺素:在上述条件下比较稳定,几乎不被碘氧化,需在酒石酸氢钾的饱和溶液(pH为3.56)中被碘氧化,溶液为五色或仅显微红色或淡紫色。
肾上腺素:在酸性条件下,被过氧化氢氧化后,溶液显血红色。
甲醛-硫酸反应:重酒石酸去甲肾上腺素:橙色→暗紫色。
异丙肾上腺素:污紫色。
去氧肾上腺素:污紫色。
紫外特征吸收与红外吸收光谱。
肾上腺素、重酒石酸去甲肾上腺素、盐酸去氧肾上腺素和盐酸异丙肾上腺素均需检查酮体。
紫外吸收分光光度法。
酮体在310nm处有最大吸收,而药物本身在此波长处几乎没有吸收。
规定:在310nm波长处测定吸收度不得大于0.05,即相当于含酮体的量低于0.06.含量测定:非水溶液滴定法。
冰醋酸为溶剂,加入醋酸汞试液消除氢卤酸的干扰,结晶紫为指示液。
溴量法:盐酸去氧肾上腺素及其注射液采用此方法测定含量。
利用药物中的苯酚结构,在酸性溶液中酚羟基邻、对位活泼氢能与过量的溴定量地发生溴代反应,再以碘量法测定剩余的溴,根据消耗的溴及硫代硫酸钠两种滴定液的量即可计算各供试品的含量。
操作要点:⑴游离溴及碘极易挥散,操作过程中必须防止逸失。
⑵不能加入太过量的溴,否则在溴代反应中会引起酚羟基的氧化或溴化,一般加入的溴液以过量2为宜。

怎么检验铜化学成份的方法
有几种常用的方法可以检验铜的化学成份,包括:
1. 铜离子检测:通过添加某些特定试剂,如二硫化氢(H2S)或氨水(NH3),可以生成特征性的沉淀或溶液颜色变化,进而确认铜的存在。
2. 火焰测试:将铜样品置于烧嘴火焰中,观察火焰变色。
铜在焰色测试中会呈现特征性的蓝绿色。
3. X射线荧光光谱(XRF):这是一种非破坏性的测试方法,通过测量样品中的X射线荧光来分析其化学成分。
可以通过测量铜的特征性X射线发射来确定其含量。
4. 电化学测试:使用电化学方法,如电化学石墨炉原子吸收光谱法(EAGF-AAS),可以测定铜的含量。
该方法通常需要使用特定的仪器和实验条件。
5. 化学分析法:通过对铜样品进行溶解,并使用化学试剂进行反应,可以进一步分析铜的化学成分。
常用的化学分析方法有滴定法、石墨炉原子吸收光谱分析法(GFAAS)等。
根据具体需求和实验条件,可以选择适合的方法进行铜化学成分的检验。

pan滴定铜离子颜色变化引言:铜离子是一种常见的金属离子,其在溶液中呈现出特殊的颜色。
本文将从理论和实验两个方面探讨铜离子在pan滴定过程中的颜色变化,旨在深入了解铜离子的性质和滴定分析的原理。
一、铜离子的特性铜离子是一种二价阳离子,化学符号为Cu2+。
它具有一种独特的蓝绿色,这是因为铜离子对可见光的吸收特性造成的。
铜离子的颜色与其电子结构和配位方式有关。
二、pan滴定的原理pan滴定是一种常用的分析化学方法,用于测定溶液中金属离子的浓度。
pan滴定的原理是基于配体与金属离子之间的络合反应。
在pan滴定中,常用的指示剂是1,10-苯菲啰啉(pan),它能够与铜离子形成稳定的配合物。
三、铜离子和pan的络合反应铜离子和pan之间的络合反应可以用下面的方程式表示:Cu2+ + pan → [Cu(pan)]2+在此反应中,铜离子和pan配体结合形成了稳定的铜-pan配合物。
这种配合物具有特殊的颜色,并且在滴定过程中发生颜色的变化。
四、pan滴定铜离子的实验步骤1. 准备铜离子溶液和pan指示剂溶液;2. 将铜离子溶液滴入滴定瓶中;3. 滴加pan指示剂溶液,观察颜色变化;4. 继续滴加指示剂溶液,直至颜色发生明显变化;5. 记录滴定过程中消耗的指示剂体积。
五、颜色变化的解释在pan滴定过程中,初始时的铜离子溶液呈现无色或淡黄色。
随着pan指示剂的滴加,铜离子与pan配体发生络合反应,形成蓝色或紫色的铜-pan配合物。
当铜离子与pan配体的摩尔比为1:1时,颜色变化最为明显。
六、颜色变化的机理铜离子和pan配体之间的颜色变化是由于电子跃迁引起的。
在铜离子的电子结构中,存在未占据的d轨道,而pan配体中的羰基(C=O)具有一对孤对电子。
当铜离子与pan配体结合时,d轨道与羰基的孤对电子之间发生电子跃迁,产生了特定的吸收峰,使得配合物呈现出蓝绿色。
七、pan滴定铜离子的应用pan滴定铜离子的方法广泛应用于环境监测、水质分析和食品检测等领域。

Cu的显色与药物分析引言铜是一种重要的金属元素,在许多领域具有广泛的应用。
其中,铜的显色反应在药物分析中起着重要的作用。
本文将介绍铜的显色特性以及在药物分析中的应用。
铜的显色特性水合离子与铜络合物铜离子(Cu2+)在水中可以形成多种水合离子和络合物。
其中,最常见的是四水合铜离子(Cu(H2O)42+)。
此外,铜离子还可以与其他配体形成各种络合物,如铜三胺络合物(Cu(NH3)32+)和铜二乙醇络合物(Cu(C2H5OH)2^2+)等。
铜的氧化还原性铜离子具有较强的氧化还原性。
在适当的条件下,它可以发生氧化反应或还原反应。
例如,Cu2+可以被还原为Cu+,进一步还原为Cu。
此外,它还可以参与其他氧化还原反应,如与硫化物反应生成硫化铜。
铜在药物分析中的应用铜作为指示剂铜的显色特性使其成为一种常用的指示剂。
在药物分析中,通过观察溶液的颜色变化来判断溶液中物质的存在与浓度。
例如,一些药物分析方法使用铜络合物的颜色作为定量分析的依据。
铜的显色反应铜离子可以与许多物质发生显色反应。
其中一种常见的反应是铜离子与酚类化合物发生络合反应,生成显色的络合物。
这种反应常用于测定药物中的酚类成分。
此外,铜离子还可以与其他有机物发生显色反应,如与某些草酸类物质发生还原反应生成蓝色络合物。
铜的定量分析铜离子的定量分析是药物分析中的一个重要研究方向。
常用的铜离子定量方法包括电化学方法、光度法、荧光法等。
其中,最常用的方法是光度法,通过测定铜络合物的吸收光谱来确定铜的浓度。
结论铜的显色特性在药物分析中具有重要的应用。
铜可以作为指示剂使用,并与许多物质发生显色反应。
其定量分析方法也得到了广泛研究和应用。
对铜的显色与药物分析的研究有助于提高药物分析的准确性和灵敏度。
参考文献1.Xiao L, et al. Copper complexes as dyes in clinical and analytical chemistry. Trends Anal Chem. 2020;124:115789.2.Gao Y, et al. Determination of copper in pharmaceutical products by spectrophotometry. Int J Anal Chem.2021;2021:6649465.。
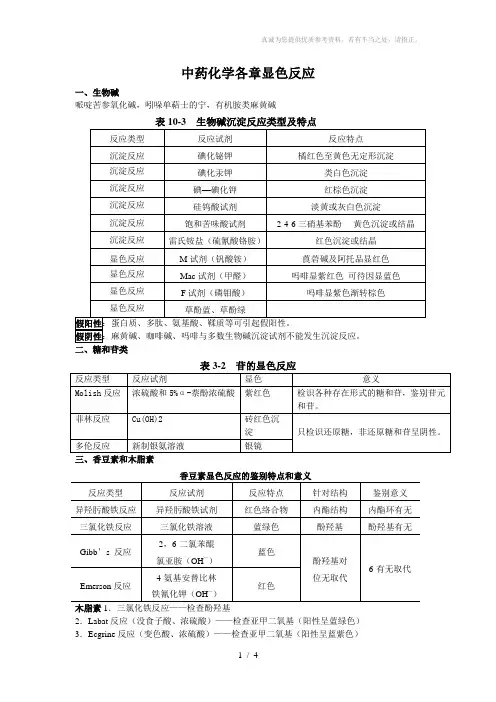
中药化学各章显色反应
一、生物碱
哌啶苦参氧化碱,吲哚单萜士的宁,有机胺类麻黄碱
二、糖和苷类
三、香豆素和木脂素
香豆素显色反应的鉴别特点和意义
2.Labat反应(没食子酸、浓硫酸)——检查亚甲二氧基(阳性呈蓝绿色)3.Ecgrine反应(变色酸、浓硫酸)——检查亚甲二氧基(阳性呈蓝紫色)
四、醌类
醌类化合物不同颜色反应鉴别特点及意义
五、黄酮类
的存在。
若有3-OH和(或)5-OH,加二氯氧锆显黄色。
若只有5-OH,加枸橼酸后黄色减
褪,若有3-OH ,则加枸橼酸后黄色不变,因此可用于区分黄酮和黄酮醇。
用于鉴别3-OH 的存在。
二酚羟基或兼有3-羟基、4-酮基或5-羟基、4-
酮基结构的化合物反应生成沉淀。
而碱式醋酸铅的沉淀能力要大得多,一般酚类化合物均可与其发生沉淀反应。
① 二氢黄酮易在碱液中开环,转变成相应的异构体查耳酮,显橙色至黄色。
②黄酮醇类在碱液中先呈黄色,通入空气后变为棕色。
③分子结构中有邻二酚羟基或3,4’-二羟基取代时,在碱液中不稳定,易被氧化,产生沉淀。
六、皂苷类
1)、甾体母核的显色反应
八、胆汁酸
胆汁酸的鉴别反应
九、其他成分
氨基酸的显色反应。

药物分析重点整理绪论1、药物分析:利用分析测定手段,发展药物的分析方法,研究药物的质量规律,对药物进行全面检验与控制的科学。
2、药物分析任务:对药物进行全面的分析研究,确立药物的质量规律,建立合理有效的药物质量控制方法和标准,保证药品的质量稳定与可控,使用安全和有效。
3、药品四大管理规范:①GLP:药物非临床研究质量管理规范②GCP:药品临床试验质量管理规范③GMP:药品生产质量管理规范④GSP:药品经营质量管理规范第一章药品质量研究的内容与药典概况1、药品制定的标准基础:对药物的研制、开发、生产的全面分析研究的结果2、国家药品标准构成:①凡例:共性问题的统一规定(称为药品标准术语)②正文③通则:制剂通则、通用检测方法、指导原则3、溶解度:P14(易溶:1-不到10ml,微溶:100-不到1000ml,不溶:10000ml)4、药品检查项目:安全性、有效性、均一性、纯度5、标示量:每一支、片或其他每一个单位制剂中含有主药的重量或含量或装量6、称重与量取:①精密称定:千分之一;②称定:百分之一;精密量取:对该体积移液管的精度的要求7、恒重:指供试品连续2次干燥后称重的差异在0.3mg以内的重量8、药品的原则:科学性、先进性、规范性、权威性9、中药材名称:中文名称+拉丁名称10、熔点:①初熔:供试品在毛细管内开始局部液化出现明显液滴的温度②全熔:供试品全部液化时的温度③药物含有杂质时,熔点低于纯品,熔程增大11、比旋度:在一定波长与温度下,偏振光透过每1ml中含有1g旋光性物质的溶液且光路长为1dm时,测得的旋光度12、百分吸收系数:当溶液浓度c为1%(g/ml)、液层厚度l为1cm时的吸光度A(A=Ecl)13、药物含量测定方法选择标准:①化学原料药:容量分析法②药物制剂:色谱法14、稳定性实验:影响因素试验、加速试验、长期试验15、《中国药典》的内容:一部中药、二部化学药品、三部生物制品、四部通则和药用辅料16、假药、劣药:P66第二章药物的鉴别试验(鉴别真伪)1、有机氟化物鉴别原理:经氧瓶燃烧法破坏,被碱性溶液吸收成为无机氟化物,与茜素氟蓝、硝酸亚铈在pH4.3溶液中形成蓝紫色络合物2、无机酸根:P753、专属性鉴别试验:是证实某一种药物的依据,根据每一种药物化学结构的差异及其所引起的物理化学特性不同,选用某些特有的灵敏的定性反应来鉴别药物的真伪4、影响鉴别试验的条件:溶液浓度、溶液温度、溶液pH 、试验时间、试剂用量、干扰物质5、对照试验:为了阐明某种因素的影响、效应或意义时,常改变此因素而保持其它因素不变进行试验,并把试验结果进行比较,这种试验叫对照试验第三章 药物的杂志检查1、杂质来源:①生产过程中引入的杂质;②贮藏过程中引入的杂质2、杂质分类:①来源:一般杂质(信号杂质)、特殊杂质(有关物质)②毒性:毒性杂质、信号杂质(一般无毒)③性质:无机杂质、有机杂质(特定杂质、非特定杂质)3、杂质限量:①定义:药物中所含杂质的最大允许量②杂质限量=%100*供试品量杂质最大允许量 ③限量检查法:A 、对照法:需要供试品%100**SV C L 供试品量杂质标准溶液 B 、灵敏法:不需要对照品C 、比较法:需要待测杂质的参数4、检查方法:①化学方法:显色反应法、沉淀反应法、生成气体法、滴定法②色谱法:A 、薄层色谱法B 、HPLC :(1)外标法:(2)加校正因子法R R s C A C A f //s = x''s //C A C A f x s = C 、GC③光谱法:紫外-可见光光度法、红外分光光度法、原子吸收分光光度法 ④热分析法:(1)热重分析法TG :利用热天平在程序控制温度的条件下,测量物质的重量随温度变化的曲线(2)差热分析法DTA :测试品与参比物之间温度差与温度(或时间)关系的技术(3)差示扫描量热分析DSC :测量传送给供试品与参比物的热量差与温度(或时间)关系的技术(4)TG 、DTA (纵坐标T )、DSC (纵坐标dQ/dT )曲线图P1125、氯化物检查法: ①原理:白色浑浊药物:AgCl AgNO Cl 3HNO 3−−→−+-白色浑浊)(对照:AgCl AgNO ,NaCl 3HNO 3−−→−+V c②注意事项:(1)纳氏比色管刻度线高度差不超过2mm(2)放置在黑色背景上,从上向下观察(3)标准氯化物的浓度以50ml 中含50-80ug 的CI(4)加硝酸的目的:加速氯化银沉淀、产生较好浑浊、避免弱酸银盐形成(5)滤纸可预先用硝酸的水洗净后使用(6)暗处放置是为了避免Ag 单质析出6、硫酸盐检查法:①原理:白色浑浊药物:4HCl224BaSO BaCl SO −−→−+-白色浑浊)、(对照:4HCl 242BaSO BaCl SO K −−→−+V c ②注意事项:(1)标准K2SO4溶液0.1mg/ml ,50ml 溶液中含2ml 盐酸为好(2) 盐酸酸性条件下进行,防止碳酸钡等弱酸形成钡盐沉淀对比浑浊的影响7、铁盐检查法:①原理: []{()[]红色药物:--−→−−→−++++36HCl Fe Fe Fe SCN Fe 6SCN 3o 23()()[]红色、对照:--+−→−+36HCl 3SCN Fe 6SCN Fe V c②注意事项:(1)显色剂:硫氰酸铵溶液(2)氧化剂:过硫酸铵:二价铁氧化为三价铁;防止硫氰酸铁还原褪色(3离子,以免在氨碱性溶液中产生氢氧化铁沉淀8、重金属检查法:①重金属:在实验条件下能与硫代乙酰胺或硫化钠作用显色的金属②硫代乙酰胺法:(1)原理:硫代乙酰胺在弱酸性pH3.5条件下水解,产生硫化氢,与重金属粒子生成黄色到棕黑色硫化物混悬液,与一定量标准铅溶液经同法处理后颜色比较(2)适用于溶于水、稀酸和乙醇的药物(3)注意事项:置于白纸,自上而下观察;标准铅浓度为10ug/ml;标准铅溶液1-2ml;硫代乙酰胺为显色剂;酸为醋酸铅缓冲液③炽灼后的硫代乙酰胺法④硫化钠法:(1)原理:在碱性介质中,以硫化钠为沉淀剂,使Pb2+生成PbS微粒的混悬液,与一定量标准铅溶液同法处理后颜色比较(2)适用于溶于碱而不溶于稀酸或在稀酸中生成沉淀的药物。

肾上腺素类药物的结构特点:本类药物具烃氨基侧链,显弱酸性,游离碱溶于有机溶剂,其盐可溶于水;分子中具有邻苯二酚(或苯酚)结构的药物可与重金属离子络合呈色,露置空气中或遇光易氧化,色渐变深,在碱性溶液中更易变色;多数药物分子中有手性碳原子,具有光学活性;苯环上的取代基也各具特性均可供分析用。
有紫外及红外吸收特性。
鉴别:三氯化铁反应。
肾上腺素:翠绿色,加氨试液,显紫色→紫红色。
重酒石酸去甲肾上腺素:翠绿色,加碳酸氢钠试液,显蓝色→红色。
盐酸去氧肾上腺素:紫色。
盐酸异丙肾上腺素:深绿色,滴加新制的5%碳酸氢钠试液,显蓝色→红色。
氧化反应:盐酸异丙肾上腺素:在偏酸性条件下被碘迅速氧化,生成异丙基肾上腺素红,加硫代硫酸钠使碘的棕色消退,溶液显淡红色。
重酒石酸去甲肾上腺素:在上述条件下比较稳定,几乎不被碘氧化,需在酒石酸氢钾的饱和溶液(pH为3.56)中被碘氧化,溶液为五色或仅显微红色或淡紫色。
肾上腺素:在酸性条件下,被过氧化氢氧化后,溶液显血红色。
甲醛-硫酸反应:重酒石酸去甲肾上腺素:橙色→暗紫色。
异丙肾上腺素:污紫色。
去氧肾上腺素:污紫色。
紫外特征吸收与红外吸收光谱。
肾上腺素、重酒石酸去甲肾上腺素、盐酸去氧肾上腺素和盐酸异丙肾上腺素均需检查酮体。
紫外吸收分光光度法。
酮体在310nm处有最大吸收,而药物本身在此波长处几乎没有吸收。
规定:在310nm波长处测定吸收度不得大于0.05,即相当于含酮体的量低于0.06%.含量测定:非水溶液滴定法。
冰醋酸为溶剂,加入醋酸汞试液消除氢卤酸的干扰,结晶紫为指示液。
溴量法:盐酸去氧肾上腺素及其注射液采用此方法测定含量。
利用药物中的苯酚结构,在酸性溶液中酚羟基邻、对位活泼氢能与过量的溴定量地发生溴代反应,再以碘量法测定剩余的溴,根据消耗的溴及硫代硫酸钠两种滴定液的量即可计算各供试品的含量。
操作要点:⑴游离溴及碘极易挥散,操作过程中必须防止逸失。
⑵不能加入太过量的溴,否则在溴代反应中会引起酚羟基的氧化或溴化,一般加入的溴液以过量2%为宜。
薄层色谱硫酸铜显色原理
薄层色谱是一种常用的色谱分离技术,它可以用于分离和鉴定
化合物。
而硫酸铜显色则是薄层色谱中常用的显色方法之一。
硫酸
铜显色的原理是基于化合物与硫酸铜溶液发生化学反应,产生可见
的颜色沉淀。
下面我将从不同角度来解释这一原理。
首先,我们来看化学反应的原理。
硫酸铜溶液中的Cu2+离子与
化合物中的羟基或羧基发生配位反应,生成沉淀。
这种沉淀通常呈
现蓝色或绿色,因此可以用于显色和定性分析。
其次,从分析角度来看,硫酸铜显色可以帮助分析化合物的极
性和功能团。
不同类型的化合物会产生不同颜色的沉淀,从而可以
区分化合物的性质和结构。
此外,硫酸铜显色的原理还涉及到化合物的亲和性和配位化学。
一些化合物会与硫酸铜发生更强的配位作用,从而产生更明显的颜
色沉淀,这对于定性分析和定量分析都具有重要意义。
最后,从实验操作的角度来看,硫酸铜显色是一种简单、快速
且成本低廉的显色方法,因此在实验室中得到广泛应用。
它不需要
复杂的仪器和条件,适用于各种化合物的分析。
总的来说,硫酸铜显色原理涉及到化学反应、分析方法、配位化学和实验操作等多个方面。
这种显色方法在薄层色谱分析中发挥着重要作用,为化合物的分离和鉴定提供了有力的支持。
铜的化验方法简介铜是一种常见的金属元素,广泛应用于工业生产和科学研究中。
为了确定铜的含量和纯度,需要进行化验分析。
本文将介绍一些常用的铜的化验方法。
电化学法电化学法是一种常用的铜的化验方法,它基于铜在电解质溶液中的电化学行为。
通过测量电荷转移或电流,可以确定铜离子的含量。
常见的电化学法包括电位滴定法和电流滴定法。
光谱法光谱法是一种基于铜与特定波长的光相互作用的化验方法。
常见的光谱法有原子吸收光谱法和原子荧光光谱法。
原子吸收光谱法通过测量样品中铜原子的吸收特性,来确定铜的含量。
原子荧光光谱法则是通过测量样品中铜原子荧光的特性来分析铜的含量。
极谱法极谱法是一种利用电极上铜离子的电化学行为来确定铜含量的化验方法。
其中,常见的极谱法包括安培极谱法和极谱方法。
安培极谱法通过测量电流随电压变化的波形,来确定铜离子的浓度。
极谱法则通过测量铜离子再沉积在电极上的电流,来分析铜的含量。
颜色反应法颜色反应法是一种常用的快速检测铜含量的化验方法。
它基于铜离子与特定试剂产生显色反应。
常见的颜色反应法包括菲林试剂法和二氨基二巯基法。
菲林试剂法通过观察样品颜色的深浅来估测铜的含量。
而二氨基二巯基法则是通过观察样品颜色的变化来确定铜离子的浓度。
火焰法火焰法是一种利用铜化合物产生的特殊颜色来判断铜含量的化验方法。
根据不同的铜化合物,在燃烧时产生的颜色也不同,通过观察火焰颜色的变化,可以初步判断铜的含量。
结论以上列举了一些常用的铜的化验方法,包括电化学法、光谱法、极谱法、颜色反应法和火焰法。
根据实际需求和样品性质的不同,可以选择合适的方法进行铜的化验分析。
在实验过程中,注意操作规范,确保结果的准确性和可靠性。
希望本文能对您有所帮助,谢谢阅读。
中国药科大学《天然药物化学》显色反应整理(1)Vitali反应紫色(2)DDL反应黄色(3)沉淀反应书本P155糖Molish反应(试剂:浓硫酸,α-萘酚。
常用色谱显色剂:邻苯二甲酸和苯胺)糠醛衍生物和许多芳胺、酚类及具有活性次甲基的基团化合物缩合成有色的化合物香豆素:(1)异羟肟酸铁反应--------内酯的显色反应碱性条件下,香豆素内酯开环,并与盐酸羟胺缩合成异羟肟酸,再在酸性条件下与三价铁离子络合成盐而显红色。
(2)与酚类试剂的反应具有酚羟基,可与FeCl3试剂产生颜色反应;若酚羟基的对位未被取代,或6-位上没有取代,其内酯环碱化开环后,可与Gibb’s试剂、Emerson试剂反应。
机制如下:Gibb’s反应:符合以上条件的香豆素乙醇溶液在弱碱条件下,2,6-二氯(溴)醌氯亚胺试剂与酚羟基对位活泼氢缩合成蓝色化合物。
Emerson反应:符合以上条件的香豆素的碱性溶液中,加入2%的4-氨替比林和8%的铁氰化钾试剂与酚羟基对位活泼氢缩合成红色化合物。
醌类颜色反应:取决于其氧化还原性质以及分子中的酚羟基的性质。
(1)Feigl反应----醌的通性,所有具醌核的化合物均可反应。
(方法、机理:见书312页)醌类化合物在碱性条件下,经加热能迅速与醛类及邻二硝基苯反应,生成紫色化合物(2)无色亚甲蓝显色试验----可区别蒽醌与苯醌萘醌苯醌和萘醌因醌核上有活泼质子,可反应,而蒽醌无。
无色亚甲基蓝溶液,样品在白色背景上作为蓝色斑点出现。
(3)与碱的反应(Bornträger反应----可区别含羟基的蒽醌与蒽酚衍生物反应、机理、应用:见书313页。
羟基醌类在碱性溶液中发生颜色变化,会使颜色加深。
多呈橙、红、紫红色及蓝色。
例如羟基蒽醌类遇碱显红~紫红色的反应称Bornträger反应(4)与活性次甲基试剂的反应----可区别蒽醌与苯醌萘醌(Kesting-Craven法)反应、机理、应用:见书313页。
分光光度法铜的显色剂
分光光度法是一种利用物质对特定波长的光吸收特性进行定量分析的方法。
对于铜的显色剂,常用的有巴维林液(Bavlin's reagent)和锑·硫酸钾显色剂(antimony potassium tartrate reagent)。
巴维林液是一种混合溴水、水合硫酸和乙醇的显色剂,可以与铜形成稳定的混合物,可以通过检测巴维林液与铜络合物的吸收光谱来实现铜的分析。
锑·硫酸钾显色剂是一种pH为8-9的溶液,其中含有硫酸钾和
硫酸锑,可以与铜形成红褐色络合物,并且在特定波长处有明显的吸收峰。
通过检测溶液中络合物的吸收光谱,可以实现铜的定量分析。
这些显色剂在分光光度法中起到了显色和增强吸收信号的作用,使得铜的分析能够更加灵敏和准确。
在实际应用中,需要合理选择显色剂并优化实验条件,以提高分析的准确性和灵敏度。
药物分析中的显色反应【摘要】显色反应在药物分析中常用于药物的鉴别、检查和含量测定,文章着重讨论药物定量分析中的显色反应类型,特别是用于含量测定的显色反应类型――配位显色反应、氧化还原显色反应、离子缔合显色反应、重氮化-偶合显色反应、亚硝化显色反应、缩合显色反应、碱处理显色反应、脱水显色反应、电荷转移显色反应和超分子显色反应等。
【关键词】药物分析显色反应讨论Abstract:Color reactions are often used in the identification,check and content determination for drugs. The types of color reactions in pharmaceutical analysis were discussed in this paper such as complex color reaction, redox color reaction, ion combination color reaction,diazotization-coupling color reaction, nitrification color reaction,condensation color reaction, dewater color reaction, charge-transfer color reaction and supermolecule color reaction.Key words:Pharmaceutical analysis; Color reaction; Discuss所谓显色反应是指在被测药物体系中加入某种试剂而呈现颜色的反应,也叫呈色反应。
显色反应在药物分析中常用于药物的鉴别、检查和含量测定。
目前在药物分析中的显色反应有配位显色反应、氧化还原显色反应、离子缔合显色反应、电荷转移显色反应、重氮化-偶合显色反应、亚硝化显色反应、缩合显色反应和超分子显色反应等,但是至今未有人加以总结讨论,本文就这些显色反应类型分别加以讨论,以供同行们参考。