2016年初中化学计算题专项复习
- 格式:docx
- 大小:21.00 KB
- 文档页数:3

初中化学计算题汇总专项训练
计算题---专项复习
1. 某化学兴趣小组为测定空气中二氧化硫的含量,用NaOH溶液吸收SO2。
用NaOH溶液吸收100L已除去CO2的空气样品,溶液质量增加了0.64 g。
已知此时空气的密度为1.3 g/L,求:
(1)被吸收的SO2的质量。
(2)发生反应的NaOH的质量。
(3)空气中SO2的质量分数(计算结果精确到0.01%)。
2. 某混合物中含有氯化钡和氯化钠,取该混合物16.25g,全部溶于14
3.6mL水中,向所得到的混合溶液中逐滴加入溶质质量分数为10.6%的碳酸钠溶液,恰好完全反应,产生9.85g沉淀。
计算(1)所取混合物中氯化钠的质
量分数。
(2)所加碳酸钠溶液的质量。
(3)当氯化钡与碳酸钠恰好完全反应时,过滤,所得溶液中溶质的质量分数是多少。
(计算结果精确到0.01%)。

1.(7分)某学生在实验室里分析一种由碳酸钠和氢氧化钠组成的混合物。
他先称取m g此混合物倒入某容器,然后加入245g 10%的稀硫酸,结果恰好完全反映,搜集到气体;再取相同质量的该混合物配成溶液,加入必然质量的熟石灰后也恰好完全反映。
求:(1)该混合物的组成和m值;(2)该混合物溶液与熟石灰反映后所得溶液的溶质质量分数;2.(6分)碳铵化学式为:NH4 HCO3,试计算:(1)碳铵的相对分子质量为____________________;(2)碳铵中氮元素的质量分数为_______________(精准到%)。
(3)158g碳铵分解时产生氨气的质量为多少克?3.(8分)Na2O2能和水发生反映:2 Na2O2+2H2O=4NaOH+O2↑。
现将10g Na2O2样品(含有NaoH杂质)放入水中,充分反映后放出氧气。
请计算:(1)样品中Na2O2的质量分数是多少?(2)反映后形成溶液后,其溶质的质量分数是多少?4.(5分)取一段镁条置于坩埚内点燃,取得氧化镁和氮化镁混合物的总质量为0.470g。
冷却后加入足量的水,将反映的产物蒸干并灼烧,取得氧化镁的质量为O.486g。
(1)写出氮化镁与水反映生成氢氧化镁和氨气(NH3)的化学方程式;(2)计算镁条燃烧所得混合物中氮化镁的质量分数。
5.(7分)已知盐酸跟Na2CO3、NaHC03之间发生如下反映:Na2C03 + HCl == NaHC03 + NaCl NaHC03 + HCl == 2NaCl + H20 + C02↑Na2C03 + 2HCl == 2NaCl + H20 + C02↑现有含21.2g Na2C03的溶液和60g溶质质量分数为18.25%的盐酸,欲用这两种药品来制取二氧化碳。
甲方案:向Na2C03溶液中逐滴加入盐酸。
乙方案:向盐酸中逐滴加入Na2C03溶液。
试通过计算回答:这两种方案制得的二氧化碳是不是一样多?6.石灰石是山西省的要紧矿物产品之一。
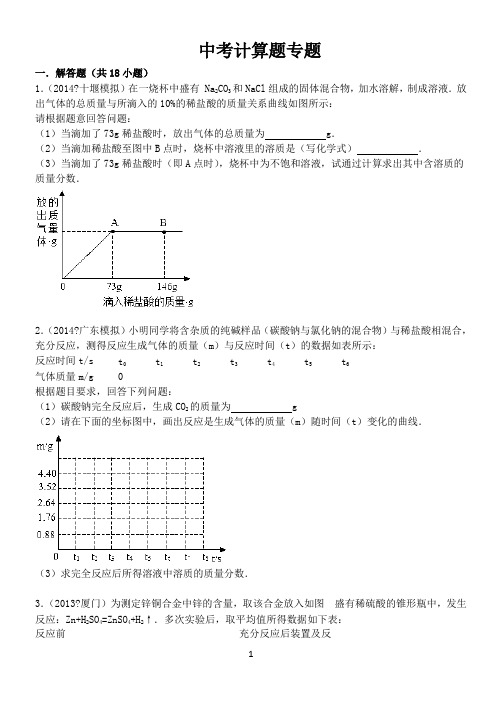
中考计算题专题一.解答题(共18小题)1.(2014?十堰模拟)在一烧杯中盛有 Na2CO3和NaCl组成的固体混合物,加水溶解,制成溶液.放出气体的总质量与所滴入的10%的稀盐酸的质量关系曲线如图所示:请根据题意回答问题:(1)当滴加了73g稀盐酸时,放出气体的总质量为g.(2)当滴加稀盐酸至图中B点时,烧杯中溶液里的溶质是(写化学式).(3)当滴加了73g稀盐酸时(即A点时),烧杯中为不饱和溶液,试通过计算求出其中含溶质的质量分数.2.(2014?广东模拟)小明同学将含杂质的纯碱样品(碳酸钠与氯化钠的混合物)与稀盐酸相混合,充分反应,测得反应生成气体的质量(m)与反应时间(t)的数据如表所示:反应时间t/s tt1t2t3t4t5t6气体质量m/g0根据题目要求,回答下列问题:(1)碳酸钠完全反应后,生成CO2的质量为g(2)请在下面的坐标图中,画出反应是生成气体的质量(m)随时间(t)变化的曲线.(3)求完全反应后所得溶液中溶质的质量分数.3.(2013?厦门)为测定锌铜合金中锌的含量,取该合金放入如图盛有稀硫酸的锥形瓶中,发生反应:Zn+H2SO4=ZnSO4+H2↑.多次实验后,取平均值所得数据如下表:反应前充分反应后装置及反装置和足量的稀硫酸质量应剩余物质质量锌铜合金质量若不考虑干燥剂吸收空气中的水蒸气,计算:(1)根据质量守恒定律求生成氢气的质量.(2)该合金中锌的质量分数.4.(2013?防城港)我们知道,每次做完实验后,剩余废液不能直接倾倒入排污管,必须回收处理.某班同学实验后收集到含有碳酸钠和氢氧化钠的混合废液,一个兴趣小组用废弃的溶质质量分数为%的硫酸来处理,并回收处理后的溶液.他们向废液中加入稀硫酸时,所得溶液pH与加入的稀硫酸质量的关系曲线如图所示.求:(1)通过如图可知,当反应进行至图中点时(填“A”、“B”或“C”),废液恰好处理完(即碳酸钠和氢氧化钠混合废液刚好完全转化成硫酸钠溶液).(2)当向混合液中加入稀硫酸至N点时,加入的稀硫酸质量为5Kg,此时溶液总质量为10kg.求此时所得溶液中溶质的质量分数(写出计算过程,溶于水的气体忽略不计).5.(2013?东营)化肥对提高农作物的产量具有重要的作用,碳铵(碳酸氢铵)就是农民朋友经常使用的一种氮肥,碳铵易溶于水、受潮时常温分解,温度越高分解越快,遇碱时放出氨气.某校化学兴趣小组为测定某碳铵肥料样品的纯度,将样品加入足量的浓氢氧化钠溶液中共热,(碳铵中的杂质不与氢氧化钠反应,反应的方程式为NH4HCO3+2NaOH=Na2CO3+2H2O+NH3↑),把产生的所有NH3用足量的硫酸溶液吸收,同时测量两分钟内硫酸溶液增加的质量,结果如下表所示.时间/S02030406080100120增加质量/g0m试回答下列问题:(1)根据碳酸氢铵的性质,你认为在使用碳铵肥料时应注意的问题是.(2)请在如图所示的坐标纸上,以反应时间为横坐标,以产生NH3质量为纵坐标,画出产生气体的质量随时间变化的关系曲线,并判断表中m约为.(3)试计算该样品中碳酸氢铵的质量分数(写出计算过程,计算结果保留一位小数).6.(2013?平谷区模拟)某合金可能由铜与镁、锌中的一种组成,现欲测定其组成,进行如下实验:取该合金样品30g放入烧杯中,然后将200g溶质质量分数为%的稀硫酸平均分四次依次加入该烧杯中,每次均充分反应.实验数据如下:请计算:(1)该合金中铜的质量分数为.(2)该合金除铜外,另一种金属是.(写出过程)(3)第三次加入稀硫酸充分反应后,所得溶液中溶质的质量分数.7.(2013?朝阳区一模)实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀的质量关系如图所示.(1)实验中生成沉淀的最大质量是g.(2)开始加入碳酸钠溶液时,还没有产生沉淀的原因是.(3)计算原滤液中氯化钙的质量分数.(已知:CaCl2+Na2CO3=CaCO3↓+2NaCl)8.(2013?济南模拟)现有HCl与CaCl2的混合溶液,为了分析混合溶液中HCl和CaCl2的质量分数,设计了如下实验方案:[实验数据]实验共记录了两组数据:第①组,气体吸收完全后,NaOH溶液质量增加;第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为10g.根据实验设计及有关数据进行分析与计算:(1)混合溶液中HCl的质量分数为.(只写结果)(2)实验中混合溶液与Na2CO3溶液恰好完全反应,经过滤后所得“滤液”中溶质的质量分数为.(不考虑过滤中的损失.只写结果,保留小数点后一位)(3)若在100g混合溶液中不断加入% 的Na2CO3的溶液,请你画出加入Na2CO3溶液的质量与产生沉淀的质量的关系图.(在答题卡的坐标图中作图)(4)混合溶液中CaCl2的质量分数为多少(写出计算过程)9.(2013?青岛模拟)工业上“侯氏”制碱法制的纯碱样品中常含有少量氯化钠,化验员对每批刚生产出的纯碱产品都要进行检测.标出各种成分的含量后投放市场,在实验室用图Ⅰ所示装置组合进行测定(假设装置气密性良好,各装置均能吸收完全;碱石灰是氧化钙和氢氧化钠的混合物),取该样品于A装置中,向其中逐滴滴加溶质的质量分数为10%的稀盐酸,放出气体的总质量与所滴加稀盐酸的质量关系曲线如图Ⅱ所示,请根据题意回答问题:(1)当滴加稀盐酸至图Ⅱ中N点时,烧杯中溶液里的溶质是(写化学式);(2)当滴加了73g稀盐酸时,放出气体的总质量为g.(3)当滴加了73g稀盐酸时(即M点时),烧杯中为不饱和溶液,试通过计算求出其中含溶质的质量分数.(4)小明认为用图Ⅰ装置组合来测定纯碱的质量分数不完善,这是因为,会导致结果(填“偏大”、“偏小”).10.(2012?南宁)为了测定某黄铜(铜锌合金)样品的组成,某化学兴趣小组的同学进行了以下实验:取四份相同质量的样品分别放入等质量的烧杯中,然后分别加入硫酸,充分反应后用天平称量,记录实验数据如下:试验次序第1次第2次第3次第4次所取样品的质量/g加入稀硫酸的质量/g生成气体的质量/g请回答下列问题并计算:(1)经分析,在第1次实验结束后,反应物完全反应完了.(2)样品与足量稀硫酸反应最多能生成气体g(3)计算样品中锌的质量分数(写出具体计算过程).(4)请在图中画出加入稀硫酸的质量与生成气体的质量的变化关系.11.(2012?历下区校级模拟)某化学兴趣小组为了分析生铁中铁的含量,进行了实验研究,即取60g经粉碎后的生铁,把800稀硫酸分4次加入到该样品中,测得数据记录如下表:第1次第2次第3次第4次加入稀硫酸质量(g)200200200200剩余固体质量(g)44(说明:生铁中杂质不溶于水,也不与硫酸反应.)(1)第2次测得剩余固体质量为,其成分为.A.铁 B.铁和碳 C.碳(2)生铁中铁的质量分数为多少(写出计算过程,结果保留到小数点后一位)(3)计算所用稀硫酸的溶质质量分数为多少(写出计算过程,结果保留到小数点后一位)并画出反应生成的氢气质量与加入稀硫酸质量的关系图.12.(2012?佛山模拟)小明同学为测定某稀硫酸溶液浓度(即溶质质量分数),他取该稀硫酸溶液20g,将30g氢氧化钡溶液分三次加入该稀硫酸溶液中,测得三次反应的有关数据见下表:第一次第二次第三次加入氢氧化钡溶液的质量/g101010生成沉淀的质量/g请根据有关数据进行分析与计算:(1)20g该稀硫酸溶液与氢氧化钡溶液完全反应时生成沉淀的质量为g.(2)将第三次反应后所得的混合液过滤,得到滤液的质量为g.(3)该稀硫酸溶液的浓度(即溶质质量分数)为多少(写出计算过程)(4)小明同时用pH计测定并记录该稀硫酸溶液与氢氧化钡溶液反应过程中混合溶液pH变化情况(如图所示),请你用虚线在图中标出该稀硫酸溶液与氢氧化钡溶液刚好完全反应时的变化点,并注明pH和所反应的氢氧化钡溶液的质量.13.(2012?金平区模拟)学校化学小组的同学用稀盐酸与石灰石(杂质不溶于水,也不与酸反应)反应制取40%的CaCl2溶液用于融雪.取稀盐酸,加入20g(足量)石灰石.反应过程如下:反应时间(s)tt1t2t3t4t5烧杯内物质质量(g)121121(1)反应共产生了CO2g.t3时溶液中的溶质是.(2)求t4时溶液的溶质质量分数.(3)将t5时烧杯内物质过滤后,蒸发g水,即可得到40%的CaCl2溶液.(4)请在座标图中画出生成气体的质量(m)g随时间(t)变化的曲线.14.(2011?黔东南州)某同学为了测定黄铜屑(由锌和铜形成的合金)样品组成,取四份样品分别加稀硫酸反应,其实验数据记录如下表.样品第1份第2份第3份第4份取样品质量(g)取稀硫酸质量(g)产生气体质量(g)试计算:(1)经分析,在第1份样品测得的数据中,(填物质)完全反应了;(2)列式计算黄铜屑样品中的锌的质量分数和所用稀硫酸中溶质的质量分数;(3)请在如图中画出在样品中加稀硫酸的质量与产生气体质量变化关系的示意图.15.(2011?泸州)小明同学将含杂质的纯碱样品(碳酸钠与氯化钠的混合物)与稀盐酸相混合,充分反应,测得反应生成气体的质量(m)与反应时间(t)的数据如下表所示:反应时间t/s tt1t2t3t4t5t6气体质量m/g0根据题目要求,回答下列问题:(1)碳酸钠完全反应后,生成CO2的质量为g(2)请在下面的坐标图中,画出反应时生成气体的质量(m)随时间(t)变化的曲线.(3)求完全反应后所得溶液中溶质的质量分数.(Na2CO3+2HCl=2NaCl+CO2↑+H2O).16.(2011?贵阳)有NaOH和Na2CO3混合物.为测定其中NaOH的质量,将固体溶于水,并逐渐加入稀硫酸至100g时,开始产生气体;再加入稀硫酸至100g时,不再产生气体,生成气体共(提示:Na2CO3+H2SO4=Na2SO4+CO2↑+H2O)(1)在图中画出产生气体的质量与所加稀硫酸质量的关系曲线.(2)求混合物中NaOH的质量是多少(3)所用稀硫酸的溶质质量分数是多少17.(2011?三水区校级二模)将20g由NaCl和CaCl2组成的固体混合物,溶于水配成50g溶液,向所得到的混合溶液中逐滴加入一定质量分数的Na2CO3溶液,加入Na2CO3溶液的质量与所得沉淀的质量关系如下表:Na2CO3溶液的质量/g20406080100生成沉淀的质量/g48x1010(1)x的值为.(2)求所加Na2CO3溶液中溶质的质量分数.(3)画出产生沉淀与所加Na2CO3溶液质量关系的曲线图.18.(2010?海陵区校级模拟)将盛有50g稀盐酸的烧杯放在天平上,然后把过量的碳酸钠加入到盛有稀盐酸的烧杯中,以测定稀盐酸中HCl的质量分数.已知反应前烧杯内稀盐酸和碳酸钠的总质量为,从反应开始至以后的6分钟内,每1分钟读1次数并记录.结果如下:时间/min0123456质量/g试回答下列问题:(1)表中有一个测定结果误差较大,这点所在的时间是第min;(2)在给出的坐标纸上,画出表示反应过程的质量与时间的曲线图;(3)试计算50g稀盐酸中HCl的质量分数(写出计算过程).一.解答题(共18小题)1.(2014?十堰模拟)在一烧杯中盛有 Na2CO3和NaCl组成的固体混合物,加水溶解,制成溶液.放出气体的总质量与所滴入的10%的稀盐酸的质量关系曲线如图所示:请根据题意回答问题:(1)当滴加了73g稀盐酸时,放出气体的总质量为g.(2)当滴加稀盐酸至图中B点时,烧杯中溶液里的溶质是(写化学式)NaCl和HCl .(3)当滴加了73g稀盐酸时(即A点时),烧杯中为不饱和溶液,试通过计算求出其中含溶质的质量分数.考点:根据化学反应方程式的计算.专题:压轴实验题;综合计算(图像型、表格型、情景型计算题).分析:(1)NaCl与盐酸能互相交换成分后不变,所以不反应.因此生成的气体是碳酸钠与73g 稀盐酸反应所生成的,根据反应的化学方程式,得出各物质之间的质量比,列出比例式,就可计算出放出气体的质量;(2)由图示可知,当滴加稀盐酸至图中A点时,恰好完全反应,再滴加稀盐酸至图中B点时,盐酸剩余,此时溶液中的溶质是氯化钠和氯化氢;(3)根据题意分析,A点时恰好完全反应,溶液里的溶质有混合物中原有的氯化钠和生成物中的氯化钠.根据反应的化学方程式,就可计算出混合物中Na2CO3的质量和反应生成的NaCl的质量.混合物的总质量减去Na2CO3的质量就是混合物中原有的氯化钠的质量,再加上反应生成的NaCl的质量就是所含溶质的质量,然后结合溶质的质量分数求解.解答:解:设放出气体的总质量为x,反应后生成NaCl的质量为y,混合物中NaCO3的质量为z2 Na2CO3+2HCl═2Na Cl+H2O+CO2↑106 73 117 44z 73g×10% y x=解得x==解得y==解得z=(1)当滴加了73g稀盐酸时,放出气体的总质量为;(2)由图示可知,当滴加稀盐酸至图中A点时,已是完全反应,再滴加稀盐酸至图中B点时,盐酸就有剩余;(3)反应后溶质NaCl的质量=+﹣=,溶液的质量是:++73g﹣=234g则所得氯化钠溶液溶质的质量分数是×100%=10%故答案为:(1);(2)NaCl和HCl;(3)当滴加了73g稀盐酸时(即A点时),溶质的质量分数是10%.点评:本题主要考查学生对完全反应的认识和运用化学方程式进行计算的能力;图象的转折点即为恰好反应的点,并根据质量守恒,反应后溶液的质量=固体混合质量+加入稀盐酸质量﹣放出气体质量.2.(2014?广东模拟)小明同学将含杂质的纯碱样品(碳酸钠与氯化钠的混合物)与稀盐酸相混合,充分反应,测得反应生成气体的质量(m)与反应时间(t)的数据如表所示:反应时间t/s tt1t2t3t4t5t6气体质量m/g0根据题目要求,回答下列问题:(1)碳酸钠完全反应后,生成CO2的质量为g(2)请在下面的坐标图中,画出反应是生成气体的质量(m)随时间(t)变化的曲线.(3)求完全反应后所得溶液中溶质的质量分数.考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.专题:压轴实验题;综合计算(图像型、表格型、情景型计算题).分析:(1)由于碳酸钠和稀盐酸反应能产生二氧化碳,根据图表数据分析得出生成二氧化碳的质量;(2)根据图表数据和坐标图中横轴与纵轴的表示,按要求画出反应生成气体的质量(m)随时间(t)变化的曲线;(3)由生成二氧化碳的质量,根据碳酸钠与稀盐酸反应的化学方程式可以计算出样品中碳酸钠的质量和生成氯化钠的质量.进而计算出样品中氯化钠的质量,再加上生成氯化钠的质量就是反应后溶液中的溶质质量,最后结合所得溶液的质量根据溶质质量分数的计算公式可以计算出反应后的溶液中溶质的质量分数.解答:解:(1)由图表数据可知,碳酸钠完全反应后,生成CO的质量为:;2(2)根据图表数据,画出反应生成气体的质量(m)随时间(t)变化的曲线:(3)设样品中碳酸钠的质量为x,反应生成NaCl的质量为yNa2CO3+2HCl=2NaCl+CO2↑+H2O106 117 44x y解之得:x= y=∴样品中氯化钠的质量为﹣=反应后溶液中溶质的质量=+=15g反应后溶液的质量=+﹣=100g∴完全反应后所得溶液中溶质的质量分数为×100%=15%故答为:(1);(2)见上表;(3):完全反应后所得溶液中溶质的质量分数为15%.点评:本题主要考查有关样品混合物的化学方程式的计算和有关溶质质量分数的计算,能锻炼学生的慎密思维及解题能力,难度较大.明确数据的分析是解答本题的关键.3.(2013?厦门)为测定锌铜合金中锌的含量,取该合金放入如图盛有稀硫酸的锥形瓶中,发生反应:Zn+H2SO4=ZnSO4+H2↑.多次实验后,取平均值所得数据如下表:反应前充分反应后装置及反装置和足量的稀硫酸质量锌铜合金质量应剩余物质质量若不考虑干燥剂吸收空气中的水蒸气,计算:(1)根据质量守恒定律求生成氢气的质量.(2)该合金中锌的质量分数.考点:根据化学反应方程式的计算.专题:压轴实验题;综合计算(图像型、表格型、情景型计算题).分析:(1)根据锌和硫酸反应生成氢气而铜不反应,所以反应前后质量减少的质量就是氢气的质量进行解答;(2)根据氢气的质量求出该合金中锌的质量以及该合金中锌的质量分数进行解答.解答:解:(1)依题意可得氢气的质量=+﹣=答:氢气的质量为(2)设该合金中锌的质量分数为x.Zn+H2SO4 ═ZnSO4+H2↑65 2×xx=%答:该合金中锌的质量分数为%.点评:解此题的关键是审清题意,找出突破口,再结合方程式进行计算,可以得到问题答案.4.(2013?防城港)我们知道,每次做完实验后,剩余废液不能直接倾倒入排污管,必须回收处理.某班同学实验后收集到含有碳酸钠和氢氧化钠的混合废液,一个兴趣小组用废弃的溶质质量分数为%的硫酸来处理,并回收处理后的溶液.他们向废液中加入稀硫酸时,所得溶液pH与加入的稀硫酸质量的关系曲线如图所示.求:(1)通过如图可知,当反应进行至图中 B 点时(填“A”、“B”或“C”),废液恰好处理完(即碳酸钠和氢氧化钠混合废液刚好完全转化成硫酸钠溶液).(2)当向混合液中加入稀硫酸至N点时,加入的稀硫酸质量为5Kg,此时溶液总质量为10kg.求此时所得溶液中溶质的质量分数(写出计算过程,溶于水的气体忽略不计).考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.专题:压轴实验题;综合计算(图像型、表格型、情景型计算题).分析:(1)根据图象分析在B时,溶液的PH等于7,溶液呈中性,废液恰好处理完;(2)根据碳酸钠和氢氧化钠与硫酸反应的方程式,找出硫酸与硫酸钠的关系式,由硫酸的质量可求出硫酸钠的质量,在根据溶液中溶质的质量分数计算.解答:解:(1)由于生成的硫酸钠溶液显中性,由图示可知,当反应进行至图中B点时,pH=7,然后又下降,说明此时恰好将废液处理完;(2)设生成的硫酸钠的质量为x由H2SO4+2NaOH═Na2SO4+2H2O、Na2CO3+H2SO4=Na2SO4+H2O+CO2↑得:H2SO4~Na2SO498 1425kg×% x解得:x=所得溶液中溶质的质量分数是:=%.答:(1)B;(2)所得溶液中溶质的质量分数是%.点评:在解此类题时,首先分析反应应用的原理,然后结合图象中的转折点,以及方程式中的比例关系进行解答.5.(2013?东营)化肥对提高农作物的产量具有重要的作用,碳铵(碳酸氢铵)就是农民朋友经常使用的一种氮肥,碳铵易溶于水、受潮时常温分解,温度越高分解越快,遇碱时放出氨气.某校化学兴趣小组为测定某碳铵肥料样品的纯度,将样品加入足量的浓氢氧化钠溶液中共热,(碳铵中的杂质不与氢氧化钠反应,反应的方程式为NH4HCO3+2NaOH=Na2CO3+2H2O+NH3↑),把产生的所有NH3用足量的硫酸溶液吸收,同时测量两分钟内硫酸溶液增加的质量,结果如下表所示.时间/S02030406080100120增加质量/g0m试回答下列问题:(1)根据碳酸氢铵的性质,你认为在使用碳铵肥料时应注意的问题是储存和运输时要密封,不要受潮或暴晒;施用后要盖土或立即灌溉;不要与碱性物质混用.(2)请在如图所示的坐标纸上,以反应时间为横坐标,以产生NH3质量为纵坐标,画出产生气体的质量随时间变化的关系曲线,并判断表中m约为.(3)试计算该样品中碳酸氢铵的质量分数(写出计算过程,计算结果保留一位小数).考点:根据化学反应方程式的计算.专题:压轴实验题;综合计算(图像型、表格型、情景型计算题).分析:(1)根据碳酸氢铵的性质进行解答;(2)根据表格中的数据进行解答;(3)根据硫酸溶液增加的质量为氨气的质量且利用化学方程式求出碳酸氢铵的质量即可.解答:解:(1)碳铵易溶于水、受潮时常温分解,温度越高分解越快,遇碱时放出氨气,所以在使用碳铵肥料时应注意的问题是储存和运输时要密封,不要受潮或暴晒;施用后要盖土或立即灌溉;不要与碱性物质混用;故填:储存和运输时要密封,不要受潮或暴晒;施用后要盖土或立即灌溉;不要与碱性物质混用;(2)根据表格中的数据,以反应时间为横坐标,以产生NH3质量为纵坐标,产生气体的质量随时间变化的关系曲线为,表中m约为;故填:;(3)解:硫酸溶液增加的质量为氨气的质量,设样品中所含碳酸氢铵的质量为X.NH4HCO3+2NaOH═Na2CO3+2H2O+NH3↑79 17XX=5g样品中所含碳酸氢铵的质量分数为×100%=%答:该样品中碳酸氢铵的质量分数为%.点评:主要对碳酸氢铵的性质作了一系列的探究,考查学生的对知识的总结能力和解决问题的能力.6.(2013?平谷区模拟)某合金可能由铜与镁、锌中的一种组成,现欲测定其组成,进行如下实验:取该合金样品30g放入烧杯中,然后将200g溶质质量分数为%的稀硫酸平均分四次依次加入该烧杯中,每次均充分反应.实验数据如下:请计算:(1)该合金中铜的质量分数为30% .(2)该合金除铜外,另一种金属是锌.(写出过程)(3)第三次加入稀硫酸充分反应后,所得溶液中溶质的质量分数.考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.专题:压轴实验题;综合计算(图像型、表格型、情景型计算题).分析:(1)由图中信息可以知道,在前三次加入稀硫酸时,固体质量均减少,但是第四次加入稀硫酸固体质量只减少了,说明第四次中稀硫酸有剩余,所以固体中铜的质量为,可以据此求算出铜的质量分数;(2)由(1)的分析可以知道,金属和50g稀硫酸恰好完全反应,可以据此结合+2价的金属与酸反应的化学方程式,判断出金属种类;(3)根据判断出的金属,写出化学方程式,求算出所生成的硫酸盐,然后结合溶质的质量分数的计算公式即可求算出反应后所得溶液中溶质的质量分数.解答:解:(1)由图中信息可以知道,在前三次加入稀硫酸时,固体质量均减少,但是第四次加入稀硫酸固体质量只减少了,说明第四次中稀硫酸有剩余,所以固体中铜的质量为,所以铜的质量分数为:×100%=30%;(2)金属和50g稀硫酸恰好完全反应,其中硫酸的质量为:50g×%=镁和锌在发生置换反应时都生成+2价的硫酸盐,故设金属的相对原子质量为X,则:M+H2SO4═MSO4 +H2↑X 98=解得:X=65,所以该金属为锌;(3)第三次加入稀硫酸充分反应后,生成硫酸锌的质量为y,氢气的质量为z,则:Zn+H2SO4═ZnSO4+H2↑98 161 2×3 y z=解得:y=,z=;所得溶液中溶质的质量分数为:×100%=%.答:第三次加入稀硫酸充分反应后,所得溶液中溶质的质量分数为%.故答案为:(1)30%;(2)锌;(3)%.点评:要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景或图表信息等,结合所学的相关知识和技能,细致地分析题意(或图表信息)等各种信息资源,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.7.(2013?朝阳区一模)实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀的质量关系如图所示.(1)实验中生成沉淀的最大质量是 5 g.(2)开始加入碳酸钠溶液时,还没有产生沉淀的原因是稀盐酸先与碳酸钠反应.(3)计算原滤液中氯化钙的质量分数.(已知:CaCl2+Na2CO3=CaCO3↓+2NaCl)考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.专题:压轴实验题;综合计算(图像型、表格型、情景型计算题).分析:(1)根据图示信息可知生成沉淀的最大质量;(2)根据稀盐酸过量,故加入碳酸钠后首先与过量的稀盐酸反应,然后再与氯化钙反应进行解答;(3)根据沉淀的最大质量可求出原滤液中氯化钙的质量,然后根据溶质的质量分数的计算方法计算质量分数.解答:解:(1)由图可以看出,生成沉淀的最大质量是5g;(2)因稀盐酸过量,故加入碳酸钠后首先与过量的稀盐酸反应,然后再与氯化钙反应,若先与氯化钙反应,生成的碳酸钙沉淀又与盐酸反应;(3)解:设原滤液中CaCl2的质量为xNa2CO3+CaCl2═CaCO3↓+2NaCl111 100x 5g=x=故原滤液中氯化钙的质量分数为:×100%=%答:原滤液中氯化钙的质量分数是%.故答案为:(1)5;(2)稀盐酸先与碳酸钠反应;(3)原滤液中氯化钙的质量分数是%.点评:此题是对物质的性质及图象识别考查题,解题的关键是能对图象有明确的认识,可以较好的培养学生良好的分析问题的能力.。

20化学计算题学生1.(2017黑龙江哈尔滨,15,2分)现有部分被氧化的铜粉固体混合物,为研究铜粉的组成情况,取4g混合物,先加热完全氧化后,再加入60 g 9.8%的稀硫酸恰好完全反应,则固体混合物中铜单质的质量分数为()A.80%B.64%C.16%D.96%2.(2017天津,15,2分)下列说法中正确的是()A.质量相等的氧化镁和硫酸镁中镁元素的质量比为3∶1B.质量相等的硫和碳分别在氧气中充分燃烧,硫比碳消耗氧气的质量大C.硝酸铵和氯化钾的混合物中氮元素质量分数为14%,该混合物中硝酸铵的质量分数为40%D.质量和质量分数均相等的氢氧化钠溶液和稀硫酸,充分反应后,向所得溶液中滴加硫酸铜溶液,不会出现蓝色沉淀3.(2015湖南郴州,20,2分)某碳酸钙和氧化钙组成的混合物中钙元素的质量分数为60%,将50 g该混合物高温煅烧至固体质量不再改变,则生成二氧化碳的质量是()A.6 gB.8 gC.13.2 gD.20 g4.(2018安徽,16,6分)尿素[CO(NH2)2]是一种常见的氮肥,工业上制备反应如下:CO2+2NH3CO(NH2)2+H2O,请计算:(1)尿素中氮元素的质量分数。
(2)生产6 t尿素,理论上需要氨气的质量是多少?5.(2018内蒙古包头,11,7分)某兴趣小组为测定石灰石中碳酸钙的质量分数,取12 g石灰石样品加入烧杯中,将120 g稀盐酸平均分四次加入,充分反应后(杂质不溶于水也不与稀盐酸反应),测得实验数据如下:分析数据计算(结果精确到0.1%):(1)该样品中碳酸钙的质量分数。
(2)所用稀盐酸的溶质质量分数。
(3)12 g样品中的碳酸钙恰好完全反应时所得溶液的溶质质量分数。
6.(2018福建,16,5分)一种新型“人造树叶”可吸收二氧化碳并转化为乙醇(C2H5OH)燃料,化学方程式为:2CO2+3H2O C2H5OH+3O2研究显示,一升“人造树叶”每天可从空气中吸收968 g CO2。

题型复习(四) 化学计算题一、题型简介化学计算题是借助数学计算知识,从反应中各种量的变化对化学概念或原理加深理解,或通过计算进一步掌握物质的性质及其变化规律的一类试题。
通过计算还能培养分析、推理、归纳等逻辑思维能力和解决实际问题的能力,是初中化学的重要组成部分。
化学计算题已不仅仅是单纯的数学运算,而是在逐步走出人为编制的、没有实际价值的偏、难、怪的误区,实现运用化学概念、理论知识解决实际问题的能力,真正体现出“化学计算”。
其中常涉及的计算类型如下:1.化学式的计算:主要涉及选择、计算,试题可结合实际生活中的物质,考查学生对化学式概念的理解、相对原子质量的计算、物质中各元素的质量及元素质量分数的计算。
2.有关化学方程式与溶液的综合计算:近几年的计算题往往把溶液的计算与化学方程式的计算结合起来,是云南中考的高频考题。
如果涉及陌生的化学反应,题中会给出相应的化学方程式。
二、方法指导化学计算一般分为有关化学式的计算、有关化学方程式的计算、有关溶液的计算、综合计算。
其中综合计算,一般表现为化学方程式和溶液中溶质质量分数两者融合的综合计算。
我省中考在此计算方面比较基础,没有过繁的数字运算,但需要掌握基本计算的方法和对化学用语的正确识别。
题型之一 根据化学式的计算从化学式中找出计量关系,确定数量关系。
常用的计算公式有:(以化合物A m B n 为例)1.相对分子质量=A 的相对原子质量×m+B 的相对原子质量×n2.元素的质量比=A 元素的质量∶B 元素的质量=(A 的相对原子质量×m)∶(B 的相对原子质量×n)3.A 的质量分数=的相对原子质量的相对原子质量n m B A m A ⨯×100%4.A 元素的质量=化合物(A m B n 的质量)×A 元素的质量分数例1 (2013·昆明)2013年6月11日,“神舟十号”成功发射。
运载“神舟十号”飞船的火箭使用偏二甲肼(C 2H 8N 2)作燃料,下列说法正确的是( )A.偏二甲肼由碳、氢、氮三种元素组成B.偏二甲肼的相对分子质量为58C.偏二甲肼中碳、氢、氮元素的质量比为2∶8∶2D.偏二甲肼中碳元素的质量分数为50%思路点拨:A.根据偏二甲肼化学式的含义进行分析判断;B.根据相对分子质量为构成分子的各原子的相对原子质量与原子个数的乘积之和,进行分析判断;C.根据化合物中各元素质量比=(各原子的相对原子质量×原子个数)之比,进行分析判断;D.根据化合物中元素的质量分数=相对分子质量原子个数相对原子质量⨯×100%,进行分析判断。

2016年04月22日计算题--金属与酸反应的初中化学组卷一.计算题(共30小题)1.(2014•汕尾)欲测定Cu﹣Zn合金及Cu﹣Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀硫酸和必要的仪器.(1)你认为能测出的质量分数的是合金.(2)取该合金的粉末26g加入该硫酸充分反应,所加稀硫酸与生成的质量关系如图所示.①生成气体的质量为g.②请计算该合金中铜的质量分数.2.(2015•娄底)马英同学取某地石灰石样品12g进行测定实验,现将100g稀盐酸分五次加入石灰石样品中(杂(1)m的值为g.(2)12g石灰石样品中碳酸钙的质量等于g.(3)反应完全后最终溶液中氯化钙的质量分数?.(写出计算过程,计算结果精确至0.1)3.(2014•东营)钙是人体中的常量元素,缺钙时可通过食用保健药剂来增加摄入量.某补钙药剂说明书的部分信息如图所示.现将100g盐酸分成5等份,逐次加到用40片该药剂制成的粉末中(其他成分不与盐酸反应),)人体缺钙易出现的疾病是,这时除在医生指导下服用保健药剂外,日常生活中要多摄入等食物.(2)该品牌补钙药剂中CaCO3的质量分数是,a的数值为.(3)求该盐酸中溶质的质量分数为(写出计算过程,计算结果保留一位小数).4.(2014•淮安)为了测定石灰石中碳酸钙的质量分数,某兴趣小组的同学称取石灰石样品12.5g,高温煅烧至质量不再改变,称得剩余固体质量为8.1g(假设杂质不参加反应;发生反应的化学方程式为CaCO3CaO+CO2↑),试计算:(1)生成二氧化碳质量是g;(2)石灰石样品中碳酸钙的质量分数是多少?(写出计算过程)5.(2015•荆门)某研究学习小组欲测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品20g,把80g稀盐酸分四次加入,实验过程所得数据如表格(已知石灰石样品中含有的二氧化硅等杂质不溶于水,不与稀盐酸反应).根据实验数据计算:(1)表中n的数值为.(2)样品中碳酸钙的质量分数是.(1)该同学制得氧气的质量为.(2)该同学所用过氧化氢溶液的溶质质量分数.(相对原子质量:H﹣1 O﹣16)7.(2015•孝感模拟)小明同学在某化工厂进行社会实践,技术员与小明一起分析由氯化钙和氯化钠组成的产品中氯化钠的含量.现取13.4g固体样品,全部溶于96.6g水中,向所得的混合溶液中滴加溶质质量分数为10.6%的碳酸钠溶液,记录了如右图所示的曲线关系.技术员提示小明:氯化钙与碳酸钠反应的化学方程式是CaCl2+Na2CO3=CaCO3↓+2NaCl.求:(1)当氯化钙与碳酸钠恰好完全反应时,消耗10.6%的碳酸钠溶液的质量是g.(2)当氯化钙与碳酸钠恰好完全反应时,过滤,所得溶液中溶质的质量分数是多少?8.(2014•娄底)硅钢是变压器、充电器中的核心材料,其主要成份是Fe和Si.某学生用硅钢样品做了如下实验:取4.2g硅钢样品,将60g稀硫酸分6次加入样品中(其中稀硫酸与硅及其它杂质不反应),充分反应后过滤、洗)从以上数据可知,稀硫酸加入第次充分反应后,铁恰好完全反应.(2)表格中m=.(3)计算所用稀硫酸中溶质的质量分数.9.(2014•抚州)实验室制取氧气时,某同学取质量为x的高锰酸钾加热,记录产生氧气的质量与反应时间的关系如图1所示,请回答下列问题:(1)t0﹣t1和t4﹣t5时段固体质量都不变,为什么?(2)请根据图中数据计算高锰酸钾的质量x为多少?(写出计算过程)(3)请在图2坐标中,画出固体中锰元素质量在t0﹣t5时段变化示意图.10.(2015•平遥县模拟)我国北方某盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠(其它杂质忽略不计).为测定该产品中碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸.当盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g,(假设产生的气体全部逸出),产生气体的质量与滴入稀盐酸的质量关系如图所示.试计算:(1)A点产生气体的质量m=.(2)试样中碳酸钠的质量分数(结果精确至0.1%).(3)B点时,烧杯内溶液中的溶质是(写出化学式).11.(2013•安徽)某石灰厂需要测定产品生石灰中杂质(杂质只含CaCO3)的质量分数.小刚进行了如图实验.请计算:(1)生成CO2气体的质量;(2)样品中CaCO3的质量分数.12.(2013•日照)“黄铜”是铜、锌合金,为了测定某黄铜样品中锌的质量分数,甲、乙、丙三位同学分别进行实(1)同学取用的稀盐酸和样品恰好完全反应,他制取的氢气的质量是.(2)计算黄铜样品中锌的质量分数.13.(2014•黄冈)有一含纯碱的食盐样品,为了测定其中碳酸钠的含量,某同学称取30g样品放入烧杯中,向烧杯中加入100g足量的稀盐酸,充分反应后烧杯中剩余物的总质量为123.4g(假设产生的气体全部逸出)(1)反应生成的气体的质量为g;(2)样品中碳酸钠的质量分数是多少?14.(2015•包头)在氯化钙和氯化钠的混合物中加入一定量的水,全部溶解得到50克混合溶液,向该溶液中逐滴加入一定溶质质量分数的碳酸钠溶液,生成沉淀与加入碳酸钠溶液的质量关系如图所示.计算:(1)所加碳酸钠溶液的溶质质量分数.(2)若恰好完全反应时所得溶液的溶质质量分数为10%,则原固体混合物的质量是多少?15.(2015•恩施州)我州地处武陵山区,具有丰富的天然石灰石、大理石(主要成分是碳酸钙)资源,纯度高、硬度大,是优质的建筑材料.为测定某地天然大理石中碳酸钙的含量(杂质不与稀盐酸反应),某化学兴趣小组成员取25g样品,加入一定溶质质量分数的稀盐酸,测得的实验数据如图所示.(1)求样品中碳酸钙的质量分数;(2)所加稀盐酸的溶质质量分数.16.(2013•咸宁)将6.8g含杂质的锌粒,加入到盛有50.0g过量的稀硫酸的烧杯中(杂质不溶于水,也不与稀硫酸反应),充分反应后,称得烧杯内物质的总质量为56.6g.试计算:(1)生成氢气的质量.(2)锌粒中所含锌的质量分数(精确到0.1%).17.(2015•蓟县二模)已知Na2CO3的水溶液呈碱性,在一烧杯中盛有20.4g Na2CO3和NaCl组成的固体混合物.向其中逐渐滴加溶质质分数为10%的稀盐酸.放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示,请根据题意回答问题:(1)当滴加稀盐酸至图中B点时,烧杯中溶液的pH7(填>、=、<).(2)当滴加稀盐酸至图中A点时,烧杯中为不饱和溶液(常温),通过计算求出其中溶质的质量分数.(计算结果保留一位小数)18.(2014•黄冈模拟)“黄铜”是铜锌合金,具有较机械性能,比纯铜耐腐蚀,街头许多“金色”饰品就是用它来制作的.现取20.0g某种黄铜投入100g某浓度的稀硫酸中,完全反应后剩余的溶液和残余固体总质量为119.8g.请计算:(1)产生氢气的质量为g.(2)这种黄铜中铜的质量分数为多少?(写出计算过程,结果精确到0.1%)19.(2013•厦门)为测定锌铜合金中锌的含量,取该合金放入如图盛有稀硫酸的锥形瓶中,发生反应:(1)根据质量守恒定律求生成氢气的质量.(2)该合金中锌的质量分数.20.(2015•河北)某同学用锌和稀硫酸制取氢气.向气体发生装置中加入一定量锌粒,将30g稀硫酸分三次加入,)共制得氢气g(2)所用稀硫酸的溶质质量分数.21.(2014•广东模拟)小明同学将13.9g含杂质的纯碱样品(碳酸钠与氯化钠的混合物)与90.5g稀盐酸相混合,根据题目要求,回答下列问题:(1)碳酸钠完全反应后,生成CO2的质量为g(2)请在下面的坐标图中,画出反应是生成气体的质量(m)随时间(t)变化的曲线.(3)求完全反应后所得溶液中溶质的质量分数.22.(2014•宁波)实验后的废液一般需回收处理,不能直接倒入排污管,小科实验后收集到含有碳酸钠和氢氧化钠的混合废液10.22g,他向废液中缓缓滴入溶质质量分数为19.6%的稀硫酸,生成二氧化碳质量与滴入稀硫酸质量的关系如图所示.当废液恰好处理完毕时,溶液总质量为20g.溶于水的气体忽略不计,则:(1)废液恰好处理完毕时.溶液的pH为.(2)图中m=g.(3)废液恰好处理完毕时,回收所得溶液的溶质质量分数是多少?23.(2014•南充)将一定质量的金属锌投入到100g稀硫酸中恰好完全反应,放出气体的质量与反应时间的关系如图所示.试求:(1)完全反应后生成H2的质量为g;(2)所用硫酸溶液中溶质的质量分数.24.(2013•莱芜)铜镁合金具有优良的导电性,常用作飞机天线等导电材料.欲测定合金的组成(其他元素忽略不计),进行如下实验:取铜合金20g放入烧杯,将280g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体(2)所加稀硫酸的溶质的质量分数.(写出计算过程)25.(2014•湖北)小夏在实验室取10g锌粒和93.7g稀硫酸放在气体发生装置中制取氢气,实验过程中,收集到的氢气与反应时间关系如图所示,求反应后所得硫酸锌溶液的溶质质量分数.26.(2015•菏泽)学习了金属的有关知识后,同学们知道了如何鉴别黄金和黄铜(铜锌合金,俗名“愚人金”),为进一步宣分析黄铜的成分,某同学进行了如下实验,称量黄铜样品20g放入锥形瓶中,向其中不断加入稀硫酸,收集生成的气体与所加稀硫酸的质量关系如图所示,求:(1)黄铜样品中锌的质量.(2)恰好完全反应时,所得溶液中溶质的质量分数.27.(2015•深圳)某小组欲用4.9%的稀H2SO4测一瓶标签破损的NaOH溶液的质量分数.(1)从一瓶标签模糊的NaOH溶液里取出几滴后向(填写溶液名称)里滴加,呈红色.(2)取10g NaOH溶液样品,并与4.9%的稀硫酸溶液混合.由图可得,完全反应时,所用稀硫酸溶液中溶质的质量为.(3)求NaOH溶液样品中溶质的质量分数.28.(2014•株洲)人体胃酸过多会引起胃病.如图所示为某抗酸药包装标签上的部分文字,请回答下列问题.(1)Al(OH)3的相对分子质量为.(2)经测定,每片该抗酸药实含氢氧化铝234mg.计算一片该抗酸药可消耗7.3%的盐酸多少克(请写出计算过程)?29.(2015•邵阳)生铁是铁的合金,化学兴趣小组的同学为测定某生铁样品中铁的质量分数.进行如下实验:称取生铁样品5.8g放入烧杯中,逐滴加入稀硫酸,所加稀硫酸的质量与放出气体的质量关系如图所示(生铁样品中的杂质不与稀硫酸反应,也不溶于水).回答下列问题:(1)当滴加稀硫酸质量为时,反应恰好完全,此时产生气体质量是.(2)计算生铁样品中铁的质量分数(结果保留0.1%,下同).(3)计算所用稀硫酸中溶质的质量分数.(温馨提示:Fe+H2SO4=FeSO4+H2↑)30.(2016•合肥校级一模)将某生铁样品5.82g,放入烧杯中,再加入过量的稀盐酸,反应时间(t)和烧杯及其所盛物质总质量(m)的关系如图所示:(1)反应停止后烧杯内剩余的固体物质是.(2)求样品中铁的质量分数.2016年04月22日计算题--金属与酸反应的初中化学组卷参考答案与试题解析一.计算题(共30小题)1.(2014•汕尾)欲测定Cu﹣Zn合金及Cu﹣Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀硫酸和必要的仪器.(1)你认为能测出的质量分数的是Cu﹣Zn合金.(2)取该合金的粉末26g加入该硫酸充分反应,所加稀硫酸与生成的质量关系如图所示.①生成气体的质量为0.2g.②请计算该合金中铜的质量分数.【考点】根据化学反应方程式的计算.【专题】综合计算(图像型、表格型、情景型计算题).【分析】(1)两种金属中一种金属的活动性比氢强,一种金属的活动性比氢弱,只有满足此条件才能测定出金属的质量分数.(2)根据氢气的质量求出锌的质量,再用合金质量减去锌的质量即为铜的质量;再用合金中铜的质量除以合金的质量乘以百分之百既得合金中铜的质量分数.【解答】解:(1)铜的活动性比氢弱,不与稀酸发生反应,锌的活动性比氢强,能与稀酸发生反应,因而铜锌合金能测定出铜的质量分数;而银的活动性比氢弱,也不与稀酸发生反应,因而铜银合金不能测定出铜的质量分数.故答案为:Cu~Zn(2)①由图示可知,生成气体的质量为0.2g;故答案为:0.2g.②设:合金中锌的质量为xZn+H2SO4=ZnSO4+H2↑65 2x 0.2gx=6.5g合金中铜的质量为:26g﹣6.5g=19.5g合金中铜的质量分数=×100%=75%答:合金中铜的质量分数为75%.【点评】稀硫酸是混合物,其溶质是硫酸,在做有关化学方程式的计算时,不能把稀硫酸的质量当成反应物的质量直接代入计算.2.(2015•娄底)马英同学取某地石灰石样品12g进行测定实验,现将100g稀盐酸分五次加入石灰石样品中(杂(1)m的值为 3.3g.(2)12g石灰石样品中碳酸钙的质量等于10g.(3)反应完全后最终溶液中氯化钙的质量分数?10.5%.(写出计算过程,计算结果精确至0.1)【考点】根据化学反应方程式的计算;有关溶质质量分数的简单计算.【专题】化学计算;综合计算(图像型、表格型、情景型计算题).【分析】(1)根据记录数据可发现,20g的盐酸完全反应生成二氧化碳气体的质量是1.1g,第4次实验中加入盐酸生成的二氧化碳是4.4g,说明了第三次实验中盐酸完全反应,可推出m的值;(2)根据二氧化碳的质量求出该石灰石样品中碳酸钙的质量、生成的氯化钙的质量;(3)根据上述计算结果和溶质的质量分数求出反应完全后最终溶液中氯化钙的质量分数.【解答】解:(1)根据记录数据可发现,20g的盐酸完全反应生成二氧化碳气体的质量是1.1g,第4次实验中加入盐酸生成的二氧化碳是4.4g,说明了第三次实验中盐酸完全反应,可推出m的值为3.3g;(2)设石灰石中CaCO3的质量为x,生成的氯化钙的质量为y.CaCO3+2HCl=CaCl2+H2O+CO2↑100 111 44x y 4.4g解得:x=10g y=11.1g(3)完全反应后最终溶液中氯化钙的质量分数是:≈10.5%故答案为:(1)3.3;(2)10;(3)10.5%.【点评】本题主要考查了学生分析图表数据,解决问题的能力,以及据方程式计算的能力.3.(2014•东营)钙是人体中的常量元素,缺钙时可通过食用保健药剂来增加摄入量.某补钙药剂说明书的部分信息如图所示.现将100g盐酸分成5等份,逐次加到用40片该药剂制成的粉末中(其他成分不与盐酸反应),)人体缺钙易出现的疾病是骨质疏松,这时除在医生指导下服用保健药剂外,日常生活中要多摄入虾皮或海带或牛奶或骨头汤等食物.(2)该品牌补钙药剂中CaCO3的质量分数是50%,a的数值为25.(3)求该盐酸中溶质的质量分数为(写出计算过程,计算结果保留一位小数).【考点】根据化学反应方程式的计算;有关溶质质量分数的简单计算;人体的元素组成与元素对人体健康的重要作用.【专题】综合计算(图像型、表格型、情景型计算题).【分析】(1)根据缺钙会引起骨质疏松,虾皮或海带或牛奶或骨头汤等含有较多的钙元素解答;(2)根据二氧化碳的质量结合化学方程式可以计算出碳酸钙的质量即可解答,根据表中数据分析可得a的值;(3)根据图2可知只有80g盐酸参加反应,根据二氧化碳的质量结合化学方程式可计算80g盐酸中氯化氢的质量即可解答.【解答】解:(1)人体缺钙易出现骨质疏松,日常生活中要多摄入虾皮或海带或牛奶或骨头汤等含有较多的钙元素的食物;(2)设40片该药剂中含碳酸钙的质量为x,消耗盐酸中的溶质质量为y,CaCO3+2HCl=CaCl2+CO2↑+H2O100 73 44x y 8.8g,x=20g,y=14.6g该品牌补钙药剂中CaCO3的质量分数是:=50%;由第1次和第4次数据可知20g稀盐酸可消耗5g碳酸钙,则第二次加入20g稀盐酸后,剩余固体为30g,第三次加入30g稀盐酸后,剩余固体为25g,故a的数值为25;(3)由表格信息可知,80g稀盐酸与40片药剂中的碳酸钙恰好完全反应,所以该盐酸中溶质的质量分数为:=18.3%;答案:(1)骨质疏松;虾皮或海带或牛奶或骨头汤等;(2)50%;25;(3)反应的盐酸中溶质的质量分数是18.3%.【点评】本题主要考查学生运用化学方程式进行和质量分数公式进行计算的能力.4.(2014•淮安)为了测定石灰石中碳酸钙的质量分数,某兴趣小组的同学称取石灰石样品12.5g,高温煅烧至质量不再改变,称得剩余固体质量为8.1g(假设杂质不参加反应;发生反应的化学方程式为CaCO3CaO+CO2↑),试计算:(1)生成二氧化碳质量是 4.4g;(2)石灰石样品中碳酸钙的质量分数是多少?(写出计算过程)【考点】根据化学反应方程式的计算.【专题】有关化学方程式的计算.【分析】碳酸钙受热分解生成氧化钙和二氧化碳,反应前后的质量差即为反应生成二氧化碳的质量;根据二氧化碳的质量可以计算碳酸钙的质量,进一步可以计算石灰石样品中碳酸钙的质量分数.【解答】解:(1)生成二氧化碳质量为:12.5g﹣8.1g=4.4g,故填:4.4.(2)设碳酸钙的质量为x,CaCO3CaO+CO2↑,100 44x 4.4g=,x=10g,石灰石样品中碳酸钙的质量分数为:×100%=80%,答:石灰石样品中碳酸钙的质量分数为80%.【点评】本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.5.(2015•荆门)某研究学习小组欲测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品20g,把80g稀盐酸分四次加入,实验过程所得数据如表格(已知石灰石样品中含有的二氧化硅等杂质不溶于水,不与稀盐酸反应).根据实验数据计算:(1)表中n的数值为 6.8.(2)样品中碳酸钙的质量分数是66%.【专题】化学计算;综合计算(图像型、表格型、情景型计算题).【分析】(1)根据图表数据可知,第1、2次反应后固体物质减少的质量都为5g,而第3次反应后固体物质减少的质量为3.2g,说明此时碳酸钙已反应完,不再产生气体,故表中n的数值为6.8.(2)根据图表数据可知,完全反应后,剩余固体物质的质量为6.8g,石灰石样品的质量减去剩余固体物质的质量就是样品中碳酸钙的质量,然后根据质量分数公式计算即可.(3)根据图表数据可知,第1、2次反应后固体物质减少的质量都为5g,说明20g稀盐酸恰好能与石灰石中的5g碳酸钙完全反应.根据碳酸钙与盐酸反应的化学方程式和第1次完全反应中碳酸钙的质量,即可计算出第一次参与反应的HCl质量,然后根据溶质的质量分数公式计算即可.【解答】解:(1)根据图表数据可知,第1、2次反应后固体物质减少的质量都为5g,而第3次反应后固体物质减少的质量为3.2g,说明此时碳酸钙已反应完,不再产生气体,故表中n的数值为6.8.故答案为:6.8.(2)样品中碳酸钙的质量分数=×100%=66%.故答案为:66%.(3)由题分析20g稀盐酸恰好能与石灰石中的5g碳酸钙完全反应设第一次参与反应的HCl质量为x,CaCO3+2HCl=CaCl2+H2O+CO2↑100 735g x解之得:x=3.65g,盐酸中溶质的质量分数为:=18.25%.答:盐酸中溶质的质量分数为18.25%.【点评】本题主要考查学生利用化学方程式和溶质的质量分数公式进行计算的能力.(1)该同学制得氧气的质量为 1.6g.(2)该同学所用过氧化氢溶液的溶质质量分数.(相对原子质量:H﹣1 O﹣16)【考点】根据化学反应方程式的计算;有关溶质质量分数的简单计算.【专题】计算题;溶质质量分数与化学方程式相结合的计算.【分析】(1)根据质量守恒定律计算生成氧气的质量;(2)根据过氧化氢在二氧化锰的催化作用下生成水和氧气,结合氧气的质量,计算出参加反应的过氧化氢的质量,再计算质量分数.【解答】解:(1)根据质量守恒定律可知,生成氧气的质量为:68g+0.1g﹣66.5g=1.6 g;(2)解:设参加反应的H2O2的质量为x,2H2O22H2O+O2↑68 32x 1.6 g=x=3.4 g×100%=5%答:该同学所用过氧化氢溶液的溶质质量分数是5%.故答案为:(1)1.6g;(2)该同学所用过氧化氢溶液的溶质质量分数是5%.【点评】本题主要考查了化学方程式的计算,难度不大,需要认真分析反应应用的原理,然后结合题中所给的数据进行计算.7.(2015•孝感模拟)小明同学在某化工厂进行社会实践,技术员与小明一起分析由氯化钙和氯化钠组成的产品中氯化钠的含量.现取13.4g固体样品,全部溶于96.6g水中,向所得的混合溶液中滴加溶质质量分数为10.6%的碳酸钠溶液,记录了如右图所示的曲线关系.技术员提示小明:氯化钙与碳酸钠反应的化学方程式是CaCl2+Na2CO3=CaCO3↓+2NaCl.求:(1)当氯化钙与碳酸钠恰好完全反应时,消耗10.6%的碳酸钠溶液的质量是100g.(2)当氯化钙与碳酸钠恰好完全反应时,过滤,所得溶液中溶质的质量分数是多少?【考点】根据化学反应方程式的计算;有关溶质质量分数的简单计算.【专题】压轴实验题;综合计算(图像型、表格型、情景型计算题).【分析】(1)由生成沉淀的质量曲线,加入100g碳酸钠溶液时,氯化钙与碳酸钠恰好完全反应;(2)当氯化钙与碳酸钠恰好完全反应时,过滤,所得溶液为氯化钠溶液,其中溶质氯化钠质量为样品中氯化钠与反应生成氯化钠的质量和,利用质量守恒定律,求得反应后溶液的质量,利用溶液中溶质的质量分数计算公式计算所得溶液中溶质的质量分数.【解答】解:(1)由题干中所述的化学反应可以知道,沉淀的质量不再增加的时候就是氯化钙与碳酸钠恰好完全反应时,由生成沉淀的质量曲线可以知道此时消耗10.6%的碳酸钠溶液的质量为100g;(2)设样品中氯化钙的质量为x,生成氯化钠的质量为yCaCl2+Na2CO3═CaCO3↓+2NaCl111 100 117x 10g y解得:x=11.1g,y=11.7g;样品中氯化钠的质量为:13.4g﹣11.1g=2.3g;所得溶液中溶质质量分数为:×100%=7%.答:当氯化钙与碳酸钠恰好完全反应时,过滤,所得溶液中溶质的质量分数是7%.【点评】主要考查学生对完全反应的认识,以及运用化学方程式和溶质质量分数公式进行计算的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.8.(2014•娄底)硅钢是变压器、充电器中的核心材料,其主要成份是Fe和Si.某学生用硅钢样品做了如下实验:取4.2g硅钢样品,将60g稀硫酸分6次加入样品中(其中稀硫酸与硅及其它杂质不反应),充分反应后过滤、洗)从以上数据可知,稀硫酸加入第5次充分反应后,铁恰好完全反应.(2)表格中m= 3.5g.(3)计算所用稀硫酸中溶质的质量分数.【考点】根据化学反应方程式的计算;有关溶质质量分数的简单计算.【专题】综合计算(图像型、表格型、情景型计算题).【分析】(1)根据表格中的数据,通过对比分析与10克稀硫酸恰好完全反应的铁的质量,每10g硫酸就消耗0.7g 铁,因此m=4.2g﹣0.7g=3.5g,所以第五次加入稀硫酸时样品中的铁已经完全反应;(2)由(1)进而可确定m的值;(3)根据10g稀硫酸只能消耗0.5g镁进行计算,算出硫酸质量,再根据质量分数的计算公式计算即可.【解答】解:(1)根据表格中的数据,通过对比分析与10克稀硫酸恰好完全反应的铁的质量,每10g硫酸就消耗0.7g铁,因此m=4.2g﹣0.7g=3.5g,所以第五次加入稀硫酸时样品中的铁已经完全反应;(2)由表格数据,通过对比分析可知,表格中的数据,通过对比分析与10克稀硫酸恰好完全反应的铁的质量,每10g硫酸就消耗0.7g铁,因此m=4.2g﹣0.7g=3.5g;(3)设10克稀硫酸中所含H2SO4的质量为x.Fe+H2SO4=FeSO4+H2↑56 980.7g xx=1.225g稀硫酸的溶质质量分数为==12.25%.答案(1)5(2)3.5g(3)所用稀硫酸中H2SO4的质量分数12.25%.【点评】本题属于表格数据题,解题的关键是能够通过表中的数据,分析出完全反应的量,同时由表中的数据分析出想要的数据才能进行解题.9.(2014•抚州)实验室制取氧气时,某同学取质量为x的高锰酸钾加热,记录产生氧气的质量与反应时间的关系如图1所示,请回答下列问题:(1)t0﹣t1和t4﹣t5时段固体质量都不变,为什么?(2)请根据图中数据计算高锰酸钾的质量x为多少?(写出计算过程)(3)请在图2坐标中,画出固体中锰元素质量在t0﹣t5时段变化示意图.【考点】根据化学反应方程式的计算.【专题】综合计算(图像型、表格型、情景型计算题).【分析】(1)根据图中信息解答;(2)根据图1可知,氧气的质量为3.2克,根据氧气的质量,利用氧气的质量根据反应的方程式即可计算出高锰酸钾的质量;(3)根据质量守恒定律,化学反应前后锰元素的质量不变解答.【解答】解:(1)根据图中信息可知:t0﹣t1固体质量不变,是因为反应还未进行;t4﹣t5时固体质量不变,是因为反应进行完全;(2)设高锰酸钾的质量是x,由图象可知该反应生成的氧气质量是3.2g;2KMnO4\frac{\underline{\;\;△\;\;}}{\;}K2MnO4+MnO2+O2↑316 32x 3.2gx=31.6g(3)31.6g高锰酸钾中锰元素的质量是31.6g×=11g答案:(1)t0﹣t1固体质量不变,是因为反应还未进行;t4﹣t5时固体质量不变,是因为反应进行完全;。
中考复习初中化学计算题专题含答案集团标准化办公室:[VV986T-J682P28-JP266L8-68PNN]中考化学计算题专项练习1. 现有一含杂质的固体氯化钡样品(杂质不溶于水),取12.5g样品放入烧杯中,然后加入39.6g水使其充分溶解,静置后滤去杂质,取10g滤液,加入足量的硝酸银溶液,完全反应后生成沉淀2.87g。
试求:(计算结果精确到0.1%)(1)滤液中溶质的质量分数;(2)样品中氯化钡的质量分数。
2. 碘盐就是在食盐中加入一定量的碘酸钾(KIO3的相对分子质量为214),食用碘盐可以有效地预防碘盐缺乏病,(计算结果保留一位小数)(1)_________mg碘酸钾中含碘20mg(2)成人每天约需0.15mg,假设这些碘盐主要是从碘盐中摄取的,若1000g 碘盐中含碘20mg,则成人每天需食用碘盐____________.g3、某课外兴趣小组对一批铁样品(含有杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中只有一位同学所取用(1)哪位同学所取的稀硫酸与铁样品恰好完全反应;(2)计算样品中铁的质量分数;(3)计算恰恰好完全反应后所得溶液中溶质的质量分数。
(烧杯的质量为25.4g;计算结果精确到1%)4、把4g硫粉放在给定质量的氧气中燃烧,有关实验数据如下表所示。
请回答下是:_________.(2)请你通过计算求出第二次实验生成二氧化硫多少克?(3)在表中填写第三次实验生成二氧化硫的质量。
5、将10g不纯的氯化镁样品(杂质不溶于水),50g水中,充分搅拌,待样品中的氯化镁全部溶解后过滤(滤液损失不计),将所得滤液与63.3g氢氧化钠溶液恰好完全反应,生成5.8g白色沉淀。
求:(1)样品中氧化镁的质量。
(2)反应所得溶液中溶质的质量分数。
6、“骨质疏松症”是由人体缺钙引起的,可服用补钙剂来治疗。
乳酸钙(CaC6H10O6·5H2O)是一种常见的补钙剂,出售乳酸钙片剂每片含乳酸钙200mg.一个成年缺钙病人每天服用20片乳酸钙片剂可达到补钙目的。
化学计算与分析专题复习可能用到的相关元素的相对原子质量:H—1、O-16、C-12、N—14、S—32、Cl-35.5、Na-23、Ca—40、Fe-56、Zn-65、Cu-64、Ag-108、Ba-137 1.现有一瓶久置的过氧化氢溶液(标签如图所示)。
已知过氧化氢溶液在存放过程中会缓慢分解。
取该溶液34g于烧杯中,加入一定量的二氧化锰,完全反应后,称得烧杯内剩余物质的总质量是33。
8g,将杯内剩余物质过滤、洗涤、干燥后得滤渣3g。
请计算:(1)现该瓶溶液的溶质质量分数。
(2)用该瓶溶液配制100g溶质质量分数为3%的过氧化氢溶液需要加入水的质量为____________g. 2.(2015·云南)100g某硫酸溶液恰好与13g锌完全反应。
请计算:(1)生成氢气的质量.(2)完全反应后所得溶液中溶质的质量分数。
(计算结果保留到0。
1%)3.某化学活动小组需要用溶质质量分数为19。
6%的稀硫酸和锌粒反应来制取氢气,但实验室现有的是溶质质量分数为98%的浓硫酸。
试计算:(1)将10g浓硫酸配制成所需的稀硫酸,需要水的质量为____________g.(2)取上述配制好的稀硫酸20g与足量锌粒充分反应,能制得氢气质量为多少?4.(2014·铁岭)向一定质量的氢氧化钠溶液中加入50g溶质质量分数为9.8%的稀硫酸,恰好完全反应,所得溶液质量为75g。
请计算:(1)50g稀硫酸中溶质的质量为_____________g.(2)所用氢氧化钠溶液的溶质质量分数。
5.(2015·青海)某工厂化验室常用10%的氢氧化钠溶液测定工业废水中硫酸的含量.(1)若配制10%的氢氧化钠溶液200g,需称取NaOH的质量是g;(2)取该氢氧化钠溶液40g恰好能将100g废水中的H2SO4中和,求废水中硫酸的质量分数(写出计算过程).6.某校实验室里有50g氢氧化钠废液,该校用某化工厂废弃的稀硫酸来中和后排放.当恰好完全反应后溶液的总质量为100g,测得反应后的溶液中溶质的质量分数为7。
2016年中考化学第一轮专题复习检测题化学计算测试题1. (重庆B 卷) 取氯酸钾和二氧化锰的混合物26g ,加热至混合物固体质量不再减少为止,冷却后称得剩余固体质址为16 .4g ,将剩余固体加入一定量的水中,充分搅拌后过滤,滤液是10%的氯化钾溶液(假设溶液无损失)。
计算:(1)生成氧气的质量。
(2)二氧化锰的质量。
( 3)氯化钾溶液中水的质量。
(1)生成氧气的质量为26g-16.4g=9.6g ;(2)设:原混合物中氯酸钾的质量为x ,生成氯化钾的质量为y245 149 96X y 9.6g 24596x 9.6g = 14996y 9.6g =X=24.5g y=14.9g所以二氧化锰的质量为26g —24.5g=1.5g(3)根据题意易知氯酸钾已全部分解,生成氯化钾的质量为14.9g所以氯化钾溶液质量为14.9g 149g 10%=氯化钾溶液中水的质量为149g —14.9g=134.1g答:(1)生成氧气质量为9.6g(2)二氧化锰的质量为1.5g(3)氯化钾溶液中水的质量为134.1g2.(苏州)二氧化硫是一种无色具有刺激性气味的气体,它进入大气后可形成硫酸型酸雨。
⑴煤、石油、木柴中都含有硫元素,点燃后均会产生二氧化硫气体,可用 ▲ 溶液检 验该气体的存在。
⑵为减少大气污染,火力发电厂采用以下两种方法吸收废气中的二氧化硫。
①用氨水吸收废气中的二氧化硫,其反应原理可用化学方程式表示为 ▲ 。
已知:亚硫酸盐不稳定,易被空气中的氧气氧化成硫酸盐。
②用石灰石浆吸收废气中的二氧化硫,其反应原理是:2CaCO3+O2+2SO22CaSO4+2CO2 。
若1000kg 废气中含有1.6kg 的二氧化硫,则至少需要含90%碳酸钙的石灰石多少千克才能将其完全吸收(写出解题过程,计算结果保留一位小数)?⑴高锰酸钾⑵①4NH3·H2O+2SO2+O2=2(NH4)2SO4+2H2O 或2NH3·H2O+2SO2+O2=2NH4HSO4 ② 解:设至少需要含90%碳酸钙的石灰石的质量为x 。
1.【2016年福建省泉州市】(6分)工厂烟气脱硫工艺,不仅能消除二氧化硫,还能将其转化为硫酸钙(CaSO4)等产品,实现“变废为宝”。
反应的化学方程式为:2CaCO3+O2+2SO2======2CaSO4+2CO2,现用1.25 t 含碳酸钙80%的石灰石吸收烟气中的二氧化硫。
求:(1)石灰石中碳酸钙的质量。
(2)可吸收二氧化硫的质量。
【答案】(1)1 t (2)0.64 t2.【2016年甘肃省白银市】(7分)某化学兴趣小组欲测定谋铁粉混合物中铁的质量分数,他们进行了如右图所示的实验。
请计算:(1)混合物中铁的质量;(2)反应后烧杯中稀硫酸无剩余,请计算所用稀硫酸中溶质的质量分数;(3)欲用98%的浓硫酸配制该浓度的稀硫酸200g需要水多少克?【答案】(1)5.6g (2)19.6%; (3)160g【解析】试题分析:(1)由图可知,滤渣4.4g为碳,故铁的质量为10g-4.4g=5.6g3.【2016年广东省】(9分)过氧化钙(CaO2)是一种环境友好的化工原料,工农业生产中用作漂白剂、种子消毒剂以及鱼类运输时的制氧剂等。
过氧化钙与水反应方程式为:2CaO2+2H2O=2Ca(OH)2+O2。
(1)若用150g某过氧化钙工业样品可制得氧气32g,请计算该过氧化钙样品的纯度(样品中CaO2的质量分数)是多少?(2)往150g上述过氧化钙工业样品中逐渐加入水至过量,在右图中画出产生氧气的曲线图。
(3)下表为市面上某种过氧化钙和过氧化钠(化学式为Na2O2,化学性质与CaO2类似)样品的一些数据:物质相对分子质量纯度价格(元/kg)Na2O278 98% 25CaO272 94% 24用3000元购买样品制氧气,请通过计算说明购买哪种产品可制得更多的O2(已知用3000元购买过氧化钙样品可制得26.1kg O2)?【答案】(1)96% (3)过氧化钙可制得更多的氧气4.【2016年湖南省郴州市】(7分)往100克含有盐酸和氯化钙的混合溶液中,加入21.2%的碳酸钠溶液,所得溶液的pH变化与加入碳酸钠溶液的质量关系如图,试分析计算:(1)a→b段表示碳酸钠与混合溶液中的反应;(2)反应到c点时,所得溶液的溶质质量分数是多少?(写出计算过程,精确到0.1%)【答案】(1)稀盐酸(2)15.6%【解析】试题分析:(1)盐酸和氯化钙的混合溶液中,滴加稀盐酸,盐酸会先于碳酸钠,溶液的pH值升高,然后碳酸钠再与氯化钙反应,溶液的pH值不变,反应结束,溶液的pH值会继续的增大,所以a→b段表示碳酸钠与混合溶液中的稀盐酸反应;(2)设盐酸和碳酸钠反应时,生成氯化钠质量为x,生成二氧化碳质量为y5.【2016年湖南省邵阳市】(8分)某化学兴趣小组参观了一个石灰厂时,带回了一些石灰石样品,同学们利用这些石灰石样品做了如下实验:取样品10g放入烧杯中,将50g稀盐酸分5次加入,实验过程所得的数据如表所示(已知石灰石样品中的杂质不参与反应,也不溶于水)。