分析化学 第二章 定量分析的一般步骤
- 格式:docx
- 大小:14.36 KB
- 文档页数:3

分析化学的定性和定量分析方法介绍分析化学是研究物质组成、结构和性质的科学,它广泛应用于各个领域,如环境监测、食品安全、医学诊断等。
在分析化学中,定性和定量分析是两个重要的方法。
本文将介绍这两种方法的基本原理和常用技术。
定性分析是确定物质组成和性质的方法。
它主要依靠观察和实验现象,通过对样品的颜色、形状、气味等特征进行分析,来推断其组成和性质。
其中,常用的定性分析方法包括颜色反应、沉淀反应和气体反应等。
颜色反应是一种常见的定性分析方法。
它基于物质在不同条件下的颜色变化来判断其组成和性质。
例如,当某种物质与特定试剂反应时,会产生明显的颜色变化,从而可以确定其存在与否。
这种方法常用于食品中添加剂的检测和药物的分析。
沉淀反应是另一种常用的定性分析方法。
它基于物质在溶液中形成沉淀的特性来判断其组成和性质。
例如,当某种物质与特定试剂反应时,会产生不溶于溶液的沉淀物,从而可以确定其存在与否。
这种方法常用于金属离子的检测和无机盐的分析。
气体反应是定性分析中的重要方法之一。
它基于物质在与气体反应时产生的气味、气体的颜色等特征来判断其组成和性质。
例如,当某种物质与特定气体反应时,会产生特殊的气味或颜色变化,从而可以确定其存在与否。
这种方法常用于有机物的鉴定和气体的检测。
与定性分析相对应的是定量分析,它是确定物质含量和浓度的方法。
定量分析主要依靠测量和计算,通过对样品的质量、体积、光谱等进行分析,来推断其含量和浓度。
其中,常用的定量分析方法包括重量法、容量法和光谱法等。
重量法是一种常见的定量分析方法。
它基于物质质量与含量之间的关系来确定样品的含量。
例如,通过称量样品和标准物质的质量,再根据它们的化学计量关系,可以计算出样品中目标物质的含量。
这种方法常用于药物含量的测定和环境样品的分析。
容量法是另一种常用的定量分析方法。
它基于物质体积与含量之间的关系来确定样品的含量。
例如,通过使用滴定法,将一种已知浓度的溶液滴加到待测样品中,直到反应终点出现颜色变化,从而可以计算出样品中目标物质的含量。


一、简答题:
1、定量分析的任务是什么?
答:定量分析的任务——是测定物质中有关组分的相对含量;
2、进行定量分析有哪些方法?
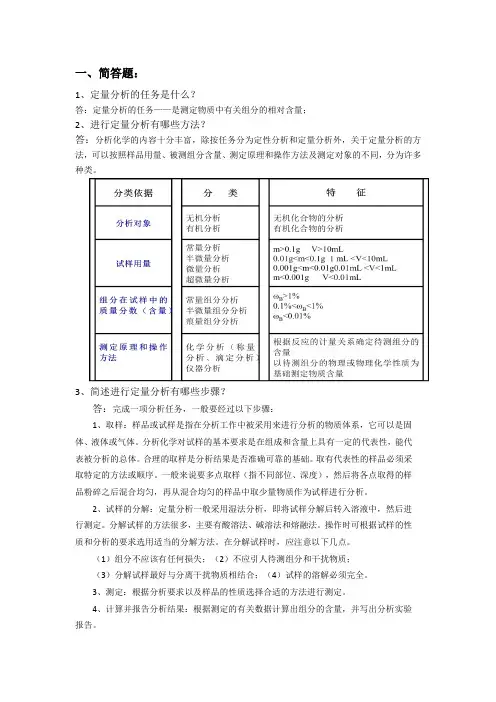
答:分析化学的内容十分丰富,除按任务分为定性分析和定量分析外,关于定量分析的方法,可以按照样品用量、被测组分含量、测定原理和操作方法及测定对象的不同,分为许多种类。
3、简述进行定量分析有哪些步骤?
答:完成一项分析任务,一般要经过以下步骤:
1、取样:样品或试样是指在分析工作中被采用来进行分析的物质体系,它可以是固体、液体或气体。
分析化学对试样的基本要求是在组成和含量上具有一定的代表性,能代表被分析的总体。
合理的取样是分析结果是否准确可靠的基础。
取有代表性的样品必须采取特定的方法或顺序。
一般来说要多点取样(指不同部位、深度),然后将各点取得的样品粉碎之后混合均匀,再从混合均匀的样品中取少量物质作为试样进行分析。
2、试样的分解:定量分析一般采用湿法分析,即将试样分解后转入溶液中,然后进行测定。
分解试样的方法很多,主要有酸溶法、碱溶法和熔融法。
操作时可根据试样的性质和分析的要求选用适当的分解方法。
在分解试样时,应注意以下几点。
(1)组分不应该有任何损失;(2)不应引人待测组分和干扰物质;
(3)分解试样最好与分离干扰物质相结合;(4)试样的溶解必须完全。
3、测定:根据分析要求以及样品的性质选择合适的方法进行测定。
4、计算并报告分析结果:根据测定的有关数据计算出组分的含量,并写出分析实验报告。






1.定量分析的一般步骤是、、、。
(试样的采取和制备;试样的分解;测定方法的选择;分析结果准确度的保证和评价)2.化学分析法主要用于组分的测定,组分质量分数在以上;仪器分析法通常适于组分的测定,组分质量分数在以下。
(常量;1%;微量或痕量;1%)3.已知黄铁矿中硫含量约为30 % , 为获得约0.5 g BaSO4沉淀, 应称取试样g。
[M r(BaSO4)=233.4, A r(S)=32.06](0.2g)4.分解试样所用的HCl,H2SO4和HNO3三种强酸中,具有强络合作用的酸是,其生成的盐几乎均易溶于水的酸是。
(HCl;HNO3)5.偶然误差的正态分布曲线的两个重要参数是和,它们分别表示测量结果的和。
(总体平均值μ;标准偏差σ;准确度;精密度)6. 系统误差的特点是:1. ;2. ;3. 。
(重复性;单向性;可测性)7.校准、做试验,做试验,对分析结果加以能减少系统误差。
(仪器;空白;对照;校正)8.在分析过程中,下列情况各造成何种(系统、偶然)误差。
(1)称量时,试样吸收了空气中的水分。
(2)读取滴定管读数时,最后一位数值估计不准。
(3)重量法测定SiO2时,试液中硅酸沉淀不完全。
(系统误差,偶然误差,系统误差)9.判断误差类型:a. 用分析天平称量时,试样吸收了空气中的水分,属于误差;b. 用分析天平称量时,不小心将样品洒落在天平称量盘上,属于误差;(系统误差;过失误差)10.判断下列误差属于何种类型:a. 以含量为95%的金属锌作为基准物质标定EDTA 溶液的浓度,属于误差;b. 移液管转移溶液之后残留量稍有不同,属于误差。
(系统误差;偶然误差)11.在分析过程中,下列情况各造成何种(系统、偶然)误差。
(1)称量过程中天平零点略有变动。
(2)读取滴定管读数时,最后一位数值估计不准。
(3)分析用试剂含有微量待测组分。
(偶然误差,偶然误差,系统误差)12.由某种固定原因造成的使测定结果偏高所产生的误差属于误误差。
定量分析化学教案第一章:定量分析化学基础1.1 定义和意义介绍定量分析化学的概念和重要性解释定量分析与定性分析的区别1.2 定量分析方法介绍常用的定量分析方法,如滴定法、原子吸收光谱法、X射线荧光光谱法等解释每种方法的原理和应用范围1.3 数据处理与误差分析介绍数据处理的基本原则和方法,如有效数字的规则、平均值的计算等解释误差来源和减小误差的方法第二章:滴定法2.1 滴定法的基本原理介绍滴定法的定义和分类,如酸碱滴定、氧化还原滴定等解释滴定反应的化学原理和滴定曲线2.2 滴定实验操作介绍滴定实验的基本操作步骤,如准备滴定瓶、滴定管的校准等演示滴定实验的操作技巧和注意事项2.3 滴定法的应用介绍滴定法在不同领域的应用实例,如determination of hardness of water, vitamin C content in food等解释滴定法在实际应用中的局限性和改进方法第三章:原子吸收光谱法3.1 原子吸收光谱法的基本原理介绍原子吸收光谱法的原理和仪器设备解释原子吸收光谱法的测量方法和光谱特性3.2 原子吸收光谱法的应用介绍原子吸收光谱法在不同领域的应用实例,如环境监测、生物分析等解释原子吸收光谱法在实际应用中的局限性和改进方法3.3 原子吸收光谱法的操作和维护介绍原子吸收光谱法的操作步骤和注意事项解释仪器维护和校准的方法和重要性第四章:X射线荧光光谱法4.1 X射线荧光光谱法的基本原理介绍X射线荧光光谱法的原理和仪器设备解释X射线荧光光谱法的测量方法和光谱特性4.2 X射线荧光光谱法的应用介绍X射线荧光光谱法在不同领域的应用实例,如材料分析、地质研究等解释X射线荧光光谱法在实际应用中的局限性和改进方法4.3 X射线荧光光谱法的操作和维护介绍X射线荧光光谱法的操作步骤和注意事项解释仪器维护和校准的方法和重要性第五章:数据处理与误差分析5.1 数据处理的基本原则和方法介绍数据处理的基本原则和方法,如有效数字的规则、平均值的计算等解释常见数据处理方法的原理和应用范围5.2 误差来源和减小误差的方法解释误差来源和减小误差的方法,如仪器误差、方法误差等介绍误差分析的基本方法和常用误差计算公式5.3 结果报告和质量控制介绍结果报告的格式和内容,如实验数据、计算结果等解释质量控制的重要性和方法,如标准品的应用、方法的验证等第六章:样品的前处理6.1 样品采集与制备介绍样品采集的原则和方法,如随机采样、代表性样品等解释样品制备的目的和常用方法,如干燥、消解、过滤等6.2 样品处理与分离介绍样品处理与分离的方法,如固液萃取、离子交换、色谱法等解释每种方法的应用范围和操作步骤6.3 样品前处理操作技巧介绍样品前处理操作的技巧和注意事项,如避免交叉污染、准确测量等演示常见样品前处理操作的实验步骤第七章:仪器分析方法7.1 光谱分析法介绍光谱分析法的原理和应用,如紫外可见光谱法、红外光谱法等解释光谱分析法的选择和操作步骤7.2 色谱分析法介绍色谱分析法的原理和应用,如气相色谱法、液相色谱法等解释色谱分析法的选择和操作步骤7.3 质谱分析法介绍质谱分析法的原理和应用,如离子阱质谱、飞行时间质谱等解释质谱分析法的选择和操作步骤第八章:质量控制与验证8.1 质量控制原则介绍质量控制的原则和目的,如保证数据的准确性和可靠性解释质量控制的方法和常用指标,如精密度、准确度等8.2 方法验证介绍方法验证的原则和方法,如线性关系、范围验证等解释方法验证的过程和结果评价8.3 实验室质量管理与认证介绍实验室质量管理体系的建立和运行,如ISO 17025认证解释实验室质量管理与认证的重要性第九章:定量分析实验案例分析9.1 实验案例一:酸碱滴定法测定未知溶液的pH值介绍实验目的和原理,如酸碱滴定的反应和滴定曲线的分析解释实验步骤和数据处理方法9.2 实验案例二:原子吸收光谱法测定水样中的铜含量介绍实验目的和原理,如原子吸收光谱法的测量方法和光谱特性解释实验步骤和数据处理方法9.3 实验案例三:高效液相色谱法测定药物成分介绍实验目的和原理,如高效液相色谱法的分离机制和操作步骤解释实验步骤和数据处理方法第十章:总结与展望10.1 定量分析化学的重要性总结定量分析化学在科学研究和工业应用中的重要性强调定量分析化学在解决实际问题中的作用10.2 发展趋势与挑战讨论定量分析化学的发展趋势和面临的挑战提出应对策略和发展方向,如新技术的开发和应用、数据共享等重点和难点解析重点环节一:定量分析与定性分析的区别补充和说明:本环节需要重点讲解定量分析与定性分析的定义、区别以及在实际应用中的重要性。
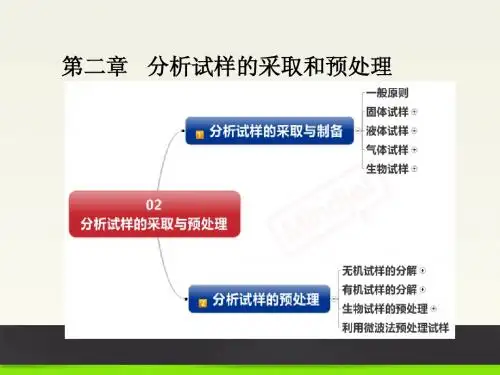
第二章定量分析的一般步骤
一、分析试样的采集与制备
1.试样的采集与制备:是指从大批物料中采取少量的样本作为原始试样,然后再制备成供分析用的最终式样。
采样的基本原则:均匀、合理、具有代表性
试样的形态:气体、液体、固体
2.取样方法:
气体样品:集气法(eg.工厂废气中有毒气体的分析)、富集法(eg.大气污染物的测定、室内甲醛的含量测定)
固体样品:抽样样品法(“四角+中央”)、圆锥四分法
液体样品:混合均匀后按照上中下分层取样
二、试样的分解(预处理)
1.分解试样的原则:
①式样分解必须完全,处理后的溶液中不得残留原试样的细屑或粉末
②式样分解过程中待测组分不应挥发
③不应引入待测组分和干扰物质
2.分解方法:溶解法、熔融法、消解法
(1)溶解法:
水:例(NH4)2SO4中含氮量的测定
酸:HCl、H2SO4、HNO3、HF等及混合酸分解金属、合金、矿石等碱:例:NaOH溶解铝合金分析Fe、Mn、Ni含量
有机溶剂:相似相溶原理
(2)熔融法:
酸溶:K2S2O7、KHSO4溶解氧化物矿石
碱溶:Na2CO3、NaOH、Na2O2溶解酸性矿物质
(3) 消解法——测定有机物中的无机元素
湿法消解:通常用硝酸和硫酸混合物与试样一起置于克氏烧瓶中,一定温度下分解,属于氧化分解法常用试剂:HNO3、H2SO4、HClO4、H2O2和KMnO4等。
干法灰化:待测物质加热或燃烧后灰化、分解,余留残渣用适当的溶剂溶解。
适用范围:有机物和生物试样中金属元素、硫、卤素等无机元素。
常用方法:坩埚灰化法、氧瓶燃烧法和低温灰化法。
三、常用的分离、富集方法
1. 分离:让试样中的各组分互相分开的过程(纯化)
分离的作用:提高方法的选择性、提高方法的灵敏度、准确度
分离方法:沉淀分离、萃取分离、挥发分离、色谱分离
2. 富集:待测组分含量低于测定方法的检测限时,在分离时将其浓缩使其能被测定
富集方法:萃取富集、吸附富集、共沉淀富集
四、测定方法的选择
分析对象(样品性质、组分含量、干扰情况)→分析方法(准确度、
灵敏度、选择性、适用范围)→用户(用户对分析结果的要求和对分析费用的承受度)→成本(时间、人力、设备、消耗品)
五、分析结果的计算与评价
1. 分析结果的计算及评价的目的:判断分析结果的准确度、灵敏度、选择性等是否达到要求
2. 含量计算方法:根据分析过程中有关反应的化学计量关系及分析测量所得数据进行计算
3. 测定结果及误差分布情况的分析:可采取统计学方法进行评价,如平均值、相对标准偏差、置信度、显著性检查等。