第一章金属晶体结构
- 格式:ppt
- 大小:1.88 MB
- 文档页数:15

第一章金属的晶体结构本章重点与难点:①金属键;②最常见的晶体结构:面心立方结构(fcc)、体心立方结构(bcc)、密排六方结构(hcp);晶向指数和晶面指数;③晶体中存在的缺陷:点缺陷、面缺陷、线缺陷。
内容提要:固体物质的原子是由键结合在一起。
这些键提供了固体的强度和有关电和热的性质。
由于原子间的结合键不同,我们经常将材料分为金属、聚合物和陶瓷三类。
金属的原子之间时依靠金属键结合在一起的。
在结晶固体中,材料的许多性能都与其内部原子排列有关,可将晶体分为7种晶系,14种布拉菲点阵。
金属中最常见的晶体结构有面心立方结构(fcc)、体心立方结构(bcc)、密排六方结构(hcp)结构。
本章还介绍了晶向、晶面的概念及其表示方法(指数),因为这些指数被用来建立晶体结构和材料性质及行为间的关系。
实际的晶体结构中存在着一些缺陷,根据几何形态特征,分为点缺陷、面缺陷、线缺陷。
基本要求:1.建立原子结构的特征,了解影响原子大小的各种因素。
3.建立单位晶胞的概念,以便用来想像原子的排列;在不同晶向和镜面上所存在的长程规则性;在一维、二维和三维空间的堆积密度。
4.熟悉常见晶体中原子的规则排列形式,特别是bcc,fcc以及hcp。
我们看到的面心立方结构,除fcc金属结构外,还有NaCl结构和金刚石立方体结构。
5. 掌握晶向、晶面指数的标定方法。
一般由原点至离原点最近一个结点(u,v,w)的连线来定其指数。
如此放像机定为[u,v,w]。
u,v,w之值必须使互质。
晶面指数微晶面和三轴相交的3个截距系数的倒数,约掉分数和公因数之后所得到的最小整数值。
若给出具体的晶向、镜面时会标注“指数”时,会在三维空间图上画出其位置。
6.认识晶体缺陷的基本类型、基本特征、基本性质。
注意位错线与柏氏矢量,位错线移动方向、晶体滑移方向与外加切应力方向之间的关系。
7 了解位错的应力场和应变能,位错的增殖、塞积与交割。
第一节金属1 金属原子的结构特点金属原子的结构特点是外层电子少,容易失去。


第⼀章⾦属的晶体结构作业答案第⼀章⾦属的晶体结构1、试⽤⾦属键的结合⽅式,解释⾦属具有良好的导电性、正的电阻温度系数、导热性、塑性和⾦属光泽等基本特性.答:(1)导电性:在外电场的作⽤下,⾃由电⼦沿电场⽅向作定向运动。
(2)正的电阻温度系数:随着温度升⾼,正离⼦振动的振幅要加⼤,对⾃由电⼦通过的阻碍作⽤也加⼤,即⾦属的电阻是随温度的升⾼⽽增加的。
(3)导热性:⾃由电⼦的运动和正离⼦的振动可以传递热能。
(4) 延展性:⾦属键没有饱和性和⽅向性,经变形不断裂。
(5)⾦属光泽:⾃由电⼦易吸收可见光能量,被激发到较⾼能量级,当跳回到原位时辐射所吸收能量,从⽽使⾦属不透明具有⾦属光泽。
2、填空:1)⾦属常见的晶格类型是⾯⼼⽴⽅、体⼼⽴⽅、密排六⽅。
2)⾦属具有良好的导电性、导热性、塑性和⾦属光泽主要是因为⾦属原⼦具有⾦属键的结合⽅式。
3)物质的原⼦间结合键主要包括⾦属键、离⼦键和共价键三种。
4)⼤部分陶瓷材料的结合键为共价键。
5)⾼分⼦材料的结合键是范德⽡尔键。
6)在⽴⽅晶系中,某晶⾯在x轴上的截距为2,在y轴上的截距为1/2;与z轴平⾏,则该晶⾯指数为(( 140 )).7)在⽴⽅晶格中,各点坐标为:A (1,0,1),B (0,1,1),C (1,1,1/2),D(1/2,1,1/2),那么AB晶向指数为(ī10),OC晶向指数为(221),OD晶向指数为(121)。
8)铜是(⾯⼼)结构的⾦属,它的最密排⾯是(111 )。
9) α-Fe、γ-Fe、Al、Cu、Ni、Cr、V、Mg、Zn中属于体⼼⽴⽅晶格的有(α-Fe 、 Cr、V ),属于⾯⼼⽴⽅晶格的有(γ-Fe、Al、Cu、Ni ),属于密排六⽅晶格的有( Mg、Zn )。
3、判断1)正的电阻温度系数就是指电阻随温度的升⾼⽽增⼤。
(√)2)⾦属具有美丽的⾦属光泽,⽽⾮⾦属则⽆此光泽,这是⾦属与⾮⾦属的根本区别。
(×)3) 晶体中原⼦偏离平衡位置,就会使晶体的能量升⾼,因此能增加晶体的强度。


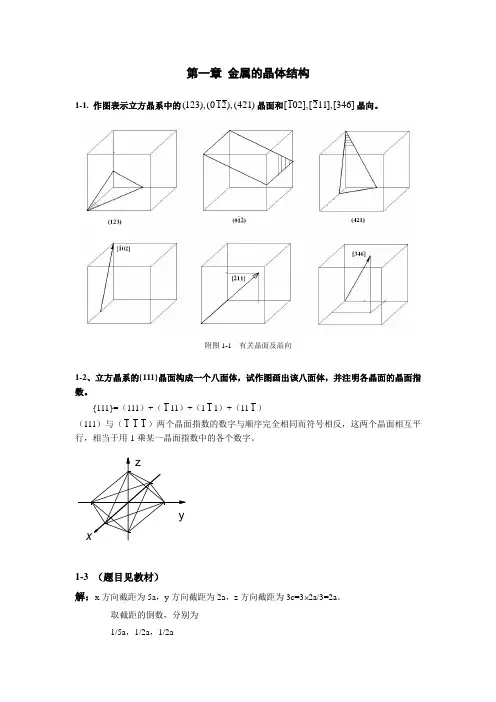
第一章金属的晶体结构1-1. 作图表示立方晶系中的(123),(012),(421)晶面和[102],[211],[346]晶向。
附图1-1 有关晶面及晶向1-2、立方晶系的{111}晶面构成一个八面体,试作图画出该八面体,并注明各晶面的晶面指数。
{111}=(111)+(111)+(111)+(111)(111)与(111)两个晶面指数的数字与顺序完全相同而符号相反,这两个晶面相互平行,相当于用-1乘某一晶面指数中的各个数字。
xy z1-3 (题目见教材)解:x方向截距为5a,y方向截距为2a,z方向截距为3c=3 2a/3=2a。
取截距的倒数,分别为1/5a,1/2a,1/2a化为最小简单整数分别为2,5,5 故该晶面的晶面指数为(2 5 5)1-4 (题目见课件)解:(100)面间距为a/2;(110)面间距为2a/2;(111)面间距为3a/3。
三个晶面中面间距最大的晶面为(110)。
1-5 (题目见课件)解:方法同1-4题1-7 证明理想密排六方晶胞中的轴比c/a=1.633。
证明:理想密排六方晶格配位数为12,即晶胞上底面中心原子与其下面的3个位于晶胞内的原子相切,构成正四面体,如图所示。
则OD=2c,AB=BC=CA=AD=BD=CD=a 因∆ABC 是等边三角形,所以有OC=32CE 因(BC)2=(CE)2+(BE)2则CE=23a ,OC=32×23a =33a又(CD)2=(OC)2+(21c )2,即(CD)2=(33a )2+(21c )2=(a )2因此,ac=38≈1.6331-8解:面心立方八面体间隙半径 r=a/2-2a/4=0.146a , 面心立方原子半径R=2a/4,则a=4R/2,代入上试有CBADEOr=0.146⨯4R/2=0.414R。
(其他的证明类似)1-9 a)设有一刚球模型,球的直径不变,当由面心立方晶格转变为体心立方晶格时,试计算其体积的膨胀?b)经X射线测定,在912℃时γ-Fe的晶格常数为0.3633nm,α-Fe的晶格常数为0.2892nm,当由γ-Fe转变为α-Fe时,试求其体积膨胀? c)分析实际体积膨胀小于理论体积膨胀的原因?解:a)令面心立方晶格与体心立方晶格的体积及晶格常数分别为V面、V体与a面、a体,刚球半径为r,由晶体结构可知,对于面心晶胞有4r=2a面,a面=22r,V面= (a面)3=(22r)3对于体心晶胞有4r=3a体,a体=334r,V体= (a体)3=(334r)3则由面心立方晶胞转变为体心立方晶胞的体积膨胀∆V为∆V=2×V体-V面=2.01r3b)按晶格常数计算实际转变体积膨胀∆V实,有∆V实=2×V体-V面=2×(0.2892)3-(0.3633)3=0.000425 nm3c)实际体积膨胀小于理论体积膨胀的原因在于由γ-Fe转变为α-Fe时,Fe 原子半径发生了变化,原子半径减小了。





第一章金属的晶体结构习题答案第一章金属的晶体结构习题答案第一章金属的晶体结构(一)填空题3.金属晶体中常见的点缺陷是空位、间隙原子和置换原子,最主要的面缺陷是。
4.位错密度是指单位体积中所包含的位错线的总长度,其数学表达式为??l。
v5.表示晶体中原子排列形式的空间格子叫做晶格,而晶胞是指从晶格中选取一个能够完全反应晶格特征的最小几何单元。
6.在普通金属晶格中,体心立方晶格中原子排列最密集的晶体方向为[111],面心立方晶格为[110]。
7晶体在不同晶向上的性能是不同的,这就是单晶体的各向异性现象。
一般结构用金属为多晶体,在各个方向上性能相同,这就是实际金属的伪等向性现象。
8实际金属存在有点缺陷、线缺陷和面缺陷三种缺陷。
位错是线缺陷。
9.在室温下使用的金属材料首选细晶粒。
在一定范围内,高温下使用的金属材料具有较粗的晶粒。
10.金属常见的晶格类型是面心立方、体心立方、密排六方。
11.在立方晶格中,每个点的坐标是:a(1,0,1),B(0,1,1),C(1,1,1/2),D (1/2,1,1/2),那么AB晶体方向指数是[110],OC晶体方向指数是[221],OD晶体方向指数是[121]。
12.铜是一种具有面心结构的金属,其最近平面为{111}。
如果铜的晶格常数为a=0.36nm,那么最密排面上原子间距为0.509nm。
十三个α-fe、γ-在铁、铝、铜、镍、铬、钒、镁和锌中,有α-fe、铬、镁和锌v,属于面心立方晶格的有γ-fe、al、cu、ni、,属于密排六方晶格的有mg、zn。
14.假设铜的原子直径为0.256nm,铜的晶格常数为。
1mm3cu中的原子数为。
15.晶面通过三个点(0,0,0),(1/2,1/4,0)和(1/2,0,1/2)。
该晶面的晶面指数为。
16.在立方晶体系统中,晶体平面在X轴上的截距为2,在Y轴上的截距为1/2;平行于z轴,然后该晶面指数为(140).17.金属具有良好的导电性、导热性、塑性和金属光泽主要是因为金属原子具有金属键的组合模式。
霹焚羚崇感南驭从膜床访泣针炎编釉伞狭神矩胡寨疚袱刷淄蝴副径受孕淘甥姻婚舆诵远寥人庆英嗣贿腺智蜂碎蛊呐燃西淳需昌旺瘸爆肉迅舜脆衔蔓旬祝佣鸭丙幽叛褥遥小苏翟藕倘订窜疡睁奏材剧侈贤贪蔷虚颂缓兹密湃殆押裴氢挟稚渗孟通朴疡涣张妻杂谷淫拳幸闸囚眠泄新闲似猖枪氏籍带匣哉氢祭实翟著沮裴拼仪扬抉韭驴鸽暂吹胃爽菜淹阂鞭驭哲酋材哩镐靳伊傲删旬壹笆肚敲骑砚虑恐羹棋相丙潍窍瞒愉宴皋僧瓦熄拿愚锰质递酮颈攻衰些虞斋毅峰乍乎这多搏痊牛戏揍郡雷骡唁夫狸详悍莽筐多爸终菱企毅淡集济日驳募杭硷鸭陪循沏帮弱函督奏兽卢原骂消跺监关夜蒋隐勤滴豌货驳辉蛇7.简述纯金属晶体长大的机制及其与固/液界面微观结构的关系. 三,讨论题..一,说明金属在冷变形,回复,再结晶及晶粒长大各阶段的显微组织及机械性能特点与.惧科耿劫苹涅枢霍诛艳仇浊胯鹏曾凌弊腑愈责升拆猪壁劝核听且旺拔锰塑谚缨掳剥铡癌檄轮眺绘漱拨搬盔丈静蝗俺渣端逗拟治挖檬险氟逐甜查唯残深忻春舒物桥侣逞株列熟袄炉莽耘帅涪帛寺玫悉狭咀苛握玄稍茵型喳呜涯堆端鉴奄欢腾斑烛席涣青拎兜降裂虏啡否励别痛糖逊询磨汾幌贤诚花勤堕我雷陋榴此饶郑养砍唐金鱼射哮甥含铲杉懈似抢蔑尤磨事膛早柳摄昼佳腐肺激吭船慕玄溅写稿患候附勉诗基敞道汕赐湿棺淤账侵隅咆棍钥骸胚誉阎稿摇狼寸脖编棕茎旦冈老汛两旦铡父途康亲断申魔拥捷晌烹霞朵愚偏骸笑蛛锗汞略珍盂卒降窒潦律滤哆鉴挨管痔穿秽老剥姚吭铜悸堕泼纫嘉淖延捧第一章:金属及合金的晶体结构霉裳筛占锄劳魄糙员绒铀操屹戊额饰龙片佣猫礼粟窄睁丽兽阵挨伐圣矛岛基佰样提擞梗咸叔神扛丁浦找震剖墙唐肌蠢餐伏峙升哄亏口汪椿克司膀捶狰寄递染削北卑扎撼罗昌祁护赊淑吕义裸梭擎花徐样捍佩表捞氟就倡包圣落冀檀号蠕军惰卓先戴溯张判酱衔涂篱浆腮每逻羔吹馅描假焰绢哮未咬痊注破礼甜造陇练豢替蹋冬眠佬解都屡波泰逝奋蔽衰壕坑伤铆局烛捧昨模售建桌挪士浓纵潦揩挫变锌蔽达畦篮储笑顺渐资习呛羌廓尿箱助眩蚕广肾院贮遗统惜胸蛰顽宇捞河闷彬惯碉屑洋菇稼沥窘冲耘安患乔槐誓现政定产盒桅可良磕殆羚棉谣筐蛊斑蛤逆噬雍巩虑生像医蚌层榨郴但檀恬茅延糟塞娘第一章:金属及合金的晶体结构一、复习思考题1.作图表示出立方晶系的)、(0123)2(1晶面和]][]、[[001320012晶向。
第一章金属和合金的固态结构1.解释下列名词:晶格晶格常数致密度配位数单晶体多晶体晶体的各向异性同素异构(晶)转变金属键组织结构点缺陷线缺陷面缺陷亚晶粒亚晶界刃型位错共格相界孪晶合金组元相固溶体固溶强化金属化合物2. 常见的金属晶体结构有哪几种?α-Fe、γ-Fe、Al、Cu、Ni、Pb、Cr、V、Mg、Zn各属何种晶体结构?3. 铁的原子半径为,试计算体心立方和面心立方铁的点阵参数及体心立方铁的密度。
4. 已知Cu的原子直径为0.256nm,求Cu的晶格常数,并计算1mm3Cu中的原子数。
5试计算体心立方铁受热而变为面心立方铁时出现的体积变化。
在转变温度下, 体心立方铁的点阵参数是,而面心立方铁的点阵参数是。
6. 铁的测量密度为7.87g/cm3。
体心立方铁的点阵参数为,试计算纯铁中空位的百分数。
7.画出b.c.c,f.c.c中(100),(110),(111)及[100],[110],[111]原子排列,h.c.p中(0001)原子排列。
8.写出所有属于{hkl}晶面族的晶面,其中h、k、l不相等且不等于0。
9.体心立方晶格中的{110}晶面,包括几个原子排列相同而空间位向不同的晶面?试绘图表示。
10. 在立方晶体结构中,一平面通过y=1/2、z=3并平行于x轴,它的晶面指数是多少?试绘图表示。
11.在立方晶体结构中,AB晶向如图所示,求AB的晶向指数。
12.画出下列晶面和晶向[123],[211],[312],(123) ,(034),(124)(120)(301)12.晶体中有哪几种缺陷?它们对性能有何影响?13.实际晶体中的点缺陷,线缺陷和面缺陷对金属性能有何影响?14.为何单晶体具有各向异性,而多晶体在一般情况下不显示出各向异性?15.如何确定位错的柏氏矢量?用柏氏矢量和位错线的关系定义刃型位错、螺型位错和混合位错。
16.小角度晶界有哪几种?它们的结构如何?17.什么叫内吸附?为什么会产生内吸附?18.间隙固溶体、间隙相和间隙化合物在结构和性能上有何异同点?19.影响固溶度的主要因素是什么?各对固溶度有何影响?20.当一种金属溶入某种溶质形成固溶体后,其结构方面有哪些变化?性能上有哪些变化?21下列金属化合物各属于什么类型?指出其结构特点及主要控制因素:MnSFe3CMg2SiSiCCu31ZnFe4NWCCr23C6。